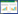扩展功能
文章信息
- 张晓波, 朱笔通, 产竹华, 赵春贵, 曾润颖, 杨素萍
- ZHANG Xiao-Bo, ZHU Bi-Tong, CHAN Zhu-Hua, ZHAO Chun-Gui, ZENG Run-Ying, YANG Su-Ping
- 有机碳对海洋着色菌YL28去除无机三态氮的影响
- Effect of organic carbons on the removal of inorganic nitrogen coexisting in marine aquaculture by a marine purple sulfur bacterium, Marichramatium gracile YL28
- 微生物学通报, 2017, 44(5): 1017-1027
- Microbiology China, 2017, 44(5): 1017-1027
- DOI: 10.13344/j.microbiol.china.160474
-
文章历史
- 收稿日期: 2016-06-24
- 接受日期: 2016-09-28
- 优先数字出版日期(www.cnki.net): 2016-11-03
2. 国家海洋局第三海洋研究所 福建 厦门 361005
2. Third Institute of Oceanography, State Oceanic Administration, Xiamen, Fujian 361005, China
养殖水体中氨氮和亚硝氮等有害物质超标,已经排在了众多污染物首位(中国农业环境保护部2012年中国渔业生态环境状况公报),不但严重地制约了水产养殖业的发展,也严重影响到食品安全和人类健康[1-3]。研究表明,微生物修复技术在养殖水体净化、水产动物疾病的防控、氨氮和亚硝氮去除等方面发挥了重要作用[4-7]。尽管已有很多微生物制剂(例如:以不产氧光合细菌、芽孢杆菌、乳酸菌、酵母菌、硝化细菌、反硝化细菌、蛭弧菌、荧光假单胞菌等为菌种的单一或复合制剂)广泛应用于水产养殖业,但深入挖掘针对性强、适应性好的新型高效水质修复剂一直备受关注。现有研究显示,养殖水体底部的泥水界面层是微生物代谢转化有机物的重要区域[8-9],这一区域有机物不断积累,适应于这种富营养环境的优势菌群快速增长,消耗溶氧,进而导致厌氧或兼性厌氧微生物代谢旺盛,不能将有机物彻底降解,硝化细菌等化能自养菌数量相对减少,有机小分子化合物以及氨氮、硝氮和亚硝氮等无机氮不断积累并向水体释放[9-10]。再者,泥水界面光照往往不足,也制约了光合生物的光合作用和脱氮能力;特别是海洋生态系统中,大量海藻死亡降解产生了海藻多糖、海藻寡糖以及其降解产物,也可能对微生物的脱氮具有调节作用。因此,研制适应于这种泥水界面环境且能高效脱除无机三态氮的微生物制剂是有望针对性解决这一问题的良策,但目前研究和应用的微生物能否适应这一环境还有待考证。
不产氧光合细菌(Anoxygenic phototrophic bacteria,APB)代谢方式灵活多样,具有高效去除有害有机物、无机物和重金属等多种污染物的特性[11-13],多年来一直被广泛应用于水产养殖业[5-6]。APB不仅可作为饵料,也可抑制水体病原菌生长,增强养殖动物的抗病能力,甚至能有效去除水体中氨氮、硝氮和H2S等有害物质。目前应用于养殖水体的APB种类主要包括Rhodobacter (Rba.) sphaeroides、Rhodopseudomonas (Rps.) palustris、Rubrivivax gelatinosa、Rhodobacter capsulata、Phaeospirillum fulvum等[7]。近年来,关于APB对无机三态氮的去除特性及环境因子对其去除特性影响的研究已有较多报道[14-16],表明在适宜的光、氧、温度、pH、盐度等条件下,许多APB菌株对氨氮和/或亚硝氮具有良好去除能力,但不同菌株对无机三态氮的去除能力以及环境适应能力有很大差异。但在无机三态氮共存体系中,APB对氨氮、硝氮和亚硝氮去除特性的报道较少[7, 17-19]。本课题组曾报道了一株海洋着色菌(Marichromatium gracile) YL28[20],该菌株对无机三态氮具有较高的去除能力,尤其能以高浓度亚硝氮为唯一氮源而生长[7],可认为是目前对亚硝氮去除能力最高的APB菌株之一[19]。在此基础上,进一步研究了该菌株静息细胞对无机三态氮的脱除能力[17],亚硝酸盐对该菌株生长、无机氮去除和光合色素合成的影响[19]以及小分子有机碳(乙酸、乙醇和葡萄糖)和有机氮化物(尿素和蛋白胨)对无机三态氮脱除的影响[18]。在养殖水体中,无机三态氮常常共存,有机碳更是多样化,但目前缺乏无机三态氮共存体系中评价微生物脱氮能力的报道,尤其缺乏海水养殖水体中可能存在的复杂有机碳(如海藻多糖及其不完全降解产物海藻寡糖等)对微生物脱氮性能影响的报道,也未见黑暗厌氧环境APB脱氮的报道。
近年研究揭示,海洋碳在全球碳循环中具有重要作用[21-22],海水养殖水体也是直接影响海洋生态环境的重要因素之一。海水养殖水体环境复杂,存在多种类型有机碳,经过生物代谢与转化,有机碳不仅对水体中微生物群落的演替有重要调控作用,同时其相互转化也使水体环境不断变化。微生物制剂投放于海水养殖水体,其功效的发挥势必受到水体环境中有机碳的影响,因此,研究不同类型有机碳对微生物制剂功效的影响不仅对微生物制剂的研制与合理应用有重要推动作用,而且也能为提升海水养殖业管理水平提供参考。本文在适宜条件(光照厌氧、温度、盐度和pH)下,着重研究了高浓度无机三态氮共存条件下,17种有机碳(包括小分子有机酸盐、单糖、双糖、寡糖、多糖和酵母提取物)对Marichromatium gracile YL28生长和无机三态氮去除性能的影响。同时选择最适有机碳乙酸钠,在黑暗厌氧环境中考察了该菌株的生长及脱氮效果,以期为微生物制剂的针对性合理应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株: 海洋着色菌(Marichromatium gracile) YL28,分离自福建泉州洛阳桥红树林潮间带泥水样,16S rRNA基因GenBank登录号为JF719917,本室鉴定与保藏[20]。 1.1.2 主要仪器和试剂: A390紫外可见分光光度计,翱艺仪器(上海)有限公司;5417R台式高速离心机,Eppendorf;PCD 650水质分析仪,OAKTON (美国)。氯化铵、亚硝酸钠、硝酸钾,国产优级纯,其余试剂为国产分析纯,购自国药集团化学试剂有限公司;壳寡糖,食品级,大连中科格莱克生物科技有限公司;卡拉胶和黄原胶,食品级,青岛佰仁生物科技有限公司;海藻寡糖采用酶法降解龙须菜琼胶所得,单糖聚合度主要为2、3、4和6,纯度达95%以上,由国家海洋局第三海洋研究所提供。 1.2 培养基和菌种的制备培养基:在Pfennig (1988年)培养基[20]基础上,添加24.3 mmol/L NaAc,以0.75 mmol/L Na2S2O3·5H2O取代1.5 mmol/L Na2S·9H2O,NaHCO3浓度由0.15%调整为0.10%,NaCl为3%,pH约7.0。菌种悬液制备:室温、4 505×g离心8 min收集光照厌氧培养4 d的菌体细胞,用无菌2% NaCl溶液洗涤菌体3次,制备成OD660约2.5的菌种悬液。
1.3 测定体系测定体系为无机三态氮共存体系,在培养基中加入无机氮化物并用测试的有机碳替代1.2培养基中的NaAc,未特别说明,无机氮化物为氯化铵、亚硝酸钠、硝酸钾,其浓度分别为6.2、6.0和4.5 mmol/L,以实测值为准;测试的17种有机碳浓度为2.0 g/L,其中有机酸盐不包括金属离子的质量,调整体系pH约为7.0。培养容器为蓝盖玻璃瓶,总容积为310 mL,同一处理设置3个重复,按5%接种菌种悬液,用无菌培养基充满培养瓶,于30、3 000 lx光照厌氧培养。定时取样测定无机三态氮含量和菌体生物量,对照(CK)不含有机碳。
1.4 生物量、pH和无机三态氮的测定采用比浊法测定菌体生物量,在光程为1 cm比色杯中,于分光光度计上测定660 nm下的光密度值(OD660),以培养基为参照。用水质分析仪测定样品pH。
采用次溴酸钠氧化法(GB12763.4-91)、N-(1-萘基)-乙二胺分光光度法(GB13580.7-92) 和紫外分光光度法(HJ/T3462007) 分别测定水体中氨氮、亚硝氮和硝氮含量。无机三态氮的含量均以氮素的含量计算,重复测定3次。
无机氮残留率(r)依据公式r(%)=Ct/C0×100计算,式中C0和Ct分别表示无机三态氮的初始浓度和测定时浓度(mmol/L)。使用SPSS 16.0软件中单因素方差分析(One-way ANOVA)对测定指标进行显著性分析,显著性水平设为0.05。
2 结果与分析 2.1 有机碳对YL28生长和去除无机三态氮能力的影响在无机三态氮共存体系中处理6 d,17种有机碳对YL28生物量、无机三态氮去除的影响如图 1所示。结果显示,未添加有机碳的对照中,菌体未呈现良好的光自养生长,对氨氮和硝氮去除率很低,但对亚硝氮具有较好的去除特性,去除率达48.91%。添加4种有机酸盐(乙酸钠、丙酮酸钠、琥珀酸钠、柠檬酸钠)时,菌体能够良好生长并有效去除无机三态氮,生物量(OD660)为0.782-1.479,氨氮去除率为73.23%-87.15%,硝氮和亚硝氮的去除率分别达到97.92%和99.98%以上。添加酵母提取物时,生物量(OD660)最高,可达1.896,对硝氮和亚硝氮具有良好去除能力,去除率分别达83.29%和99.89%,但几乎不能去除氨氮。添加单糖(葡萄糖和果糖)、双糖(麦芽糖和蔗糖)和寡糖(壳寡糖和海藻寡糖)时,菌体可生长也可去除氨氮,能良好地去除硝氮和亚硝氮,菌体生物量(OD660)在0.359-0.515,氨氮去除率在44.82%-54.53%,硝氮和亚硝氮的去除率可分别达87.88%和99.96%,与有机酸盐相比,在这些糖类体系中菌体生物量和氨氮去除率显著降低,硝氮和亚硝氮去除率却维持很高水平。在多糖(β-环糊精、淀粉、黄原胶、琼脂粉、海藻酸钠和卡拉胶)体系中,菌体生长不良,氨氮、硝氮和亚硝氮的去除率均较低,与对照相近,但在海藻酸钠体系中,由于海藻酸钠对菌体具有絮凝作用(数据未显示),体系中亚硝氮积累,与对照相比明显升高。由此可见,在无机三态氮共存体系中,该菌株在小分子有机酸盐(乙酸钠、丙酮酸钠、琥珀酸钠、柠檬酸钠)、单糖(葡萄糖和果糖)、双糖(麦芽糖和蔗糖)和寡糖(壳寡糖和海藻寡糖)等有机碳环境下均具有良好脱氮能力,尤其是硝氮和亚硝氮。有机碳不同,菌体生长和去除无机三态氮能力表现出差异,相对而言,这几种小分子有机酸盐更利于菌体生长和无机三态氮的去除,其中乙酸盐和丙酮酸钠相对更好,酵母提取物虽显著促进菌体生长,也有利于硝氮和亚硝氮的去除,但明显不利于氨氮的去除。

|
| 图 1 无机三态氮共存体系中,有机碳对YL28菌体生物量(A)、氨氮(B)、硝氮(C)和亚硝氮(D)去除的影响 Figure 1 Effect of organic carbons on biomass (A), removal of ammonia (B), nitrate (C) and nitrite (D) in inorganic nitrogen existing simultaneously water 注:1:乙酸钠;2:丙酮酸钠;3:琥珀酸钠;4:柠檬酸钠;5:葡萄糖;6:果糖;7:蔗糖;8:麦芽糖;9:壳寡糖;10:海藻寡糖;11:海藻酸钠;12:β-环糊精;13:淀粉;14:黄原胶;15:卡拉胶;16:琼脂粉;17:酵母提取物;18:乙酸钠+海藻寡糖;19:乙酸钠+海藻酸钠;20:乙酸钠+β-环糊精;21:乙酸钠+卡拉胶;22:对照(不含有机碳化物).初始氮浓度(C,mmol/L):氨氮:6.22;硝氮:6.14;亚硝氮:4.52.小写英文字母表示不同处理显著性差异水平(P < 0.05). Note: 1: Acetate; 2: Pyruvate; 3: Succinate; 4: Citrate; 5: Glucose; 6: Fructose; 7: Sucrose; 8: Maltose; 9: Chito-oligosaccharide; 10: Seaweed oligosaccharides; 11: Alginate; 12: β-Cyclodextrin; 13: Starch; 14: Xanthangum; 15: Carrageenan; 16: Agar; 17: Yeast extract; 18: Acetate+seaweed oligosaccharides; 19: Acetate+alginate; 20: Acetate+β-cyclodextrin; 21: Acetate+carrageenan; 22: CK (without organic carbon). Initial concentration (C, mmol/L): Ammonia: 6.22; Nitrate: 6.14; Nitrite: 4.52. The lower case letters represent the significant difference level (P < 0.05). |
|
|
不同碳源复合结果如图 1所示,结果表明:当适宜有机碳(如乙酸钠)与难利用有机碳(如海藻酸钠、β-环糊精和卡拉胶)共存时,YL28仍表现出良好生长和去除无机三态氮能力。当海藻寡糖与乙酸钠共存时,与乙酸钠体系相比,菌体生物量和氨氮去除率显著升高,但硝氮和亚硝氮去除率未见进一步升高,这是由于在乙酸钠体系中硝氮和亚硝氮去除率已达很高的缘故。
2.2 有机碳对菌体生长和脱氮过程的影响依据2.1中的结果,进一步选取7种有机碳及其组合,探求它们对菌株生长与脱氮过程的影响。结果如图 2所示,除了未添加有机碳对照和海藻酸钠外,YL28均能在有机酸盐(乙酸钠、丙酮酸钠)、单糖(葡萄糖)、寡糖(海藻寡糖)、酵母提取物以及乙酸钠+海藻寡糖复合有机碳体系中生长,随着培养时间延长,菌体生物量升高,直至趋于稳定。有机碳不同,初始生长速率相近,但达到稳定期的时间和最大生物量有所不同,在葡萄糖和海藻寡糖体系中菌体在2 d时生长趋于稳定,而在乙酸钠、丙酮酸钠、酵母提取物以及乙酸钠+海藻寡糖体系中菌体在3 d时生长才趋于稳定。趋于平衡时,生物量由高到低(按添加有机碳顺序排序)依次为海藻寡糖+乙酸钠 > 酵母提取物 > 乙酸钠 > 丙酮酸钠 > 海藻寡糖 > 葡萄糖 > 海藻酸钠。除了在酵母提取物体系中氨氮会有暂时积累外,其他几种有机碳及其组合中,氨氮去除过程与菌体生长过程基本吻合,生物量高,氨氮去除率也高。该菌株除了海藻酸钠,在乙酸钠、丙酮酸钠、葡萄糖、海藻寡糖和酵母提取物体系中对硝氮和亚硝氮均具有良好的去除能力,生物量越高,有机碳的利用度越好,硝氮去除速率越高,最大去除率达98%以上,但酵母提取物体系例外,虽然其生物量最高,但硝氮去除速率和最大去除率均降低。就亚硝氮去除过程而言,酵母提取物延缓了亚硝氮去除速率,其他可利用有机碳体系中,亚硝氮被快速(1 d内)除去,去除速率相近,去除率均可达99%以上。
|
| 图 2 无机三态氮共存体系中,有机碳对菌体生物量(A)、氨氮(B)、硝氮(C)和亚硝氮(D)去除过程的影响 Figure 2 Effect of organic carbons on biomass (A), removal process of ammonia (B), nitrate (C) and nitrite (D) in inorganic nitrogen existing simultaneously water 注:□:对照(不含有机碳);■:乙酸钠;○:丙酮酸钠;●:葡萄糖;△:海藻寡糖;▲:海藻酸钠;▽:酵母提取物;▼:乙酸钠+海藻寡糖.初始氮浓度(C,mmol/L):氨氮:6.22;硝氮:6.14;亚硝氮:4.52. Note: □: CK; ■: Acetate; ○: Pyruvate; ●: Glucose; △: Seaweed oligosaccharides; ▲: Alginate; ▽: Yeast extract; ▼: Acetate+ seaweed oligosaccharides. Initial concentration (C, mmol/L): Ammonia: 6.22; Nitrate: 6.14; Nitrite: 4.52. |
|
|
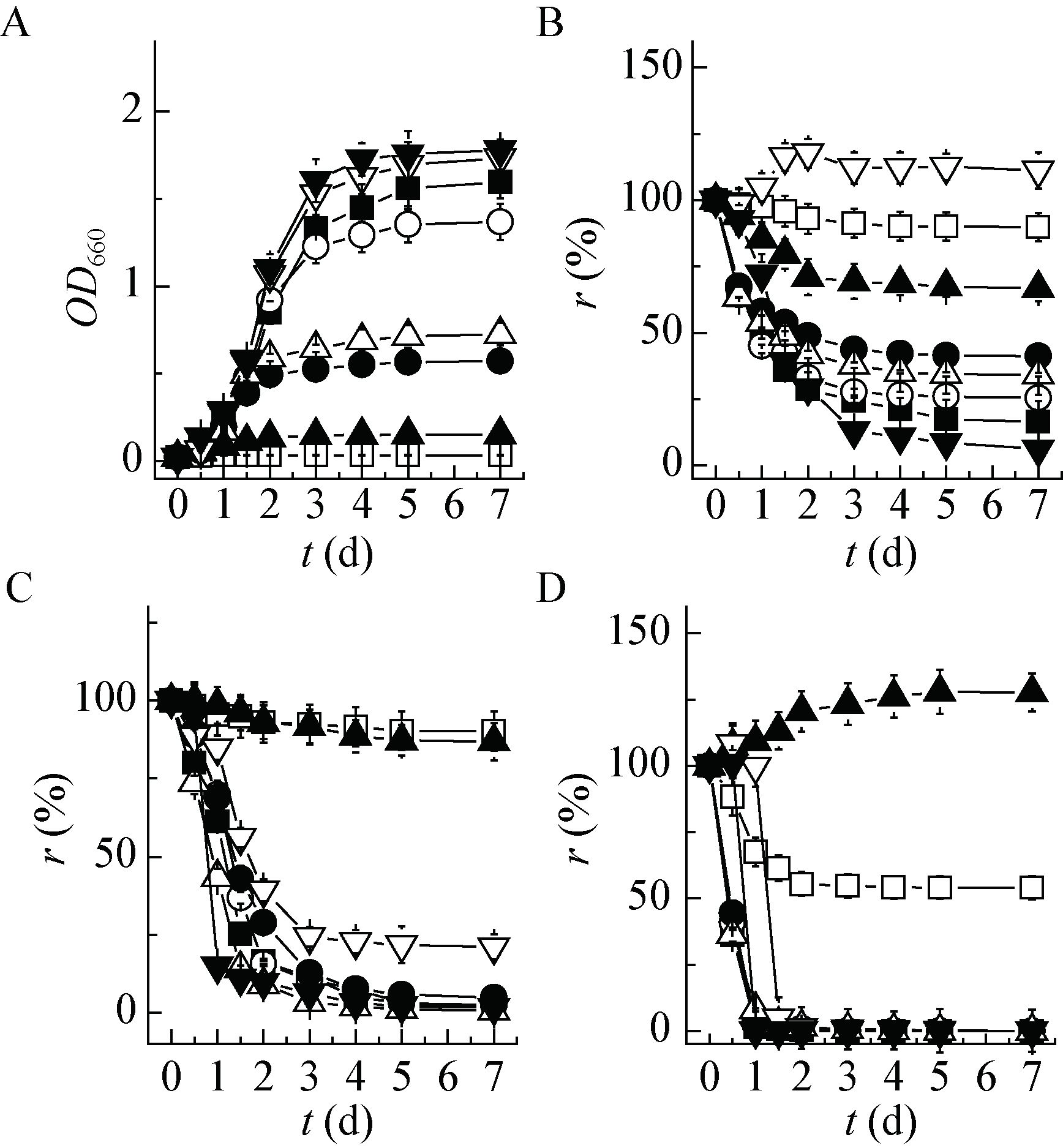
海藻寡糖是一种功能性低聚糖,具有生物保护作用[23],在污染修复方面,常用作重金属污染土壤的修复[24]和降解化石燃料污染物的添加剂[25],但能否提高脱氮菌的脱氮效率还未见报道。为此,本文探究了海藻寡糖与乙酸钠复合有机碳对YL28脱氮效果的影响。正如2.1和2.2结果显示,海藻寡糖与乙酸钠复合有机碳体系中,YL28生长和氨氮去除能力明显升高,硝氮和亚硝氮依然保持很高的去除活性,为了更突出地考察乙酸钠体系中添加海藻寡糖后产生的效应,进一步提高了实验体系中的无机三态氮浓度,结果如图 3所示。在无机三态氮共存的乙酸钠体系中添加不同浓度海藻寡糖,处理6 d (图 3A),随海藻寡糖浓度的升高,菌体生物量、氨氮去除率均升高,但硝氮去除率有所降低,与对照相比降低了14.27%,而对亚硝氮去除率影响不大,去除率均达99.8%以上;当海藻寡糖达到7.5 g/L时,生物量(OD660)最大,约达2.14,当海藻寡糖2.0 g/L时氨氮去除率为92.93%,接近最大去除率(96.04%),海藻寡糖浓度进一步升高,氨氮去除率增幅很小。
|
| 图 3 海藻寡糖-乙酸钠复合碳源对菌体生长和无机三态氮去除过程的影响 Figure 3 Effect of the combination of seaweed oligosaccharides and acetate sodium on cell growth and removal of inorganic nitrogen 注:A:无机三态氮残留率(r,%)/生物量(OD660);B:生物量;C:氨氮;D:硝氮;E:亚硝氮.初始氮浓度(C,mmol/L):氨氮:6.90;硝氮:8.55;亚硝氮:7.32. Note: A: removal rate of ammonia, nitrate and nitrite (r, %)/biomass(OD660); B: Biomass; C: Ammonia; D: Nitrate; E: Nitrie. Initial concentration (C, mmol/L): Ammonia: 6.90; Nitrate: 8.55; Nitrite: 7.32. |
|
|
分析菌体生长和无机三态氮去除过程(图 3B-E),随培养时间增加,生物量升高,氨氮、硝氮和亚硝氮去除率升高。在选择的浓度范围内,随海藻寡糖浓度升高,菌体生长速率和最大生物量升高,氨氮去除速率和最大去除率升高,硝氮去除速率不变,最大去除率降低,但仍保持在87.99%以上,对亚硝氮去除速率和最大去除率影响不大,2 d内亚硝氮几乎可完全去除。当海藻寡糖浓度(2.0 g/L)较低时,4 d内硝氮几乎可完全去除,当海藻寡糖为7.5 g/L时,体系中有少量硝氮积累,处理至7 d时仍不能完全去除。由此可见,在高浓度三态无机氮共存的乙酸钠体系中添加适量海藻寡糖,菌体生长和氨氮去除能力升高,但硝氮和亚硝氮的去除能力并未升高,添加高浓度海藻寡糖可引起硝氮的积累,其原因尚需进一步研究。
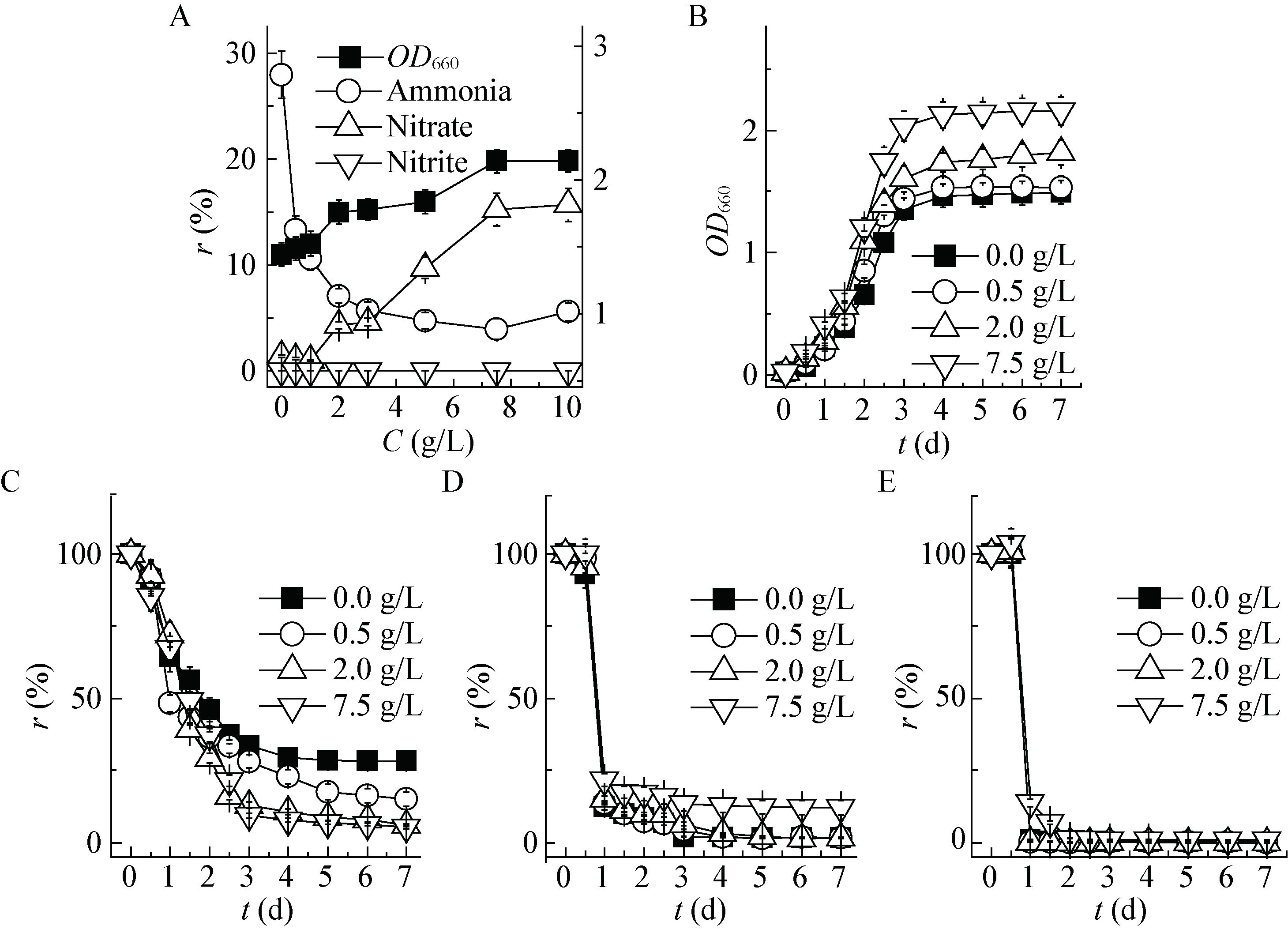
2.4 酵母提取物和乙酸钠复合有机碳对YL28生长和无机三态氮去除过程的影响在酵母提取物体系中,氨氮去除受到抑制,甚至体系中氨氮含量进一步升高(图 1),为改善菌体在酵母提取物体系中的脱氮能力,进一步探求了酵母提取物与乙酸钠共同存在时菌体生长与无机氮去除情况,结果如图 4所示。从浓度效应来看(图 4A),在酵母提取物和乙酸钠共存体系中处理6 d,在选择的浓度范围内,随酵母提取物浓度升高,菌体生物量升高,氨氮去除率降低,当浓度高于1.0 g/L时,氨氮去除率基本维持在38%,不再降低,硝氮和亚硝氮去除率分别达97%和99%以上。从时间效应分析(图 4B-E),随时间延长,菌体生物量以及氨氮、硝氮和亚硝氮的去除率均逐渐升高并趋于稳定;随酵母提取物浓度增加,菌体生长速率和最大生物量升高,而氨氮去除速率和最大去除率降低,硝氮最大去除率并未降低,但去除速率降低,亚硝氮去除速率和最大去除率则不受酵母提取物浓度影响。由此可见,酵母提取物与乙酸钠共存时能良好地改善菌株对氨氮的去除。
|
| 图 4 酵母提取物-乙酸钠复合有机碳对菌体生长和无机三态氮去除过程的影响 Figure 4 Effect of the combination of yeast extract and acetate sodium on cell growth and removal of inorganic nitrogen 注:A:无机三态氮残留率(r,%)/生物量(OD660);B:生物量;C:氨氮;D:硝氮;E:亚硝氮.初始氮浓度(C,mmol/L):氨氮:7.11;硝氮:8.53;亚硝氮:6.79. Note: A: removal rate of ammonia, nitrate and nitrite (r, %)/biomass(OD660); B: Biomass; C: Ammonia; D: Nitrate; E: Nitrie. Initial concentration (C, mmol/L): Ammonia: 7.11; Nitrate: 8.53; Nitrite: 6.79. |
|
|
上述结果显示,在无机三态氮共存体系中,当YL-28处于光照厌氧环境时,该菌株对无机三态氮具有良好去除作用,但尚不明确该菌株在黑暗厌氧环境中是否也具有高效脱氮能力?因此选择在脱氮适宜有机碳(乙酸钠)条件下,进一步观察了该菌株对无机三态氮的脱氮能力。图 5结果显示,该菌在氨氮为唯一氮源的黑暗环境中基本不生长,对氨氮几乎没有去除能力,但在无机三态氮共存环境中,该菌则能良好生长,也能良好去除无机三态氮,最大生物量(OD660)约1.0,氨氮、硝氮和亚硝氮最大去除率(3 d)分别达87%、95%和99%。在光照厌氧环境中,该菌株以氨氮为氮源、乙酸钠为有机碳良好生长,但不能在黑暗厌氧环境中生长;而在无机三态氮共存的体系中却能良好生长,表明该菌株能够通过呼吸性硝酸盐还原(反硝化)过程消耗硝酸盐和亚硝酸盐产能,同化氨氮供菌体生长,进而去除环境中的氨氮、硝氮和亚硝氮。由此可见,在无机三态氮共存的体系中,APB具有良好的黑暗厌氧生长及脱氮特性,这大大地拓宽了该菌株的适用性。

|
| 图 5 黑暗厌氧条件下,在以无机三态氮共存体系(实心)和以氨氮为唯一氮源体系中(空心)菌体生长和无机三态氮的去除过程 Figure 5 The cell growth and removal of inorganic nitrogen under anaerobically in the dark when using coexisting inorganic nitrogen (black) and ammonia (white) as the sole nitrogen source, respectively 注:初始氮浓度(C,mmol/L):氨氮:2.09;硝氮:2.03;亚硝氮:2.04. Note: Initial concentration (C, mmol/L): Ammonia: 2.09; Nitrate: 2.03; Nitrite: 2.04. |
|
|
无机三态氮对水产养殖具有严重的危害,尤其是水体中的氨氮和亚硝氮直接危害养殖动物[26]。一般来说,硝氮对养殖生物无毒,但能被微生物转化产生氨氮和亚硝氮[27],给水产动物带来危害。虽然很多微生物制剂已用于水体污染物的净化,但复杂的水体环境因子势必影响制剂的净化效果。
APB能够利用异养微生物代谢产生的小分子有机物(糖、酸和醇等)以及H2S和氨等合成细胞自身物质,从而有效去除水体中氨氮、硝氮和H2S等有害物质,已被广泛地应用于养殖水体有害污染物的净化。目前,关于APB对氨氮和亚硝氮去除特性及其环境因素的研究已有较多报道,一般来说,在适宜菌体生长条件下,菌体对氨氮和亚硝氮具有良好去除能力,但不同菌株对无机三态氮的去除能力表现出很大不同,尤其在不同有机碳环境中同一菌株对无机氮去除具有很大差异[15, 28]。在复杂水体环境中,多种有机碳共存,势必对微生物代谢转化和水体污染物的净化具有重要的影响。本研究的特色是在高浓度无机三态氮共存体系中系统地研究了一系列有机碳及其组合对APB脱除无机三态氮的影响,尤其结合水产养殖实际情况,选择了海藻多糖及其降解产物——海藻寡糖以及有机碳之间的相互组合,阐明了不同有机碳及其相互组合对海洋着色菌(M. gracile) YL28去除无机三态氮的规律,还进一步阐明了该菌株在厌氧黑暗环境中具有良好的去除无机三态氮能力。
本课题组前期结果表明,YL28是迄今报道的对亚硝氮耐受和去除能力最高的APB菌株之一[19],对单一无机三态氮和共存的无机三态氮均具有良好去除能力[7, 17-19]。在此基础上,本文进一步探究了无机三态氮共存体系中系列有机碳及其相互组合对YL28去除无机三态氮的影响,以及在黑暗厌氧环境中YL28对无机三态氮的去除能力。结果
表明:(1) 在光照厌氧条件下,小分子有机酸盐(乙酸钠、丙酮酸钠、琥珀酸钠、柠檬酸钠)是该菌株生长和去除无机三态氮的良好有机碳,体系pH升高达9.0以上(数据未显示)。(2) 单糖(葡萄糖和果糖)、双糖(麦芽糖和蔗糖)和寡糖(壳寡糖和海藻寡糖)是菌体可利用有机碳,能够良好地去除硝氮和亚硝氮,但氨氮去除能力较低。(3) 多糖(β-环糊精、淀粉、黄原胶、琼脂粉、海藻酸钠和卡拉胶)为难利用有机碳,该菌基本不生长,脱氮能力也很低。(4) 酵母提取物是细胞生长及硝氮和亚硝氮去除的良好有机碳,但严重抑制氨氮去除。究其原因,酵母提取物是天然有机营养物,可为菌体生长提供碳、氮、生长因子等营养促进菌体生长,但APB普遍具有氨化作用,通过氨化作用,酵母提取物释放大量氨氮,表观上未呈现对氨氮的去除,而相关反硝化作用酶依然保持较高活性。(5) 当酵母提取物与乙酸钠复合时,可有效缓解酵母提取物对氨氮去除抑制效应,随酵母提取物浓度升高,氨氮去除率呈降低趋势。当难利用有机碳(如海藻酸钠、卡拉胶、β-环糊精)与良好有机碳(如乙酸钠)复合时,菌体生长和无机三态氮去除能力等同良好有机碳水平,其原因可能是这些多糖虽然难以被菌体所利用,但它们均为食品级,对菌体无毒无害,菌体仍然可利用体系中的乙酸钠,保持良好的生长和代谢能力。(6) 当可利用有机碳(如海藻寡糖)与良好有机碳(如乙酸钠)共存时,随海藻寡糖浓度升高,菌体生物量和氨氮去除能力升高,其原因可能是体系pH效应的影响。前期研究表明,在以乙酸钠为唯一添加碳源体系中,培养液pH通常会升高,有时可达9.0以上,而在可利用糖体系中,pH通常会降低。若不同类型有机碳复合,缓冲了体系pH变化,有利于菌体生长提高生物量,同化氨能力也提高,表现出氨氮去除率升高。据文献[29]报道,巨大芽孢杆菌(Bacillus megaterium) X2菌株在乙酸钠为有机碳时氨氮(起始浓度50 mg/L)去除率约为16%,而该YL28在乙酸钠体系中氨氮(起始浓度6.22 mol/L)去除率约87%,由此可见,YL28菌株更适合于环境中积累小分子有机酸的环境中脱氮。
综上所述,在无机三态氮共存体系中,YL28菌株在光照厌氧以及黑暗厌氧条件下均能良好生长并去除环境中的无机三态氮。去除无机三态氮的良好有机碳是小分子有机酸盐(乙酸钠、丙酮酸钠、琥珀酸钠、柠檬酸钠),其中乙酸钠和丙酮酸钠更好。不同类型可利用有机碳相互复合或共存(如海藻寡糖与乙酸钠)提高菌体的脱氮能力。
| [1] | Zhang M, Zheng P, Wang R, et al. Nitrate-dependent anaerobic ferrous oxidation (NAFO) by denitrifying bacteria: a perspective autotrophic nitrogen pollution control technology[J]. Chemosphere, 2014, 117 : 604–609. DOI:10.1016/j.chemosphere.2014.09.029 |
| [2] | Tang WZ, Shan BQ, Cui JG, et al. Effects of nitrogen pollution on periphyton distribution, elemental composition and assemblage shifts in river ecosystems[J]. Clean-Soil Air Water, 2015, 43(10) : 1375–1380. DOI:10.1002/clen.v43.10 |
| [3] | Crab R, Avnimelech Y, Defoirdt T, et al. Nitrogen removal techniques in aquaculture for a sustainable production[J]. Aquaculture, 2007, 270(1/4) : 1–14. |
| [4] | He RQ. Environmental remediation a key issue in microbiology China[J]. Microbiology China, 2012, 39(1) : 1. (in Chinese) 赫荣乔. 环境修复成为我国微生物研究的热点领域[J]. 微生物学通报, 2012, 39(1) : 1. |
| [5] | Qi ZZ, Zhang XH, Boon N, et al. Probiotics in aquaculture of China-current state, problems and prospect[J]. Aquaculture, 2009, 290(1/2) : 15–21. |
| [6] | Newaj-Fyzul A, Al-Harbi AH, Austin B. Review: developments in the use of probiotics for disease control in aquaculture[J]. Aquaculture, 2014, 431 : 1–11. DOI:10.1016/j.aquaculture.2013.08.026 |
| [7] | Jiang P, Zhao CG, Jia YQ, et al. Inorganic nitrogen removal by a marine purple sulfur bacterium capable of growth on nitrite as sole nitrogen source[J]. Microbiology China, 2014, 41(5) : 824–831. (in Chinese) 蒋鹏, 赵春贵, 贾雅琼, 等. 以亚硝氮为唯一氮源生长的海洋紫色硫细菌去除无机三态氮[J]. 微生物学通报, 2014, 41(5) : 824–831. |
| [8] | Zhou YB, Liu YJ. Primary analysis of the energy budget and flow in the shrimp pond ecosystem[J]. Acta Ecologica Sinica, 2000, 20(3) : 474–481. (in Chinese) 周一兵, 刘亚军. 虾池生态系能量收支和流动的初步分析[J]. 生态学报, 2000, 20(3) : 474–481. |
| [9] | Statton J, Cambridge ML, Dixon KW, et al. Aquaculture of Posidonia australis seedlings for seagrass restoration programs: effect of sediment type and organic enrichment on growth[J]. Restoration Ecology, 2013, 21(2) : 250–259. DOI:10.1111/rec.2013.21.issue-2 |
| [10] | Li G, Wu ZB, Hou YS, et al. Nitrogen biotransformation and its relative microorganism in aquaculture waters[J]. Chinese Journal of Eco-Agriculture, 2006, 14(1) : 11–15. (in Chinese) 李谷, 吴振斌, 侯燕松, 等. 养殖水体氮的生物转化及其相关微生物研究进展[J]. 中国生态农业学报, 2006, 14(1) : 11–15. |
| [11] | Harwood CS. Degradation of aromatic compounds by purple nonsulfur bacteria[A]//Hunter CN, Daldal F, Thurnauer MC, et al, eds. The Purple Phototrophic Bacteria[M]. Berlin: Springer Netherlands, 2009: 577-594 |
| [12] | Zhao CG, Zhang Y, Chan ZH, et al. Insights into arsenic multi-operons expression and resistance mechanisms in Rhodopseudomonas palustris CGA009[J]. Frontiers in Microbiology, 2015, 6 : 986. |
| [13] | Zhao L, Zhao CG, Han DX, et al. Anaerobic utilization of phenanthrene by Rhodopseudomonas palustris[J]. Biotechnology letters, 2011, 33(11) : 2135–2140. DOI:10.1007/s10529-011-0681-x |
| [14] | Chen YH, Yang ZH, Yu GH, et al. Influence of illumination, oxygen, pH and salinity on growth and nitrite removal effect of Rhodopseudomonas palustris strain 2-8[J]. South China Fisheries Science, 2010, 6(4) : 1–5. (in Chinese) 陈燕红, 杨紫红, 喻国辉, 等. 光照、氧气、pH和盐度对沼泽红假单胞菌2-8生长和亚硝酸盐消除的影响[J]. 南方水产, 2010, 6(4) : 1–5. |
| [15] | Yu JA, Zhang CK, Chen F, et al. Denitration of photosynthetic bacteria P4 strain[J]. Journal of Shanghai Jiaotong University, 2000, 34(11) : 1579–1582, 1597. (in Chinese) 俞吉安, 张承康, 陈峰, 等. 光合细菌P4株的反硝化作用[J]. 上海交通大学学报, 2000, 34(11) : 1579–1582, 1597. |
| [16] | Zheng H, Zhang DM, Wang YN, et al. Removal of inorganic nitrogen and COD from carp farming waste water by Rhodopseudomonas[J]. Ecological Science, 2012, 31(4) : 435–440. (in Chinese) 郑卉, 张德民, 王一农, 等. 红假单胞菌去除养鱼废水三态氮及COD的研究[J]. 生态科学, 2012, 31(4) : 435–440. |
| [17] | Jiang P, Hong X, Zhao CG, et al. Reciprocal transformation of inorganic nitrogen by resting cells of Marichromatium gracile YL28[J]. Journal of Huaqiao University (Natural Science), 2015, 36(2) : 185–189-189. (in Chinese) 蒋鹏, 洪璇, 赵春贵, 等. 海洋着色菌 Marichromatium gracile YL28静息细胞对无机三态氮的相互转化作用[J]. 华侨大学学报:自然科学版, 2015, 36(2) : 185–189-189. |
| [18] | Jiang P, Zhao CG, Yang SP. Influences of low-molecular-weight organic carbon and nitrogen sources on growth and inorganic nitrogen removal by Marichromatium gracile strain YL28[J]. Oceanologia et Limnologia Sinica, 2014, 45(6) : 1218–1224. (in Chinese) 蒋鹏, 赵春贵, 杨素萍. 小分子有机碳、氮源对海洋着色菌(Marichromatium gracile)生长和去除高浓度无机三态氮的影响[J]. 海洋与湖沼, 2014, 45(6) : 1218–1224. |
| [19] | Jiang P, Zhao CG, Jia YQ, et al. Effects of nitrite on ammonia-nitrogen removal and nitrite-nitrogen as well as photopigment biosynthesis of Marichromatium gracile YL28[J]. Microbiology China, 2015, 42(7) : 1216–1223. (in Chinese) 蒋鹏, 赵春贵, 贾雅琼, 等. 亚硝氮对海洋着色菌亚硝氮和氨氮去除以及光合色素合成的影响[J]. 微生物学通报, 2015, 42(7) : 1216–1223. |
| [20] | Zhao JY, Fu YN, Zhao CG, et al. Identification and characterization of a purple sulfur bacterium from mangrove with rhodopin as predominant carotenoid[J]. Acta Microbiologica Sinica, 2011, 51(10) : 1318–1325. (in Chinese) 赵江艳, 傅英楠, 赵春贵, 等. 一株高含玫红品的红树林海洋紫色硫细菌分离鉴定及特性[J]. 微生物学报, 2011, 51(10) : 1318–1325. |
| [21] | Dang HY, Jiao NZ. Perspectives on the microbial carbon pump with special reference to microbial respiration and ecosystem efficiency in large estuarine systems[J]. Biogeosciences, 2014, 11(14) : 3887–3898. DOI:10.5194/bg-11-3887-2014 |
| [22] | Jiao NZ, Legendre L, Robinson C, et al. Comment on "Dilution limits dissolved organic carbon utilization in the deep ocean"[J]. Science, 2015, 350(6267) : 1483. |
| [23] | Hou YP, Gao JL, Gu L, et al. Effects of agaro-oligosaccharide treatment on postharvest quality of cherry tomatoes during cold storage[J]. Journal of Food Processing and Preservation, 2015, 39(6) : 949–955. DOI:10.1111/jfpp.12308 |
| [24] | Zhang ZX, Xu JC, Sheng T, et al. Effect of alginate-derived oligosaccharide on the rape (Brassica chinensis L.) and soil contaminated with cadmium or lead[J]. Science and Technology of Food Industry, 2014, 35(7) : 49–52, 56. (in Chinese) 张朝霞, 许加超, 盛泰, 等. 海藻寡糖对镉、铅单一污染的小油菜及土壤的影响[J]. 食品工业科技, 2014, 35(7) : 49–52, 56. |
| [25] | Tang JC, Wang F, Chu HR, et al. Bioremediation of petroleum contaminated soils by combination of zea mexicana and alginate oligosaccharides[J]. Journal of Agro-Environment Science, 2010, 29(11) : 2107–2113. (in Chinese) 唐景春, 王斐, 褚洪蕊, 等. 玉米草(Zea Mexicana)与海藻寡糖联合修复石油烃污染土壤的研究[J]. 农业环境科学学报, 2010, 29(11) : 2107–2113. |
| [26] | Foss A, Imsland AK, Roth B, et al. Effects of chronic and periodic exposure to ammonia on growth and blood physiology in juvenile turbot (Scophthalmus maximus)[J]. Aquaculture, 2009, 296(1/2) : 45–50. |
| [27] | Gutierrez-Wing MT, Malone RF. Biological filters in aquaculture: trends and research directions for freshwater and marine applications[J]. Aquacultural Engineering, 2006, 34(3) : 163–171. DOI:10.1016/j.aquaeng.2005.08.003 |
| [28] | Liu SJ, Sun Y, Cen YH, et al. Biological control of nitrite in fish farming ponds by Photosynthetic nonsulfer bacteria[J]. Environmental Science, 1995, 16(6) : 21–23. (in Chinese) 刘双江, 孙燕, 岑运华, 等. 采用光合细菌控制水体中亚硝酸盐的研究[J]. 环境科学, 1995, 16(6) : 21–23. |
| [29] | Hou Y, Sun JD, Xu JQ, et al. Degrading characters of ammonia nitrogen in aquatic water of Bacillus megaterium[J]. Journal of Shenyang Agricultural University, 2006, 37(4) : 607–610. (in Chinese) 侯颖, 孙军德, 徐建强, 等. 巨大芽孢杆菌对养殖水体氨氮降解特性研究[J]. 沈阳农业大学学报, 2006, 37(4) : 607–610. |
 2017, Vol. 44
2017, Vol. 44