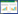扩展功能
文章信息
- 侯正欣, 董超, 马萱, 史延茂
- HOU Zheng-Xin, DONG Chao, MA Xuan, SHI Yan-Mao
- 海洋来源链霉菌MY0504产纤溶酶的发酵条件优化
- Optimization of fermentation for fibrinolytic enzyme production by Streptomyces MY0504 from ocean
- 微生物学通报, 2017, 44(5): 1009-1016
- Microbiology China, 2017, 44(5): 1009-1016
- DOI: 10.13344/j.microbiol.china.160470
-
文章历史
- 收稿日期: 2016-06-22
- 接受日期: 2016-09-08
- 优先数字出版日期(www.cnki.net): 2016-09-28
2. 河北省科学院生物研究所 河北 石家庄 050081
2. Institute of Biology, Hebei Academy of Sciences, Shijiazhuang, Hebei 050081, China
正常情况下血液中凝血机制和抗凝血机制处于动态平衡状态,这种平衡可以维持血液通畅和伤口愈合,当抗凝和纤溶机制出现问题时,不溶性的纤维蛋白在血管中积累导致血栓形成,进一步导致心肌梗死等心血管疾病,严重危害人类的生命健康[1]。在现代饮食结构及生活习惯等因素的影响下,心血管疾病发病率和死亡率有逐年升高的趋势,据世界卫生组织报道,在2008年全世界有1 730万人死于心血管疾病,并推测到2030年将有超过2 300万人死于此类疾病[2]。因此,关于血栓疾病药物的研究一直被持续关注。
目前,被广泛用于治疗血栓病的疗法是溶栓疗法[3-4],溶栓剂主要分为两种类型,一种是纤溶酶原激活物,如组织型纤溶酶原激活物(t-PA)[5]和尿激酶(u-PA)[6];另一种是纤溶酶类物质,它们可以直接作用于血纤维蛋白,从而迅速溶解血栓,如纳豆激酶[7]、蚓激酶[8]等。u-PA和t-PA仍广泛应用于溶栓治疗,但这些药物副作用较大,仅能注射不可口服,且价格昂贵。因此,国内外研究人员一直在努力寻找更安全有效的溶栓剂。
海洋微生物日益成为研究的焦点,它们具有独特的生理功能,可以在极端环境中生存,产生很多新型的代谢产物[9-11]。而放线菌早已被证实能产生种类繁多的活性物质[12],因此,海洋来源放线菌逐渐成为生产新的天然产物的最具潜力的类群,其产生的代谢物质很可能更加符合人类对有效药物的需求。
本实验室从渤海海域筛选到了一株产纤溶酶的链霉菌MY0504,本文对其产纤溶酶的发酵条件进行了优化,提高了发酵液酶活,为进一步分离纯化并确定此纤溶酶的性质奠定了基础。
1 材料与方法 1.1 材料 1.1.1 菌种: 菌株MY0504,由本实验室自渤海海域海水中分离,通过生理生化试验及16S rRNA基因序列分析确定其为链霉菌属,菌株已保藏在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏编号No. 10664。 1.1.2 培养基: 牛肉膏蛋白胨培养基[13](g/L):蛋白胨10.0,牛肉膏3.0,NaCl 5.0。 1.1.3 主要试剂和仪器: 牛纤维蛋白原购自Sigma公司;凝血酶购自石家庄华瑞创新生物科技开发中心;尿激酶购自辽宁卫星制药厂。 1.2 分析方法 1.2.1 菌株的生长曲线: 保藏菌种经斜面活化后,挑取部分到600 mL (3 L摇瓶)牛肉膏蛋白胨培养基中,28、200 r/min培养6 d,每隔12 h取样测菌体干重及发酵液酶活,做3次重复。 1.2.2 纤溶酶酶活测定: 发酵液中纤溶酶酶活采用改进的纤维蛋白平板法进行测定[14]。每个样品在已制备好的纤维平板上点样10 µL,37养箱中恒温孵育15 h,得到的透明圈面积与酶活对数成正比关系,用尿激酶作为标准品,再根据透明圈面积可得到样品酶活。 1.3 发酵条件优化设计 1.3.1 单因素试验: 不同碳源对MY0504菌株产纤溶酶的影响:以蛋白胨(10 g/L)为氮源,分别以浓度为5g/L的葡萄糖、蔗糖、麦芽糖、果糖、可溶性淀粉作为碳源,装液量50 mL (250 mL摇瓶),接种量10% (体积比),28、200 r/min培养4.5 d。每个处理做3个平行。发酵结束后用纤维蛋白平板法测定发酵上清液酶活,确定不同碳源对菌株产酶的影响。不同氮源对MY0504菌株产纤溶酶的影响:以葡萄糖(5 g/L)为碳源,分别以浓度为10 g/L的蛋白胨、豆饼粉、酵母粉、(NH4)2SO4作为氮源,装液量50 mL (250 mL摇瓶),接种量10% (体积比),28、200 r/min培养4.5 d。每个处理做3个平行。发酵结束后用纤维蛋白平板法测定发酵上清液酶活,确定不同氮源对菌株产酶的影响。
无机盐对MY0504菌株产纤溶酶的影响:以牛肉膏蛋白胨培养基为基础,分别加入不同数量级浓度的NaCl、K2HPO4·3H2O、MgSO4·7H2O、FeSO4·7H2O,装液量50 mL (250 mL摇瓶),接种量10% (体积比),28、200 r/min培养4.5 d。每个处理做3个平行。发酵结束后用纤维蛋白平板法测定发酵上清液酶活,确定不同浓度的无机盐对菌株产酶的影响。进一步确定各无机盐浓度应处的水平。
1.3.2 Plackett-Burman设计: 根据单因素试验结果,选取8个因素进行P-B试验设计,将每个因素设置高低两个水平,并设置3个虚拟因素用于估算误差,如表 1所示。| 编码 Code |
变量 Variables |
低水平 Low level-1 |
高水平 High level+1 |
| A | Glucose (g/L) | 5 | 10 |
| B | Temperature (℃) | 23 | 28 |
| C | Dummy 1 | - | - |
| D | pH | 7.0 | 9.0 |
| E | Yeast powder (g/L) | 10 | 20 |
| F | Dummy 2 | - | - |
| G | MgSO4·7H2O(g/L) | 0.5 | 1.0 |
| H | NaCl (g/L) | 5 | 10 |
| J | Dummy 3 | - | - |
| K | K2HPO4·3H2O(g/L) | 2 | 4 |
| L | FeSO4·7H2O (g/L) | 0.02 | 0.04 |
| 因素 Variables | Level | ||
| -1 | 0 | 1 | |
| (A)Glucose (g/L) | 15 | 20 | 25 |
| (B)Yeast powder (g/L) | 20 | 25 | 30 |
| (C)Temperature (℃) | 21 | 24 | 27 |
如图 1所示,菌株在0-24 h的生长处于迟缓期,24 h后进入对数生长期,发酵60 h后进入平稳生长期,培养6 d未见明显衰亡。在对数生长期期间菌株最健壮,最适合作为种子液接种到发酵培养基中,因此,选取生长48 h的菌株作为种子。从产酶曲线可见,在4.5 d时发酵液酶活最高,因此,选择发酵时间为4.5 d。菌株在进入平稳期时开始产生纤溶酶并积累,说明该酶的产生和菌体生长是非偶联的关系,酶的合成类型属于滞后合成型。在4.5 d时酶活力最高,之后酶活下降,分析可能在发酵进行4.5 d后纤溶酶积累过多造成反馈抑制,或者产生了抑制纤溶酶活力或抑制其合成的新的产物。

|
| 图 1 MY0504菌株生长曲线及产酶曲线 Figure 1 The growth and enzyme production curves of strain MY0504 |
|
|
在优化后培养条件下,菌株生长环境发生较大改变,因此在优化后的发酵过程中曾定时取样测发酵液酶活,发现在4.5 d时发酵液酶活力仍最高,因此其他培养条件的改变对此菌株产纤溶酶的最佳发酵时间影响不大。
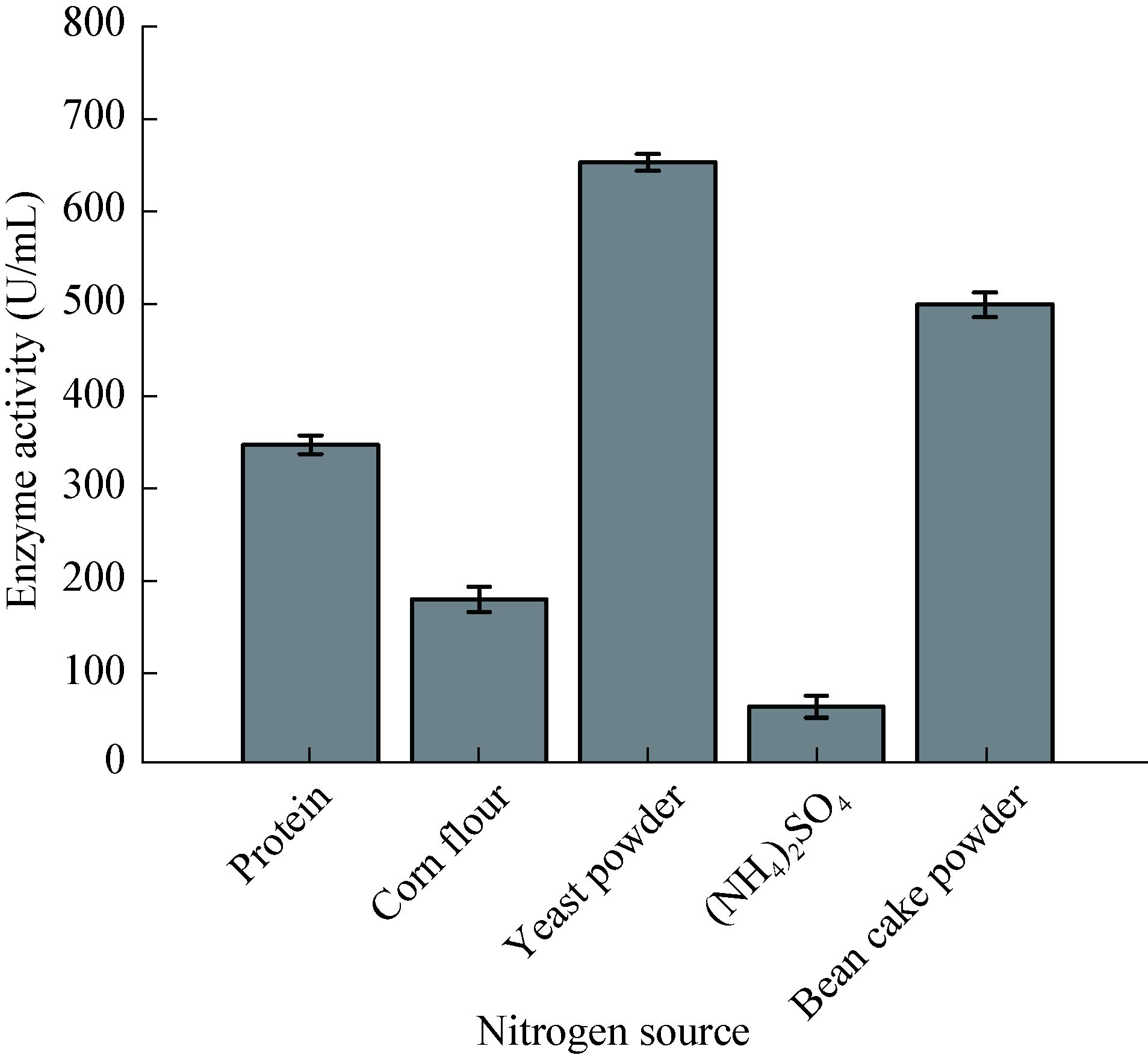
2.2 发酵条件的优化 2.2.1 单因素试验: 单因素试验结果见图 2、图 3、图 4及图 5,可以看出,对菌株MY0504产纤溶酶最有利的碳氮源为葡萄糖和酵母粉。一定量的NaCl、MgSO4·7H2O、K2HPO4·3H2O、FeSO4·7H2O对纤溶酶产生有利,且它们较为适合的水平分别为(质量体积比):0.5%、0.05%、0.5%、0.002%。在此基础上,确定初始发酵培养基为(g/L):葡萄糖5.0,酵母粉10.0,NaCl 5.0,MgSO4·7H2O 0.5,K2HPO4·3H2O 5.0,FeSO4·7H2O 0.02。培养条件为:温度28,初始pH 7.5,接种量10% (体积比),装液量50 mL (250 mL摇瓶),摇床200 r/min培养4.5 d。在此条件下,发酵液酶活达到927 U/mL。

|
| 图 2 不同碳源对酶活的影响 Figure 2 Effects of different carbon sources on enzyme activity |
|
|
|
| 图 3 不同氮源对酶活的影响 Figure 3 Effects of different nitrogen sources on enzyme activity |
|
|

|
| 图 4 不同浓度无机盐对酶活的影响 Figure 4 Effects of inorganic salt with different concentration on enzyme activity |
|
|
|
| 图 5 不同浓度FeSO4·7H2O对酶活的影响 Figure 5 Effects of FeSO4·7H2O with different concentration on enzyme activity |
|
|
| Test No. | A | B | (C) | D | E | (F) | G | H | (J) | K | L | Enzyme activity (U/mL) |
| 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | 197.2 |
| 2 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 019.3 |
| 3 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | 589.0 |
| 4 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 712.2 |
| 5 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 484.1 |
| 6 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | 710.3 |
| 7 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 084.9 |
| 8 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | 579.2 |
| 9 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | 992.7 |
| 10 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 722.8 |
| 11 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | 529.1 |
| 12 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 497.2 |
| 因素 Factors | 回归系数 Regression coefficient | 贡献值 Contribution (%) | 重要性 Significance |
| Glucose | 160.08 | 21.92 | 2 |
| Temperature | -210.20 | 28.78 | 1 |
| pH | -42.65 | 5.84 | 6 |
| Yeast powder | 147.18 | 20.15 | 3 |
| MgSO4·7H2O | 90.95 | 12.45 | 4 |
| Nacl | 35.28 | 4.83 | 7 |
| K2HPO4·3H2O | 43.38 | 5.94 | 5 |
| FeSO4·7H2O | 0.62 | 0.09 | 8 |
| Test No. |
Glucose (g/L) |
Yeast powder (g/L) |
Temperature (℃) |
Enzyme activity (U/mL) |
| 1 | 5 | 10 | 30 | 581.2 |
| 2 | 10 | 15 | 28 | 848.5 |
| 3 | 15 | 20 | 26 | 1 035.9 |
| 4 | 20 | 25 | 24 | 1 850.1 |
| 5 | 25 | 30 | 22 | 961.1 |
| 6 | 30 | 35 | 20 | 493.6 |
| Test No. | Glucose (A) | Yeast powder (B) | Temperature (C) | Enzyme activity (U/mL) |
| 1 | -1 | 0 | 1 | 1 185.5 |
| 2 | 0 | 0 | 0 | 2 218.0 |
| 3 | 0 | 1 | -1 | 1 540.4 |
| 4 | 0 | 0 | 0 | 2 175.0 |
| 5 | 0 | 1 | 1 | 1 285.0 |
| 6 | 0 | 0 | 0 | 2 068.0 |
| 7 | -1 | -1 | 0 | 1 441.5 |
| 8 | 1 | 0 | 1 | 1 586.0 |
| 9 | -1 | 0 | -1 | 1 208.5 |
| 10 | 0 | -1 | -1 | 1 205.0 |
| 11 | 0 | 0 | 0 | 1 965.5 |
| 12 | -1 | 1 | 0 | 1 562.0 |
| 13 | 0 | 0 | 0 | 1 804.0 |
| 14 | 1 | -1 | 0 | 1 825.0 |
| 15 | 1 | 1 | 0 | 1 771.0 |
| 16 | 0 | -1 | 1 | 1 413.0 |
| 17 | 1 | 0 | -1 | 1 313.0 |
| 项目Item | 平方和Sum of squares | 自由度Degree of freedom | Fvalues | P > F |
| Model | 1.955E+006 | 9 | 10.50 | 0.0026 |
| A | 2.441E+005 | 1 | 11.80 | 0.0109 |
| B | 41112.78 | 1 | 1.99 | 0.2015 |
| C | 5151.13 | 1 | 0.25 | 0.6331 |
| AB | 56287.56 | 1 | 2.72 | 0.1431 |
| AC | 21904.00 | 1 | 1.06 | 0.3378 |
| BC | 53592.25 | 1 | 2.59 | 0.1516 |
| A2 | 2.725E+005 | 1 | 13.17 | 0.0084 |
| B2 | 1.981E+005 | 1 | 9.57 | 0.0175 |
| C2 | 9.243E+005 | 1 | 44.67 | 0.0003 |
| Residual | 1.449E+005 | 7 | ||
| Lackof fit | 32975.69 | 3 | 0.39 | 0.7656 |
| Pureerror | 1.119E+005 | 4 | ||
| Cortotal | 2.100E+006 | 16 |
|
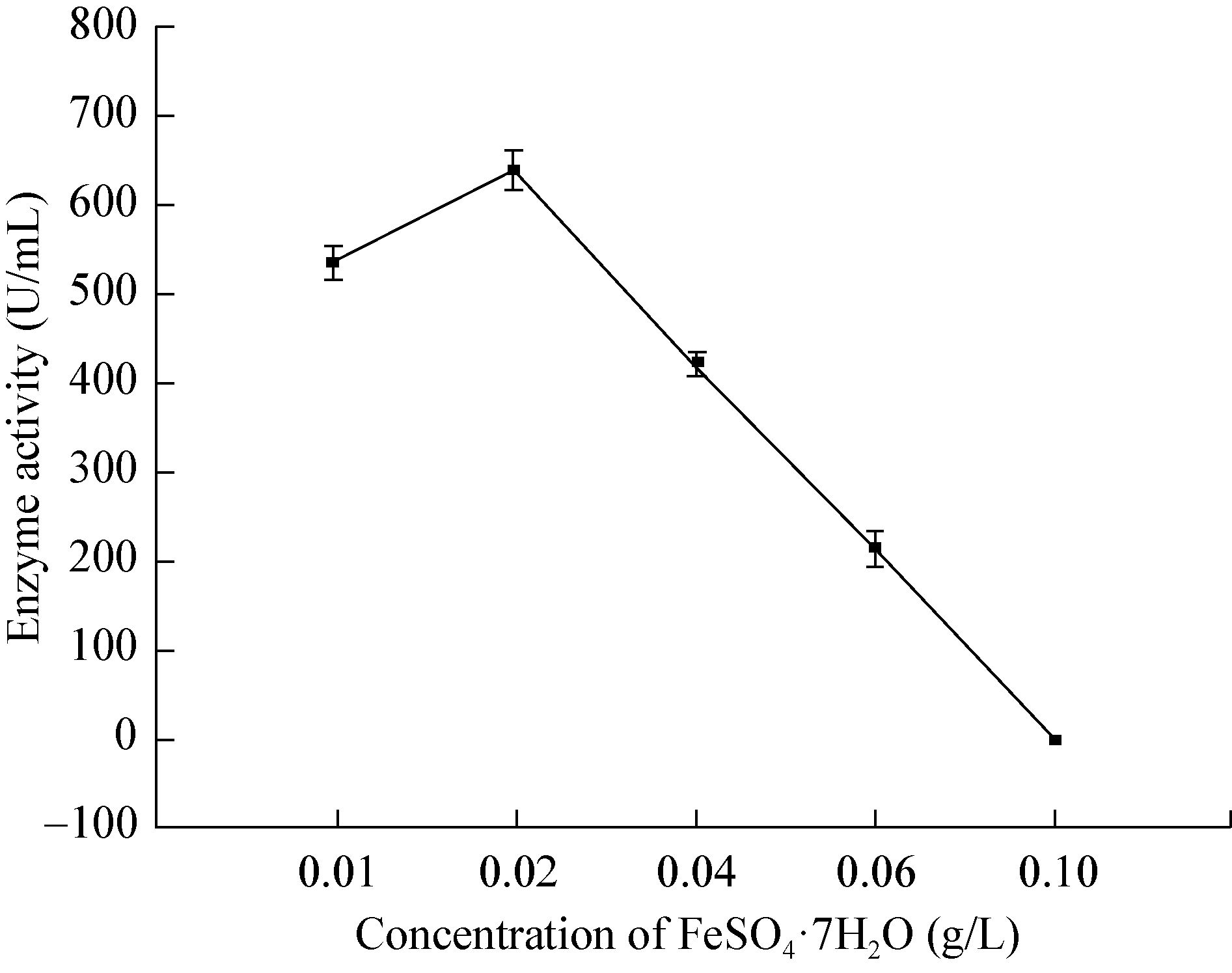
| 图 6 二因素交互作用响应面图及等高线图 Figure 6 Surface and contour plots of two factor interactions |
|
|
解方程后得到最大响应值即发酵液最大酶活为2 078.3 U/mL,对应的变量浓度为:葡萄糖21.68 g/L,酵母粉25.31 g/L,温度24。
2.3 模型的验证为了验证模型预测的准确性,在预测的最佳发酵条件下进行4次发酵试验。测得了发酵液平均纤溶酶酶活为2 190.6 U/mL,与模型预测值相差不大,因此该模型可以较好的预测实际酶活值。
3 讨论血栓病逐渐成为危害人类生命健康的最大杀手,急需寻找更加安全有效且价格低廉的溶栓药物,本实验室从渤海海域分离出一株具有纤溶活性的链霉菌MY0504,通过优化发酵条件提高了纤溶酶产量,为进一步研究此纤溶酶的结构及开发为新型溶栓药物奠定基础。本文通过单因素试验及响应面设计确定了最优发酵条件,最终发酵液纤溶酶活力可达2 190.6 U/mL,是优化前酶活的4倍,且在同类研究中处于较高水平[16-18]。
用Plackett-Burman设计筛选主要因素时,发现温度对酶活的影响很大,且是负效应,说明在温度较低情况下有利于产生纤溶酶,同时发现菌株喜低温,在低温条件下生长良好,菌体较多,这可能与该菌株分离自海洋环境有关,但是温度太低可能会造成代谢缓慢,产物减少,因此经响应面优化后确定的最优发酵温度为24。以优化的发酵条件,本实验室尝试在100 L发酵罐中进行扩大培养,结果发酵液纤溶酶活力未达到预期值,推测是由于发酵罐搅拌叶产生的机械损伤较大,或者为消泡加入了较多的食用油而影响了菌体产酶。因此,该菌株的发酵工艺扩大还需要进一步探索。但本试验的发酵条件优化方法和结果对于后续研究有良好的指导作用。
| [1] | Ahn MJ, Ku HJ, Lee SH, et al. Characterization of a novel fibrinolytic enzyme, bsFA, from Bacillus subtilis ZA400 in kimchi reveals its pertinence to thrombosis treatment[J]. Journal of Microbiology and Biotechnology, 2015, 25(12) : 2090–2099. DOI:10.4014/jmb.1509.09048 |
| [2] | Vijayaraghavan P, Vincent SGP. Statistical optimization of fibrinolytic enzyme production using agroresidues by Bacillus cereus IND1 and its thrombolytic activity in vitro[J]. BioMed Research International, 2014, 2014 : 725064. |
| [3] | Chitte RR, Dey S. Potent fibrinolytic enzyme from a thermophilic Streptomyces megasporus strain SD5[J]. Letters in Applied Microbiology, 2000, 31(6) : 405–410. DOI:10.1046/j.1365-2672.2000.00831.x |
| [4] | Narasimhan MK, Chandrasekaran M, Rajesh M. Fibrinolytic enzyme production by newly isolated Bacillus cereus SRM-001 with enhanced in vitro blood clot lysis potential[J]. The Journal of General and Applied Microbiology, 2015, 61(5) : 157–164. DOI:10.2323/jgam.61.157 |
| [5] | Banerjee A, Chisti Y, Banerjee UC. Streptokinase-a clinically useful thrombolytic agent[J]. Biotechnology Advances, 2004, 22(4) : 287–307. DOI:10.1016/j.biotechadv.2003.09.004 |
| [6] | Yan F, Yan JP, Sun WT, et al. Thrombolytic effect of Subtilisin QK on carrageenan induced thrombosis model in mice[J]. Journal of Thrombosis and Thrombolysis, 2009, 28(4) : 444–448. DOI:10.1007/s11239-009-0333-3 |
| [7] | Zhu JH, Du LX, Lu FP, et al. Purification and characterization of a strong fibrinolytic enzyme-nattokinase[J]. Microbiology China, 2006, 33(1) : 68–71. (in Chinese) 朱建辉, 杜连祥, 路福平, 等. 高效溶栓酶——纳豆激酶的纯化及酶学性质研究[J]. 微生物学通报, 2006, 33(1) : 68–71. |
| [8] | Ge T, Liang GD. The progress in the studies on the thrombolysis enzymes of earthworm[J]. China Biotechnology, 2003, 23(4) : 48–52. (in Chinese) 葛涛, 梁国栋. 蚓激酶研究进展[J]. 中国生物工程杂志, 2003, 23(4) : 48–52. |
| [9] | Valli S, Suvathi SS, Aysha OS, et al. Antimicrobial potential of Actinomycetes species isolated from marine environment[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(6) : 469–473. DOI:10.1016/S2221-1691(12)60078-1 |
| [10] | Gandhimathi R, Arunkumar M, Selvin J, et al. Antimicrobial potential of sponge associated marine actinomycetes[J]. Journal de Mycologie Médicale/Journal of Medical Mycology, 2008, 18(1) : 16–22. DOI:10.1016/j.mycmed.2007.11.001 |
| [11] | Naveena B, Sakthiselvan P, Elaiyaraju P, et al. Ultrasound induced production of thrombinase by marine actinomycetes: kinetic and optimization studies[J]. Biochemical Engineering Journal, 2012, 61 : 34–42. DOI:10.1016/j.bej.2011.12.007 |
| [12] | Zotchev SB. Marine actinomycetes as an emerging resource for the drug development pipelines[J]. Journal of Biotechnology, 2012, 158(4) : 168–175. DOI:10.1016/j.jbiotec.2011.06.002 |
| [13] | Shen P, Chen XD. Microbiology Experiment[M].4th edition.. Beijing: Higher Education Press, 2010 . (in Chinese) 沈萍, 陈向东. 微生物学实验[M].第4版.. 北京: 高等教育出版社, 2010 . |
| [14] | Yang M, Dong C, Shi YM, et al. Improvement on the method of measuring the activity of nattokinase with agarose-fibrin plate[J]. China Brewing, 2008(7) : 77–80. (in Chinese) 杨明, 董超, 史延茂, 等. 纤维蛋白平板法测定纳豆激酶方法的改进[J]. 中国酿造, 2008(7) : 77–80. |
| [15] | Qi XZ, Wang LQ, Meng P, et al. Medium optimization of α-glucosidase inhibitors production by response surface analysis[J]. Microbiology China, 2012, 39(2) : 203–210. (in Chinese) 齐西珍, 王利强, 孟鹏, 等. 利用响应面法优化α-糖苷酶抑制剂发酵培养基[J]. 微生物学通报, 2012, 39(2) : 203–210. |
| [16] | Yuan SL, Xing DM, Dou SH, et al. Optimization of fermentation conditions of a fibrinolytic enzyme stain CNY16 with high activity and preliminary study of its enzymatic propertie[J]. Microbiology China, 2014, 41(8) : 1621–1628. (in Chinese) 袁慎亮, 邢德明, 窦少华, 等. 高产纤溶酶菌株CNY16发酵条件优化及其酶学特性初步研究[J]. 微生物学通报, 2014, 41(8) : 1621–1628. |
| [17] | Jiao L, Yu HW, Guo RF, et al. Study on the fermentation for fibrinolytic enzyme from Pichia pastoris PK53[J]. Food and Fermentation Industries, 2011, 37(3) : 94–98. (in Chinese) 焦龙, 于宏伟, 郭润芳, 等. 毕赤酵母工程菌PK53产纤溶酶发酵条件的优化[J]. 食品与发酵工业, 2011, 37(3) : 94–98. |
| [18] | Hong Y, Liu XL, Deng YP, et al. Optimization of fibrinolytic enzyme production by using Neurospora sitophila[J]. The Food Industry, 2015, 36(4) : 96–99. (in Chinese) 洪瑜, 刘晓兰, 邓永平, 等. 好食脉孢霉产纤溶酶的液体发酵条件优化[J]. 食品工业, 2015, 36(4) : 96–99. |
 2017, Vol. 44
2017, Vol. 44