扩展功能
文章信息
- 程瑞雪, 蹇华哗, 许冠鹏, 王风平
- CHENG Rui-Xue, JIAN Hua-Hua, XU Guan-Peng, WANG Feng-Ping
- 深海来源低温诱导表达载体pSW4的构建及其应用
- Construction of cold inducible expression vector pSW4 and expression of DNA polymerase Ⅲ epsilon subunit
- 微生物学通报, 2017, 44(4): 983-990
- Microbiology China, 2017, 44(4): 983-990
- DOI: 10.13344/j.microbiol.china.160369
-
文章历史
- 收稿日期: 2016-05-09
- 接受日期: 2016-06-03
- 优先数字出版日期(www.cnki.net): 2016-10-09
海洋作为地球上最大的生态系统,蕴含着丰富的生物基因资源[1-2]。Shewanella菌属广泛分布于包括深海在内的各类环境中,具有强大的呼吸能力,能够使用十几种甚至几十种不同的电子受体进行厌氧呼吸,它们不仅能够利用锰铁等常见的金属氧化物,还能够利用很多不常见的金属或者非金属物质作为电子受体,例如铀、铬、锝、镎、钚、钒、碘、硒、碲等,甚至还有一些菌株能够还原芳香族化合物,这使得Shewanella菌属在环境生物修复 (如放射性污染的环境) 和微生物燃料电池方面有着巨大的应用潜力[3-5]。
由于绝大多海洋微生物,特别是深海微生物无法在实验室操作环境下获得纯培养,因此,蛋白异源表达是获取深海生物基因资源的重要途径之一[6-7]。但是目前常用的蛋白系统在表达深海来源蛋白时经常出现基因不表达、蛋白失活及形成包涵体等问题,这在很大程度上限制了深海生物基因资源的开发利用[8-9]。目前已报道的唯一利用深海细菌构建表达系统的尝试来自于Photobacterium profundum SS9,其分离自2 500 m水深的深海沉积物。Lauro等利用接合转移自杀载体pEE3和表达载体pJN105中的元件构建了表达载体pFL190 (9 538 bp),并用其在P.profundum SS9中表达了β-Galactosidase,活性检测发现其效率约为以Escherichia coli为宿主的18%[10]。
深海细菌Shewanella piezotolerans WP3分离自西太平洋1 914 m水深的深海沉积物中,为兼性厌氧菌,能利用多种物质作为电子受体生长[11-12]。其生长温度范围在0−28之间,压力范围0.1−50 MPa[13],可作为深海来源基因表达的良好宿主菌。前期的研究中,我们已经将WP3包含天然噬菌体SW1改造成为穿梭质粒pSW2 (表 1),其可在大肠杆菌及希瓦氏菌中稳定复制[14]。虽然该载体能够在WP3中表达异源蛋白,但是其中仍然存在一些非必需基因,可进一步进行最小化改造。另外,pSW2低温诱导效率偏低,缺少蛋白纯化标签,因此还需要进一步的优化。本研究通过对pSW2优化改造构建高效低温诱导表达载体pSW4,并且表达深海来源的聚合酶亚基。本研究得到的深海低温表达系统WP3-pSW4为今后环境污染物高效降解菌的构建提供了较好的工具和经验参考。
| 引物及用途 Primer and application |
核苷酸序列 nucleotide sequence (5′→3′) |
| 载体构建Vector construction | |
| pSW2PR1869-For | GGGAATCCTGCTCTGCGAGGAAGGCATACCCTGACGGTGC |
| pSW2PR1869-Rev | GCGACGCGTGCATGCCTGCAGAGGCTGTTTTAACTCTGACTCAACA |
| pSW2-For | TGCAGGCATGCACGCGTC |
| pSW2-For | CCTCGCAGAGCAGGATTCC |
| ΔfpsB-For | AATACATAAACTATGACTGAATTTA |
| ΔfpsB-Rev | TCAGTCATAGTTTATGTATTCCTAT |
| MCS+His-Tag-For | TCAGAGTTAAAACAGCCTATGCGATCGGGGCCCCA |
| MCS+His-Tag-Rev | GGTACCGAGCTCCTCGAGGTGATGATGATGATGAT |
| pSW3-For | CTCGAGGAGCTCGGTACCCGGGGAT |
| pSW3-Rev | ATCAAGACAGCGCAATCACCAAAGACTTGAACGTC |
| GFP-For | GTCAGAGTTAAAACAGCCTCATGGTGAGCAAGGGCGAGG |
| GFP-Rev | GCGACGCGTGCATGCCTGCATTACTTGTACAGCTCGTCCATGCC |
| pSW4-For | TGCAGGCATGCACGCGTC |
| pSW4-Rev | GAGGCTGTTTTAACTCTGACTCAACA |
| 缺失突变Deletion mutation | |
| pSW2ΔfpsBCD-For | AGCGGGCCCTTAGGCGCATTCAAATAAAT |
| pSW2ΔfpsBCD-Rev | AGCGGGCCCTTTATGTATTCCTATTTATT |
| pSW2ΔfpsCD-For | AGCGGGCCCTTAGGCGCATTCAAATAAAT |
| pSW2ΔfpsCD-Rev | AGCGGGCCCATAAGATCCCTTTATAGCGT |
| pSW2ΔfpsA-For | AGCGGGCCCCCTTGGACTCGTGTCAATAA |
| pSW2ΔfpsA-Rev | AGCGGGCCCTGTAGCGTTGTGGCCTAGTT |
| pSW2ΔfpsB-For | AGCGGGCCCCTATGACTGAATTTAAGCGT |
| pSW2ΔfpsB-Rev | AGCGGGCCCTTTATGTATTCCTATTTATT |
| pSW2ΔfpsC-For | AGCGGGCCCCATGAATACATTGATGATTT |
| pSW2ΔfpsC-Rev | AGCGGGCCCATAAGATCCCTTTATAGCGT |
| pSW2ΔfpsD-For | AGCGGGCCCTTAGGCGCATTCAAATAAAT |
| pSW2ΔfpsD-Rev | AGCGGGCCCGGTTATTTGTTCCTAACTGC |
| pSW2ΔfpsR-For | TTGGGGGCCCTTTGTTCGCCCCTTT |
| pSW2ΔfpsR-Rev | CACGGGGCCCCGACGCGTGCATGCC |
| 蛋白表达克隆Protein expression | |
| pSW4-01203-For | CATCATCACGCGCGCCCGCGGATGAACATAGTTTCTAGTGCAAAAAGG |
| pSW4-01203-Rev | ATGATGATGATGATGAGGCCTTTATTCACGCCAGGCACAAA |
穿梭载体pSW2 (6 451 bp) 由深海丝状噬菌体SW1改造而来,因而保留一些与载体复制无关的基因,如编码衣壳蛋白 (fpsC,fpsD) 和单链结合蛋白 (fpsB) 的基因 (表 2)。因此,我们首先对这些片段进行了缺失验证,从而确定pSW2中可以删减的序列。通过反向PCR的方法构建了单基因缺失的pSW2突变质粒pSW2ΔfpsB、pSW2ΔfpsC和pSW2ΔfpsD,多基因缺失的pSW2突变质粒pSW2ΔfpsCD和pSW2ΔfpsBCD。所得质粒转入E.coli WM3064菌株,经双酶切验证正确 (图 1) 后再通过接合转移导入WP3,根据接合转移是否成功判断该序列是否为pSW2复制所必需 (表 3)。
| 名称 Name |
链 Strand |
大小 Length (aa) |
位置 Location |
功能注释 Function |
| fpsA | + | 541 | 672–2 297 | 复制蛋白 |
| fpsB | + | 104 | 2 359–2 673 | 单链结合蛋白 |
| fpsC | + | 61 | 2 496–2 681 | 主要衣壳蛋白 |
| fpsD | + | 79 | 2 775–3 014 | 次要衣壳蛋白 |
| ChlR | − | 220 | 3 218–3 878 | 氯霉素抗性基因 |
| fpsR | − | 116 | 6 146–50 | 调控蛋白 |
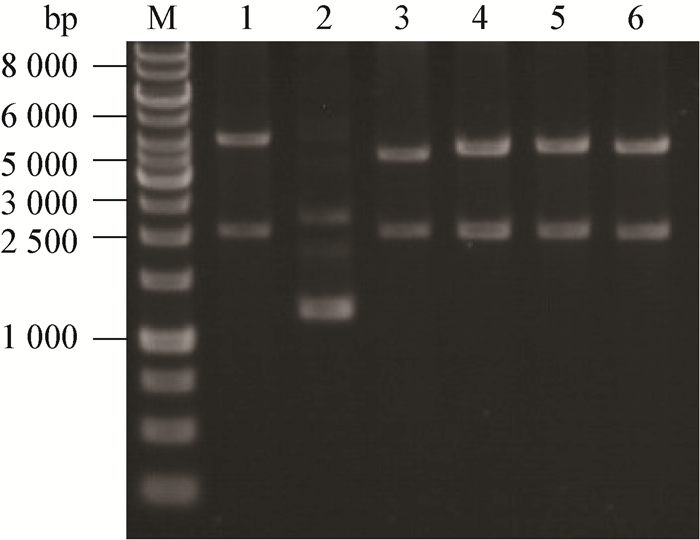
|
| 图 1 pSW2突变载体双酶切验证DNA电泳图 Figure 1 Electrophoretic analysis of DNA restriction fragments from pSW2 mutated vectors Note: M: GeneRulerTM 1 kb DNA ladder. 1: pSW2; 2: pSW2ΔfpsBCD; 3: pSW2ΔfpsCD; 4: pSW2ΔfpsB; 5: pSW2ΔfpsC; 6: pSW2ΔfpsD. |
|
|
| 突变载体 Mutated vectors |
敲除片段 Mutated sequences (bp) |
接合转移 (Yes/No) Conjugal transfer |
| pSW2ΔfpsBCD | 1 236 | N |
| pSW2ΔfpsCD | 519 | Y |
| pSW2ΔfpsA | 1 625 | N |
| pSW2ΔfpsB | 314 | Y |
| pSW2ΔfpsC | 186 | Y |
| pSW2ΔfpsD | 240 | Y |
根据不同缺失突变载体的接合转移实验结果,判定pSW2质粒上可敲除片段包括fpsB、fpsC、fpsD。另外,fpsCD也可同时敲除。编码复制蛋白的基因fpsA敲除后,接合转移无法成功,说明fpsA对于pSW2在WP3中复制是必需的 (表 3)。
2.2 pSW2突变载体的表达能力检测对于获得的一系列pSW2突变载体,以绿色荧光蛋白GFP为报告基因对它们在低温下的蛋白表达能力进行了检测。需要指出的是,pSW2原来所用的是噬菌体自身的启动子 (PfpsA),其存在着强度较低的问题。为了提高低温下启动子的强度,在pSW2突变载体中加入了编码冷激蛋白基因的启动子 (PcspA)。结果显示,加入PcspA后,pSW2的表达能力确实有部分提高。更显著的是,fpsB基因敲除后,pSW2突变载体 (pSW2ΔfpsB-PcspA) 的GFP强度较原始载体极大地提高。其中20条件下增加2.7倍,4条件下增加10.7倍 (图 2)。

|
| 图 2 pSW2突变载体在不同温度条件下的GFP强度检测 Figure 2 GFP intensity assays of pSW2 mutated vectors at different temperatures |
|
|
在以上工作的基础上,对表达载体pSW2进行了一系列的改造,包括敲除fpsB基因,添加强启动子PcspA及RBS位点,添加多克隆位点Multiple cloning site (MCS) 和6×His标签方便外源蛋白N-末端、C-末端连接标签以供蛋白纯化 (图 3)。以上全长为101 bp的序列通过全基因合成,然后用同源重组的方法克隆到PcspA启动子的尾部。最终完成了全部的改造,新的载体命名为pSW4 (NCBI GenBank登录号KX296734),其全长为6 623 bp。
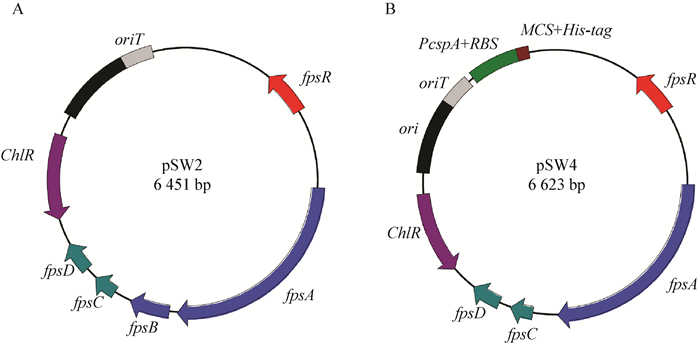
|
| 图 3 pSW2 (A) 与pSW4 (B) 对比图 Figure 3 Comparison of pSW2 (A) and pSW4 (B) vector |
|
|
为了验证pSW4的可用性,我们选择了深海嗜冷细菌Shewanella psychrophila WP2中的基因sps01203 (编码DNA聚合酶Ⅲ的ε亚基),其全长为729 bp。将片段克隆至pSW4,双酶切验证正确 (图 4A)。构建的表达载体pSW4-01203通过接合转移到WP3中,得到表达菌株WP3-pSW4-01203。按照1:100的比例接种于锥形瓶中培养 (2216E培养基,20℃、200 r/min) 约12 h,待菌株生长至平台期 (OD600=3.5) 将锥形瓶转移至4低温诱导36 h,最后高速离心收集菌体,提取蛋白并通过SDS-PAGE检测目的条带。结果显示目的条带单一,且大小与理论值一致 (图 4B)。蛋白纯化后计算其得率为11.13 mg/L。

|
| 图 4 重组质粒pSW4-01203双酶切验证DNA电泳图 (A) 及蛋白表达纯化SDS-PAGE图 (B) Figure 4 Electrophoretic analysis of DNA restriction fragments from recombinant plasmid pSW4-01203 and SDS-PAGE of purified protein Note: A: M: GeneRulerTM 1 kb DNA ladder. 1: pSW4; 2: pSW4-01203. B: M: Protein standard marker; 1: Purified Sps01203 recombinant protein. |
|
|
DNA聚合酶Ⅲ的ε亚基一般具有核酸酶活性。分别以双链和单链DNA作为底物通过Urea-denatured PAGE检测 (图 5) 发现,在金属离子Mn2+存在的条件下,Sps01203蛋白具有切割dsDNA的核酸酶活性。而在金属离子Mn2+和Mg2+存在的条件下,Sps01203蛋白具有切割ssDNA (图 6) 的核酸酶活性。以上结果说明,通过pSW4能表达出可溶蛋白,且具有活性。

|
| 图 5 Sps01203在不同金属离子条件下切割dsDNA酶活检测 Figure 5 Analysis of dsDNA nuclease activity of the Sps01203 protein with different metal ions |
|
|

|
| 图 6 Sps01203在不同金属离子条件下切割ssDNA酶活检测 Figure 6 Analysis of ssDNA nuclease activity of the Sps01203 protein with different metal ions |
|
|
Shewanella piezotolerans WP3分离自深海环境,是良好的低温蛋白表达宿主菌。其天然丝状噬菌体SW1具有低温诱导的特征,已被改造成能在E.coli和Shewanella不同菌株中穿梭的质粒pSW2,但是其作为一个功能完全的表达载体还需要进一步地改造完善[14]。通过对pSW2的敲除实验发现,单链结合蛋白FpsB的缺失不影响pSW2在WP3中的复制,同时其低温条件下蛋白表达能力显著提高。在此基础上构建的表达载体pSW4与pSW2大小相当,但包括了强启动子和蛋白纯化标签。通过深海细菌WP2的聚合酶Ⅲ ε亚基 (Sps01203) 的表达和体外活性检测,证实了pSW4的实用性。本研究构建的WP3-pSW4系统是国内首次利用深海来源的菌株和质粒构建低温蛋白表达系统。与来自于南极海水中的低温表达系统 (Shewanella sp. Ac10-pJRD215) 相比[15],WP3-pSW4系统在20条件下表达效率相当,4℃条件下表达效率更高;而与同样来自于深海的P.profundum SS9-pFL190系统相比[10],其优势包括宿主菌基因组更小 ( < 19%)、接合转移效率更高 ( > 4.5×102)、温度范围更宽 (0−28、生物量更高 (10倍),因而具有较好的应用潜力。
海洋是地球最大的生态系统,而深海是海洋的主要组成部分,具有黑暗、高压、低温、寡营养等极端环境,蕴含着丰富的生物基因资源[16]。对这些基因资源利用工具,如蛋白表达系统的开发改造不仅对了解微生物的极端环境适应性机理具有重要的意义,还能够促进对于海洋生物基因资源的有效开发利用。WP3能够耐受多重极端环境,特别是具有良好的低温生长能力并能够利用多种物质作为电子受体[11-13],因此是构建环境污染物降解菌的良好材料。本研究中构建的深海蛋白表达载体pSW4与WP3具有天然的适配性[17-18],可用来高效表达一些与污染物降解相关的基因簇。今后将尝试利用该系统进行相关的应用性研究。
| [1] | Zeng RY, Chan ZH. Progress in research and development techniques on deep sea microorganism resource[J]. Chinese Bulletin of Life Sciences, 2012, 24(9) : 991–996. (in Chinese) 曾润颖, 产竹华. 深海微生物资源研究开发技术进展[J]. 生命科学, 2012, 24(9) : 991–996. |
| [2] | Xiao X, Wang FP. Research and development of deep-sea microbes[J]. Chinese Journal of Antibiotics, 2006, 31(2). (in Chinese) 肖湘, 王风平. 深海微生物的研究开发[J]. 中国抗生素杂志, 2006, 31(2). |
| [3] | Fredrickson JK, Romine MF, Beliaev AS, et al. Towards environmental systems biology of Shewanella[J]. Nature Reviews Microbiology, 2008, 6(8) : 592–603. DOI:10.1038/nrmicro1947 |
| [4] | Hau HH, Gralnick JA. Ecology and biotechnology of the genus Shewanella[J]. Annual Review of Microbiology, 2007, 61 : 237–258. DOI:10.1146/annurev.micro.61.080706.093257 |
| [5] | Nealson KH, Scott J. Ecophysiology of the genus Shewanella[J]. Prokaryotes, 2006, 6 : 1133–1151. |
| [6] | Bowler C, Karl DM, Colwell RR. Microbial oceanography in a sea of opportunity[J]. Nature, 2009, 459(7244) : 180–184. DOI:10.1038/nature08056 |
| [7] | Zhang C, Kim SK. Research and application of marine microbial enzymes: status and prospects[J]. Marine Drugs, 2010, 8(6) : 1920–1934. DOI:10.3390/md8061920 |
| [8] | Chen R. Bacterial expression systems for recombinant protein production: E.coli and beyond[J]. Biotechnology Advances, 2012, 30(5) : 1102–1107. DOI:10.1016/j.biotechadv.2011.09.013 |
| [9] | Rosano GL, Ceccarelli EA. Recombinant protein expression in Escherichia coli: advances and challenges[J]. Frontiers in Microbiology, 2014, 5(172). |
| [10] | Lauro FM, Eloe EA, Liverant N, et al. Conjugal vectors for cloning, expression, and insertional mutagenesis in Gram-negative bacteria[J]. Bio Techniques, 2005, 38(5) : 708–710. |
| [11] | Wang FP, Wang P, Chen MX, et al. Isolation of extremophiles with the detection and retrieval of Shewanella strains in deep-sea sediments from the west Pacific[J]. Extremophiles, 2004, 8(2) : 165–168. DOI:10.1007/s00792-003-0365-0 |
| [12] | Xiao X, Wang P, Zeng X, et al. Shewanella psychrophila sp. nov. and Shewanella piezotolerans sp. nov., isolated from west Pacific deep-sea sediment[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(1) : 60–65. DOI:10.1099/ijs.0.64500-0 |
| [13] | Wang FP, Wang JB, Jian HH, et al. Environmental adaptation: genomic analysis of the piezotolerant and psychrotolerant deep-sea iron reducing bacterium Shewan piezotolerans WP3[J]. PLoS One, 2008, 3(4) : e1937. DOI:10.1371/journal.pone.0001937 |
| [14] | Yang XW, Jian HH, Wang FP. pSW2, a novel low-temperature-inducible gene expression vector based on a filamentous phage of the deep-sea bacterium Shewanella piezotolerans WP3[J]. Applied and Environmental Microbiology, 2015, 81(16) : 5519–5526. DOI:10.1128/AEM.00906-15 |
| [15] | Miyake R, Kawamoto J, Wei YL, et al. Construction of a low-temperature protein expression system using a cold-adapted bacterium, Shewanella sp. strain Ac10, as the host[J]. Applied and Environmental Microbiology, 2007, 73(15) : 4849–4856. DOI:10.1128/AEM.00824-07 |
| [16] | Leary D, Vierros M, Hamon G, et al. Marine genetic resources: a review of scientific and commercial interest[J]. Marine Policy, 2009, 33(2) : 183–194. DOI:10.1016/j.marpol.2008.05.010 |
| [17] | Wang F, Wang FP, Li Q, et al. A novel filamentous phage from the deep-sea bacterium Shewanella piezotolerans WP3 is induced at low temperature[J]. Journal of Bacteriology, 2007, 189(19) : 7151–7153. DOI:10.1128/JB.00569-07 |
| [18] | Jian HH, Xu J, Xiao X, et al. Dynamic modulation of DNA replication and gene transcription in deep-sea filamentous phage SW1 in response to changes of host growth and temperature[J]. PLoS One, 2012, 7(8) : 41578. DOI:10.1371/journal.pone.0041578 |
 2017, Vol. 44
2017, Vol. 44