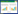扩展功能
文章信息
- 姚韧辉, 董卓, 李会, 许正宏
- YAO Ren-Hui, DONG Zhuo, LI Hui, XU Zheng-Hong
- 离子液体-水双相体系中Gibberella intermedia C1双羟化去氢表雄酮 (DHEA)
- Dihydroxylation of dehydroepiandro sterone (DHEA) by Gibberella intermedia C1 in an ionic liquid-water biphasic system
- 微生物学通报, 2017, 44(4): 859-864
- Microbiology China, 2017, 44(4): 859-864
- DOI: 10.13344/j.microbiol.china.160839
-
文章历史
- 收稿日期: 2016-11-18
- 接受日期: 2017-01-19
- 优先数字出版日期(www.cnki.net): 2017-01-19
2. 江南大学药学院 江苏 无锡 214122
2. Jiangnan University, School of Pharmaceutical Science, Wuxi, Jiangsu 214122, China
近年来甾体药物的应用领域不断扩大,在消炎、利尿、避孕、抗病毒以及抗肿瘤等方面有较好的疗效[1-2]。甾体药物是全球市场占有率第二大类药物,产业发展态势良好[3]。三羟基雄甾烯酮 (7α, 15α-diOH-DHEA) 是一种重要的医药中间体,可用于合成全球销量较大的口服避孕药“Yasmin”的活性成分屈螺酮[4]。利用Gibberella intermedia C1能够将去氢表雄酮 (dehydroepiandrosterone,DHEA) 转化为7α, 15α-diOH-DHEA[5](图 1),但是DHEA在水中的低溶解度极大地限制其双羟化效率[6]。目前,有机溶剂-水双相体系的应用有效解决了甾体底物水溶性差的问题,同时省去产物后续分离提取操作步骤[7]。但有机溶剂会影响微生物细胞结构和代谢过程,导致许多杂质的产生[8],并且有机溶剂的使用不仅污染环境,还会危害人体健康,无法满足绿色安全生产要求。
|
| 图 1 G.intermedia C1转化DHEA的反应式 Figure 1 Biotransformation of DHEA by G. intermedia C1 |
|
|
离子液体作为一种新型绿色化学溶剂,在生物催化领域中逐渐替代有机溶剂发挥较强的作用。2000年,Cull等首次将离子液体[Bmim][PF6]应用于Rhodococcus R312全细胞生物转化过程,成功将1, 3-异苯二甲腈转化为3-氰基苯甲酰胺和3-氰基苯甲酸[9];2001年,Howarth等成功将[Bmim][PF6]应用于固定化面包酵母还原酮类化合物的催化反应中[10]。Pfruender等实验证明Lactobacillus kefir、Escherichia coli、Saccharomyces cerevisiae三种细胞在[Bmim][PF6]、[Bmim][NTF2]、OMA[NTF2]离子液体-缓冲液溶液的两相体系中均能够维持良好的细胞膜完整性和生物催化能力[11-12]。Wu等在[Bmim][PF6]、[Bmim][NTF2]两种离子液体-水双相体系中研究了Rhizopus nigricans羟化甾体类底物16α, 17-环氧黄体酮生成11α-16α, 17-环氧黄体酮,发现[Bmim][PF6]离子液体对真菌细胞无明显毒害作用,并大幅度提高了底物转化效率。与传统有机溶剂相比,离子液体具有不易挥发、不易燃等优点,在真菌全细胞生物转化中具有巨大的应用潜力[13]。
基于以上分析,本文分别考察两种疏水性离子液体[Hmim][PF6]、[Bmim][PF6]和3种亲水性离子液体[Bmim][BF4]、[Bmim][NTF2]、[Emim][EtSO4]对G.intermedia C1双羟化DHEA反应的影响,构建合适的离子液体-水双相体系;并在此基础上,优化双羟化反应条件,以期进一步提高产物摩尔得率。
1 材料与方法 1.1 菌株G.intermedia C1,本实验室筛选并保藏。
1.2 主要试剂和仪器DHEA和7α, 15α-diOH-DHEA均为化学纯,浙江省台州市兴业化工有限公司;离子液体1-己基-3-甲基咪唑六氟磷酸盐 ([Bmim][PF6])、1-丁基-3-甲基咪唑六氟磷酸盐 ([Hmim][PF6])、1-乙基-3-甲基咪唑硫酸乙酯盐 ([Emim][EtSO4])、1-丁基-3-甲基咪唑四氟硼酸盐 ([Bmim][BF4]) 和1-丁基-3-甲基咪唑双三氟甲基磺酰亚胺盐 ([Bmim][NTF2]) 均为实验纯,上海成捷化学有限公司;乙腈 (色谱纯),国药集团化学试剂公司;其他试剂均为市售分析纯。
UltiMate 3000型液相色谱仪,美国戴安有限公司;Agilent TC-C18高效液相色谱柱,北京京科瑞达科技有限公司;HYL-C组合式摇床,太仓强乐实验设备有限公司;SPX-250B-Z型生化培养箱,上海博讯实业有限公司;梅特勒AL104电子天平,梅特勒-托利多公司。
1.3 培养基固体培养基 (g/L):葡萄糖10.0、酵母粉7.5、NaCl 1.5、KH2PO4 2.5、琼脂20.0,pH 7.0。种子培养基 (g/L):葡萄糖10.0、酵母粉7.5、NaCl 1.5、KH2PO4 2.5,pH 7.0。转化培养基 (g/L):葡萄糖10.0、酵母粉20.0、玉米浆9.0、FeSO4 0.1,pH 7.0。以上培养基灭菌条件均为0.1 MPa、15 min。
1.4 培养和转化方法 1.4.1 菌种活化: 将保藏于−80 ℃的G.intermedia C1接种至斜面固体培养基中,于28 ℃培养48 h,待斜面表面长出均匀白色菌丝体后置于4保存备用。 1.4.2 种子培养: 从斜面固体培养基挑取2–3环菌丝体接种于装有50 mL种子培养基的500 mL摇瓶中,30 ℃、220 r/min培养24 h。 1.4.3 菌体培养: 将种子液以4%接种量接种至装有30 mL转化培养基的250 mL摇瓶中,30 ℃、220 r/min培养24 h。 1.4.4 生物转化: 在上述培养了24 h的菌悬液中加入适量不同种类的离子液体和一定浓度的底物DHEA,随后将摇瓶30 ℃、220 r/min转化72 h。同时以不添加离子液体的转化实验为对照组。 1.4.5 5 L发酵罐转化: 在选取最适离子液体基础上,对其在摇瓶中筛选好的最佳转化条件进行5 L发酵罐放大实验。温度为30 ℃,搅拌转速为400 r/min,通气量为0.18 m3/h。通过自动流加40%的醋酸或10%的氢氧化钠来调控转化过程的pH为7.0。 1.5 分析方法 1.5.1 生物量的测定: 将离心管洗净并称管重,得到空离心管重,即为P0。在发酵过程中,取一定体积 (1 mL) 的菌液加入离心管中,离心弃去上清,再用无菌水将菌体洗涤3次。将菌体置于75烘箱中烘干至恒重。称量得到菌体加离心管的重量之和,为P1。P1与P0重量之差为菌体的生物量。 1.5.2 HPLC分析: 取500 μL发酵液,加入等体积乙酸乙酯振荡萃取,离心收集有机相,萃取7次合并萃取得到的有机相后烘干,得到白色固体粉末,用5倍体积的乙腈复溶,0.22 μm有机滤膜过滤。采用UltiMate 3000型液相色谱仪进行测定,色谱柱为Agilent TC-C18柱 (5 μm,4.6 mm×250 mm),柱温30,紫外检测器,检测波长为216 nm。流动相为乙腈:水为7:3 (体积比),流速为0.5 mL/min,进样量10 μL。产物摩尔得率计算方法:产物摩尔得率=(Cp×Ms)/(Cs×Mp)×100%
底物转化率=(Cs−C0)/Cs×100%
式中:C0、Cs,初始及检测点的底物DHEA的质量浓度 (g/L);Cp,待测转化液中产物的质量浓度 (g/L);Ms,底物摩尔质量 (g/mol);Mp,产物摩尔质量 (g/mol)。
2 结果与讨论 2.1 离子液体种类筛选考察了2种疏水性离子液体[Hmim][PF6]、[Bmim][PF6]和3种亲水性离子液体[Bmim][BF4]、[Bmim][NTF2]、[Emim][EtSO4]对G.intermedia C1双羟化DHEA反应的影响。此时,底物DHEA的投料浓度为4 g/L,离子液体添加浓度分别为低浓度0.8% (体积比) 和高浓度1.5% (体积比),结果见表 1。
| 离子液体种类 The types of ionic liquids |
离子液体添加浓度 The adding concentration of ionic liquids (%) |
生物量 Biomass (g/L) |
底物转化率 The conversion rate (%) |
产物得率 Product yield (%) |
| 对照组Control | 0 | 24.1±1.0 | 73.0±1.5 | 43.4±0.7 |
| [Hmim][PF6] | 0.8 | 20.3±1.2 | 58.1±0.7 | 24.4±1.0 |
| 1.5 | 15.5±0.8 | 37.7±0.5 | 13.0±0.2 | |
| [Bmim][PF6] | 0.8 | 18.3±0.7 | 41.7±1.0 | 19.7±0.9 |
| 1.5 | 15.5±0.5 | 30.1±1.4 | 10.1±0.4 | |
| [Bmim][BF4] | 0.8 | 18.8±0.8 | 61.8±1.8 | 36.3±1.8 |
| 1.5 | 14.2±1.1 | 64.2±1.4 | 38.2±1.6 | |
| [Bmim][NTF2] | 0.8 | 19.2±1.4 | 48.6±0.7 | 16.7±0.6 |
| 1.5 | 13.3±0.4 | 41.8±0.8 | 15.6±0.3 | |
| [Emim][EtSO4] | 0.8 | 24.2±1.4 | 85.6±1.8 | 51.0±1.2 |
| 1.5 | 22.3±1.2 | 65.6±1.3 | 42.5±0.4 |
由表 1可知:[Emim][EtSO4]离子液体-水双相体系中双羟化反应效果明显好于其他实验组。低浓度 (0.8%,体积比) 的[Emim][EtSO4]-水体系中产物7α, 15α-diOH-DHEA得率最高,达到51.0%±1.2%,与对照相比提高了17.5%;离子液体[Hmim][PF6]、[Bmim][PF6]、[Bmim][BF4]和[Bmim][NTF2]对菌体毒害作用明显,菌体的生物量较对照有所降低;同时,即使在低浓度条件下,底物DHEA转化率、7α, 15α-diOH-DHEA产物得率也明显低于对照组。据Couling等[14]的研究结果报道,离子液体对于生物转化反应的影响与离子液体结构相关;随着阳离子母体咪唑环上碳链的延长,离子液体亲脂性增强,从而增大了离子液体对细胞膜的损害,对菌体细胞毒害作用增强。本研究中用到的其他离子液体如[Hmim][PF6]、[Bmim][PF6]、[Bmim][NTF2]和[Bmim][BF4]阳离子咪唑环上的碳链较长,对赤霉菌及其酶系统具有一定的毒性。因此选取的最适离子液体为[Emim][EtSO4]。
2.2 Emim][EtSO4]浓度对DHEA双羟化反应的影响双相体系中,离子液体的添加浓度对甾体的生物转化反应至关重要,因此进一步考察了最适离子液体[Emim][EtSO4]的浓度对赤霉菌双羟化底物DHEA的影响 (图 2)。结果表明,随着离子液体浓度的提高,7α, 15α-diOH-DHEA的摩尔得率先增后减。当[Emim][EtSO4]离子液体添加浓度为0.8% (体积比) 时,底物转化率和产物得率均达到最高。因此,[Emim][EtSO4]的最适添加浓度为0.8%。

|
| 图 2 [Emim][EtSO4]离子液体浓度对DHEA双羟化反应的影响 Figure 2 The effects of the [Emim][EtSO4] concentrations on the dihydroxylation of DHEA |
|
|
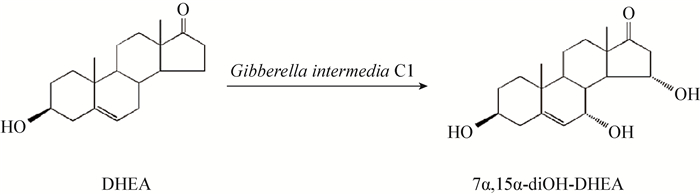
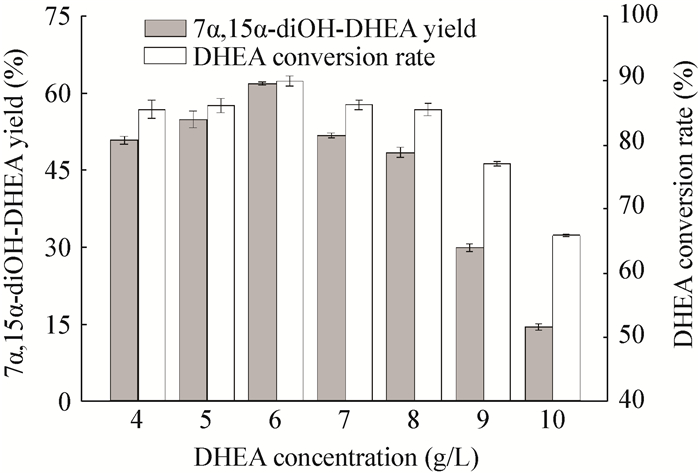
为了进一步提高目的产物7α, 15α-diOH-DHEA的得率,本文进一步提高了底物DHEA的投料浓度,考察了其浓度对[Emim][EtSO4]离子液体-水双相体系中转化反应的影响,结果如图 3所示。随着DHEA投料浓度的增大,7α, 15α-diOH-DHEA产物得率先上升后下降。当DHEA浓度为6 g/L时,底物的转化率及产物7α, 15α-diOH-DHEA的得率均达到最大,分别为90.0%±0.8%和62.0%±0.3%。当底物浓度进一步提高时,产物得率下降趋势比较显著。分析其原因可能是在[Emim][EtSO4]离子液体-水双相体系中底物DHEA传质阻力相对较小,增大DHEA投料浓度加重了对菌体的伤害,从而导致菌体羟化活力下降 (图 4)[15]。因此,在[Emim][EtSO4]离子液体-水双相体系中,底物DHEA的最适投料浓度为6 g/L。
|
| 图 3 不同底物DHEA投料的浓度对DHEA双羟化反应的影响 Figure 3 The effects of the substrate DHEA concentrations on the dihydroxylation of DHEA |
|
|
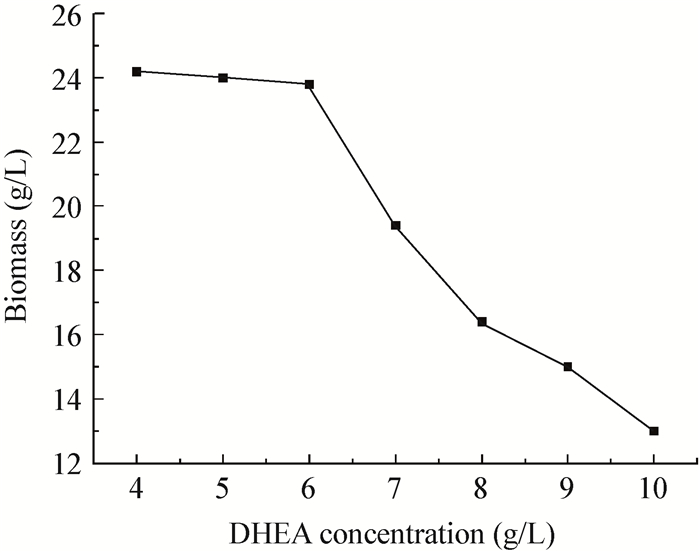
|
| 图 4 不同底物DHEA投料浓度对生物量的影响 Figure 4 The effects of the substrate DHEA adding concentrations on the biomass |
|
|
由于DHEA的双羟化反应主要由微生物细胞内的P450羟化酶发挥作用[3]。此类生物转化所采用的转化方式均是当菌体生长到一定阶段,即细胞中的P450羟化酶活性较高时,再进行底物DHEA的投加。因此,本研究在G.intermedia C1生长的不同时间 (0、6、12、18、24和30 h) 加入0.8% (体积比) 的[Emim][EtSO4]和6 g/L的DHEA至转化培养基,考察了底物投料时间对DHEA双羟化反应的影响 (图 5)。结果表明,在菌体生长后12 h投加底物转化时,底物DHEA转化率和7α, 15α-diOH-DHEA得率均较高,分别达到95.2%±0.3%和70.3%±1.0%。投料时间的提前或延后,底物DHEA转化率和7α, 15α-diOH-DHEA得率均有所降低。可能的原因是,菌体生长早期细胞的生长量与活力均不足,羟化酶活性较低。然而在菌体生长后期进行底物投料,菌体生长停滞,代谢缓慢,底物DHEA对羟化酶的诱导效果不显著,从而影响了菌株对底物DHEA的转化效率。在菌体生长12 h时,菌体代谢旺盛,羟化酶活性较高,因此有利于DHEA的双羟化反应。
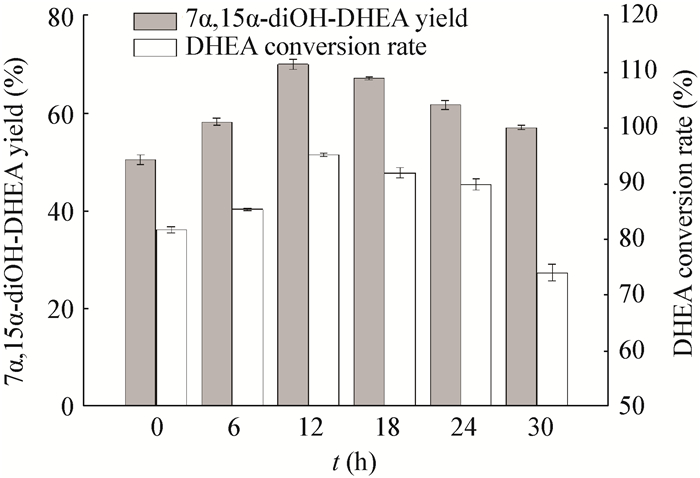
|
| 图 5 底物DHEA投料时间对DHEA双羟化反应的影响 Figure 5 The effects of the substrate DHEA adding times on the dihydroxylation of DHEA |
|
|
根据以上研究结果,最终确定了摇瓶中离子液体-水双相体系的最适转化条件为:菌体生长12 h后,向转化培养基中加入0.8% (体积比) [Emim][EtSO4]和6 g/L底物DHEA。在以上最适条件下,对体系进行了5 L发酵罐的放大实验,考察了在离子液体-水双相体系中G.intermedia C1双羟化DHEA的转化过程,如图 6所示。结果表明,在转化60 h时,产物7α, 15α-diOH-DHEA的浓度最高,达到5.03±0.21 g/L,其摩尔得率为75.5%。从而有效证明了构建的离子液体-水双相体系应用于G.intermedia C1双羟化反应具有操作简单、转化率高等优点。

|
| 图 6 5L发酵罐中赤霉菌转化底物DHEA的过程曲线 Figure 6 The bioconversion curve of Gibberella intermedia C1 from DHEA in 5 L fermentor |
|
|
离子液体具有良好的热稳定性和化学稳定性、毒性低且能够回收利用,是对环境友好的新型绿色溶剂,已逐渐取代挥发性有机溶剂应用于催化合成、分离分析等众多领域[16]。本文通过构建离子液体-水双相体系用于G.intermedia C1双羟化DHEA的反应中,有效改善了底物DHEA溶解度低的问题,提高产物7α, 15α-diOH-DHEA的得率。在摇瓶发酵时,当菌体生长12 h后,加入0.8% (体积比) 的[Emim][EtSO4]和6 g/L底物DHEA,产物得率达到62.0%。此外,进一步在5 L发酵罐中进行了放大实验,产物7α, 15α-diOH-DHEA的得率达到最高,提高至75.5%,转化时间也由摇瓶的72 h缩短至60 h。实验结果表明本文构建的离子液体-水双相转化体系具有操作简单、生物相容性好、有效提高转化率等优点,可成功应用于G.intermedia C1双羟化DHEA的转化体系中,为其规模化生产奠定一定的基础。
| [1] | Pollard DJ, Woodley MJ. Biocatalysis for pharmaceutical intermediates: The future is now[J]. Trends in Biotechnology, 2006, 25(2) : 66–73. |
| [2] | Mahato SB, Garai S. Advances in microbial steroid biotransformation[J]. Steroids, 1997, 62(4) : 332–345. DOI:10.1016/S0039-128X(96)00251-6 |
| [3] | Tong WY, Dong X. Microbial biotransformation: recent developments on steroid drugs[J]. Recent Patents on Biotechnology, 2009, 3(2) : 141–153. DOI:10.2174/187220809788700157 |
| [4] | Romano A, Romano D, Ragg E, et al. Steroid hydroxylations with Botryodiplodia malorum and Colletotrichum lini[J]. Steroids, 2006, 71(6) : 429–434. DOI:10.1016/j.steroids.2006.01.014 |
| [5] | Li H, Fu ZZ, Zhang XM, et al. The Efficient Production of 3β, 7α, 15α-Trihydroxy-5-Androsten-17-One from Dehydroepiandrosterone by Gibberella intermedia[J]. Applied Biochemistry and Biotechnology, 2014, 174(8) : 2960–2971. DOI:10.1007/s12010-014-1240-4 |
| [6] | Yang K, Li XJ, Feng X, et al. Effects of substrate dispersion and dissolution on microbial enzymatic conversion of steroid[J]. Microbiology China, 2001, 28(6) : 68–71. (in Chinese) 阳葵, 李晓静, 冯霞, 等. 底物的分散和溶解对甾体微生物酶反应的影响[J]. 微生物学通报, 2001, 28(6) : 68–71. |
| [7] | Fu ZZ. Studies on screening of Gibberella intermedia and its bioconversion conditions for the preparation of 3β, 7α, 15α-trihydroxy-5-androsten-l7-one[D]. Jiangsu: Master's Thesis of Jiangnan University, 2014 付珍珍. 生物转化制备三羟基雄甾烯酮赤霉菌的筛选及工艺优化[D]. 江苏: 江南大学硕士学位论文, 2014 |
| [8] | Zhang YQ, Wang DQ. Advances in microbial transformation of phytosterol into steroid medicine intermediates[J]. Microbiology China, 2006, 33(2) : 142–146. (in Chinese) 张裕卿, 王东青. 植物甾醇微生物转化制备甾体药物中间体的研究进展[J]. 微生物学通报, 2006, 33(2) : 142–146. |
| [9] | Cull S, Holbrey J, Vargas M, et al. Room-temperature ionic liquids as replacements for organic solvents in multiphase bioprocess operations[J]. Biotechnology and Bioengineering, 2000, 69(2) : 227–233. DOI:10.1002/(ISSN)1097-0290 |
| [10] | Howarth J, James P, Dai JF. Immobilized baker's yeast reduction of ketones in an ionic liquid, [Bmim]PF6 and water mix[J]. Tetrahedron Letters, 2001, 42(42) : 7517–7519. DOI:10.1016/S0040-4039(01)01601-X |
| [11] | Pfruender H, Amidjojo M, Kragl U, et al. Efficient whole-cell biotransformation in a biphasic ionic liquid/water system[J]. Angewandte Chemie International Edition, 2004, 43(34) : 4529–4531. DOI:10.1002/(ISSN)1521-3773 |
| [12] | Pfruender H, Jones R, Weuster BD, et al. Water immiscible ionic liquids as solvents for whole cell biocatalysis[J]. Journal of Biotechnology, 2006, 124(1) : 182–190. DOI:10.1016/j.jbiotec.2005.12.004 |
| [13] | Wu DX, Guan YX, H Q, et al. 11α-Hydroxylation of 16α, 17-epoxyprogesterone by Rhizopus nigricans in a biphasic ionic liquid aqueous system[J]. Bioresource Technology, 2011, 102(20) : 9368–9373. DOI:10.1016/j.biortech.2011.07.060 |
| [14] | Couling DJ, Bernot RJ, Docherty KM, et al. Assessing the factors responsible for ionic liquid toxicity to aquatic organisms via quantitative structure-property relationship modeling[J]. Green Chemistry, 2006, 8(18) : 82–90. |
| [15] | Li H, Fu ZZ, Li H, et al. Improvement of the steroid dihydroxylation efficiency from dehydroepiandrosterone using a substrate pre-induction biotransformation process[J]. Biotechnology and Bioprocess Engineering, 2013, 18(3) : 486–490. DOI:10.1007/s12257-012-0828-1 |
| [16] | Rogers RD, Seddon KR. Ionic liquids-solvents of the future?[J]. Science, 2003, 302(5646) : 792–793. DOI:10.1126/science.1090313 |
 2017, Vol. 44
2017, Vol. 44