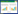扩展功能
文章信息
- 吴彬, 裴智鹏, 成骋, 吴斌, 何冰芳
- WU Bin, PEI Zhi-Peng, CHENG Cheng, WU Bin, HE Bing-Fang
- 利用指数流加补料高密度发酵产β-呋喃果糖苷酶重组大肠杆菌
- High density fermentation for beta-fructofuranosidase production by recombinant Escherichia coli BL21(DE3) using exponential fed-batch culture strategy
- 微生物学通报, 2017, 44(4): 766-773
- Microbiology China, 2017, 44(4): 766-773
- DOI: 10.13344/j.microbiol.china.160274
-
文章历史
- 收稿日期: 2016-03-31
- 接受日期: 2016-06-03
- 优先数字出版日期(www.cnki.net): 2016-09-05
2. 南京工业大学药学院 江苏 南京 211816
2. School of Pharmaceutical Sciences, Nanjing Tech University, Nanjing, Jiangsu 211816, China
β-呋喃果糖苷酶 (beta-fructofuranosidase,β-FFase,EC.3.2.1.26) 是一类具有高效果糖基水解和转移能力的糖苷酶。该酶不但可用于合成低聚果糖[1]和低聚乳果糖[2-3],还可用于天然药物的糖基化修饰[4-5],因此在食品以及医药行业有着广泛的应用前景。
β-呋喃果糖苷酶广泛存在于自然界,主要来源于真菌,如黑曲霉 (Aspergillus niger) 和酵母 (Saccharomyces cerevisiae) 等,然而利用黑曲霉生产β-呋喃果糖苷酶发酵周期普遍较长。2010年,Driouch等[6]分别采用批式发酵和补料反馈策略发酵产β-呋喃果糖苷酶的黑曲霉SKAn1015,酶活最高分别达到780 U/ml和2 800 U/ml,但发酵周期分别长达100 h和180 h。此外,2016年,Ali等[7]利用批次发酵策略,发酵酿酒酵母IIB-IX产β-呋喃果糖苷酶,酶活达到74 U/mL,但酶产量相对较低。
鉴于此,本实验室前期自行筛选得到β-呋喃果糖苷酶产生菌阿氏节杆菌NJEM01 (CCTCC M2012155)[4],通过构建带有信号肽pelB与β-呋喃果糖苷酶融合的表达质粒pET22b-pelB-β-ffase,以BL21(DE3) 为宿主得到胞外表达的重组大肠杆菌 (Escherichia coli) BL21(DE3)/pET22b-β-ffase[8],该酶具有独特的底物多样性和高效的寡糖合成能力[9-11]。
高密度发酵工艺[12]可进一步缩短发酵周期,提高生产效率,降低生产成本,简化产品纯化工艺。本研究通过比较指数流加策略中不同阶段比生长速率大小,优化诱导时机实现工程菌的高密度生长与目标酶的高产量表达,为后期果糖苷酶制剂的放大生产提供理论指导。
1 材料与方法 1.1 材料 1.1.1 菌种: β-呋喃果糖苷酶来源于本实验室前期筛选得到的菌株阿氏节杆菌NJEM01 (CCTCC M2012155)[4],β-呋喃果糖苷酶基因序列的相关专利号为CN102732456A[13]。本实验室前期通过构建带有信号肽pelB与β-呋喃果糖苷酶融合的表达质粒pET22b-pelB-β-ffase,导入宿主菌大肠杆菌BL21(DE3),获得胞外表达β-呋喃果糖苷酶的重组大肠杆菌BL21(DE3)/pET22b-β-ffase[8]。 1.1.2 培养基: LB培养基[14]、发酵培养基和补料培养基[15]。 1.1.3 主要试剂和仪器: 葡萄糖、蛋白胨和酵母粉,美国Invitrogen公司;异丙基-β-D-硫代吡喃半乳糖苷 (IPTG)、氯化钙、氯化钠和维生素,美国Sigma公司;25%氨水,昆山东梅化工有限公司。色谱系统为Dionex P680高效液相色谱仪,赛墨飞 (Thermo Scientific) 公司;生物传感分析仪SBA-40C型,山东科学院;752S紫外分光光度计,上海棱光技术有限公司;5 L发酵罐BIOTECH-5JG,上海保兴生物设备有限公司。 1.2 培养方法使用LB培养基进行种子液培养,之后将种子液按5%的接种量接入装有2 L发酵培养基的5 L发酵罐中,在37 ℃搅拌速率200 r/min,通空气量3 L/min,通过25%氨水调节控制pH在6.8±0.2条件下进行批式发酵,生长9 h后降温至28 ℃,加入终浓度为0.1 mmol/L的IPTG进行诱导表达。
1.3 分析方法 1.3.1 细胞干重和葡萄糖含量: 发酵过程中通过紫外分光光度计检测细胞密度OD600,细胞干重通过将待测菌液置于离心瓶中12 000 r/min离心10 min,去离子水洗涤,重复洗涤3次后置于75 ℃烘箱烘干至恒重,然后称重,并根据细胞干重DCW (y) 与OD600 (x) 线性回归方程y=0.412 7x+ 0.724 7 (R2=0.999 1) 得到细胞干重;用生物传感仪SBA-40C测葡萄糖含量。 1.3.2 酶活和蛋白分析: 取50 μL β-FFase酶液加入950 μL蔗糖底物溶液 (1 mol/L),置于45 ℃水浴锅中反应30 min后立即煮沸15 min,利用生物传感仪SBA-40C检测葡萄糖浓度,计算酶活力。每分钟产生1 μmol葡萄糖所需的酶量定义为一个酶活力单位 (U);发酵液上清蛋白采用SDS-PAGE进行分析。 1.3.3 乙酸测定: 采用高效液相色谱法 (RP-HPLC)[16]检测乙酸。分析柱为Kromasil100-5 C18 (4.6 mm× 250 mm,5 μm,100 A),紫外检测波长为210 nm,流速为1 mL/min,柱温为30 ℃,检测过程中通过稀释发酵液上清,控制乙酸浓度在0.1-1.0 g/L范围内。 1.3.4 指数补料方程: 指数流加补料实际上是通过控制比生长速率来控制限制性底物的流加速率,以此来控制细胞的生长速度,使得乙酸积累控制在临界点以下。计算补料流加率的公式[17]如下:

|
(1) |
其中,μ为比生长速率值,μset为设定比生长速率值;X0和V0为补料起始时细胞干重 (g/L) 和发酵液体积 (L);SF为补料培养基葡萄糖的浓度 (g/L);m为保持系数[g/(g·h)-0.025][18];YX/S为产出系数 (g/g),即每g葡萄糖可产生多少g细胞干重,通过公式 (2) 计算YX/S。
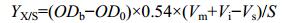
|
(2) |
其中,ODb为补料前发酵液的OD600值;OD0为发酵开始时的OD600值;0.54为1个单位OD600在1 L发酵液中含有的细胞干重为0.54;Vm为发酵合成培养基的初始体积 (L);Vi为发酵种子液的体积 (L);Vs为取样体积 (L);S为合成培养基中含有的葡萄糖的总量 (g)。
2 结果与分析 2.1 补料策略优化 2.1.1 指数流加补料与溶氧反馈补料两种策略对发酵产酶的影响: 溶氧反馈补料和指数流加补料策略能有效提高菌体密度,增加重组蛋白的表达量,因此是高密度发酵中常用的补料策略。2005年,岑仡等[19]报道控制溶氧大于30%有利于重组大肠杆菌菌体生长以及重组蛋白的表达;2014年,Schaepe等[15]报道了重组大肠杆菌比生长速率在0.10-0.30 h-1范围内生长时,更有利于菌体的生长以及产物的生成。研究分别比较溶氧反馈控制 (图 1a) 和指数流加补料调控策略 (图 1b) 对重组大肠杆菌BL21(DE3)/pET22b-β-ffase细胞生长以及重组蛋白表达的影响。由图 1a可见,溶氧反馈控制 (DO > 30%),最终发酵16 h得到细胞密度OD600约为98,细胞干重约为41 g/L,酶活约为4.9×104 U/L,单位菌体产酶量为1 195 U/g,产酶速率为9.84×103 U/(L·h),结果表明溶氧反馈控制尽管对菌体生长有利,但该发酵过程在发酵7 h时就开始积累乙酸,虽然菌体量高但酶活反而没有指数流加补料的酶活高。Nakano等[20]报道了乙酸积累是大肠杆菌细胞生长表达过程中的重要影响因素,因此推测溶氧反馈补料中的酶活不高可能是由于乙酸积累造成的。由图 1B可见,设置比生长速率为0.30 h-1的指数流加补料策略,发酵最终得到菌体OD600约为68,细胞干重为29 g/L,酶活为6.0×104 U/L,单位菌体产酶量为2 069 U/g,产酶速率为1.2×104 U/(L·h),该过程虽然菌体生物量比溶氧控制少,但在13 h时才开始乙酸积累,表明乙酸积累得到了较好的控制,单位菌体产酶量显著上升,是溶氧反馈控制的1.7倍。
|
| 图 1 补料方式对细胞生长和β-呋喃果糖苷酶表达的影响 Figure 1 Effects of feeding strategy on cell growth and β-FFase production 注:A:溶氧反馈补料 (DO > 30%);B:指数流加补料 (μ=0.30 h-1). Note: A: Dissolved oxygen feedback control (DO > 30%); B: Exponential fed-batch culture (μ=0.30 h-1). |
|
|
实验表明当发酵6 h时,溶氧急剧上升,意味着初始培养基中的葡萄糖消耗完,根据方法1.3.4中的公式 (2) 计算得产出系数YX/S约为0.47。根据方法1.3.4中的公式 (1),计算各比生长速率下的流加速率,进而控制流加补料速率。
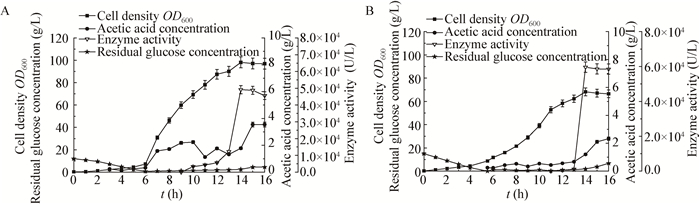
图 2与表 1结果表明,当以比生长速率为0.30 h-1生长时,发酵后期乙酸积累,菌体开始自溶,单位菌体产酶量较低,但当比生长速率为0.10 h-1时,菌体生长缓慢,单位菌体产酶量和产率都较低,生产强度不够,而在比生长速率为0.20 h-1时,菌体干重达到35 g/L,同时单位菌体产酶达到2 085 U/g,因此后期选择比生长速率为0.20 h-1作为前期指数流加补料的生长指标。Lindqvist等[23]和Johnston等[24]报道了过高的比生长速率易导致补料流速过快,同时可能导致乙酸积累引起酶失活和质粒不稳定,不利于菌体生长以及产酶。

|
| 图 2 比生长速率对细胞生长和β-呋喃果糖苷酶酶活的影响 Figure 2 Effects of specific growth rate on cell growth and β-FFase production Note: A: μ=0.30 h-1; B: μ=0.20 h-1; C: μ=0.10 h-1. |
|
|
| 项目 Item |
μset (h-1) | ||
| 0.10 | 0.20 | 0.30 | |
| 发酵周期 | 20 | 18 | 16 |
| Time (h) | |||
| 菌体密度 | 76 | 82 | 68 |
| Cell density (OD600) | |||
| 细胞干重 | 32 | 35 | 29 |
| Dry cell weight (g/L) | |||
| β-FFase酶活 | 6.3×104 | 7.3×104 | 6.0×104 |
| Enzyme activity (U/L) | |||
| 单位菌体产酶量 | 1 969 | 2 085 | 2 062 |
| Unit cell enzyme activity (U/g) | |||
| 产酶速率 |
1.05×104 | 1.46×104 | 1.20×104 |
| Enzyme production rate (U/(L·h)) | |||
发酵过程可分为诱导前和诱导后,双阶段比生长速率指数流加策略在诱导前补料流加主要为了菌体量的增加,诱导后补料流加主要为了重组蛋白的表达。在诱导前期使用较高比生长速率0.20 h-1可有效缩短菌体生长周期,但由上述实验结果可知,比生长速率0.20 h-1进行补料发酵,诱导开始后仍有一定量的乙酸积累,对菌体生长产酶有一定影响,因此诱导后通过降低比生长速率来避免乙酸积累对重组蛋白表达的抑制,选择比生长速率0.08、0.10、0.13、0.16 h-1进一步进行优化。
诱导后不同比生长速率对重组菌生长及产酶的影响见图 3与表 2,结果表明当诱导后μ为0.10 h-1时,菌体生物量最高,得到细胞干重50 g/L,酶活达到1.53×104 U/L,单位菌体产酶量达到3 060 U/g,产酶速率为2.55×104 U/(L·h),虽然比诱导后μ为0.13 h-1时总酶活高,但单位菌体产酶量和产酶速率均更低,而当比生长速率提高至0.16 h-1时,也有一定量的乙酸积累,酶活和产酶效率并不是最高的,表明诱导后低生长速度有利保持细胞完整性,自溶菌体少,且有利于表达蛋白的分泌,但是若比生长速率过低,生产周期长,强度低,产酶效率低。Puertas等[22]在比生长速率对重组大肠杆菌产蛋白影响的研究中表明较低的比生长速率有利于保持质粒的稳定性,促进菌体的生长和产酶的效能。双阶段指数流加诱导后比生长速率为0.13 h-1时,发酵产β-呋喃果糖苷酶重组大肠杆菌的细胞干重、酶活和单位菌体产酶量分别是前面单一比生长速率为0.20 h-1时的1.3、2.0和1.5倍。
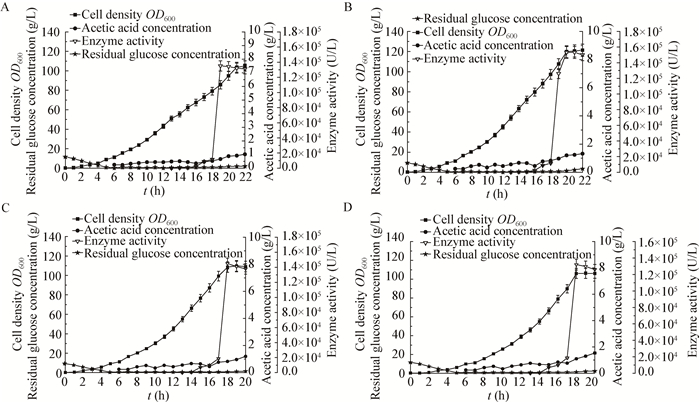
|
| 图 3 诱导后不同比生长速率对菌体密度以及产β-呋喃果糖苷酶的影响曲线 Figure 3 Effects of specific growth rate after induction on cell growth and β-FFase production 注:A:μ=0.08 h-1;B:μ=0.10 h-1;C:μ=0.13 h-1;D:μ=0.16 h-1.诱导前比生长速度均为0.20 h-1. Note: A: μ=0.08 h-1; B: μ=0.10 h-1; C: μ=0.13 h-1; D: μ=0.16 h-1. Before induction, the growth rate was 0.20 h-1. |
|
|
| 项目 Item |
μset (h-1) | |||
| 0.08 | 0.10 | 0.13 | 0.16 | |
| 发酵周期 | 22 | 22 | 20 | 20 |
| Time (h) | ||||
| 菌体密度 | 104 | 120 | 109 | 106 |
| Cell density (OD600) | ||||
| 细胞干重 | 44 | 50 | 46 | 45 |
| Dry cell weight (g/L) | ||||
| β-FFase酶活 | 1.28×105 | 1.53×105 | 1.46×105 | 1.32×105 |
| Enzyme activity (U/L) | ||||
| 单位菌体产酶量 | 2 910 | 3 060 | 3 174 | 2 933 |
| Unit cell enzyme activity (U/g) | ||||
| 产酶速率 | 1.83×104 | 2.55×104 | 2.92×104 | 2.64×104 |
| Enzyme production rate ((U/(L·h)) | ||||
大肠杆菌的发酵中,合适的诱导时机对工程菌重组蛋白的高效表达非常重要,且通常诱导时机选择在指数生长期间。刘维明等[25]报道了重组大肠杆菌诱导时机在指数期间对重组大肠杆菌的生长和产酶有利。本研究分别在指数期间选择指数前期、指数中期、指数中后期对产β-呋喃果糖苷酶重组大肠杆菌进行诱导,不同诱导时机的菌体生物OD600分别为39、46、59和69时加入终浓度为0.1 mmol/L IPTG进行诱导。
由表 3和图 4可知:诱导OD600为39和46时,细胞生物量和酶活并不高,且生长表达周期达到了22 h,推测此时诱导剂加入过早,IPTG对菌体生长和表达有一定抑制;然而当OD600为69时再进行诱导,菌体活力已经错过了最旺盛时期,单位菌体产酶量反而显著下降;菌体在对数生长中期OD600为59时诱导,最终细胞密度达到OD600为121,酶活达到1.79×105 U/L,单位菌体产酶量达到3 510 U/g,产酶速率达到3.58×104 U/(L·h),进一步提高了产酶能力。以上结果表明,诱导时机不仅会影响菌体生长,还会影响重组菌的产酶,因此在菌体最有活力时期进行诱导才可获得最高效的表达。叶逢春等[26]已报道了IPTG对菌体生长有一定抑制作用,过早进行诱导对菌体生长表达不利,与实验结果相符。
| 项目 Item |
OD600 | |||
| 39 | 46 | 59 | 69 | |
| 发酵周期 | 20 | 20 | 20 | 18 |
| Time (h) | ||||
| 菌体密度 | 99 | 109 | 121 | 112 |
| Cell density (OD600) | ||||
| 细胞干重 | 42 | 46 | 51 | 47 |
| Dry cell weight (g/L) | ||||
| β-FFase酶活 | 1.19×105 | 1.45×105 | 1.79×105 | 1.23×105 |
| Enzyme activity (U/L) | ||||
| 单位菌体产酶量 | 2 833 | 3 152 | 3 510 | 2 617 |
| Unit cell enzyme activity (U/g) | ||||
| 产酶速率 | 1.98×104 | 2.42×104 | 3.58×104 | 2.46×104 |
| Enzyme production rate (U/(L·h)) | ||||

|
| 图 4 诱导时机对菌体密度以及β-呋喃果糖苷酶的影响曲线 Figure 4 Effects of induction time on cell growth and β-FFase production Note: A: OD600=39; B: OD600=46; C: OD600=59; D: OD600=69. |
|
|
在上述优化后的最优条件下,对酶活力最高点时的发酵液上清进行蛋白胶分析 (图 5),看到发酵液上清中存在一大小约55 kD的蛋白条带,与前期研究得到的β-FFase条带大小一致[8],高纯度的蛋白有助于后期酶制剂的制备,为其工业化应用奠定了基础。

|
| 图 5 β-呋喃果糖苷酶β-FFase在重组菌株中胞外表达产物的SDS-PAGE图 Figure 5 SDS-PAGE analysis of extracellular proteins of recombinants 注:M:标准蛋白Marker;1:发酵液上清. Note: M: Protein marker; 1: Fermentation supernatant. |
|
|
本研究首次采用双阶段指数流加补料策略,进行重组大肠杆菌高密度发酵产β-呋喃果糖苷酶,确定了诱导前期比生长速率为0.20 h-1,诱导后期比生长速率为0.13 h-1的双阶段指数流加补料策略。优化条件下发酵18 h,细胞干重达到51 g/L,酶活最高达1.79×105 U/L,单位菌体产酶量达到3 510 U/g,产酶速率达到3.58×104 U/(L·h),细胞干重、单位菌体产酶量和产酶速率分别是是指数流加未优化前生物量与酶活的1.8、1.7和3.0倍。与国内外报道相比[6-7, 27-28],本研究显著提高了β-呋喃果糖苷酶生产强度,降低了生产成本。此外,本研究利用重组菌产β-呋喃果糖苷酶,得到高纯度的胞外表达蛋白,大大简化了下游分离纯化难度。研究成果为生物法制备低聚果糖和低聚乳果糖等功能性寡糖、天然药物的酶法改性等奠定了基础。
| [1] | Ozimek LK, Kralj S, van der Maarel MJ, et al. The levansucrase and inulosucrase enzymes of Lactobacillus reuteri 121 catalyse processive and non-processive transglycosylation reactions[J]. Microbiology, 2006, 152(4) : 1187–1196. DOI:10.1099/mic.0.28484-0 |
| [2] | Ito T, Fujita K, Hara K, et al. Cloning and expression of β-fructofuranosidase gene from Arthrobacter sp. K-1[J]. Journal of Applied Glycoscience, 2002, 49(3) : 291–296. DOI:10.5458/jag.49.291 |
| [3] | Tonozuk T, Tamaki A, Yokoi G, et al. Crystal structure of a lactosucrose-producing enzyme, Arthrobacter sp. K-1 β-fructofuranosidase[J]. Enzyme and Microbial Technology, 2012, 51(6/7) : 359–365. |
| [4] | He BF, Wu XM, Chu JL, et al. Fructose glycosylation puerarin, preparation method and application thereof: China, CN102443027A[P]. 2012-05-09 (in Chinese) 何冰芳, 吴薛明, 储建林, 等. 果糖基化葛根素及其制备方法与用途: 中国, CN102443027A[P]. 2012-05-09 |
| [5] | He BF, Wu XM, Chu JL, et al. Fructose glycation mangiferin and preparation method and application thereof: China, CN102863484A[P]. 2013-01-09 (in Chinese) 何冰芳, 吴薛明, 储建林, 等. 果糖基化芒果苷及其制备方法与用途: 中国, CN102863484A[P]. 2013-01-09 |
| [6] | Driouch H, Roth A, Dersch P, et al. Optimized bioprocess for production of fructofuranosidase by recombinant Aspergillus niger[J]. Applied Microbiology and Biotechnology, 2010, 87(6) : 2011–2024. DOI:10.1007/s00253-010-2661-9 |
| [7] | Ali S, Aslam A, Hayyat MU. Double mutation of Saccharomyces cerevisiae for enhanced β-D-fructofuranosidase fructohydrolase productivity and application of growth kinetics for parametric significance analysis[J]. Brazilian Journal of Microbiology, 2016, 47(1) : 136–142. DOI:10.1016/j.bjm.2015.11.024 |
| [8] | Su H, Chen QZ, He BF. Expression, purification, and crystallization of an organic solvent-tolerant β-fructofuranosidase[J]. Microbiology China, 2015, 42(11) : 2126–2132. (in Chinese) 苏汇, 陈琼珍, 何冰芳. 耐有机溶剂果糖苷酶的胞外表达、纯化和结晶[J]. 微生物学通报, 2015, 42(11) : 2126–2132. |
| [9] | Wu XM, Chu JL, Wu B, et al. An efficient novel glycosylation of flavonoid by β-fructosidase resistant to hydrophilic organic solvents[J]. Bioresource Technology, 2013, 129 : 659–662. DOI:10.1016/j.biortech.2012.12.041 |
| [10] | Wu XM, Chu JL, Liang JY, et al. Efficient enzymatic synthesis of mangiferin glycosides in hydrophilic organic solvents[J]. RSC Advances, 2013, 3(41) : 19027–19032. DOI:10.1039/c3ra42648c |
| [11] | Chu JL, Wu XM, Wu B, et al. Characteristics of an organic solvent-tolerant β-fructofuranosidase from Arthrobacter arilaitensis NJEM01 and efficient synthesis of prebiotic kestose[J]. Journal of Agricultural and Food Chemistry, 2014, 62(24) : 5408–5411. DOI:10.1021/jf5020523 |
| [12] | Shiloach J, Fass R. Growing E. coli to high cell density-A historical perspective on method development[J]. Biotechnology Advances, 2006, 23(5) : 345–357. |
| [13] | He BF, Wang R, Wu XM, et al. Organic solvent-tolerant glycosidase Fru6, its mutants and its applications: China, CN102732456A[P]. 2012-10-17 (in Chinese) 何冰芳, 王瑞, 吴薛明, 等. 耐有机溶剂糖苷酶Fru6及其突变体和应用: 中国, CN102732456A[P]. 2012-10-17 |
| [14] | Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual[M]. Huang PT, trans. 2nd edition. Beijing: Science Press, 2002 (in Chinese) 萨姆布鲁克J, 拉塞尔DW.分子克隆实验指南[M].黄培堂, 译.第2版.北京:科学出版社, 2002 |
| [15] | Schaepe S, Kuprijanov A, Simutis R, et al. Avoiding overfeeding in high cell density fed-batch cultures of E. coli during the production of heterologous proteins[J]. Journal of Biotechnology, 2014, 192 : 146–153. DOI:10.1016/j.jbiotec.2014.09.002 |
| [16] | Suárez DC, Kilikian BV. Acetic acid accumulation in aerobic growth of recombinant Escherichia coli[J]. Process Biochemistry, 2000, 35(9) : 1051–1055. DOI:10.1016/S0032-9592(00)00140-0 |
| [17] | Lee Y, Lee SY. Enhanced production of poly (3-hydroxybutyrate) by filamentation-Suppressed recombinant Escherichia coli in a defined medium[J]. Journal of environmental polymer degradation, 1996, 4(2) : 131–134. DOI:10.1007/BF02074874 |
| [18] | Korz DJ, Rinas U, Hellmuth K, et al. Simple fed-batch technique for high cell density cultivation of Escherichia coli[J]. Journal of Biotechnology, 1995, 39(1) : 59–65. DOI:10.1016/0168-1656(94)00143-Z |
| [19] | Cen Y, Tong Y, Yang F. Effect of dissolved oxygen on high density fermentation of E. coli in producing rhG-CSF[J]. Journal of Pharmaceutical Practice, 2005, 29(3) : 197–231. (in Chinese) 岑仡, 童涌, 杨峰. 溶氧浓度对rhG-CSF工程菌高密度发酵的影响[J]. 药学实践杂志, 2005, 29(3) : 197–231. |
| [20] | Nakano K, Rischke M, Sato S, et al. Influence of acetic acid on the growth of Escherichia coli K12 during high-cell-density cultivation in a dialysis reactor[J]. Applied Microbiology and Biotechnology, 1997, 48(5) : 597–601. DOI:10.1007/s002530051101 |
| [21] | Riesenberg D. High-cell-density cultivation of Escherichia coli[J]. Current Opinion in Biotechnology, 1991, 2(3) : 380–384. DOI:10.1016/S0958-1669(05)80142-9 |
| [22] | Puertas JM, Ruiz J, de la Vega MR, et al. Influence of specific growth rate over the secretory expression of recombinant potato carboxypeptidase inhibitor in fed-batch cultures of Escherichia coli[J]. Process Biochemistry, 2010, 45(8) : 1334–1341. DOI:10.1016/j.procbio.2010.04.024 |
| [23] | Lindqvist R, Barmark G. Specific growth rate determines the sensitivity of Escherichia coli to lactic acid stress: Implications for predictive microbiology[J]. BioMed Research International, 2014, 2014(10) : 471317. |
| [24] | Johnston W, Cord-Ruwisch R, Cooney M. Industrial control of recombinant E. coli fed-batch culture: new perspectives on traditional controlled variables[J]. Bioprocess and Biosystems Engineering, 2002, 25(2) : 111–120. DOI:10.1007/s00449-002-0287-8 |
| [25] | Liu WM, Yang ZJ, Luo JX, et al. Optimization of fermentation conditions of recombinant E. coli for coexpression of leucine dehydrogenase and formate dehydrogenase[J]. Chinese Journal of Bioprocess Engineering, 2015, 13(4) : 23–28. (in Chinese) 刘维明, 杨震炯, 罗积杏, 等. 重组大肠杆菌共表达亮氨酸脱氢酶和甲酸脱氢酶发酵条件优化[J]. 生物加工过程, 2015, 13(4) : 23–28. |
| [26] | Ye FC, Chen Y, Xing XH. Optimization of cultivation conditions of recombinant E. coli for production of soluble MBP-fused heparinase Ⅰ[J]. Chinese Journal of Bioprocess Engineering, 2006, 4(3) : 28–32. (in Chinese) 叶逢春, 陈银, 邢新会. 重组大肠杆菌生产可溶性MBP融合肝素酶的培养条件优化[J]. 生物加工过程, 2006, 4(3) : 28–32. |
| [27] | lvaro-Benito M, de Abreu M, Portillo F, et al. New insights into the fructosyltransferase activity of Schwanniomycesoccidentalis β-fructofuranosidase, emerging from nonconventional codon usage and directed mutation[J]. Applied and Environmental Microbiology, 2010, 76(22) : 7491–7499. DOI:10.1128/AEM.01614-10 |
| [28] | Dhake AB, Patil MB. Effect of substrate feeding on production of fructosyltransferase by Penicillium purpurogenum[J]. Brazilian Journal of Microbiology, 2007, 38(2) : 194–199. DOI:10.1590/S1517-83822007000200002 |
 2017, Vol. 44
2017, Vol. 44