扩展功能
文章信息
- 姚焱彬, 李倩文, 杨志鹏, 陆萍, 魏建忠, 孙裴, 李郁
- YAO Yan-Bin, LI Qian-Wen, YANG Zhi-Peng, LU Ping, WEI Jian-Zhong, SUN Pei, LI Yu
- 检测猪丹毒杆菌抗体重组SpaA ELISA的建立
- Development of recombinant SpaA-based ELISA for detection of antibodies against swine erysipelas
- 微生物学通报, 2017, 44(3): 739-748
- Microbiology China, 2017, 44(3): 739-748
- DOI: 10.13344/j.microbiol.china.160233
-
文章历史
- 收稿日期: 2016-03-22
- 接受日期: 2016-06-14
- 优先数字出版日期(www.cnki.net): 2016-06-21
2. 安徽省畜禽产业共性技术研究院 安徽 合肥 230036
2. Anhui Institute of Generic Industrial Science and Technology in Livestock and Poultry, Hefei, Anhui 230036, China
猪丹毒 (Swine erysipelas) 是由猪丹毒杆菌 (Erysipelothrix rhusiopathiae) 引起的一种人畜共患传染病,其临诊特征主要为高热、急性败血症、皮肤疹块、慢性疣状心内膜炎及皮肤坏死与多发性非化脓性关节炎[1]。目前,该病在世界上大多数国家都有分布,呈散发或流行性发生,给养猪业造成了很大的经济损失,也给人体健康带来威胁。
由SpaA基因编码的猪丹毒杆菌表面保护性抗原 (Surface protective antigen,Spa) 分为三类,即SpaA、SpaB、SpaC,目前研究最多的是SpaA蛋白。SpaA基因的大小为1 881 bp,它所编码的SpaA蛋白主要是由N端的免疫保护性区域 (Immunoprotection domain) 和C端的细胞结合区域 (Cell-binding domain) 组成。研究表明,SpaA蛋白具有良好的免疫原性,能激发机体产生具有保护性的中和抗体[2],是猪丹毒杆菌的主要免疫保护性抗原,而且该抗原几乎存在于所有毒力较强的猪丹毒杆菌中[3]。
目前,猪丹毒杆菌抗体检测技术主要包括免疫荧光抗体实验 (Immunofluorescent antibody,IFA)、间接血凝实验 (Indirect hemagglutination test,IHA)、酶联免疫吸附实验 (Enzyme-linked immunosorbent assay,ELISA)[4-5]等。其中,IFA敏感可靠但需要昂贵的仪器设备,IHA敏感度较低且不能实现高通量的检测样本,而ELISA则具有操作简便、价格低廉、试验周期短、快速敏感、无需复杂仪器设备、易于大批量检测等优点。Imada等以猪丹毒杆菌SpaA蛋白作为包被抗原建立了间接ELISA方法,既能评价母源抗体水平和疫苗免疫效果,也能进行野毒感染的监测[6]。Giménez-Lirola等采用SpaA蛋白建立的间接ELISA方法可测定不同血清型猪丹毒杆菌抗体,不仅样品批量大,而且检测结果稳定[7]。本实验将临床分离的猪丹毒杆菌 (1a型) SpaA基因克隆到原核表达载体pGEX-6P-1(+) 构建重组质粒pGEX-6P-1-SpaA,在E. coli Rosetta (DE3) 菌中进行优化表达,表达的重组蛋白进行SDS-PAGE和Western blot分析。以纯化回收后SpaA重组蛋白作为包被抗原建立猪丹毒杆菌抗体的间接ELISA检测方法,并将检测结果与美国TSZ公司猪丹毒杆菌抗体检测试剂盒和western blot检测结果进行对比。旨在研发一种简便、快速、特异的检测方法,为猪群免疫监测和猪丹毒流行病学调查提供技术支撑。
1 材料与方法 1.1 菌株、载体和血清及培养基猪丹毒杆菌HF20120609 (1a型),大肠杆菌 (E. coli) DH5α、Rosetta (DE3) 菌株,原核表达载体pGEX-6P-1,猪丹毒杆菌阴性血清和阳性血清,传染性胸膜肺炎放线杆菌 (APP),猪圆环病毒2型 (PCV2),猪伪狂犬病毒 (PRV),副猪嗜血杆菌 (HPS),猪瘟病毒 (CSFV),猪传染性胃肠炎病毒 (TGEV) 阳性血清,均由安徽农业大学动物传染病实验室保存提供;待检血清采自安徽地区部分猪场;含0.6%酵母浸膏胰酪胨大豆肉汤 (TSB-YE)、含0.6%酵母浸膏胰酪胨大豆琼脂 (TSA-YE)、LB肉汤购自绍兴天恒生物科技有限公司。
1.2 主要试剂和仪器限制性内切酶BamH Ⅰ和Xho Ⅰ、T4 DNA连接酶、Marker DL2000、10×Loading buffer购自宝生物工程 (大连) 有限公司;DNA胶回收试剂盒和质粒抽提试剂盒购自天根生物有限公司;谷胱甘肽GST琼脂糖凝胶FF购自北京瑞达恒辉科技发展有限公司;新生小牛血清购自杭州四季青有限公司;牛血清蛋白 (BSA)、3, 3′, 5, 5′-四甲基联苯胺 (TMB)显色液、未预染和预染标准蛋白Marker、甘氨酸、异丙基-β-D-硫代半乳糖苷 (IPTG)、氨苄青霉素 (Amp)、30%丙烯酰胺溶液、考马斯亮蓝R250、β-巯基乙醇和二氨基联苯胺 (DAB) 购自上海生工生物工程技术服务有限公司;十二烷基硫酸钠 (SDS)、过硫酸铵、三羟甲基氨基甲烷 (Tris碱)、HRP标记羊抗猪IgG抗体 (IgG-HRP) 购自SIGMA公司;酶标板购自美国Costar公司;商品化猪丹毒杆菌抗体检测试剂盒购自美国TSZ公司 (P8823)。台式高度冷冻离心机购自德国BECKMAN公司;Tprofessional ThermoCycler梯度PCR仪购自德国耶拿分析仪器股份公司。
1.3 目的蛋白的表达及鉴定 1.3.1 引物的合成: 根据GenBank中已登录的猪丹毒杆菌SpaA基因主要免疫保护区N端序列 (登录号EF688017.1),设计一对特异性引物,预期扩增片段为1 266 bp,引物由宝生物工程有限公司合成。引物序列如下 (下划线部分为BamH Ⅰ和Xho Ⅰ酶切位点):P1:5′-CGCGGATCCATGGATTCGACA GATATTTCTGTGA-3′;P2:5′-CCGCTCGAGATTC GATTCGGGTTTTGATTGA-3′。
1.3.2 目的片段扩增及重组质粒的构建: 采用煮沸法提取细菌基因组DNA为模板,进行PCR扩增。反应体系:PCR Master mix 12.5 μL,10 μmol/L上下游引物各1 μL,1 μg/L DNA模板1 μL,灭菌双蒸水9.5 μL。反应条件:95 ℃ 5 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 90 s,35个循环;72 ℃ 10 min。反应结束后,将PCR产物于1.0%的琼脂糖凝胶进行电泳,并用DNA凝胶回收试剂盒回收目的片段。目的片段和pGEX-6P-1载体用BamH Ⅰ和Xho Ⅰ双酶切后经琼脂糖凝胶电泳回收,两者用T4 DNA连接酶于16 ℃连接过夜,连接产物转化入E. coli DH5α感受态细胞,涂布于含100 mg/L的Amp的LB平板。PCR菌落鉴定阳性的克隆进一步作测序鉴定。测序由金斯瑞生物技术有限公司进行。 1.3.3 SpaA重组蛋白表达及纯化: 重组质粒转化表达菌E. coli Rosetta (DE3) 感受态细胞,挑取单菌落接种于含50 mg/L Amp的2 mL LB液体培养基中,37 ℃、120 r/min振荡培养过夜,待其生长至对数期时 (OD620为0.6),加入IPTG诱导,摸索最佳诱导条件表达,离心收集菌体。经超声破碎菌体后,离心收集超声上清与谷胱甘肽GST琼脂糖凝胶FF在室温条件下振荡结合1 h,用20 mmol/L谷胱甘肽溶液洗脱得到纯化目的蛋白。用核酸蛋白仪测定纯化后的重组蛋白含量,并进行SDS-PAGE分析。 1.3.4 SpaA重组蛋白的Western blot分析: 将纯化后的重组蛋白转印到硝酸纤维素膜上,含5%脱脂奶粉的封闭液中4 ℃过夜,以猪丹毒杆菌阳性血清 (1:100稀释) 为一抗,37 ℃作用1 h,洗膜后用羊抗猪IgG-HRP (1:2 000稀释) 为二抗,37 ℃作用1 h,最后在DAB缓冲溶液中显色。 1.4 SpaA重组蛋白间接ELISA方法的建立 1.4.1 间接ELISA主要操作步骤: 将纯化重组蛋白进行适当稀释后加入酶标板,4 ℃包被过夜;PBST (PBS中加入0.05%吐温20) 洗涤3次,加入1% BSA,37 ℃封闭1 h;PBST洗涤3次后加入稀释的血清,37 ℃作用1 h;PBST洗涤3次后加入稀释的羊抗猪IgG-HRP,37 ℃作用1 h;PBST洗涤3次后加入TMB底物显色,加入终止液,测定OD450值。每个稀释度3个重复,取其平均值,计算每个条件下OD450, P/OD450, N值。选择阳性血清OD450值接近1.0,OD450, P/OD450, N值最大的反应组合作为间接ELISA的最佳反应条件[8]。 1.4.2 最佳抗原包被浓度和血清稀释度的确定: 采用方阵滴定法确定最佳抗原包被浓度和血清稀释度。以pH 9.6的碳酸盐缓冲液将纯化重组蛋白作4个浓度梯度,分别稀释至终浓度为4.0、2.0、1.0、0.5 mg/L,4 ℃过夜包被酶标板。猪丹毒杆菌阴性血清和阳性血清均按1:50、1:100、1:200、1:400倍稀释后进行方阵试验,测定OD450值。 1.4.3 封闭液种类的确定: 以1% BSA、2% BSA、1%明胶、2%脱脂奶粉、5%血清为封闭液,37 ℃封闭2 h,按照ELISA操作程序测定。重复3次操作,取平均值,计算P/N值。 1.4.4 一抗最佳作用时间的选择: 加入一抗后,分别在37 ℃作用30、60、90 min后进行间接ELISA测定。重复3次操作,取平均值,计算P/N值。 1.4.5 二抗浓度的选择: 按照上述确定好的最佳条件依次进行包被、封闭、加入阴性血清和阳性血清后,将羊抗猪IgG-HRP分别做1:800、1:1 000、1:2 000、1:3 000稀释,按照间接ELISA方法测定。重复3次操作,取平均值,计算P/N值。 1.4.6 二抗作用时间的选择: 按照最佳条件进行包被、封闭、加样,加入二抗后37 ℃分别孵育30、45、60 min,按照间接ELISA方法测定。重复3次操作,取平均值,计算P/N值。 1.4.7 显色时间的确定: 按照已确定的最佳条件进行间接ELISA试验,最后加入TMB后分别显色5、10、15 min后测定OD450值,重复3次操作,取平均值,计算P/N值。 1.4.8 临界值的确定: 按照上述建立的间接ELISA方法检测30份已知猪丹毒杆菌抗体阴性血清,在最佳反应条件下进行间接ELISA试验,测定其OD450值并进行统计学分析,计算平均值x和标准差s,以OD450 < x+2s作为阴性判定标准,OD450≥x+3s作为阳性判定标准,介于两者之间者则判为可疑[8]。 1.5 特异性试验用建立的间接ELISA方法检测未经稀释的APP、HPS、PCV2、PRV、CSFV、TGEV阳性血清,同时设置猪丹毒杆菌阳性、阴性血清对照,分析该检测方法的特异性。
1.6 重复性试验在相同试验条件下,随机选取4份猪丹毒杆菌抗体水平不同的血清样品,每份血清样品平行做6个重复,用同一批次包被的纯化重组抗原建立的ELISA方法检测,结果进行统计学分析,以检测批内重复性。在相同试验条件下,随机选取4份猪丹毒杆菌抗体水平不同的血清样品,每份血清样品平行做3个重复,取平均值,用6个不同批次包被的纯化重组蛋白建立的ELISA方法检测,结果进行统计学分析,以检测批间重复性。
1.7 比对试验临床采集90份猪丹毒疫苗免疫后的健康猪血清样品,应用建立的间接ELISA方法以及美国TSZ公司生产的商品化试剂盒同步进行猪丹毒杆菌抗体的检测,比较检测结果,计算二者符合率、敏感性和特异性。符合率=(阳性结果相同样本数+阴性结果相同样本数)/总样本数;敏感性=阳性结果相同样本数/商品化试剂盒检测的阳性样本数;特异性=阴性结果相同样本数/商品化试剂盒检测的阴性样本数。
临床采集54份猪丹毒疫苗免疫后的健康猪血清样品,应用建立的间接ELISA方法进行猪丹毒杆菌抗体的检测,同时采用Western blot进行鉴定。比较检测结果,计算二者符合率、敏感性和特异性。
2 结果与分析 2.1 SpaA基因的扩增经PCR扩增和琼脂糖凝胶电泳检测,得到与预期片段大小 (1 266 bp) 相符的DNA条带 (图 1)。
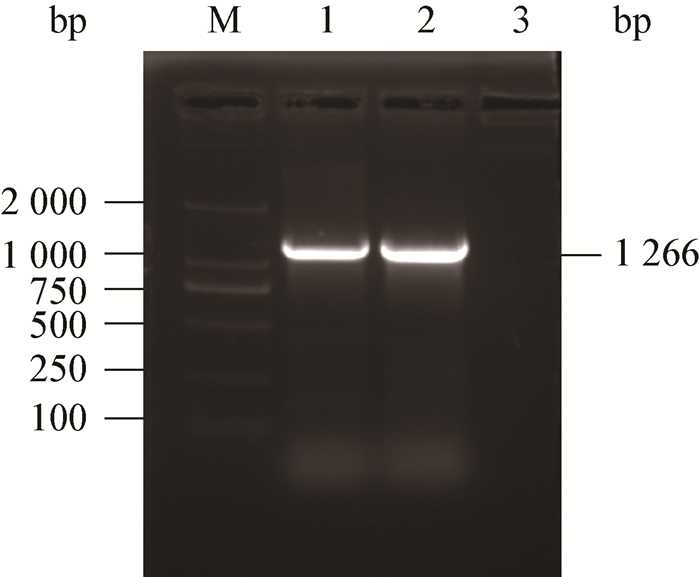
|
| 图 1 猪丹毒杆菌SpaA基因PCR扩增结果 Figure 1 PCR amplification of SpaA gene of Erysipelothrix rhusiopathiae 注:M:DNA marker DL2000;1-2:SpaA PCR产物;3:阴性对照. Note: M: DNA marker DL2000; 1-2: PCR product of SpaA; 3: Negative control. |
|
|
将经PCR鉴定为阳性的重组质粒双酶切后,可见约1 266 bp的目的条带和4 900 bp的质粒条带 (图 2)。重组质粒pGEX-6P-1-SpaA的测序结果显示,片段大小与预期相符。

|
| 图 2 重组质粒的双酶切鉴定 Figure 2 Restrictive digestion of recombinant plasmid 注:M:Marker DL10000;1:BamHⅠ/XhoⅠ双酶切重组质粒pGEX-6P-1-SpaA;2:阴性对照. Note: M: Marker DL10000; 1: Digested pGEX-6P-1-SpaA; 2: Negative control. |
|
|
经IPTG (终浓度0.6 mmol/L) 37 ℃诱导4 h时蛋白表达量最大,在预期的75 kD处出现目的蛋白条带。重组蛋白主要以可溶性蛋白形式存在。纯化后的重组蛋白含量为232 mg/L (图 3)。

|
| 图 3 重组SpaA蛋白表达与纯化的SDS-PAGE分析 Figure 3 SDS-PAGE analysis of recombinant SpaA protein expression and purification 注:M:蛋白质分子质量标准;1:诱导后重组菌裂解物;2:诱导前重组菌裂解物;3:诱导后的pET-32a (+) 重组菌;4:超声上清;5:超声沉淀;6:纯化前的重组蛋白;7:纯化后的重组蛋白. Note: M: Protein molecular weight marker; 1: Recombinant bacterial extract after induction; 2: Recombinant bacterial extract before induction; 3: Induced pET-32a (+) recombinant; 4: Supernatant after ultrasonic disruption; 5: Pellets after ultrasonic disruption; 6; Recombinant protein before purification; 7: Purified recombinant protein. |
|
|
Western blot结果显示,在75 kD处出现明显的特异性条带,而非诱导后的裂解产物则无特异性条带,表明目的基因在E. coli Rosetta (DE3) 中得到正确表达,表达产物能够与猪丹毒杆菌阳性血清发生特异性结合,具有良好的反应原性 (图 4)。

|
| 图 4 重组蛋白的Western blot鉴定 Figure 4 Western blot analysis of recombinant SpaA protein 注:M:蛋白质分子质量标准;1:诱导后的裂解产物;2:非诱导后的裂解产物. Note: M: Protein marker; 1: Lysate of induced bacteria; 2: Lysate of non-induced bacteria. |
|
|
| 抗原包被浓度 Coating concentration of antigen (μg/mL) |
指标 Index |
血清稀释度Serum dilutions | |||
| 1:50 | 1:100 | 1:200 | 1:400 | ||
| 4 | OD450, P | 1.403 | 1.151 | 0.834 | 0.526 |
| OD450, N | 0.463 | 0.238 | 0.189 | 0.148 | |
| OD450, P/OD450, N | 3.030 | 4.840 | 4.410 | 3.550 | |
| 2 | OD450, P | 1.225 | 1.103 | 0.664 | 0.659 |
| OD450, N | 0.358 | 0.259 | 0.177 | 0.154 | |
| OD450, P/OD450, N | 3.420 | 4.260 | 3.750 | 4.280 | |
| 1 | OD450, P | 1.398 | 1.074 | 0.707 | 0.473 |
| OD450, N | 0.394 | 0.210 | 0.174 | 0.142 | |
| OD450, P/OD450, N | 3.550 | 5.110 | 4.060 | 3.330 | |
| 0.5 | OD450, P | 1.279 | 1.118 | 0.653 | 0.518 |
| OD450, N | 0.371 | 0.244 | 0.209 | 0.156 | |
| OD450, P/OD450, N | 3.450 | 4.580 | 3.120 | 3.320 | |
| 指标 Index |
1% BSA | 2% BSA | 5%胎牛血清 5% Fetal bovine serum |
2%脱脂奶粉 2% Skimmed milk powder |
1%明胶 1% Gelatin |
| OD450, P | 0.962 | 1.349 | 1.716 | 0.804 | 0.686 |
| OD450, N | 0.220 | 0.363 | 0.644 | 0.263 | 0.329 |
| OD450, P/ OD450, N | 4.370 | 3.720 | 2.660 | 3.060 | 2.090 |
| 指标 Index |
30 min | 60 min | 90 min |
| OD450, P | 0.845 | 1.035 | 1.331 |
| OD450, N | 0.192 | 0.215 | 0.383 |
| OD450, P/OD450, N | 4.400 | 4.810 | 3.480 |
| 二抗稀释倍数 Goat-anti-swine-HRP dilution |
OD450, P | OD450, N | OD450, P/OD450, N |
| 1:800 | 1.441 | 0.371 | 3.880 |
| 1:1 000 | 1.062 | 0.214 | 4.960 |
| 1:2 000 | 0.756 | 0.199 | 3.800 |
| 1:3 000 | 0.493 | 0.135 | 3.650 |
| 指标 Index |
30 min | 45 min | 60 min |
| OD450, P | 0.730 | 1.152 | 1.351 |
| OD450, N | 0.192 | 0.216 | 0.297 |
| OD450, P/OD450, N | 3.800 | 5.330 | 4.550 |
| 指标 Index |
5 min | 10 min | 15 min |
| OD450, P | 0.746 | 1.157 | 1.429 |
| OD450, N | 0.126 | 0.193 | 0.397 |
| OD450, P/OD450, N | 5.130 | 5.990 | 3.690 |
利用建立的间接ELISA方法检测APP、HPS、PCV2、PRV、CSFV、TGEV阳性血清,结果均为阴性,猪丹毒杆菌阴性、阳性血清对照均成立 (表 7)。表明建立的间接ELISA检测方法具有较好的特异性。
| 血清Serum | OD450 | 结果Result |
| APP | 0.273 | − |
| HPS | 0.175 | − |
| PCV2 | 0.053 | − |
| PRV | 0.124 | − |
| CSFV | 0.195 | − |
| TGEV | 0.149 | − |
| 阳性对照Positive control | 1.140 | + |
| 阴性对照Negative control | 0.192 | − |
表 8显示,批内重复试验变异系数均小于10%,表明批内重复性较好;表 9显示,批间重复试验变异系数均小于10%,表明批间重复性较好。
| 血清编号 Serum No. |
各重复孔的OD450 Duplicability’s OD450 | 平均值 x |
标准差 s |
变异系数 CV (%) |
|||||
| 1st | 2nd | 3rd | 4th | 5th | 6th | ||||
| 1 | 1.083 | 1.162 | 1.045 | 1.137 | 1.129 | 1.055 | 1.102 | 0.048 | 4.33 |
| 2 | 0.823 | 0.721 | 0.819 | 0.852 | 0.773 | 0.759 | 0.791 | 0.049 | 6.13 |
| 3 | 1.241 | 1.257 | 1.173 | 1.196 | 1.204 | 1.276 | 0.040 | 0.032 | 2.49 |
| 4 | 1.415 | 1.533 | 1.514 | 1.426 | 1.431 | 1.429 | 0.051 | 0.035 | 3.23 |
| 血清编号 Serum No. |
各批次的OD450值OD450 values of different batch | 平均值 x |
标准差 s |
变异系数 CV (%) |
|||||
| 1st | 2nd | 3rd | 4th | 5th | 6th | ||||
| 1 | 1.073 | 1.026 | 0.993 | 0.937 | 1.065 | 1.039 | 1.022 | 0.050 | 4.95 |
| 2 | 0.826 | 0.877 | 0.923 | 0.854 | 0.947 | 0.912 | 0.890 | 0.046 | 5.12 |
| 3 | 1.125 | 1.107 | 1.243 | 1.258 | 1.164 | 1.257 | 1.192 | 0.069 | 5.77 |
| 4 | 0.792 | 0.749 | 0.814 | 0.803 | 0.776 | 0.842 | 0.796 | 0.032 | 4.02 |
建立的间接ELISA方法与美国TSZ公司商品化试剂盒的检测结果符合率为92.2%,敏感性为96.0%,特异性为73.3% (表 10)。
| 项目 Item |
阳性Positive | 阴性 Negative |
总数 Total |
| 建立间接ELISA方法 The developed indirect ELISA |
76 | 14 | 90 |
| 美国TSZ公司试剂盒 US TSZ company kit |
75 | 15 | 90 |
| 符合数 Coincidence numbers |
72 | 11 | 83 |
| 符合率 Coincidence rates (%) |
92.2 | ||
应用建立的间接ELISA方法的检测结果与Western blot的鉴定结果符合率为92.59%,敏感性为93.33%,特异性为88.89% (表 11)。
| 项目 Item |
阳性 Positive |
阴性 Negative |
总数 Total |
| 建立间接ELISA方法 The developed indirect ELISA |
43 | 11 | 54 |
| Western blot | 45 | 9 | 54 |
| 符合数 Coincidence numbers |
42 | 8 | 50 |
| 符合率 Coincidence rates (%) |
92.59 | ||
自Pasteur在1882年首次从病死猪的皮肤血管中分离到猪丹毒杆菌之后,猪丹毒便逐渐出现在人们的视野中[9]。20世纪80年代和90年代初,猪丹毒、猪瘟和猪肺疫并称为影响我国养猪业的三大传染病。随着规模化养殖中抗生素和疫苗的普遍使用,猪丹毒得到控制并逐渐淡出了人们的视线。然而,近几年我国江西、浙江、湖南、四川、云南、广州、福建以及安徽等地均有猪丹毒散发的报道[10-11];美国、日本、巴西、泰国、加拿大等国猪丹毒的发生也有明显的增多[12-13];猪丹毒似乎又有卷土重来之势,给养殖业带来了很大的经济损失。目前免疫接种是预防和控制猪丹毒的重要措施。因此,建立一种特异、敏感、快速检测猪丹毒杆菌抗体的方法,对于合理评价猪丹毒疫苗的免疫效果具有重要的意义[4]。
猪丹毒杆菌血清型众多,作为主要免疫保护性抗原的SpaA蛋白存在于毒力较强的血清型1a、1b、2、5、8、9、12、15、16、17和N型的菌株中,而临床猪丹毒杆菌分离菌则以血清型1a、1b、2型为主,这3种血清型中的SpaA蛋白又具有高保守性和同源性[14-16],从而为其作为疫苗、诊断制剂的研发、应用提供了支持。SpaA蛋白主要保护功能的核心片段为N端[17]。Imada等克隆和表达了位于SpaA蛋白N端348个氨基酸 (第61个到第408个氨基酸),能防止猪感染猪丹毒杆菌[18]。Shimoji等证明SpaA蛋白N端的2/3区域可刺激小鼠免疫系统产生较高水平保护性抗体,从而抵御猪丹毒杆菌的侵袭[19]。刘丹丹等克隆和表达的SpaA蛋白N端免疫保护区,能完全保护小鼠免受猪丹毒杆菌强毒株的攻击[20]。李伟杰等通过SpaA蛋白的序列分析和结构预测,提出SpaA蛋白无跨膜区域,可以实现较高量及可溶性表达[21]。本实验去除了SpaA蛋白前端信号肽序列及C端重复序列,克隆与表达N端免疫保护区,亲和层析法纯化蛋白,Western blot鉴定表达蛋白具有良好的反应原性,从而为建立检测猪丹毒杆菌抗体的间接ELISA方法奠定了良好基础。
本实验进一步应用重组表达纯化的猪丹毒杆菌SpaA蛋白作为包被抗原,通过对抗原包被浓度、血清稀释度和酶标二抗最佳稀释度等条件的优化,建立了猪丹毒杆菌抗体间接ELISA检测方法。通过特异性试验、重复性试验及比对试验,证明建立的间接ELISA方法特异性良好、重复性好。应用该方法和商品化ELISA检测试剂盒同步对猪丹毒疫苗免疫的健康猪血清样品进行检测,敏感性96.0%,总符合率92.2%;应用该方法和western blot同步对猪丹毒疫苗免疫的健康猪血清样品进行检测与鉴定,敏感性93.33%,总符合率92.59%。综合证明本实验所建立的间接ELISA检测结果与美国TSZ公司猪丹毒杆菌抗体检测试剂盒以及Western blot鉴定结果具有较高的一致性。相比Imada及Giménez-Lirola等的研究结果[6-7],本实验所建立的ELISA方法还需要扩大对临床不同样品的检测应用,从而进一步验证该法可作为一种可靠的技术手段用于猪丹毒杆菌的抗体检测及流行病学调查。
| [1] | Cooper J, Stuart B, Cole J. Erysipelothrix rhusiopathiae associated with swine abortion[J]. Georgia Veterinanin, 1980, 32(2) : 10. |
| [2] | Cheun HI, Kawamoto K, Hiramatsu M, et al. Protective immunity of SpaA-antigen producing Lactococcus lactis against Erysipelothrix rhusiopathiae infection[J]. Journal of Applied Microbiology, 2004, 96(6) : 1347–1353. DOI:10.1111/jam.2004.96.issue-6 |
| [3] | Galán JE, Timoney JF. Cloning and expression in Escherichia coli of a protective antigen of Erysipelothrix rhusiopathiae[J]. Infection and Immunity, 1990, 58(9) : 3116–3121. |
| [4] | Xiao GS, Cao SJ, Wen XT. Development and application of Dot-PAA-ELISA rapidly detecting antibodies against swine erysipelas[J]. Chinese Journal of Preventive Veterinary Medicine, 2005, 27(1) : 59–62. (in Chinese) 肖国生, 曹三杰, 文心田. Dot-PAA-ELISA快速检测猪丹毒抗体方法的建立与应用[J]. 中国预防兽医学报, 2005, 27(1) : 59–62. |
| [5] | Yang H, Chen TX. Indirect hemagglutination test to detect swine erysipelas maternal antibodies[J]. Gansu Animal and Veterinary Sciences, 1988(1) : 5. (in Chinese) 杨宏, 陈天祥. 用间接血凝试验检测猪丹毒母源抗体[J]. 甘肃畜牧兽医, 1988(1) : 5. |
| [6] | Imada Y, Mori Y, Daizoh M, et al. Enzyme-linked immunosorbent assay employing a recombinant antigen for detection of protective antibody against swine erysipelas[J]. Journal of Clinical Microbiology, 2003, 41(11) : 5015–5021. DOI:10.1128/JCM.41.11.5015-5021.2003 |
| [7] | Giménez-Lirola LG, Xiao CT, Halbur PG, et al. Development and evaluation of an enzyme-linked immunosorbent assay based on a recombinant SpaA protein (rSpaA415) for detection of anti-Erysipelothrix spp. IgG antibodies in pigs[J]. Journal of Microbiological Methods, 2012, 91(1) : 191–197. DOI:10.1016/j.mimet.2012.06.011 |
| [8] | Hua Y, Wang W, Li Y, et al. Prokaryotic expression of the structural protein S of porcine epidemic diarrhea virus and establishment of an indirect ELISA for an detection of antibody against porcine epidemic diarrhea[J]. Microbiology China, 2016, 43(2) : 434–443. (in Chinese) 华耀, 王玮, 李郁, 等. 猪流行性腹泻病毒S蛋白主要抗原表位区的原核表达及间接ELISA检测方法的建立[J]. 微生物学通报, 2016, 43(2) : 434–443. |
| [9] | Norrung V, Molin G. A new serotype of Erysipelothrix rhusiopathiae isolated from pig slurry.[J]. Acta Vet Hung, 1991, 39(3/4) : 137–138. |
| [10] | Song PW, Zhu QL. The current swine erysipelas alert scale prevalence and harm[J]. Swine Production, 2013(5) : 117–118. (in Chinese) 宋培武, 朱巧玲. 警惕当前猪丹毒在规模猪场的流行与危害[J]. 养猪, 2013(5) : 117–118. |
| [11] | Lu P, Huang XH, Li CF, et al. Isolation, identification and characterization of Erysipelothrix rhusiopathiae in Anhui province[J]. Microbiology China, 2014, 41(9) : 1822–1828. (in Chinese) 陆萍, 黄晓慧, 李春芬, 等. 安徽部分地区猪丹毒杆菌的分离鉴定及生物学特性研究[J]. 微生物学通报, 2014, 41(9) : 1822–1828. |
| [12] | Opriessnig T, Hoffman LJ, Harris DL, et al. Erysipelothrix rhusiopathiae: genetic characterization of Midwest US isolates and live commercial vaccines using pulsed-field gel electrophoresis[J]. Journal of Veterinary Diagnostic Investigation, 2004, 16(2) : 101–107. DOI:10.1177/104063870401600202 |
| [13] | Wang Q, Fidalgo S, Chang BJ, et al. The detection and recovery of Erysipelothrixspp. in meat and abattoir samples in Western Australia[J]. Journal of Applied Microbiology, 2002, 92(5) : 844–850. DOI:10.1046/j.1365-2672.2002.01578.x |
| [14] | Ozawa M, Yamamoto K, Kojima A, et al. Etiological and biological characteristics of Erysipelothrix rhusiopathiae isolated between 1994 and 2001 from pigs with swine erysipelas in Japan[J]. Journal of Veterinary Medical Science, 2009, 71(6) : 697–702. DOI:10.1292/jvms.71.697 |
| [15] | Imada Y, Takase A, Kikuma R, et al. Serotyping of 800 strains of Erysipelothrix isolated from pigs affected with erysipelas and discrimination of attenuated live vaccine strain by genotyping[J]. Journal of Clinical Microbiology, 2004, 45(5) : 2121–2126. |
| [16] | Lu Q, Li MB, Peng XW, et al. Bioinformatics analysis of SpaA gene of Erysipelothrix rhuriopathiae[J]. Progress in Veterinary Medicine, 2015, 36(9) : 23–27. (in Chinese) 卢琴, 李明波, 彭先文, 等. 猪丹毒杆菌SpaA基因的生物信息学分析[J]. 动物医学进展, 2015, 36(9) : 23–27. |
| [17] | Yan PF, Su YH, Zhao YX, et al. Identification of the major domain in surface protective antigen (SpaA) responsible for immunological protection from Erysipelothrix rhusiopathiae C43150[J]. Xinjiang Agricultural Sciences, 2010, 47(6) : 1224–1230. (in Chinese) 晏鹏飞, 苏幼红, 赵银霞, 等. 猪丹毒丝菌C43150株表面保护性抗原A的免疫功能区分析[J]. 新疆农业科学, 2010, 47(6) : 1224–1230. |
| [18] | Imada Y, Goji N, Ishikawa H, et al. Truncated surface protective antigen (SpaA) of Erysipelothrix rhusiopathiae serotype 1a elicits protection against challenge with serotypes 1a and 2b in pigs[J]. Infection and Immunity, 1999, 67(9) : 4376–4382. |
| [19] | Shimoji Y, Mori Y, Fischetti VA. Immunological characterization of a protective antigen of Erysipelothrix rhusiopathiae:identification of the region responsible for protective immunity[J]. Infection and Immunity, 1999, 67(4) : 1646–1651. |
| [20] | Liu DD, Borrathybay E, Yang ZL, et al. Immunological testing of protein protective domain SpaA of Erysipelothrix rhusiopathiae[J]. Journal of Microbiology, 2013, 33(5) : 5–11. (in Chinese) 刘丹丹, 恩特马克·布拉提白, 杨振龙, 等. 红斑丹毒丝菌SpaA蛋白保护区域的免疫学检测[J]. 微生物学杂志, 2013, 33(5) : 5–11. |
| [21] | Li WJ, Zhao Y, Kang K, et al. Cloning and sequence analysis of SpaA gene of Erysipelothrix rhusiopathiae and prediction of protein structure[J]. Chinese Journal of Veterinary Science, 2011, 31(11) : 1631–1634, 1639. (in Chinese) 李伟杰, 赵耘, 康凯, 等. 红斑丹毒丝菌SpaA抗原基因的克隆、序列分析及蛋白结构预测[J]. 中国兽医学报, 2011, 31(11) : 1631–1634, 1639. |
 2017, Vol. 44
2017, Vol. 44




