扩展功能
文章信息
- 王年, 鲁小璐, 邬梦晓俊, 王猛, 王红梅
- WANG Nian, LU Xiao-Lu, WU Meng-Xiao-Jun, WANG Meng, WANG Hong-Mei
- 微生物氧化As (Ⅲ) 和Sb (Ⅲ) 的研究进展
- Progress in microbial oxidation of As (Ⅲ) and Sb (Ⅲ)
- 微生物学通报, 2017, 44(3): 689-700
- Microbiology China, 2017, 44(3): 689-700
- DOI: 10.13344/j.microbiol.china.160312
-
文章历史
- 收稿日期: 2016-04-15
- 接受日期: 2016-06-07
- 优先数字出版日期(www.cnki.net): 2016-10-11
砷和锑是化学元素周期表中第五主族的两性类金属,具有相似的化学特性和毒性,广泛存在于岩石圈、水圈和生物圈。两种元素均被美国国家环境保护局 (USEPA) 认定为一级污染物[1-2]。世界卫生组织规定:饮用水中锑的含量不能超过5 μg/L,我国相关法律规定饮用水中砷的含量不得超过10 μg/L。
长期暴露在高砷环境中将会导致一系列的健康问题,如:皮肤病[3]、心血管疾病[4]、神经疾病[5]、免疫疾病[6],甚至癌症[7]。近年来,人类活动导致大量的砷释放到水体和土壤环境中,对人类的生命和健康构成了严重的威胁。印度[8]、孟加拉国[9]、美国[10]、智利[11]和中国[12]等地区均发生过严重的砷中毒事件,严重危害了人们的生命安全。目前砷污染已经成为了全球性的环境问题[13]。
与砷相比,人们对于锑的相关认识较少,这限制了对其相关毒性和地球化学循环的了解。锑是一种重要的战略储备资源,广泛运用于工业半导体、二极管、玻璃及阻燃剂材料等诸多产品中[14]。锑可以被用于热带原生动物疾病杀虫剂,如利什曼虫[15],也可以用来治疗HIV患者[16]。尽管自然环境中锑的浓度很低 (土壤中锑的浓度不到1 mg/kg[17],水中锑的浓度不到1 μg/kg[14]),但随着人类活动的加剧,越来越多的锑被释放到环境中。主要的锑污染来源于采矿和工业排放,在提炼中常伴有含砷固废 (砷碱渣) 的产生。我国的锑产量占世界的80%,很多地区由于锑矿的开采导致了严重的环境污染[18]。湖南锡矿山号称“世界锑都”,该地区农用土壤和井水中的锑含量分别为:141.92−8 733.26 mg/kg和131−22 980 μg/L,远远超过世界卫生组织的规定的值[19-20]。
砷和锑的化学相似性促使人们更加关注它们在各种环境中的生物地球化学行为。由于它们拥有相同的S2P3外围电子轨道,砷和锑在环境中呈现同样的氧化还原状态,价态可以从−3至+5,在环境中它们最常见的氧化价态是+3和+5。环境中砷和锑的毒性取决于它们在化合物中的价态。通常砷的毒性是:有机砷化合物[如:三甲基砷 (Trimethylarsine,TMA)] < 五价砷[As (Ⅴ)] < 三价砷[(As (Ⅲ)]。与砷类似,锑的毒性依次是:有机锑化合物[如:三甲基锑 (Trimethylstibine,TMS)] < 五价锑[Sb (Ⅴ)] < 三价锑[Sb (Ⅲ)][21]。它们在生物细胞反应中对磷 (P) 元素有着很强的取代作用,因此对DNA复制以及细胞的新陈代谢具有很强的抑制作用[22]。世界健康组织对砷和锑的摄入有严格的标准:砷每日的摄取容许量 (Acceptable daily intake,ADI) 为2 mg/kg体重[23],锑每日的耐受摄入量 (Tolerable daily intake,TDI) 为6 mg/kg体重[24]。
尽管砷和锑对于人类来说具有很强的毒性,但一些微生物却能够在砷、锑浓度极高的环境下生存,甚至利用砷或锑为细胞的生长提供能量。这些微生物在长期的演化过程中进化出了各种各样的代谢机制,在砷和锑的地球化学循环过程中发挥着重要的作用,包括氧化、还原和甲基化等[2, 25-29]。其中,微生物的氧化作用可以将毒性较强的As (Ⅲ) 和Sb (Ⅲ) 氧化为毒性较低的As (Ⅴ) 和Sb (Ⅴ)。在自然界中,砷和锑的氧化是一个极其缓慢的过程[30-31],而在微生物的作用下,它们的氧化速率明显提高[32-33],因此,微生物的氧化作用被认为是一种砷和锑污染环境潜在的修复方法。近年来,有关砷氧化微生物的研究日益成熟,而关于锑氧化微生物的研究才刚刚开始。本文将介绍砷和锑氧化微生物的国内外研究进展,为深入研究砷、锑氧化微生物的多样性和代谢机制以及污染环境治理的应用提供参考。
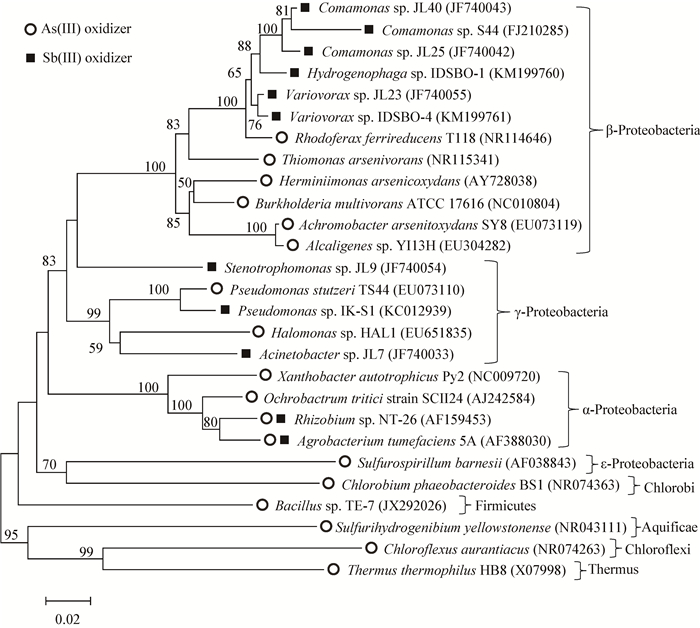
1 微生物多样性 1.1 砷氧化微生物的多样性砷氧化微生物能将进入体内及环境中毒性较高的As (Ⅲ) 氧化为毒性较低的As (Ⅴ),达到为自身解毒的目的,同时也极大地影响砷的转化与迁移。早在1918年,Green就从牛圈的消毒液中分离到了第一株具有As (Ⅲ) 氧化能力的菌株[34],但当时并没有引起人们的注意。直到1949年,Turner分离到了15株异养型砷氧化细菌,砷氧化微生物才引起了人们的关注[35]。目前,人们发现砷氧化微生物在自然界中分布极其广泛,如在矿区、地下水、海洋、热泉以及各种极端环境等都有分布 (表 1,图 1)。从生物学分类上,砷氧化微生物主要属于无色杆菌属 (Achromobacter)、土壤杆菌属 (Agrobacterium)、产碱菌属 (Alcazigenes)、芽孢杆菌属 (Bacillus)、假单胞菌属 (Pseudomonas)、根瘤菌属 (Rhizobium)、栖热菌属 (Thermus)、硫单胞菌属 (Thiomonas) 和黄单胞菌属 (Xanthomonas)[2, 57-58]。这些微生物大多分离自高砷的环境中,拥有着较高的耐砷能力以及不同的氧化能力。如1976年,Philips等从未经处理的污水中分离到了砷氧化菌Alcaligenes faecalis,该菌可以耐受10 mmol/L的砷浓度[59];2015年,Jiang等从中国云南腾冲热泉中发现了一株化能自养As (Ⅲ) 氧化微生物菌株TCC9-4,该菌在40时候酶活性最高,能在36 h内将100 mg/L的砷几乎氧化完全[60]。这些微生物在特定的环境中与砷长期共存,广泛参与了砷的地球化学循环。
| 菌名 Names of arsenite oxidizers |
AoxB/ArxA序列注册号 GenBank accession number of AoxB/ArxA-like arsenite oxidases |
分离环境 Environments isolated |
营养类型 Nutritional types |
参考文献 References |
| Alkalilimnicola ehrlichii MLHE-1 | ABI57766a | 盐碱湖 | 厌氧自养 | [36] |
| Acinetobacter sp. WA19 | ABD72614 | 湖底沉积物 | ND | [37] |
| Thiomonas arsenitoxydans 3As | ACA28599 | 酸性富砷废水 | 自养 | [38] |
| Micromonospora sp. X14 | CCD32987 | 酸性矿坑水 | 异养 | [39] |
| Sinorhizobium sp. M14 | ADO95186 | 金矿 | 异养 | [40] |
| Polaromonas sp. GM1 | ABW84260 | 矿区微生物席 | 异养 | [41] |
| Ectothiorhodospira sp. PHS-1 | EHQ52454a | 热泉微生物席 | 光合自养 | [42] |
| Thermus sp. str. HR13 | ABB17184 | 富砷热泉 | 异养 | [43] |
| Azoarcus sp. DAO1 | ND | 工厂附近砷污染土 | 厌氧自养 | [44] |
| Achromobacter arsenitoxydans SY8 | AGUF01000052 | 养猪场 | 异养 | [45] |
| Ochrobactrum tritici strain SCII24 | ACK38267 | 小麦根部 | 异养 | [46] |
| Methylocystis sp. SC2 | CCJ06851 | 污染地下水 | 异养 | [47] |
| Thermus scotoductus SA-01 | ADW22085 | 矿区3.2 km下裂隙水 | 厌氧异养 | [48] |
| Bosea sp. WAO | ABJ55855 | 含砷页岩 | 自养 | [49] |
| Variovorax sp. RM1 | ABD35886 | 草场 | ND | [37] |
| Roseovarius sp. 217 | EAQ26064 | 海洋表面水 | 异养 | [50] |
| Marinobacter santoriniensis NKSG1 | ACF09051 | 富砷海洋沉积物 | 异养 | [51] |
| Aeropyrum camini SY1 | BAN91066 | 深海热泉口 | 异养 | [52] |
| Roseobacter litoralis Och149 | WP_013962104 | 海藻 | 光合自养 | [53] |
| Sulfurospirillum barnesii | WP_014770544 | 硒污染沼泽地沉积物 | 厌氧异养 | [54] |
| Herminiimonas arsenicoxydans | AAN05581 | 重金属污染底泥 | 异养 | [55] |
| Alcaligenes faecalis NCIB8687 | AY297781 | 牛圈消毒液 | 异养 | [56] |
| Mesorhizobium sp. DM1 | ABD35887 | 无砷土壤 | ND | [37] |
| 注:a:ArxA类型砷氧化酶序列注册号;ND:未鉴定. Note: a: GenBank accession number of ArxA-like arsenite oxidase; ND: the content is unidentified. | ||||
|
| 图 1 基于最大似然法的砷和锑氧化菌16S rRNA基因系统发育进化树 Figure 1 Maximum-likelihood phylogenetic tree of 16S rRNA gene of arsenite and antimonite oxidizers |
|
|
根据代谢类型的不同,砷氧化菌主要分为异养型砷氧化菌和化能自养型砷氧化菌。前者能够氧化As (Ⅲ),但同时需要氧化有机物作为能量和合成细胞物质的来源,被认为是一种细胞的解毒机制。后者则是以As (Ⅲ) 作为电子供体,以O2 (有氧环境下) 或NO3− (厌氧环境下) 等作为电子受体,利用这个过程产生的能量固定CO2,维持细胞的生长[2]。如2014年,Dong等从日本工厂附近的砷污染土壤中发现了一株化能自养砷氧化菌Sinorhizobium sp. KGO-5,该菌可以氧化As (Ⅲ) 获得能量,同时固定CO2作为碳源供给自身生长[61]。2002年,Oremland等从美国加利福尼亚州莫诺湖底部的湖水中,最早分离得到了一株厌氧自养砷氧化菌种Strain MLHE-1,它可以氧化As (Ⅲ) 同时还原NO3−,获得能量供给自身生长[62]。然而,由于可培养的微生物仅占微生物总数的1%左右,仅仅利用纯培养的方法会极大地限制人们对环境中砷氧化微生物多样性的认识,而分子生物学手段的出现则恰好弥补了这个缺陷。砷氧化微生物通过砷氧化酶AoxAB和ArxAB[63]将As (Ⅲ) 氧化为As (Ⅴ),而前者是本文重点讨论的对象,该酶由砷氧化酶基因 (aoxAB) 转录表达[64]。2007年,Inskeep等利用7株砷氧化菌的AoxB序列的保守区设计出了两对引物 (1F/1R和2F/2R),成功扩增出了多个砷氧化菌的aoxB基因,但从非砷氧化微生物中未得到相应片段的产物,证明了这两对引物有一定的专一性;同时从多种环境样品中扩增到了新的aoxB基因文库序列,说明砷氧化菌无处不在,且砷氧化酶基因具有很高的多样性[37]。2015年,Zhang等利用这两对引物成功扩增出了中国南方水稻田中的aoxB基因,通过序列比对发现水稻田中存在着大量不能得到有效注释的砷氧化酶基因[26]。Rhine等根据6株自养型 (Autotroph) 和异养型 (Heterotroph) 砷氧化菌的AoxB序列设计引物 (69F/1374R),并利用此引物对扩增8株好氧砷氧化菌和2株厌氧砷氧化菌,发现除了2株厌氧型砷氧化菌外,其余菌株都扩增出了1 200 bp左右的目的片段[49]。由于环境中的氧化菌大多是在好氧的环境中生存,因此该引物对可用于环境中大多数菌aoxB基因的扩增。随后,Fan等利用数据库中的5条AoxB序列设计了3个PCR引物 (AoxB-F、AoxB-R1和AoxB-R2),成功扩增出了中国西北地区山阴县砷污染沉积物中的砷氧化酶基因,揭示了大量隶属于α-和β-变形菌门的砷氧化微生物[58]。Quéméneur等利用细菌及古菌的AoxB序列设计了新的引物 (aoxBM1-2F/aoxBM3-2R),扩增到了大量砷氧化微生物的aoxB序列,而且通过与16S rRNA基因序列一起比对并构建系统进化树,充分确定了砷氧化酶基因作为分子标签用来研究砷氧化微生物进化关系的地位[57]。该方法大大提高了人们对自然环境中具有砷氧化能力的微生物多样性的认识。本课题组前期开展了江汉平原钻孔沉积物中砷代谢微生物的研究,目前正在开展对湖南锡矿山地下水和土壤等样品中aoxB等功能基因的研究,以期了解世界上最大的锑矿区中砷氧化微生物的多样性和丰度。
1.2 锑氧化菌的多样性锑氧化菌能将毒性较强的Sb (Ⅲ) 转化为毒性相对较弱的Sb (Ⅴ),这种机理对于锑污染区的修复以及自然界锑的循环代谢起着非常重要的作用。由于对于锑氧化微生物的研究开展得相对较晚,目前报道的锑氧化微生物的种类相对较少,主要发现于锑矿区及锑污染地区 (图 1,表 2)。1974年,Lialikova报道了第一株锑氧化菌Stibiobactersenarmontii[65]。1977年,Torma等发现Thiobacillus ferrooxidans可以将Sb2S3 (俗称辉锑矿) 氧化为游离态的Sb (Ⅲ),并随后将生成的Sb (Ⅲ) 氧化为Sb (Ⅴ)[66]。Agrobacteriumtumefaciens 5A是一株As (Ⅲ) 氧化菌,Lehr等在该菌的砷氧化酶基因aoxAB缺失表达的突变菌株中发现了Sb (Ⅲ) 氧化能力[71]。2013年,Li等从“世界锑都”中国湖南冷水江市锡矿山分离得到了6株具有Sb (Ⅲ) 氧化能力的菌,这些菌株表现出不同的Sb (Ⅲ) 氧化能力,其中一株能在3 d内将50 μmol/L的Sb (Ⅲ) 彻底氧化[33]。Hamamura等从日本市之川锑矿区分离到了3株具有Sb (Ⅲ) 氧化能力的菌株,经过鉴定属于α-和γ-变形菌门[67]。Shi等从中国采集了11种不同的矿物样品 (富含Sb/Cu等),分离得到了100多株耐锑和耐铜菌,其中有36株具有Sb (Ⅲ) 氧化能力,这些菌株主要来自于假单胞菌属 (Pseudomonas)、丛毛单胞菌属 (Comamonas) 和不动杆菌属 (Acinetobacter)[68]。同年,Luo等利用高通量测序鉴定了中国湖南锡矿山的典型土样,通过生物信息学分析,发现放线菌门、厚壁菌门、软壁菌门、硝化螺旋菌门及芽单胞菌门与污染物Sb有着明显的联系,暗示锑代谢微生物极大可能存在于这5个门类中[72]。2015年,Terry等从矿区污染土壤中分离到两株锑氧化菌IDSBO-1和IDSBO-4,前者不仅可以利用氧气作为电子受体,还可以利用硝酸盐作为电子受体,后者在氧化Sb (Ⅲ) 的同时还能固定环境中的CO32−和HCO3−为有机物[70]。2015年,Wang等通过对Agrobacterium tumefaciens 5A砷氧化酶基因的敲除回补实验和对菌株NT-26的砷氧化酶的酶动力学实验,证明砷氧化酶能够氧化环境中约30%的锑[73],由此推断砷氧化酶也具有氧化锑的能力。笔者通过利用16S rRNA基因序列构建系统发育进化树发现,目前已鉴定的锑氧化菌与砷氧化菌类似,都主要分布于α-、β-和γ-变形菌门,然而二者在小的分类单元的分布上存在比较大的区别,且仅有部分锑氧化菌同时表现出砷氧化能力,说明这两类微生物之间既存在密切的联系,又存在着一定的差异 (图 1,表 2)。
| 菌名 Names of antimonite oxidizers |
是否具有砷氧化能力 With arsenite oxidation ability or not |
分离环境 Environments isolated |
营养类型 Nutritional types |
参考文献 References |
| Stibiobacter senarmontii | ND | ND | 自养 | [65] |
| Thiobacillus ferrooxidans | ND | 酸性矿坑水 | 自养 | [66] |
| Sinorhizobium sp. IK-A2 | 是 | 锑矿区土壤 | 自养 | [67] |
| Comamonas sp. S44 | 否 | 锑矿区土壤 | 异养 | [33] |
| Pseudomonas sp. DF3 | 是 | 铁矿 | ND | [68] |
| Sphingopyxis sp. DS8 | 否 | 铜-铁矿 | ND | [68] |
| Agrobacterium tumefaciens 5A | 是 | 非饱和土 | 异养 | [69] |
| Rhizobium sp. NT-26 | 是 | 金矿 | 自养 | [69] |
| Hydrogenophaga sp. IDSBO-1 | 是 | 矿区沉积物 | 厌氧自养 | [70] |
| Variovorax sp. IDSBO-4 | 是 | 矿区沉积物 | 自养 | [70] |
| 注:ND:未鉴定或未找到. Note: ND: the content is unidentified or not found. | ||||
由于只有部分锑氧化菌具有砷氧化能力,所以单独利用砷氧化酶基因不能够探索到环境中大多数的锑氧化菌 (图 1,表 2)。值得注意的是,还有一种叫做AnoA的酶也被发现具有锑氧化能力,该酶由anoA基因表达,但目前仅少数锑氧化菌的anoA基因被鉴定得到,该基因的保守性以及是否广泛存在于锑氧化菌中还不得而知,因此大量的anoA基因序列亟待被鉴定来确定其是否可以作为良好的分子标签来检测环境中的锑氧化菌[69]。
2 微生物氧化砷和锑的分子机制 2.1 微生物氧化砷的机制目前,对于微生物氧化砷的分子机制已经研究得比较深入。砷氧化菌是通过砷氧化酶将As (Ⅲ) 氧化为As (Ⅴ)。1992年,研究者们就从Alcaligenes faecalis中纯化得到了第一个砷氧化酶[74]。经证实,砷氧化酶是一种胞外周质酶,属于钼离子结合的二甲基亚砜氧化还原酶 (DMSO) 家族,其成熟蛋白由2个亚基 (α和β) 组成异源二聚体 (α1β1) 或异源四聚体 (α2β2)。其中,大亚基 (α) 是一个含有钼离子中心的[3Fe-4S]聚簇的硫铁蛋白,小亚基 (β) 是一个包含有[2Fe-2S]聚簇的硫铁蛋白。大小亚基分别由结构基因aoxB和aoxA表达[75]。砷氧化过程发生在细胞的周质空间中,电子传递路径为:As (Ⅲ) 的2个电子传递到砷氧化酶大亚基 (AoxB) 的钼蝶呤上,接着传递到AoxB的[3Fe-4S]簇上,然后到AoxA的[2Fe-2S]簇上,再经过其它电子受体 (如AoxC蛋白、细胞色素c554),最终到达呼吸链末端的O2等电子受体[76]。
经鉴定,砷氧化酶结构基因 (aoxBA) 存在于砷氧化酶基因簇 (aox操纵子) 中,由其上游的调控基因 (aoxRSX) 和其下游的辅助基因 (cyc1、moaA) 等调控表达[77]。其中,AoxR与AoxS分别为反应调节子和组氨酸激酶,可以被磷酸化传递细胞信号[78]。研究发现,缺失aoxS基因的菌株丧失了砷氧化表型[79]。而敲除aoxR基因会严重抑制aoxS基因的表达[77]。周质结合蛋白AoxX与磷酸盐结合蛋白高度相似,存在于细胞周质中,靠近组氨酸激酶AoxS,受As (Ⅲ) 的上调诱导,敲除aoxX基因的突变株中,砷氧化酶基因aoxBA受到了抑制,使其丧失了砷氧化能力[80]。目前普遍接受的是砷氧化三组分调控系统:当环境中存在As (Ⅲ) 时,As (Ⅲ) 结合蛋白AoxX会结合进入细胞周质的As (Ⅲ),并将信号传递给组氨酸激酶AoxS,使其发生自身磷酸化。自身磷酸化的AoxS将反应调节子AoxR磷酸化后,由磷酸化的AoxR调控砷氧化酶基因簇的表达[80-81]。同时,最新的研究表明,镶嵌在细胞质膜上的通道蛋白Acr3和DctA在调控aoxBA的表达过程中也起到了关键的作用[82]。
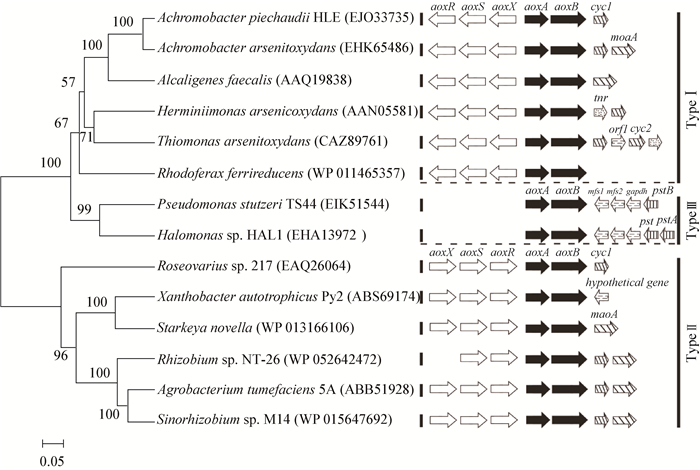
环境中的As (Ⅲ) 能诱导砷氧化酶基因的表达,但是在不同的菌株中,砷氧化酶诱导表达的机制并不完全一样。经过克隆解析不同细菌的砷氧化酶基因簇 (aox操纵子),发现这种机制的不同是由aoxBA基因与其周围相关基因的数目、位置及转录方向决定的。这种基因结构差异可以大致归为3种类型:类型Ⅰ:aoxBA基因与其调控基因aoxRSX转录方向相反[83];类型Ⅱ:aoxBA基因与其调控基因aoxRSX转录方向一致[84];类型Ⅲ:aoxBA基因周围不存在调控基因aoxRSX,而是存在着与磷酸代谢调控相关的基因[85]。笔者经过分析现已鉴定的aox操纵子,发现砷氧化酶基因簇 (aox操纵子) 的多样性可能与大亚基AoxB蛋白的进化关系存在着密切的联系 (图 2)。当菌株中AoxB氨基酸序列的相似度大于95%时,其砷氧化酶基因簇的结构与已知的基本相同;当菌株中AoxB氨基酸序列的相似度低于85%时,其砷氧化酶基因簇上下游的基因会存在较小的差异;而当菌株中AoxB氨基酸序列的相似度低于50%时,砷氧化酶基因簇的调控基因会存在巨大差别,暗示该菌株中极大可能存在着不同的砷氧化调控机制。这将对环境中携带有新型砷氧化酶基因簇砷氧化菌的发现具有一定的指导意义。
锑与砷属于同族元素,在化学性质上有很大的相似性,它们都通过甘油通道蛋白 (GlyF) 进入细胞,通过跨膜蛋白 (ArsB) 泵出细胞,并且一些砷氧化菌同样表现出了锑氧化能力[87]。因此,人们过去一直认为砷氧化酶同样可以氧化锑。直到2007年,
Lehr等在研究一株既能氧化砷又能氧化锑的菌株A. tumefaciens 5A时,发现在其砷氧化酶调控基因 (aoxR) 缺失突变体中,未检测到砷氧化酶基因 (aoxBA) 的表达,却依然检测到了与野生型5A相当的Sb (Ⅲ) 氧化能力;并且通过RT-PCR实验,发现环境中的Sb (Ⅲ) 并没有促进砷氧化酶基因 (aoxBA) 的表达[71]。这说明,微生物具有独立的Sb (Ⅲ) 氧化功能基因,在代谢不同元素时具有较强的辨识能力。但后来,Wang等发现砷氧化酶大亚基AoxB的缺失,减少了菌株A. tumefaciens 5A三分之一的锑氧化效率,进一步分离纯化NT-26的砷氧化酶,经过酶动力学实验证明,砷氧化酶同样可以行使氧化锑的能力,但效率明显低于砷氧化效率[73]。然而Shi等通过鉴定从不同矿区分离得到的锑氧化菌,发现仅有小部分锑氧化菌含有砷氧化酶基因[68]。Li等从中国湖南冷水江市锡矿山分离得到了6株具有Sb (Ⅲ) 氧化能力,但不具有As (Ⅲ) 氧化能力的菌,这些菌株表现出不同的Sb (Ⅲ) 氧化能力,暗示微生物对于锑的氧化存在着不同的机制[69]。Terry等从矿区污染土壤中分离到的锑氧化菌IDSBO-1能利用氧化锑过程中产生的能量,表明微生物对于锑的氧化与能量代谢过程存在着偶联的关系[70]。2015年,Li等通过利用加Sb (Ⅲ) 与不加Sb (Ⅲ) 的培养基培养Agrobacterium tumefaciens GW4,并观察对比它们的蛋白表达情况,找到了一个可能参与锑氧化过程的蛋白AnoA。通过进一步的实验,发现AnoA缺失突变菌株GW4减少了约30%的锑氧化效率,AnoA过表达的菌株GW4则增加了约30%的氧化效率[69]。这表明,AnoA参与了菌株GW4的锑氧化过程,属于锑氧化酶的部分功能基因。这些研究表明,尽管锑与砷有着相似的化学性质,但微生物对于锑和砷的代谢机制却存在较大差异,并且对锑的代谢机制具有一定的多样性。参与微生物氧化锑的酶不止一个。但截止目前,完整的锑氧化酶系统还没有被鉴定得到,急需开展进一步的研究。本课题组于2015年7月份从“世界锑都”湖南冷水江市锡矿山采集了典型的锑污染土壤、尾矿、废石、废渣、矿石以及矿坑水等样品,目前已从不同样品中分离纯化得到多株高效锑氧化菌,下一步将尽快开展锑氧化酶的深入探索,以期全面揭示锑氧化微生物的氧化机制。
3 应用由于As (Ⅲ) 毒性高、移动性强,为了高效去除As (Ⅲ),通常都会先将As (Ⅲ) 氧化为毒性低、容易被吸附的As (Ⅴ),再通过吸附或沉淀法除去带负电荷的砷酸根离子AsO43−。常用的吸附剂包括活性炭、活性铝、赤铁矿、金属氧化物及其水合氧化物等[88],碳和金属氧化物的纳米材料作为新型材料也有着广阔的应用前景[79-91]。最早的沉淀法是利用石灰法产生砷酸钙[Ca3(AsO4)2]沉淀有效去除含砷废水中的As (Ⅴ)[92],铁盐法能够生成难溶于水的砷酸铁 (FeAsO4) 沉淀进一步提高除砷效果[93],添加高分子絮凝剂 (Polymer flocculant) 可以有效促进沉淀效应[75]。
采用传统的物理化学法 (如:氧化剂氧化法、离子交换法和萃取法等),氧化效率较低,成本较高,而且在修复过程中会产生有害的副产物,对环境造成二次污染,因此利用高效的砷氧化菌将成为新的选择。目前,人们已经利用生物反应器、活性污泥等方法对部分砷氧化菌应用于环境修复的潜力进行了探究。2012年,Ito等将一株隶属于粘着剑菌属 (Ensifer adhaerens) 的好氧砷氧化菌固定在连续流动生物反应器中,作为人工合成地下水中As (Ⅲ) 的预处理步骤,在水力停留时间 (hydraulic retention time,HRT) 为1 h时,其砷氧化效率高达92%[94]。由于砷污染环境大多都是营养匮乏的,自养型砷氧化菌不仅可以利用砷氧化过程产生的能量,还能固定环境中的CO2,被认为是砷污染环境微生物修复的极佳选择。2008年,Andrianisa等在污水处理厂的活性污泥中分离到了化能自养砷氧化微生物,该活性污泥可以在9 d的时间内将100 mg/L的As (Ⅲ) 氧化完全,随后,污水中转化得到的As (Ⅴ) 被铁的氢氧化物吸附沉淀下来[95]。2012年,Dastidar等将一株自养砷氧化菌Thiomonas arsenivorans b6固定到生物反应器中,在As (Ⅲ) 浓度约为500 mg/L、水力停留时间0.2 d的条件下,As (Ⅲ) 去除能力高达87.5%[96]。在深层沉积物或地下水等还原性环境中,As (Ⅲ) 为砷的主要存在形式,厌氧型砷氧化微生物也被证明可以有效缓解地下水的砷污染。2010年,Sun等将具有砷氧化能力的反硝化细菌 (denitrifying bacteria) 形成的生物膜固定在含有活性氧化铝 (activated alumina,AA) 的流动反应器中,发现依赖于NO3−的厌氧型砷氧化菌能够成功氧化环境中的As (Ⅲ),并间接增强了活性氧化铝对As (Ⅴ) 的吸附[97]。目前,利用基因工程改良优势菌种以及利用植物-微生物联合修复砷污染的报道甚少,微生物应用于土壤、水体等严重被污染环境的修复手段还需要继续挖掘。
当前,对于锑氧化菌的研究刚刚起步,仅有十几株锑氧化菌被报道,其代谢机制尚不明确。相信随着更多的锑氧化菌被发现,锑氧化菌的代谢机制将不断明确,对于锑污染环境的微生物修复可行性的研究也会像砷一样日渐明确。
4 展望砷、锑都是用途广泛的战略资源,我国砷矿区开采历史悠久,而锑矿产量约占世界的80%。随着经济的发展,人们对于矿区的开采力度越来越大,矿区周边的土壤、水体等已经受到了严重污染,对人类的健康构成了严重威胁。微生物对于砷、锑的氧化,能降低环境中重金属的毒性和迁移能力,被认为是一种环保、高效的修复手段。目前,越来越多的具有潜在生物修复能力的砷氧化菌被分离纯化,它们的代谢机制不断被揭示和阐明,这些研究成果对于污染环境的治理具有重要的参考价值。利用基因工程改造培育出适应性强且功能强大的砷氧化菌种,并深入探讨微生物与植物的联合修复机制,将会最大限度提高重金属污染地区的修复效果。由于环境的复杂多变,砷氧化菌应用于环境修复的可行性仍需进一步论证。随着锑污染越来越严重,锑代谢微生物,尤其是锑氧化微生物越来越被人们关注。由于锑与砷的化学相似性,对于锑氧化微生物的研究可以参考砷氧化微生物的研究手法。建议继续分离纯化高效的锑氧化菌,并对锑氧化菌开展蛋白质组学和基因组学研究。随着研究的不断深入,锑氧化微生物的氧化机制、多样性及应用于环境污染修复的潜力将越来越明朗。
| [1] | Pirnie M. Technologies and Costs for Removal of Arsenic from Drinking Water[M]. Washington, DC: EPA, 1999: 1 -290. |
| [2] | Yamamura S, Amachi S. Microbiology of inorganic arsenic: from metabolism to bioremediation[J]. Journal of Bioscience and Bioengineering, 2014, 118(1) : 1–9. DOI:10.1016/j.jbiosc.2013.12.011 |
| [3] | Chen YT, Scanlan MJ, Sahin U, et al. A testicular antigen aberrantly expressed in human cancers detected by autologous antibody screening[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(5) : 1914–1918. DOI:10.1073/pnas.94.5.1914 |
| [4] | Wang CH, Hsiao CK, Chen CL, et al. A review of the epidemiologic literature on the role of environmental arsenic exposure and cardiovascular diseases[J]. Toxicology and Applied Pharmacology, 2007, 222(3) : 315–326. DOI:10.1016/j.taap.2006.12.022 |
| [5] | Mukherjee SC, Rahman MM, Chowdhury UK, et al. Neuropathy in arsenic toxicity from groundwater arsenic contamination in West Bengal, India[J]. Journal of Environmental Science and Health, Part A, 2003, 38(1) : 165–183. DOI:10.1081/ESE-120016887 |
| [6] | Tondel M, Rahman M, Magnuson A, et al. The relationship of arsenic levels in drinking water and the prevalence rate of skin lesions in Bangladesh[J]. Environmental Health Perspectives, 1999, 107(9) : 727–729. DOI:10.1289/ehp.99107727 |
| [7] | Chen CJ, Chen CW, Wu MM, et al. Cancer potential in liver, lung, bladder and kidney due to ingested inorganic arsenic in drinking water[J]. British Journal of Cancer, 1992, 66(5) : 888–892. DOI:10.1038/bjc.1992.380 |
| [8] | Héry M, van Dongen BE, Gill F, et al. Arsenic release and attenuation in low organic carbon aquifer sediments from West Bengal[J]. Geobiology, 2010, 8(2) : 155–168. DOI:10.1111/gbi.2010.8.issue-2 |
| [9] | Uddin R, Huda NH. Arsenic poisoning in bangladesh[J]. Oman Medical Journal, 2011, 26(3) : 207. DOI:10.5001/omj.2011.51 |
| [10] | Bundschuh J, Litter MI, Parvez F, et al. One century of arsenic exposure in Latin America: a review of history and occurrence from 14 countries[J]. Science of the Total Environment, 2012, 429 : 2–35. DOI:10.1016/j.scitotenv.2011.06.024 |
| [11] | Escudero LV, Casamayor EO, Chong G, et al. Distribution of microbial arsenic reduction, oxidation and extrusion genes along a wide range of environmental arsenic concentrations[J]. PLoS One, 2013, 8(10) : e78890. DOI:10.1371/journal.pone.0078890 |
| [12] | Tang J, Bian JM, Li ZY, et al. Relationship between hydrochemical environment and arsenism in areas with arsenic poisoning drinking water in China[J]. Asian Journal of Ecotoxicology, 2013, 8(2) : 222–229. (in Chinese) 汤洁, 卞建民, 李昭阳, 等. 中国饮水型砷中毒区的水化学环境与砷中毒关系[J]. 生态毒理学报, 2013, 8(2) : 222–229. |
| [13] | Mandal BK, Suzuki KT. Arsenic round the world: a review[J]. Talanta, 2002, 58(1) : 201–235. DOI:10.1016/S0039-9140(02)00268-0 |
| [14] | Filella M, Belzile N, Chen YW. Antimony in the environment: a review focused on natural waters: Ⅰ. Occurrence[J]. Earth Science Reviews, 2002, 57(1/2) : 125–176. |
| [15] | Vásquez L, Dagert JVS, Scorza JV, et al. Pharmacokinetics of experimental pentavalent antimony after intramuscular administration in adult volunteers[J]. Current Therapeutic Research, 2006, 67(3) : 193–203. DOI:10.1016/j.curtheres.2006.06.005 |
| [16] | Fowler B, Goering P. Metals and Their Compounds in the Environment: Occurrence, Analysis, and Biological Relevance[M]. New York: VCH Publishers, 1991: 743 -750. |
| [17] | Crommentuijn T, Sijm D, de Bruijn J, et al. Maximum permissible and negligible concentrations for metals and metalloids in the Netherlands, taking into account background concentrations[J]. Journal of Environmental Management, 2000, 60(2) : 121–143. DOI:10.1006/jema.2000.0354 |
| [18] | Lan WY, Song SQ, Wu HD, et al. Effect of soil antimony (Ⅲ) pollution on the growth and quality of sweet mustard[J]. Environmental Science & Technology, 2009, 32(2) : 20–23. (in Chinese) 蓝唯源, 宋书巧, 吴浩东, 等. 土壤三价锑污染对甜芥菜生长及品质的影响研究[J]. 环境科学与技术, 2009, 32(2) : 20–23. |
| [19] | Mo CL, Wu FC, Fu ZY, et al. Antimony, arsenic and mercury polluton in agricultural soil of antimony mine area in Xikuangshan, Hunan[J]. Acta Mineralogica Sinica, 2013, 33(3) : 344–350. (in Chinese) 莫昌琍, 吴丰昌, 符志友, 等. 湖南锡矿山锑矿区农用土壤锑、砷及汞的污染状况初探[J]. 矿物学报, 2013, 33(3) : 344–350. |
| [20] | Xie LN, Zhou JW, Hao CM, et al. Hydrochemical characteristics and contaminative causes of groundwater in the north area of Xikuangshan antimony mine, Hunan province[J]. Geological Science and Technology Information, 2016, 35(2) : 197–202. (in Chinese) 谢李娜, 周建伟, 郝春明, 等. 湘中锡矿山北矿区地下水化学特征及污染成因[J]. 地质科技情报, 2016, 35(2) : 197–202. |
| [21] | Wilson SC, Lockwood PV, Ashley PM, et al. The chemistry and behaviour of antimony in the soil environment with comparisons to arsenic: a critical review[J]. Environmental Pollution, 2010, 158(5) : 1169–1181. DOI:10.1016/j.envpol.2009.10.045 |
| [22] | Shotyk W, Krachler M, Chen B. Anthropogenic impacts on the biogeochemistry and cycling of antimony[J]. Metal Ions in Biological Systems, 2005, 44 : 171–203. |
| [23] | WHO. Evaluation of certain food additives and contaminants: thirty-third report of the Joint FAO/WHO expert committee on food additives[R]. Geneva: World Health Organization, 1989 |
| [24] | WHO. Antimony in drinking-water: background document for development of WHO guidelines for drinking-water quality[R]. Geneva: World Health Organization, 2003 |
| [25] | Wang PP, Sun GX, Jia Y, et al. A review on completing arsenic biogeochemical cycle: microbial volatilization of arsines in environment[J]. Journal of Environmental Sciences, 2014, 26(2) : 371–381. DOI:10.1016/S1001-0742(13)60432-5 |
| [26] | Zhang SY, Zhao FJ, Sun GX, et al. Diversity and abundance of arsenic biotransformation genes in paddy soils from southern China[J]. Environmental Science & Technology, 2015, 49(7) : 4138–4146. |
| [27] | Yang J, Zhu YG. Progress in study of mechanisms of microbial arsenic transformation in environment[J]. Asian Journal of Ecotoxicology, 2009, 4(6) : 761–769. (in Chinese) 杨婧, 朱永官. 微生物砷代谢机制的研究进展[J]. 生态毒理学报, 2009, 4(6) : 761–769. |
| [28] | Wang GJ, Huang YY, Li J. Bacteria live on arsenic analysis of microbial arsenic metabolism-a review[J]. Acta Microbiologica Sinica, 2011, 51(2) : 154–160. (in Chinese) 王革娇, 黄银燕, 李洁. "吃"砒霜的细菌——解析微生物的砷代谢[J]. 微生物学报, 2011, 51(2) : 154–160. |
| [29] | Li MS, Li J, Wang GJ. Research advances in microbial mechanism of antimony[J]. Journal of Huazhong Agricultural University, 2013, 32(5) : 15–19. (in Chinese) 李明顺, 李洁, 王革娇. 微生物对锑的代谢机制研究进展[J]. 华中农业大学学报, 2013, 32(5) : 15–19. |
| [30] | Leuz AK, Johnson CA. Oxidation of Sb (Ⅲ) to Sb (Ⅴ) by O2 and H2O2 in aqueous solutions[J]. Geochimica et Cosmochimica Acta, 2005, 69(5) : 1165–1172. DOI:10.1016/j.gca.2004.08.019 |
| [31] | Johnson DL, Pilson MEQ. The oxidation of arsenite in seawater[J]. Environmental Letters, 1975, 8(2) : 157–171. DOI:10.1080/00139307509437429 |
| [32] | Cullen WR, Reimer KJ. Arsenic speciation in the environment[J]. Chemical Reviews, 1989, 89(4) : 713–764. DOI:10.1021/cr00094a002 |
| [33] | Li J, Wang Q, Zhang SZ, et al. Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil[J]. International Biodeterioration & Biodegradation, 2013, 76 : 76–80. |
| [34] | Green HH. Description of a bacterium which oxidizes arsenite to arsenate, and of one which reduces arsenate to arsenite, isolated from a cattle-dipping tank[J]. South African Journal of Science, 1918, 14 : 465–467. |
| [35] | Turner A. Bacterial oxidation of arsenite[J]. Nature, 1949, 164(4158) : 76–77. DOI:10.1038/164076a0 |
| [36] | Hoeft SE, Blum JS, Stolz JF, et al. Alkalilimnicola ehrlichii sp. nov., a novel, arsenite-oxidizing haloalkaliphilic gammaproteobacterium capable of chemoautotrophic or heterotrophic growth with nitrate or oxygen as the electron acceptor[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(3) : 504–512. DOI:10.1099/ijs.0.64576-0 |
| [37] | Inskeep WP, Macur RE, Hamamura N, et al. Detection, diversity and expression of aerobic bacterial arsenite oxidase genes[J]. Environmental Microbiology, 2007, 9(4) : 934–943. DOI:10.1111/emi.2007.9.issue-4 |
| [38] | Slyemi D, Moinier D, Brochier-Armanet C, et al. Characteristics of a phylogenetically ambiguous, arsenic-oxidizing Thiomonas sp., Thiomonas arsenitoxydans strain 3AsT sp. nov.[J]. Archives of Microbiology, 2011, 193(6) : 439–449. DOI:10.1007/s00203-011-0684-y |
| [39] | Delavat F, Lett MC, Lièvremont D. Novel and unexpected bacterial diversity in an arsenic-rich ecosystem revealed by culture-dependent approaches[J]. Biology Direct, 2012, 7 : 28. DOI:10.1186/1745-6150-7-28 |
| [40] | Drewniak L, Matlakowska R, Sklodowska A. Arsenite and arsenate metabolism of Sinorhizobium sp. M14 living in the extreme environment of the Zloty Stok gold mine[J]. Geomicrobiology Journal, 2008, 52(7/8) : 363–370. |
| [41] | Osborne TH, Jamieson HE, Hudson-Edwards KA, et al. Microbial oxidation of arsenite in a subarctic environment: diversity of arsenite oxidase genes and identification of a psychrotolerant arsenite oxidiser[J]. BMC Microbiology, 2010, 10 : 205. DOI:10.1186/1471-2180-10-205 |
| [42] | Kulp TR, Hoeft SE, Asao M, et al. Arsenic (Ⅲ) fuels anoxygenic photosynthesis in hot spring biofilms from Mono Lake, California[J]. Science, 2008, 321(5891) : 967–970. DOI:10.1126/science.1160799 |
| [43] | Gihring TM, Banfield JF. Arsenite oxidation and arsenate respiration by a new Thermus isolate[J]. FEMS Microbiology Letters, 2001, 204(2) : 335–340. DOI:10.1111/fml.2001.204.issue-2 |
| [44] | Rhine ED, Phelps CD, Young LY. Anaerobic arsenite oxidation by novel denitrifying isolates[J]. Environmental Microbiology, 2006, 8(5) : 899–908. DOI:10.1111/emi.2006.8.issue-5 |
| [45] | Li XY, Hu Y, Gong J, et al. Genome sequence of the highly efficient arsenite-oxidizing bacterium Achromobacter arsenitoxydans SY8[J]. Journal of Bacteriology, 2012, 194(5) : 1243–1244. DOI:10.1128/JB.06667-11 |
| [46] | Branco R, Francisco R, Chung AP, et al. Identification of an aox system that requires cytochrome c in the highly arsenic-resistant bacterium Ochrobactrum tritici SCII24[J]. Applied and Environmental Microbiology, 2009, 75(15) : 5141–5147. DOI:10.1128/AEM.02798-08 |
| [47] | Dam B, Dam S, Kube M, et al. Complete genome sequence of Methylocystis sp. strain SC2, an aerobic methanotroph with high-affinity methane oxidation potential[J]. Journal of Bacteriology, 2012, 194(21) : 6008–6009. DOI:10.1128/JB.01446-12 |
| [48] | Kieft TL, Fredrickson JK, Onstott TC, et al. Dissimilatory reduction of Fe (Ⅲ) and other electron acceptors by a Thermus isolate[J]. Applied and Environmental Microbiology, 1999, 65(3) : 1214–1221. |
| [49] | Rhine E, Chadhain SN, Zylstra G, et al. The arsenite oxidase genes (aroAB) in novel chemoautotrophic arsenite oxidizers[J]. Biochemical and Biophysical Research Communications, 2007, 354(3) : 662–667. DOI:10.1016/j.bbrc.2007.01.004 |
| [50] | Miller TR, Belas R. Dimethylsulfoniopropionate metabolism by Pfiesteria-associated Roseobacter spp.[J]. Applied and Environmental Microbiology, 2004, 70(6) : 3383–3391. DOI:10.1128/AEM.70.6.3383-3391.2004 |
| [51] | Handley KM, Héry M, Lloyd JR. Redox cycling of arsenic by the hydrothermal marine bacterium Marinobacter santoriniensis[J]. Environmental Microbiology, 2009, 11(6) : 1601–1611. DOI:10.1111/emi.2009.11.issue-6 |
| [52] | Daifuku T, Yoshida T, Kitamura T, et al. Variation of the virus-related elements within syntenic genomes of the hyperthermophilic Archaeon Aeropyrum[J]. Applied and Environmental Microbiology, 2013, 79(19) : 5891–5898. DOI:10.1128/AEM.01089-13 |
| [53] | Kalhoefer D, Thole S, Voget S, et al. Comparative genome analysis and genome-guided physiological analysis of Roseobacter litoralis[J]. BMC Genomics, 2011, 12 : 324. DOI:10.1186/1471-2164-12-324 |
| [54] | Stolz JF, Ellis DJ, Blum JS, et al. Note: Sulfurospirillum barnesii sp. nov. and Sulfurospirillum arsenophilum sp. nov., new members of the Sulfurospirillum clade of the ε-Proteobacteria[J]. International Journal of Systematic and Evolutionary Microbiology, 1999, 49(3) : 1177–1180. |
| [55] | Muller D, Simeonova DD, Riegel P, et al. Herminiimonas arsenicoxydans sp. nov., a metalloresistant bacterium[J]. International journal of systematic and evolutionary microbiology, 2006, 56(8) : 1765–1769. DOI:10.1099/ijs.0.64308-0 |
| [56] | Phung LT, Trimble WL, Meyer F, et al. Draft genome sequence of Alcaligenes faecalis subsp. faecalis NCIB 8687 (CCUG 2071)[J]. Journal of Bacteriology, 2012, 194(18) : 5153. DOI:10.1128/JB.01185-12 |
| [57] | Quéméneur M, Heinrich-Salmeron A, Muller D, et al. Diversity surveys and evolutionary relationships of aoxB genes in aerobic arsenite-oxidizing bacteria[J]. Applied and Environmental Microbiology, 2008, 74(14) : 4567–4573. DOI:10.1128/AEM.02851-07 |
| [58] | Fan H, Su C, Wang Y, et al. Sedimentary arsenite-oxidizing and arsenate-reducing bacteria associated with high arsenic groundwater from Shanyin, Northwestern China[J]. Journal of Applied Microbiology, 2008, 105(2) : 529–539. DOI:10.1111/jam.2008.105.issue-2 |
| [59] | Philips SE, Taylor ML. Oxidation of arsenite to arsenate by Alcaligenes faecalis[J]. Applied and Environmental Microbiology, 1976, 32(3) : 392–399. |
| [60] | Jiang DW, Li P, Jiang Z, et al. Chemolithoautotrophic arsenite oxidation by a thermophilic Anoxybacillus flavithermus strain TCC9-4 from a hot spring in Tengchong of Yunnan, China[J]. Frontiers in Microbiology, 2015, 6 : 360. |
| [61] | Dong D, Ohtsuka T, Dong DT, et al. Arsenite oxidation by a facultative chemolithoautotrophic Sinorhizobium sp. KGO-5 isolated from arsenic-contaminated soil[J]. Bioscience, Biotechnology, and Biochemistry, 2014, 78(11) : 1963–1970. DOI:10.1080/09168451.2014.940276 |
| [62] | Oremland RS, Hoeft SE, Santini JM, et al. Anaerobic oxidation of arsenite in Mono Lake water and by a facultative, arsenite-oxidizing chemoautotroph, strain MLHE-1[J]. Applied and Environmental Microbiology, 2002, 68(10) : 4795–4802. DOI:10.1128/AEM.68.10.4795-4802.2002 |
| [63] | Zargar K, Conrad A, Bernick DL, et al. ArxA, a new clade of arsenite oxidase within the DMSO reductase family of molybdenum oxidoreductases[J]. Environmental Microbiology, 2012, 14(7) : 1635–1645. DOI:10.1111/j.1462-2920.2012.02722.x |
| [64] | Muller D, Lièvremont D, Simeonova DD, et al. Arsenite oxidase aox genes from a metal-resistant β-proteobacterium[J]. Journal of Bacteriology, 2003, 185(1) : 135–141. DOI:10.1128/JB.185.1.135-141.2003 |
| [65] | Lialikova NN. Stibiobacter senarmontii-a new microorganism oxidizing antimony[J]. Mikrobiologiia, 1974, 43(6) : 941–948. |
| [66] | Torma AE, Gabra GG. Oxidation of stibnite by Thiobacillus ferrooxidans[J]. Antonie van Leeuwenhoek, 1977, 43(1) : 1–6. DOI:10.1007/BF02316204 |
| [67] | Hamamura N, Fukushima K, Itai T. Identification of antimony-and arsenic-oxidizing bacteria associated with antimony mine tailing[J]. Microbes and Environments, 2013, 28(2) : 257–263. DOI:10.1264/jsme2.ME12217 |
| [68] | Shi ZJ, Cao Z, Qin D, et al. Correlation models between environmental factors and bacterial resistance to antimony and copper[J]. PLoS One, 2013, 8(10) : e78533. DOI:10.1371/journal.pone.0078533 |
| [69] | Li JX, Wang Q, Li MS, et al. Proteomics and genetics for identification of a bacterial antimonite oxidase in Agrobacterium tumefaciens[J]. Environmental Science & Technology, 2015, 49(10) : 5980–5989. |
| [70] | Terry LR, Kulp TR, Wiatrowski H, et al. Microbiological oxidation of antimony (Ⅲ) with oxygen or nitrate by bacteria isolated from contaminated mine sediments[J]. Applied and Environmental Microbiology, 2015, 81(24) : 8478–8488. DOI:10.1128/AEM.01970-15 |
| [71] | Lehr CR, Kashyap DR, McDermott TR. New insights into microbial oxidation of antimony and arsenic[J]. Applied and Environmental Microbiology, 2007, 73(7) : 2386–2389. DOI:10.1128/AEM.02789-06 |
| [72] | Luo JM, Bai YH, Liang JS, et al. Metagenomic approach reveals variation of microbes with arsenic and antimony metabolism genes from highly contaminated soil[J]. PLoS One, 2014, 9(10) : e108185. DOI:10.1371/journal.pone.0108185 |
| [73] | Wang Q, Warelow TP, Kang YS, et al. Arsenite oxidase also functions as an antimonite oxidase[J]. Applied and Environmental Microbiology, 2015, 81(6) : 1959–1965. DOI:10.1128/AEM.02981-14 |
| [74] | Anderson GL, Williams J, Hille R. The purification and characterization of arsenite oxidase from Alcaligenes faecalis, a molybdenum-containing hydroxylase[J]. Journal of Biological Chemistry, 1992, 267(33) : 23674–23682. |
| [75] | Ellis PJ, Conrads T, Hille R, et al. Crystal structure of the 100 kDa arsenite oxidase from Alcaligenes faecalis in two crystal forms at 1.64 and 2.03 [J]. Structure, 2001, 9(2) : 125–132. DOI:10.1016/S0969-2126(01)00566-4 |
| [76] | Mukhopadhyay R, Rosen BP, Phung LT, et al. Microbial arsenic: from geocycles to genes and enzymes[J]. FEMS Microbiology Reviews, 2002, 26(3) : 311–325. DOI:10.1111/j.1574-6976.2002.tb00617.x |
| [77] | Kashyap DR, Botero LM, Franck WL, et al. Complex regulation of arsenite oxidation in Agrobacterium tumefaciens[J]. Journal of Bacteriology, 2006, 188(3) : 1081–1088. DOI:10.1128/JB.188.3.1081-1088.2006 |
| [78] | Sardiwal S, Santini JM, Osborne TH, et al. Characterization of a two-component signal transduction system that controls arsenite oxidation in the chemolithoautotroph NT-26[J]. FEMS Microbiology Letters, 2010, 313(1) : 20–28. DOI:10.1111/fml.2010.313.issue-1 |
| [79] | Zhao K, Huang YY, Wang Q, et al. Isolation and identification of arsenite oxidase gene and regulatory sequences in an arsenite-oxidizing bacterium Acidovorax sp. GW2[J]. Journal of Huazhong Agricultural University, 2011, 30(1) : 23–29. (in Chinese) 赵凯, 黄银燕, 王倩, 等. 三价砷氧化细菌Acidovorax sp. GW2中As (Ⅲ) 氧化酶基因和调控序列的克隆鉴定[J]. 华中农业大学学报, 2011, 30(1) : 23–29. |
| [80] | Liu GH, Liu MY, Kim EH, et al. A periplasmic arsenite-binding protein involved in regulating arsenite oxidation[J]. Environmental Microbiology, 2012, 14(7) : 1624–1634. DOI:10.1111/j.1462-2920.2011.02672.x |
| [81] | Wang GJ, Wang Q, Chen F, et al. Research progress of microbial arsenite oxidation regulation[J]. Journal of Microbiology, 2014, 34(5) : 1–7. (in Chinese) 王革娇, 王倩, 陈芳, 等. 微生物砷氧化调控研究进展[J]. 微生物学杂志, 2014, 34(5) : 1–7. |
| [82] | Kang YS, Shi ZJ, Bothner B, et al. Involvement of the Acr3 and DctA anti-porters in arsenite oxidation in Agrobacterium tumefaciens 5A[J]. Environmental Microbiology, 2015, 17(6) : 1950–1962. DOI:10.1111/1462-2920.12468 |
| [83] | Battaglia-Brunet F, Dictor MC, Garrido F, et al. An arsenic (Ⅲ)-oxidizing bacterial population: selection, characterization, and performance in reactors[J]. Journal of Applied Microbiology, 2002, 93(4) : 656–667. DOI:10.1046/j.1365-2672.2002.01726.x |
| [84] | Kashyap DR, Botero LM, Lehr C, et al. A Na+:H+ antiporter and a molybdate transporter are essential for arsenite oxidation in Agrobacterium tumefaciens[J]. Journal of Bacteriology, 2006, 188(4) : 1577–1584. DOI:10.1128/JB.188.4.1577-1584.2006 |
| [85] | Lin YB, Fan HX, Hao XL, et al. Draft genome sequence of Halomonas sp. strain HAL1, a moderately halophilic arsenite-oxidizing bacterium isolated from gold-mine soil[J]. Journal of Bacteriology, 2012, 194(1) : 199–200. DOI:10.1128/JB.06359-11 |
| [86] | Slyemi D, Moinier D, Talla E, et al. Organization and regulation of the arsenite oxidase operon of the moderately acidophilic and facultative chemoautotrophic Thiomonas arsenitoxydans[J]. Extremophiles, 2013, 17(6) : 911–920. DOI:10.1007/s00792-013-0573-1 |
| [87] | Meng YL, Liu ZJ, Rosen BP. As (Ⅲ) and Sb (Ⅲ) uptake by GlpF and efflux by ArsB in Escherichia coli[J]. Journal of Biological Chemistry, 2004, 279(18) : 18334–18341. DOI:10.1074/jbc.M400037200 |
| [88] | Sarkar A, Paul B. The global menace of arsenic and its conventional remediation-a critical review[J]. Chemosphere, 2016, 158 : 37–49. DOI:10.1016/j.chemosphere.2016.05.043 |
| [89] | Martinson CA, Reddy KJ. Adsorption of arsenic (Ⅲ) and arsenic (Ⅴ) by cupric oxide nanoparticles[J]. Journal of Colloid and Interface Science, 2009, 336(2) : 406–411. DOI:10.1016/j.jcis.2009.04.075 |
| [90] | Patra AK, Dutta A, Bhaumik A. Self-assembled mesoporous γ-Al2O3 spherical nanoparticles and their efficiency for the removal of arsenic from water[J]. Journal of Hazardous Materials, 2012, 201-202 : 170–177. DOI:10.1016/j.jhazmat.2011.11.056 |
| [91] | Lata S, Samadder S. Removal of arsenic from water using nano adsorbents and challenges: a review[J]. Journal of Environmental Management, 2016, 166 : 387–406. DOI:10.1016/j.jenvman.2015.10.039 |
| [92] | Huang ZL, Liu YY, Tao QY, et al. Influencing factors of arsenic removal by lime precipitation[J]. Chinese Journal of Environmental Engineering, 2012, 6(3) : 734–738. (in Chinese) 黄自力, 刘缘缘, 陶青英, 等. 石灰沉淀法除砷的影响因素[J]. 环境工程学报, 2012, 6(3) : 734–738. |
| [93] | Jiang ML, Guo L, Du YG, et al. Comparative study of arsenic removal by ferric chloride and ferrous sulphate[J]. Sulphuric Acid Industry, 2012(5) : 45–48. (in Chinese) 蒋明磊, 郭莉, 杜亚光, 等. 三氯化铁和硫酸亚铁除砷的比较研究[J]. 硫酸工业, 2012(5) : 45–48. |
| [94] | Ito A, Miura J, Ishikawa N, et al. Biological oxidation of arsenite in synthetic groundwater using immobilised bacteria[J]. Water Research, 2012, 46(15) : 4825–4831. DOI:10.1016/j.watres.2012.06.013 |
| [95] | Andrianisa HA, Ito A, Sasaki A, et al. Biotransformation of arsenic species by activated sludge and removal of bio-oxidised arsenate from wastewater by coagulation with ferric chloride[J]. Water Research, 2008, 42(19) : 4809–4817. DOI:10.1016/j.watres.2008.08.027 |
| [96] | Dastidar A, Wang YT. Modeling arsenite oxidation by chemoautotrophic Thiomonas arsenivorans strain b6 in a packed-bed bioreactor[J]. Science of the Total Environment, 2012, 432 : 113–121. DOI:10.1016/j.scitotenv.2012.05.051 |
| [97] | Sun WJ, Sierra-Alvarez R, Field JA. The role of denitrification on arsenite oxidation and arsenic mobility in an anoxic sediment column model with activated alumina[J]. Biotechnology and Bioengineering, 2010, 107(5) : 786–794. DOI:10.1002/bit.22883 |
 2017, Vol. 44
2017, Vol. 44