扩展功能
文章信息
- 蔡海松, 林晓栩, 郭永华, 陈龙军, 张慧, 邱宏端, 林新坚, 陈济琛
- CAI Hai-song, LIN Xiao-xu, GUO Yong-hua, CHEN Long-jun, ZHANG Hui, QIU Hong-duan, LIN Xin-jian, CHEN Ji-chen
- 信号肽及化学通透剂对环糊精葡萄糖基转移酶胞外分泌的影响
- Effects of different signal peptides and chemical penetrators on extracellular production of recombinant cyclodextrin glycosyltransferase
- 微生物学通报, 2017, 44(3): 601-610
- Microbiology China, 2017, 44(3): 601-610
- DOI: 10.13344/j.microbiol.china.160257
-
文章历史
- 收稿日期: 2016-03-29
- 接受日期: 2016-08-05
- 优先数字出版日期(www.cnki.net): 2016-09-07
2. 福州大学生物科学与工程学院 福建 福州 350108
2. College of Biological science and Engineering, Fuzhou University, Fuzhou, Fujian 350108, China
环糊精葡萄糖基转移酶 (Cyclodextrin Glycosyltransferas,简称CGTase) 是α-淀粉酶家族的一个重要成员[1],将淀粉及相关基质转化成环糊精 (CDs)[2]。CDs是一种环状结构的低聚糖[3],内疏水外亲水,广泛应用于食品、医药和环保等领域[4]。据报道嗜碱脂肪芽孢杆菌、浸麻芽孢杆菌属和软化芽孢杆菌等菌株能产CGTase[5]。地芽孢杆菌属是一个新属,该属的菌株产CGTase的报道很少[6],本实验室筛选得到一株地芽孢杆菌CHB1能产耐高温的CGTase,但在大肠杆菌中表达时胞外分泌量较少[7]。
信号肽可以实现外源重组蛋白在大肠杆菌中分泌表达[8-9]。由于大肠杆菌细胞的特殊性,重组蛋白分泌到培养基中需要跨越内外两层细胞膜,跨内膜的分泌需要借助信号肽的作用。信号肽利用其N端的正电荷和H域的疏水性以静电作用和疏水作用参与转运蛋白,目的蛋白跨越内膜时信号肽被特定的信号肽酶切割而形成成熟的蛋白[10]。然而到达周质空间的目的蛋白借助非特异性渗透或者化学通透剂跨越外膜释放到培养基中[11-12]。因此,运用信号肽和化学通透剂等方法提高地芽孢杆菌CHB1的重组CGTase胞外分泌量具有重要意义。
本研究利用分子生物学技术构建带有地芽孢杆菌CHB1自身信号肽、OmpA、PelB信号肽和不带信号肽的4种重组质粒,研究不同信号肽与通透剂对CGTase胞外分泌的影响,提高CGTase的胞外酶活,并对信号肽和通透剂影响CGTase胞外分泌的机理进行分析,为该酶的开发应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒: 地芽孢杆菌CHB1、大肠杆菌BL21(DE3)、大肠杆菌DH5α为本实验室保存;重组表达质粒pEASY-E2-OmpA-cgt由本实验室构建并保存;pet-22b (+) 载体 (提供PelB信号肽序列)、pLLp-OmpA载体 (提供OmpA信号肽序列) 为实验室保存。 1.1.2 培养基: 地芽孢杆菌CHB1生长培养基 (g/L):大豆蛋白胨10.0,牛肉浸膏3.0,氯化钠0.2,pH 7.0。LB培养基按照参考文献[4]配置。乳糖自诱导培养基[13](g/L):蛋白胨10.0,酵母浸粉5.0,Na2HPO4 17.9,KH2PO4 6.8,(NH4)2SO4 3.3,MgSO4 0.5,Trace metal 200 μL,甘油5 mL,葡萄糖0.05%,乳糖0.2%,pH 7.0。 1.1.3 主要试剂和仪器: 限制性内切酶、Taq DNA聚合酶、DL2000 DNA marker和DL15000 DNA marker,日本TaKaRa公司;T4 DNA连接酶,加拿大Fermentas公司;原核表达载体pEASY-E2,北京全式金生物公司;DNA切胶回收试剂盒、PCR引物、异丙基硫代-β-D-半乳糖苷 (IPTG)、X-Gal、氨苄抗生素 (Amp) 及质粒快速提取试剂盒,上海生工生物工程股份有限公司;蛋白质分子量标准,美国赛默飞世尔科技公司;其余试剂均为国产或进口分析纯。TECAN Infinite F50酶标仪,瑞士Tecan公司;蛋白电泳仪、凝胶成像仪,美国Bio-Rad公司。 1.2 地芽孢杆菌CHB1基因组DNA和质粒的提取地芽孢杆菌CHB1基因组DNA的提取参照Zhou等[14]的方法进行;质粒的提取参照上海生工生物工程股份有限公司质粒提取试剂盒说明书的方法进行。
1.3 环糊精葡萄糖基转移酶基因的克隆根据地芽孢杆菌CHB1的CGTase基因序列,分别设计P1、P2两对上下游引物,如表 1所示。
| 引物名称 Primer name |
引物序列 Primer sequence (5′→3′) |
| CHB1-cgt-P1 5′ -Primer |
CGGGATCCGCAAAAGATGGCTTT CATTGATT |
| CHB1-cgt-P1 3′-Primer |
CCGCTCGAGGTTTTGCCAATTCACT ATAAT |
| cgt-P2 5′-Primer | CGGGATCCGGAAATCTTAATAAGGT AAATTTTAC |
| cgt-P2 3′-Primer | CCCTCGAGGGGTTTTGCCAATTCA CTATAATTTTTC |
以地芽孢杆菌CHB1菌株基因组DNA为模板,采用PCR方法分别以P1引物和P2引物扩增带有地芽孢杆菌CHB1自身信号肽的CHB1-cgt基因和不带信号肽的cgt基因。PCR反应体系 (20 μL):基因组DNA 2.0 μL,2×Taq Master Mix 10.0 μL,引物F和引物R (10 μmol/L) 各1.0 μL,ddH2O 6.0 μL。扩增条件:95 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min 30 s,33个循环;72 ℃ 10 min。PCR产物经1%的琼脂糖凝胶电泳检测后,胶回收纯化PCR产物,回收样品与pMD19-T载体16 ℃连接过夜,连接产物转化大肠杆菌DH5α感受态细胞,涂布平板进行蓝白斑筛选,挑取白斑进行PCR和测序验证获取阳性克隆 (pMD19-T-cgt和pMD19-T-CHB1-cgt)。
1.4 携带不同信号肽的表达质粒的构建与验证pEASY-E2-cgt重组质粒 (不含信号肽) 的构建:表达载体pEASY-E2与cgt基因连接。
pEASY-E2-CHB1-cgt重组质粒 (含有CHB1信号肽) 的构建:表达载体pEASY-E2与CHB1-cgt基因进行连接。
pEASY-E2-PelB-cgt重组质粒 (含PelB信号肽) 的构建:设计一对引物F (5′-CATGCCATGGGGAAATCTTAATAAGGTAAATTTT-3′,下划线为Nco Ⅰ限制性酶切位点) 和R (5′-CCGCTCGAGGTTTTGCCAATTCACTATAAT-3′,下划线为Xho Ⅰ限制性酶切位点) 构建重组表达质粒pet-22b (+)-cgt;以重组表达质粒pet-22b (+)-cgt为模板,PCR扩增带有PelB信号肽的PelB-cgt基因,将PelB-cgt基因与表达载体pEASY-E2连接。
上述3种连接产物分别转化大肠杆菌BL21(DE3),氨苄青霉素抗性平板筛选阳性克隆。提取质粒,进行BamH Ⅰ和Xho Ⅰ双酶切验证,并且将阳性克隆子送上海生工生物工程有限公司测序。
1.5 重组CGTase的诱导表达种子培养:将含有不同质粒的重组菌各接入装有50 mL LB培养基的250 mL三角瓶中,37 ℃、180 r/min培养8 h。
发酵培养:将种子液按2% (体积比) 的接种量,接种至装有50 mL乳糖自诱导培养基[13]的250 mL三角瓶中进行培养,25 ℃、180 r/min诱导72 h。样品于8 000 r/min离心2 min,收集上清测定胞外酶活。
各培养基使用前均需添加100 mg/L氨苄青霉素。
1.6 重组CGTase胞内外表达分析取8 mL发酵液,8 000 r/min离心2 min,分别收集上清和沉淀,上清即为胞外可溶性重组CGTase组分;沉淀部分加入3 ml 50 mmol/L的磷酸盐缓冲液 (pH 6.0),然后进行超声破碎,超声破碎液13 000 r/min离心5 min,分别收集上清和沉淀,此时的上清即为胞内可溶性重组CGTase组分,沉淀即为胞内不可溶性重组CGTase组分 (包涵体)。
1.7 重组CGTase α-环化活力和蛋白含量测定CGTase α-环化活性参照文献[15]。一个酶活单位 (U) 定义为在上述条件下每分钟生成1 μmol的环糊精所需的酶量。
蛋白含量的测定采用Bradford法[16],以牛血清白蛋白作为标准蛋白。
2 结果与分析 2.1 环糊精葡萄糖基转移酶基因的克隆以地芽孢杆菌CHB1的基因组DNA为模板,分别扩增带有地芽孢杆菌CHB1自身信号肽的CHB1-cgt基因和不带信号肽的cgt基因,获得两条大小在2 000 bp附近的DNA片段 (图 1);另外,基因测序结果显示序列没有发生突变。因此,PCR扩增获得了大小和序列均正确的CHB1-cgt和cgt基因。

|
| 图 1 CHB1-cgt和cgt基因PCR产物 Figure 1 The PCR product of CHB1-cgt and cgt gene Note: M: DL2000 DNA marker; 1: cgt gene; 2: CHB1-cgt. |
|
|
将扩增产物 (CHB1-cgt和cgt) 用BamH Ⅰ和Xho Ⅰ酶切纯化后,与同样进行双酶切的表达质粒pEASY-E2、pet-22b (+)-PelB进行连接得到重组质粒pEASY-E2-CHB1-cgt、pet-22b (+)-PelB-cgt。经BamH Ⅰ和Xho Ⅰ双酶切验证均得到大小在2 000 bp附近和5 000 bp附近的两条条带 (图 2),证明重组质粒pEASY-E2-CHB1-cgt、pet-22b (+)-cgt构建成功。

|
| 图 2 重组质粒pEASY-E2-CHB1-cgt、pet-22b (+)-PelB-cgt的双酶切验证 Figure 2 The restriction analysis of recombinant plasmid pEASY-E2-CHB1-cgt and pet-22b (+)-PelB-cgt 注:M1:λ/hind Ⅲ DNA标准分子量;1:质粒pet-22b (+)-PelB-cgt被BamH Ⅰ和Xho Ⅰ酶切;2:质粒pEASY-E2-CHB1-cgt被BamH Ⅰ和Xho Ⅰ酶切;M2:DNA标准分子量. Note: M1: λ/hind Ⅲ marker; 1: The digestion of recombinant plasmid pet-22b (+)-PelB-cgt by BamH Ⅰ and Xho Ⅰ; 2: The digestion of recombinant plasmid pEASY-E2-CHB1-cgt by BamH Ⅰ and Xho Ⅰ; M2: DL2000 DNA marker. |
|
|
以pet-22b (+)-PelB-cgt重组载体为模板,PCR扩增带有PelB信号肽的PelB-cgt基因 (图 3)。将目的片段PelB-cgt双酶切后与同样进行双酶切的表达载体pEASY-E2进行连接,得到重组质粒pEASY-E2-PelB-cgt。提取质粒进行双酶切验证,经双酶切验证得到大小在2 000 bp和5 000 bp附近的两条条带 (图 3),条带大小分别与载体片段及目的基因片段大小相符,表明重组质粒pEASY-E2-PelB-cgt构建成功。

|
| 图 3 PCR扩增产物的电泳分析及重组质粒pEASY-E2-PelB-cgt双酶切验证 Figure 3 The map of recombinant plasmid pEASY-E2-PelB-cgt and the restriction analysis of recombinant plasmid pEASY-E2-PelB-cgt Note: M1: DL2000 DNA marker; 1: PelB-cgt; 2: The digestion of recombinant plasmid pEASY-E2-PelB-cgt by Nco Ⅰ and Xho Ⅰ; M2: λ/hind Ⅲ marker. |
|
|
将重组质粒pEASY-E2-OmpA-cgt、pEASY-E2-PelB-cgt、pEASY-E2-CHB1-cgt、pEASY-E2-cgt转化至大肠杆菌BL2l (DE3) 中,挑取阳性克隆子进行诱导表达。不同信号肽对重组CGTase胞内外表达的影响情况见图 4,携带不同质粒的4种重组菌均能诱导表达CGTase,在70 kD左右出现目标条带,这与预期的CGTase的相对分子质量一致。

|
| 图 4 重组菌诱导表达CGTase SDS-PAGE电泳 Figure 4 SDS-PAGE analysis of the recombinant CGTase 注:M:蛋白标准;1:重组质粒pEASY-E2-OmpA-cgt的可溶性部分;2:重组质粒pEASY-E2-OmpA-cgt的不可溶性部分;3:重组质粒pEASY-E2-cgt的可溶性部分;4:重组质粒pEASY-E2-cgt的不可溶性部分;5:重组质粒pEASY-E2-CHB1-cgt的可溶性部分;6:重组质粒pEASY-E2-CHB1-cgt的不可溶性部分;7:重组质粒pEASY-E2-PelB-cgt的可溶性部分;8:重组质粒pEASY-E2-PelB-cgt的不可溶性部分. Note: M: Protein marker; 1: The soluble cellular fraction of recombinant plasmid pEASY-E2-OmpA-cgt; 2: The insoluble cellular fraction of recombinant plasmid pEASY-E2-OmpA-cgt; 3: The soluble cellular fraction of recombinant plasmid pEASY-E2-cgt; 4: The insoluble cellular fraction of recombinant plasmid pEASY-E2-cgt; 5: The soluble cellular fraction of recombinant plasmid pEASY-E2-CHB1-cgt; 6: The insoluble cellular fraction of recombinant plasmid pEASY-E2-CHB1-cgt; 7: The soluble cellular fraction of recombinant plasmid pEASY-E2-PelB-cgt; 8: The insoluble cellular fraction of recombinant plasmid pEASY-E2-PelB-cgt. |
|
|
通过比较发现,不同信号肽对菌诱导表达、分泌CGTase有着明显的差异,其中重组质粒pEASY-E2-OmpA-cgt与pEASY-E2-cgt的CGTase表达量大于其余两种重组质粒,pEASY-E2-OmpA-cgt的蛋白可溶性部分 (胞外分泌) 较多 (图 4),而且形成的包涵体明显比较少 (图 4)。由于信号肽作用,分泌型重组表达载体pEASY-E2-OmpA-cgt能将CGTase分泌到胞外,这为后期的优化及大规模提取奠定了基础。然而重组质粒pEASY-E2-PelB-cgt、pEASY-E2-CHB1-cgt的CGTase表达量、胞外分泌量较小 (图 4),说明不同信号肽对目的蛋白的表达、胞外分泌影响不同。
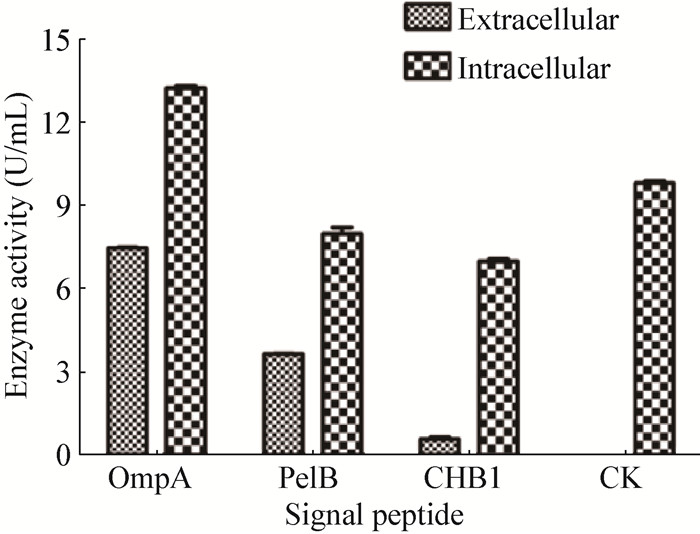
2.4 不同信号肽对重组CGTase胞外分泌的影响将携带不同质粒的4种重组菌进行发酵培养,3次平行实验测定胞内外分泌情况如图 5所示。带有OmpA信号肽的重组菌的胞外和胞内酶活均高于其他3个重组菌,在相同的发酵条件下发酵72 h,胞外酶活达到7.44 U/mL,分别是PelB信号肽和CHB1自身信号肽的2.04倍和11.27倍,而不带信号肽的重组菌胞外检测不到酶活。通过对图 4和图 5的分析表明,OmpA信号肽更利于重组CGTase的表达和胞外分泌。4种重组菌的胞内酶活都比胞外高,因此在后续的研究中,如何提高细胞外膜的通透性以促进CGTase从胞内、周质空间向胞外释放及缩短发酵周期成为研究重点。
|
| 图 5 不同信号肽对重组大肠杆菌胞内外生产CGTase的影响 Figure 5 The influence of different signal peptide on the extracellular and intracellular CGTase production by E.coli |
|
|
以重组质粒pEASY-E2-OmpA-cgt作为研究对象,诱导时分别加入了甘氨酸、Triton X-100、SDS和Tween 80四种化学通透剂,3次平行实验测定比较这4种化学通透剂对重组CGTase胞外分泌的影响,结果如图 6所示。从图 6可知,甘氨酸、Triton X-100均能促进重组CGTase的胞外分泌,随着甘氨酸、Triton X-100添加量的依次增加,胞外酶活也依次增加,当甘氨酸和Triton X-100的添加量分别为0.6%和0.3%时,甘氨酸和Triton X-100导致大肠杆菌细胞膜透性的明显增加[17],胞外酶活分别达到最大为9.27 U/mL和9.75 U/mL,但添加量过大胞外酶活性反而下降。

|
| 图 6 不同化学通透剂对重组CGTase胞外分泌的影响 Figure 6 The influence of different chemical additives on extracellular secretion of recombinant CGTase |
|
|
如图 7所示,4种化学通透剂对大肠杆菌细胞生长有不同程度的负面影响,与对照组相比,4个实验组单位体积中的细胞总数有不同的下降,这限制了重组酶胞外分泌量和生产强度的进一步增加。其中,SDS和Tween 80对菌体生长的抑制作用比较明显,发酵至72 h,添加0.1% SDS的菌体OD600仅为9.6,添加2% Tween 80的菌体OD600仅为9.9,而对照组为18.7,结果Tween 80和SDS的添加反而使胞外酶活低于空白对照;甘氨酸和Triton X-100对菌体抑制作用较弱,与对照相比,添加0.6% SDS的菌体OD600仅下降11.7%,但随着通透剂浓度增大,对菌体生长的抑制作用也增大。因此,在发酵过程中,添加适当浓度的甘氨酸和Triton X-100能够提高重组酶的胞外产量。

|
| 图 7 不同化学通透剂对重组大肠杆菌生长的影响 Figure 7 The influence of different chemical penetrators on growth of recombinant E.coli Note: A: Glycine; B: Triton X-100; C: Tween 80; D: SDS. |
|
|
如图 6所示,随着甘氨酸量的增加,胞外重组CGTase产量提高幅度下降。为了进一步提高重组CGTase的胞外分泌,因此选择添加浓度为0.6%的甘氨酸,分别在发酵的不同时间点 (15、24、36、48、72 h) 添加,考察发酵上清液中重组CGTase的酶活情况。
如图 8所示,在不同诱导时间加入0.6%的甘氨酸,对重组CGTase的胞外分泌产生不同影响,过早或过晚添加甘氨酸都不利于菌体的生长和CGTase的胞外分泌。当重组菌诱导至48 h时,菌体生长情况比较接近对照组,添加甘氨酸促进重组CGTase胞外分泌的效果最好,发酵至96 h,OD600为16.2,胞外酶活最高可达12.51 U/mL;而发酵72 h添加甘氨酸,菌体OD600达到最大17.3。其原因一方面可能是因为过早添加通透剂,由于菌量较少,并且通透剂对菌体生长具有抑制作用,因此菌体生长受阻,不利于重组蛋白的形成,从而影响胞外表达;太迟加入通透剂,由于菌体生长已经进入衰亡期,大量对目的蛋白具有降解作用的次级代谢产物已经形成,通透剂裂解菌体细胞则加速目的蛋白的降解,抑制胞外分泌。综合OD600和胞外酶活情况,甘氨酸的最佳添加浓度和时间为在发酵48 h后添加0.6%。

|
| 图 8 不同时间添加甘氨酸对重组大肠杆菌发酵产CGTase的影响 Figure 8 The effects of different addition time of glycine on CGTase by recombinant E.coli 注:A:胞外酶活性图;B:重组大肠杆菌生长曲线图. Note: A: CGTase activity; B: Growth curve of the strain. |
|
|
甘氨酸和Triton X-100对重组蛋白的胞外分泌具有促进作用,因此对于重组CGTase胞外分泌所需的甘氨酸和Triton X-100的添加浓度进行优化。根据单因素实验结果,选择甘氨酸和Triton X-100作为正交实验的具体因素 (表 2),每个因素选择4个浓度水平,以发酵72 h胞外酶活作为考察指标,确定最优的添加浓度。
| 因素 Factor |
甘氨酸 Glycine (%) |
Triton X-100 (%) |
| 1 | 0.2 | 0.1 |
| 2 | 0.4 | 0.3 |
| 3 | 0.6 | 0.6 |
| 4 | 0.8 | 1.0 |
如表 3所示,根据极差分析结果,发现甘氨酸和Triton X-100协同作用时,0.6%的甘氨酸和0.3% Triton X-100对重组CGTase胞外分泌的促进效果最明显,胞外酶活为14.27 U/mL,是不加任何化学通透剂对照组的2倍左右。
| 编号 Number |
甘氨酸 Glycine (%) |
Triton X-100 (%) |
胞外酶活 Extracellular activity (U/mL) |
| 1 | 1 | 1 | 9.36 |
| 2 | 1 | 2 | 9.12 |
| 3 | 1 | 3 | 10.04 |
| 4 | 1 | 4 | 8.33 |
| 5 | 2 | 1 | 9.19 |
| 6 | 2 | 2 | 9.28 |
| 7 | 2 | 3 | 10.55 |
| 8 | 2 | 4 | 8.92 |
| 9 | 3 | 1 | 10.37 |
| 10 | 3 | 2 | 14.27 |
| 11 | 3 | 3 | 12.55 |
| 12 | 3 | 4 | 11.50 |
| 13 | 4 | 1 | 8.23 |
| 14 | 4 | 2 | 8.92 |
| 15 | 4 | 3 | 9.37 |
| 16 | 4 | 4 | 8.10 |
| R | 12.07 | 4.74 |
信号肽一般位于重组蛋白的N端,其长度根据融合位置的不同有一定差异,长度一般为18−30个氨基酸。信号肽在一级结构上具有高度的可变性,但均具有相同的功能域,包括带正电荷的N端、疏水性的H区域和极性的C区域[9]。本研究采用信号肽预测在线分析工具http://www.cbs.dtu.dk/services/SignalP-2.0分析三大信号肽的氨基酸序列与性质,见表 4 (黑体加粗部分是信号肽的N端序列,加下划线的是C区域,斜体部分是H区域)。根据Expasy Proteomics Server在线分析软件http://web.expasy.org/protparam,其信号肽特性如表 5所示,由于OmpA信号肽是大肠杆菌外膜蛋白A的信号肽,与表达宿主的亲缘关系比PelB和CHB1自身信号肽近,而地芽孢杆菌CHB1自身信号肽对于促进CGTase的胞外表达效果相对较差,可能是由于地芽孢杆菌CHB1的信号肽不适合介导CGTase在大肠杆菌中分泌表达;H域疏水性也是决定信号肽分泌效果的重要因素,由于OmpA信号肽的H域疏水性大于其他两个信号肽,跨膜时形成的疏水作用较强,因此对目的蛋白的分泌效率较强。
| 信号肽 Signal peptide |
氨基酸序列 The amino acid sequence |
| OmpA | MKKTAIAIAVALAGFATVAQA |
| PelB | MKYLLPTAAAGLLLLAAQPAMA |
| CHB1 | MKRWLSLIFSMSLVFSAMFMMSDTQKVTVAAA |
| 信号肽 Signal peptide |
氨基酸数目 The amino acid number |
H区疏水性 H hydrophobicity |
N端带电量 N electrified capacity |
| OmpA | 21 | 2.531 | 2 |
| PelB | 22 | 1.707 | 1 |
| CHB1 | 32 | 1.067 | 3 |
Triton X-100作为一种非离子性表面活性剂,不易受强电解质的影响,并且能与生物膜中的脂类结合形成可溶性复合物,因此能改变生物膜的渗透性[18];甘氨酸可与合成肽聚糖所必需的D-丙氨酸竞争,并取代它们,形成更加松弛交联的肽聚糖,从而破坏细胞壁肽聚糖的结构,导致大肠杆菌细胞膜透性的明显增加[19]。甘氨酸和Triton X-100对于促进重组酶在大肠杆菌的胞外表达具有协同作用[18],两种或多种化学通透剂同时使用可以使分泌效果更佳。以带有OmpA信号肽的重组质粒pEASY-E2-OmpA-cgt作为研究对象,在单因素实验中,优化了甘氨酸和Triton X-100的最适添加浓度,分别为0.6%和0.3%,最适添加时间为48 h。正交实验结果表明甘氨酸和Triton X-100共同作用时的最适浓度分别为0.6%和0.3%,胞外酶活为14.27 U/mL,是不加任何化学通透剂组的2倍左右,是pEASY-E2-cgt重组菌的22.54倍。
综上所述,携带OmpA信号肽的重组质粒pEASY-E2-OmpA-cgt可以增加CGTase的可溶性表达及胞外分泌。在诱导表达时,加入适宜浓度的化学通透剂甘氨酸和Triton X-100能够有效促进CGtase的胞外分泌。
| [1] | Han RZ, Li JH, Shin HD, et al. Recent advances in discovery, heterologous expression, and molecular engineering of cyclodextrin glycosyltransferase for versatile applications[J]. Biotechnology Advances, 2014, 32(2) : 415–428. DOI:10.1016/j.biotechadv.2013.12.004 |
| [2] | Li ZF, Li B, Gu ZB, et al. Extracellular expression and biochemical characterization of α-cyclodextrin glycosyltransferase from Paenibacillus macerans[J]. Carbohydrate Research, 2010, 345(7) : 886–892. DOI:10.1016/j.carres.2010.02.002 |
| [3] | Leemhuis H, Kelly RM, Dijkhuizen L. Engineering of cyclodextrin glucanotransferases and the impact for biotechnological applications[J]. Applied Microbiology and Biotechnology, 2010, 85(4) : 823–835. DOI:10.1007/s00253-009-2221-3 |
| [4] | Li ZF. Expression of α-Cyclodextrin glycosyltransferase from Paenibacillus macerans in escherichia coli and analysis of its product specificity[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2009(in Chinese) 李兆丰. 软化类芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中的表达及其产物特异性分析[D]. 无锡: 江南大学博士学位论文, 2009 |
| [5] | Amiri A, Mohamad R, Rahim RA, et al. Cyclodextrin glycosyltransferase biosynthesis improvement by recombinant Lactococcus lactis NZ: NSP: CGT: medium formulation and culture condition optimization[J]. Biotechnology & Biotechnological Equipment, 2015, 29(3) : 555–563. |
| [6] | Zhou WM, Yang SZ, Nazina TN, et al. Progress in Geobacillusstudy[J]. Journal of Microbiology, 2005, 25(3) : 46–49. (in Chinese) 周卫民, 杨世忠, NazinaTN, 等. Geobacillus研究进展[J]. 微生物学杂志, 2005, 25(3) : 46–49. |
| [7] | Guo YH, Chen JC, Jia XB, et al. Effects of chaperone co-expression on heterologous solubility expression of thermophilic cyclodextrin glucosetransferase[J]. Microbiology China, 2016, 43(3) : 518–526. (in Chinese) 郭永华, 陈济琛, 贾宪波, 等. 分子伴侣共表达对嗜热环糊精葡萄糖基转移酶异源可溶性表达的影响[J]. 微生物学通报, 2016, 43(3) : 518–526. |
| [8] | Xiao XH, Huang L, Huang N, et al. Cloning and expression analysis of ScBAK1 gene and its alternative spliceosome in sugarcane[J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(5) : 872–881. (in Chinese) 肖新换, 黄珑, 黄宁, 等. 甘蔗ScBAK1基因及其可变剪接体的克隆与表达分析[J]. 应用与环境生物学报, 2015, 21(5) : 872–881. |
| [9] | Mergulh o FJM, Summers DK, Monteiro GA. Recombinant protein secretion in Escherichia coli[J]. Biotechnology Advances, 2005, 23(3) : 177–202. DOI:10.1016/j.biotechadv.2004.11.003 |
| [10] | Gelis I, Bonvin AMJJ, Keramisanou D, et al. Structural basis for signal-sequence recognition by the translocase motor SecA as determined by NMR[J]. Cell, 2007, 131(4) : 756–769. DOI:10.1016/j.cell.2007.09.039 |
| [11] | Low KO, Jonet MA, Ismail NF, et al. Optimization of aBacillus sp. signal peptide for improved recombinant protein secretion and cell viability in Escherichia coli[J]. Bioengineered, 2012, 3(6) : 334–338. DOI:10.4161/bioe.21454 |
| [12] | Jonet MA, Mahadi NM, Murad AMA, et al. Optimization of a heterologous signal peptide by site-directed mutagenesis for improved secretion of recombinant proteins in Escherichia coli[J]. Journal of Molecular Microbiology and Biotechnology, 2012, 22(1) : 48–58. DOI:10.1159/000336524 |
| [13] | Studier FW. Protein production by auto-induction in high-density shaking cultures[J]. Protein Expression and Purification, 2005, 41(1) : 207–234. DOI:10.1016/j.pep.2005.01.016 |
| [14] | Zhou JZ, Bruns MA, Tiedje JM. DNA recovery from soils of diverse composition[J]. Applied and Environmental Microbiology, 1996, 62(2) : 316–322. |
| [15] | Chen FJ, Xie T, Yue Y, et al. Molecular dynamic analysis of mutant Y195I α-cyclodextrin glycosyltransferase with switched product specificity from α-cyclodextrin to γ-cyclodextrin[J]. Journal of Molecular Modeling, 2015, 21(8) : 208. DOI:10.1007/s00894-015-2734-x |
| [16] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2) : 248–254. |
| [17] | Ding RR, Li ZF, Chen S, et al. Enhanced secretion of recombinant α-cyclodextrin glucosyltransferase from E.coli by medium additives[J]. Process Biochemistry, 2010, 45(6) : 880–886. DOI:10.1016/j.procbio.2010.02.009 |
| [18] | Tang JB, Yang HM, Zhang YJ, et al. Effect of glycine and Triton X-100 on the secretion of ZZ-EGFP fusion protein[J]. Chinese Medicinal Biotechnology, 2007, 2(4) : 266–269. (in Chinese) 唐金宝, 杨洪鸣, 张义军, 等. 甘氨酸和Triton X-100对ZZ-EGFP融合蛋白分泌表达影响的初步研究[J]. 中国医药生物技术, 2007, 2(4) : 266–269. |
| [19] | Hammes W, Schleifer KH, Kandler O. Mode of action of glycine on the biosynthesis of peptidoglycan[J]. Journal of Bacteriology, 1973, 116(2) : 1029–1053. |
 2017, Vol. 44
2017, Vol. 44




