扩展功能
文章信息
- 马思佳, 顾卓江, 丁丽丽, 任洪强
- MA Si-jia, GU Zhuo-jiang, DING Li-li, REN Hong-qiang
- 碳源对活性污泥微生物细胞膜特性和群落结构影响
- Effects of carbon sources on cell membrane properties and microbial community of activated sludge
- 微生物学通报, 2017, 44(3): 561-573
- Microbiology China, 2017, 44(3): 561-573
- DOI: 10.13344/j.microbiol.china.160209
-
文章历史
- 收稿日期: 2016-03-14
- 接受日期: 2016-09-07
- 优先数字出版日期(www.cnki.net): 2016-12-19
2. 海正药业 (杭州) 有限公司 浙江 杭州 311404
2. Hisun Pharmaceutical Company Limited, Hangzhou, Zhejiang 311404, China
碳源作为活性污泥微生物新陈代谢活动的主要能量来源,对活性污泥系统污染物去除 (除碳[1]、脱氮除磷[2-4]) 和污泥性能 (沉降性能[1]、絮凝性能和吸附性能[5]等) 有着重要的影响。目前,关于外界条件 (碳源[1-3]、温度[6]、溶解氧[7]等) 对活性污泥性能的影响研究多是从微生物胞外聚合物 (组成、含量、官能团) 和胞内聚合物的角度展开,对于活性污泥微生物细胞膜特征 (磷脂组成和流动性) 的研究较少,且主要集中在低温[8]方面。
微生物细胞膜磷脂组成和流动性的不同会造成微生物物质运输过程及细胞向外界环境排放的大分子物质 (蛋白质等) 含量和种类的差异[9-10]。磷脂脂肪酸 (PLFA) 为甲基化活性污泥中提取磷脂后得到的脂肪酸产物。脂肪酸通常的命名格式为X:Y ωZ(c/t),其中,X为总碳数,Y表示双键数,ω表示甲基末端,Z是距离甲基的距离,c表示顺式,t表示反式,其他字符如a和i分别表示支链的反异构和异构,10Me表示一个甲基团在距分子末端第10个碳原子上,环丙烷脂肪酸用cy表示[11]。不饱和脂肪酸和支链脂肪酸相比于饱和脂肪酸具有更低的相变温度,因此能够增加微生物的细胞膜流动性[9]。Fang等[12]的研究发现,0.01 mg/L的C60纳米粒子会造成Bacillus subtilis细胞膜支链脂肪酸的显著增加,而0.75 mg/L时则会促进不饱和脂肪酸含量的增加,两者的增加均提高了其细胞膜流动性。已有研究表明,不同碳源 (甲苯[13]、甲醇和乙醇[14]等) 条件下,单一细菌 (Pseudomonas putida和Escherichia coli K-12等) 细胞膜会形成特殊的PLFA组成改变其流动性以适应外界碳源的改变。活性污泥微生物是由细菌 (主体部分)、放线菌、真菌、原生动物、后生动物等组成,不同碳源条件下其细胞膜PLFA组成和流动性如何变化鲜有报道。
碳源、环境条件[7]、操作条件[8]的不同均会导致微生物群落结构的差异。Ahmed等[15]的研究表明,在以甲醇׃乙酸钠׃丙酸钠 (6׃3׃1) 为碳源的膜生物反应器中,促进了BetaProteobacteria含量的增多;Hagman等[16]的研究发现,由乙酸钠和甲醇组成的混合碳源,相比于乙酸钠或甲醇为单一碳源时,Azoarcus的含量有所增加。Illumina MiSeq高通量测序方法具有更高的细菌DNA覆盖率和准确性,能够提供更完整和准确的微生物群落结构信息[17]。
本研究分别以5种碳源运行序批式活性污泥 (SBR) 反应器,考察其对活性污泥微生物表面粘附力、细胞膜PLFA组成与流动性和微生物群落结构的影响,为深入了解碳源对活性污泥系统微生物性能的影响及优化反应器运行效果提供理论依据。
1 材料与方法 1.1 材料 1.1.1 反应器运行方法: 实验包括5个平行的SBR反应器,分别以葡萄糖 (反应器A)、乙酸钠 (反应器B)、蛋白胨 (反应器C)、葡萄糖׃蛋白胨 (化学需要量COD׃COD=200׃200) (反应器D) 和乙酸钠:蛋白胨 (COD׃COD=200׃200) 为碳源 (反应器E)。反应器有效容积为2 L,实验中进水为人工模拟废水,进水COD为400 mg/L,此外每升废水包含120 mg NH4Cl,19 mg KH2PO4,25 mg MgSO4·7H2O,11 mg CaCl2·2H2O和0.6 mL微量元素混合液,其中每升微量元素混合液包含:1.50 g FeCl3·6H2O,0.15 g H3BO3,0.03 g CuSO4·5H2O,0.18 g KI,0.12 g MnCl2·4H2O,0.06 g Na2MoO4·2H2O,0.12 g ZnSO4·7H2O,0.15 g CoCl2·6H2O和10.00 g EDTA。SBR反应器运行周期为12 h,分别由进水 (10 min)、反应 (660 min)、静置 (40 min) 和排水 (10 min) 组成,水力停留时间为11 h,污泥龄为10 d,溶解氧维持在4.0-5.8 mg/L,温度为25±2,进水pH 7.0±0.1。接种污泥取自南京某污水处理厂,反应器污泥浓度为3 000±100 mg/L。 1.1.2 主要试剂和仪器: 试验中所用试剂均为分析纯级别,南京化学试剂有限公司。离心机 (Centrifuge5810R),德国Eppendorf公司;紫外分光光度计 (UV-2540),日本岛津公司;水浴锅,国华电器有限公司;FastDNA® SPIN Kit for Soil,美国Qbiogene公司;气相色谱 (7890),美国安捷伦公司;原子力显微镜 (Multimode 8),德国Bruker公司;激光共聚焦显微镜 (FV1000),日本Olympuus公司;纯化试剂盒,美国OMEGA Bio-tek公司;Miseq,美国Illumina公司。 1.2 分析方法 1.2.1 常规水质指标: 按国标法[18]检测进出水COD。反应器运行稳定后[COD去除率高于90%,运行时间大于3个污泥停留时间 (SRT)],检测出水中蛋白质的含量,蛋白采用BCA蛋白质测定试剂盒 (生工) 进行测定[19],并对水样进行三维荧光光谱分析,三维荧光检测方法根据Huang等[20]的报道。 1.2.2 污泥表面粘附力分析: 反应器运行稳定后,分别取出活性污泥 (第40天),自然晾干30 min,然后进行原子力显微镜观察测定,分别测定其粘附力,其中每个样品选取3个不同区域进行测定,每个区域读数20次[21]。 1.2.3 细胞膜流动性能分析: 细胞膜磷脂流动性能分析方法根据Mullineaux等[22]的报道,在1 μmol/L BODIPY-FL-C12下培养30 min,经模拟废水洗脱未标记染料后的样品由激光共聚焦显微镜检测及分析。根据Schwartz等[23]的研究,细胞膜磷脂运行分数 (Mf) 采用公式Mf=(Ft-F0)/(Fi-F0) 进行计算,其中Ft代表恢复后的荧光强度,Fi漂白前荧光强度,F0代表漂白完成后的荧光强度。 1.2.4 细胞膜磷脂脂肪酸组成分析: 取第40天的污泥进行磷脂脂肪酸组成分析,提取方法根据Zhou等[11]的报道。经过提取和纯化的磷脂脂肪酸由气相色谱检测,所得结果利用MIDI Sherlock Microbial Identification System软件进行分析。 1.2.5 微生物群落结构检测: 活性污泥微生物群落结构采用16S rRNA基因高通量测序 (MiSeq,Illumina) 进行检测。污泥样品4 000 r/min离心5 min后弃上清液。利用试剂盒进行DNA的提取,提取后的DNA样品利用基于细菌16S rRNA基因V1-V2区通用引物进行PCR扩增。PCR反应体系为50 μL,包括10×ExTaq Buffer 5 μL,25 μmol/L MgCl2 4 μL,5 U/μL ExTaq DNA聚合酶0.25 μL,20 μmol/L正反向引物各1 μL,20 mg/L DNA模板2 μL,加灭菌水至50 μL。PCR扩增条件为:98 5 min;98,50,72,20个循环;72。经琼脂糖凝胶电泳鉴定PCR产物后,采用纯化试剂盒纯化后送至江苏中宜金大分析检测有限公司进行Miseq测序。 1.3 数据统计与分析常规水质指标的数据及绘图处理采用Origin 7.5软件,Miseq数据经Sickle及Mothur降噪后,通过RDP分类处理,将结果中相对丰度大于0.2%的属采用R语言安装包绘制heatmap。香农-威尔 (Shannon-Wiener) 多样性指数采用式 (1) 计算:
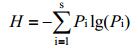
|
(1) |
式中,H为Shannon-Wiener指数,s是每个样品中细菌种类的总数,Pi为各细菌的百分比含量。微生物群落结构 (属) 和细胞膜磷脂组成与出水水质的相关性分析采用Canoco 4.5软件进行冗余 (RDA) 分析。
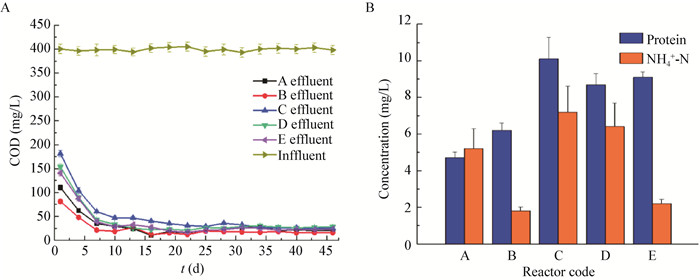
2 结果与分析 2.1 反应器运行性能不同碳源反应器进出水COD变化情况,见图 1A。所有反应器COD去除率在第25天时均高于90%。第40天时,5个反应器出水COD稳定在18.9−25.6 mg/L。反应器运行稳定后,出水氨氮和蛋白浓度见图 1B (该结果是对第30、35和40天的出水进行采样,所测结果的平均值)。三维荧光检测结果及荧光峰强度见图 2和表 1,出水中SMP的荧光峰主要分为3类:类蛋白峰A (Ex/Em=280-285/305-310,Peak A),类蛋白峰B (Ex/Em=242-252/280-290,Peak B) 和类腐殖酸峰 (Ex/Em=350-360/410-420,Peak C)[20]。
|
| 图 1 进出水COD (A)、氨氮和蛋白质浓度 (B) Figure 1 Influent and effluent COD concentration (A), effluent NH4+-N and protein concentration (B) 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: Sodium acetate; C: Peptone; D: Glucose:peptone (1:1); E: Sodium acetate:peptone (1:1). |
|
|
|
| 图 2 不同碳源反应器出水三维荧光光谱 Figure 2 EEM spectra of the effluent of reactors with different carbon sources |
|
|
| 反应器编号 Reactor code |
荧光峰A Peak A |
荧光峰B Peak B |
荧光峰C Peak C |
| A | 70.12 | 86.4 | 66.8 |
| B | 116.7 | 84.7 | 72.9 |
| C | 123.6 | 124.8 | 147.5 |
| D | 116.9 | 128.7 | 109.4 |
| E | 115.9 | 99.1 | 100.8 |
| 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: Sodium acetate; C: Peptone; D: Glucose׃peptone (1׃1); E: Sodium acetate׃peptone (1:1). |
|||
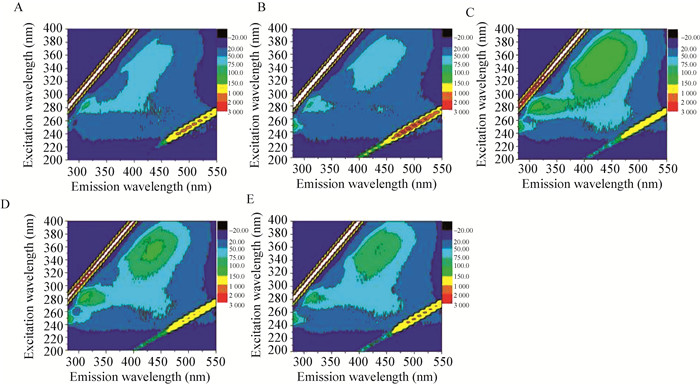
图 3为不同碳源反应器中活性污泥微生物原子力显微镜观察结果,可以看出不同碳源条件下微生物表面形貌存在较大的差异,含有蛋白胨为碳源时微生物表面形貌更为复杂。测试不同碳源反应器污泥粘附力发现,含有蛋白胨为碳源的条件下污泥粘附力均较大,分别为:蛋白胨 (C,38.7±3.6 nN) > 葡萄糖/蛋白胨 (D,37.9±2.8 nN) > 乙酸钠/蛋白胨 (E,25.7±3.9 nN) > 葡萄糖 (A,17.5±5.2 nN) > 乙酸钠 (B,16.4±6.4 nN)。Li等[24]的研究表明,微生物表面力学性能对其吸附有机物有着重要的影响。Pussak等[25]在研究微生物表面受体与碳水化合物之间的吸附作用时发现,其粘附能 (5 kJ) 较小时不利于碳水化合物的吸附。
|
| 图 3 第40天活性污泥表面AFM检测图 Figure 3 Cell surface images of activated sludge microbe using AFM at 40th day 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: sodium acetate; C: Peptone; D: Glucose׃peptone (1׃1); E: Sodium acetate׃peptone (1׃1). |
|
|
反应器运行稳定后,采集活性污泥样品进行PLFA分析,所得结果见图 4A和表 2。5个反应器污泥支链脂肪酸和不饱和脂肪酸的总含量变化为:A (60.37%) > C (53.83%) > D (51.72%) > E (48.18%) > B (35.06%)。可以看出,含有蛋白胨为碳源的污泥其支链脂肪酸和不饱和脂肪酸的含量较为相似。此外,含有蛋白胨为碳源时,18:1ω9c、15:0iso和17:0iso的含量相比于乙酸钠和葡萄糖为单一碳源时,分别提高了53.1%−354.7%、135.6%−407.9%和88.1%−264.3%。

|
| 图 4 活性污泥PLFA组成 (A) 和PCA分析 (B) Figure 4 PLFA profiles (A) and PCA analysis (B) of activated sludge 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: Sodium acetate; C: Peptone; D: Glucose:peptone (1:1); E: Sodium acetate:peptone (1:1). |
|
|
| 磷脂脂肪酸 PLFA |
A | B | C | D | E |
| 12:00 | 0.69 | 3.00 | 1.87 | 2.75 | 2.06 |
| 13:0iso | 0.05 | 0.39 | 0.07 | 0.07 | 0.16 |
| 13:0anteiso | 0.06 | 0.70 | 0.04 | 0.04 | ND |
| 13:00 | 0.11 | ND | 0.04 | 0.07 | 0.03 |
| 14:0iso | 3.82 | 0.73 | 0.98 | 1.74 | 0.80 |
| 15:1iso G | 0.23 | 0.17 | 0.51 | 0.22 | 0.50 |
| 15:0anteiso A | 2.04 | 0.22 | 0.05 | 0.27 | ND |
| 15:0iso | 1.80 | 1.26 | 6.40 | 4.24 | 5.66 |
| 15:0anteiso | 30.47 | 1.98 | 11.01 | 17.89 | 4.49 |
| 16:1iso H | 0.09 | ND | 0.24 | 0.17 | 0.26 |
| 16:0anteiso | 0.05 | ND | 0.14 | 0.12 | 0.17 |
| 15:0iso 3OH | 0.06 | 0.18 | 0.10 | 0.15 | 0.08 |
| 15:0 2OH | 0.07 | ND | 0.13 | 0.14 | 0.12 |
| 16:0iso | 9.11 | 0.67 | 9.75 | 7.52 | 2.98 |
| 16:0 10methyl | 0.56 | 0.36 | 1.99 | 1.40 | 2.01 |
| 16:0 2OH | 0.20 | ND | 0.13 | 0.21 | 0.12 |
| 16:1ω7c | 2.73 | 16.31 | 5.83 | 3.26 | 11.55 |
| 16:1ω5c | 0.35 | 0.51 | 0.54 | 0.31 | 0.76 |
| 16:00 | 19.30 | 33.24 | 19.52 | 21.36 | 23.48 |
| 17:00 | 5.16 | 0.51 | 0.42 | 1.43 | 0.53 |
| 17:0iso | 0.84 | 0.56 | 2.04 | 1.94 | 1.58 |
| 17:0cy | ND | ND | ND | ND | 0.95 |
| 17:0anteiso | 1.97 | 0.22 | 4.48 | 2.61 | 1.05 |
| 17:1ω8c | 0.75 | 0.18 | 0.41 | 0.70 | 0.31 |
| 17:0iso 3OH | 0.34 | 0.41 | 0.62 | 0.84 | 0.57 |
| 17:0 2OH | 0.12 | 0.36 | 0.21 | 0.40 | 0.27 |
| 17:0 10methyl | 0.18 | ND | 0.76 | 0.44 | 0.18 |
| 18:0iso | 0.57 | 0.17 | 0.43 | 0.38 | 0.29 |
| 18:2ω6, 9c | 0.29 | 0.40 | 1.34 | ND | 1.90 |
| 18:1ω9c | 0.96 | 0.64 | 1.97 | 2.91 | 1.47 |
| 18:1ω7c | 3.25 | 9.70 | 7.28 | 5.02 | 14.61 |
| 18:00 | 9.88 | 22.64 | 14.9 | 15.02 | 15.98 |
| 18:0 10methyl | 0.84 | 0.44 | 1.47 | 1.02 | 1.01 |
| 19:0anteiso | 0.12 | ND | 0.36 | 0.34 | 0.42 |
| 19:0iso | 0.09 | 0.27 | 0.21 | 0.22 | 0.13 |
| 19:1ω7c | 0.43 | 0.19 | 0.11 | 0.45 | 0.09 |
| 19:0cyω8c | 0.26 | 0.64 | 0.52 | 0.85 | 0.73 |
| 19:00 | 0.31 | ND | 0.11 | 0.16 | 0.07 |
| 20:4ω6, 9, 12c | 0.29 | 0.57 | 1.1 | 0.32 | 1.12 |
| 20:00 | 0.15 | 0.30 | 0.23 | 0.24 | 0.21 |
| 20:1ω9c | ND | ND | ND | 0.31 | ND |
图 4B为不同碳源活性污泥PLFA组成主成分分析结果。PC1和PC2分别代表了45.4%和33.4%的差异,结果主要分布在3个区域。含有蛋白胨为碳源的反应器微生物细胞膜PLFA组成具有一定的相似性,且主要以C17和C18为主;另外两个区域分别代表了以乙酸钠和葡萄糖为单一碳源的反应器,其PLFA组成分别以C13−C16和C15为主。Fang等[13]的研究发现,以甲苯为碳源时会促使Pseudomonas putida细胞膜不饱和脂肪酸含量的降低;Ingram[14]的研究表明,当以甲醇和乙醇为碳源时会增加Escherichia coli K-12细胞膜18:1ω7c和18:1ω9c的含量,但会降低C16:0和16:1ω7c的含量。上述结果说明,不同碳源对活性污泥微生物细胞膜PLFA组成造成了重要影响。
图 5为不同碳源活性污泥微生物细胞膜磷脂BODIPY-FL-C12标记后,漂白前、漂白后、漂白后1 min和11 min时的激光共聚焦显微镜观察结果,表 3为不同时间点所选区域的微生物细胞膜磷脂荧光强度变化结果。各个反应器活性污泥微生物细胞膜磷脂运动分数Mf分别为:D (67.3%) > E (65.4%) > C (49.4%) > A (47.9%) > B (36.7%)。含有蛋白胨为碳源时,微生物细胞膜磷脂流动性均较大,而以葡萄糖为碳源的细胞膜流动性 (表 3) 较低,与其PLFA组成中高不饱和脂肪酸和支链脂肪酸的总含量 (60.37%) 呈现不一致。这可能是由于细胞膜磷脂流动性不仅仅决定于其磷脂组成,膜蛋白的种类及与磷脂间的相互作用会对磷脂流动性造成影响[10],这方面仍需进一步的研究。Niu等[8]的研究发现,低温下微生物可以通过增加细胞膜流动性以增强对有机物运输能力。本文发现含有蛋白胨为碳源时,微生物细胞膜流动性相比于葡萄糖和乙酸钠为碳源时较高。蛋白胨为蛋白质经水解后得到的一种由胨、肽和氨基酸等组成的混合物[26],相比于葡萄糖和乙酸钠,含有蛋白胨为碳源的反应器底物组成更为复杂。蛋白胨中氨基酸进入细胞为协助扩散或主动运输,其他组分进入细胞需经过胞吞作用或经胞外蛋白酶分解为氨基酸,微生物对蛋白胨的利用过程更为复杂,因此微生物需增加其细胞膜磷脂流动性以维持良好的物质运输,且混合碳源下该机制得到了进一步的加强。
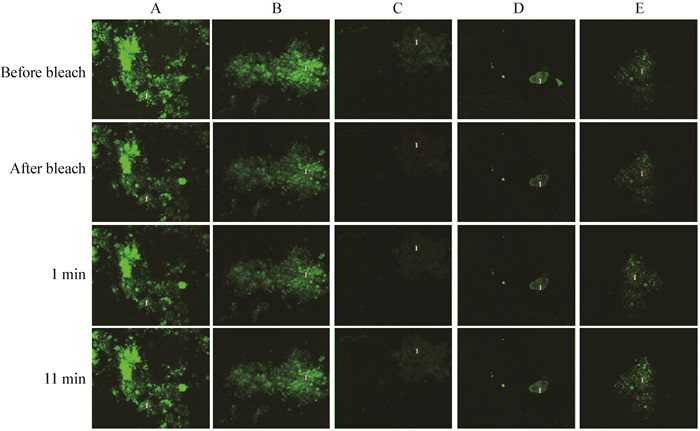
|
| 图 5 细胞膜流动性激光共聚焦显微镜观察图 Figure 5 The LSCM images of activated sludge with different carbon sources 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: Sodium acetate; C: Peptone; D: Glucose:peptone (1:1); E: Sodium acetate:peptone (1:1). |
|
|
| 反应器编号 Reactor code |
A | B | C | D | E |
| Before bleach | 774.0 | 3 061.7 | 2 463.1 | 1 785.6 | 1 876.2 |
| After bleach | 372.3 | 1 964.9 | 1 531.1 | 1 082.8 | 1 041.6 |
| 1 min | 409.6 | 1 982.5 | 1 588.5 | 1 120.8 | 1 117.5 |
| 3 min | 436.1 | 2 050.1 | 1 663.3 | 1 190.7 | 1 305.3 |
| 5 min | 484.6 | 2 121.4 | 1 727.4 | 1 334.2 | 1 398.2 |
| 7 min | 537.8 | 2 287.6 | 1 815.6 | 1 394.4 | 1 471.4 |
| 9 min | 559.2 | 2 309.1 | 1 913.7 | 1 486.6 | 1 521.8 |
| 11 min | 564.9 | 2 367.3 | 1 991.7 | 1 556.3 | 1 587.7 |
| Mf | 47.9% | 36.7% | 49.4% | 67.3% | 65.4% |
| 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: Sodium acetate; C: Peptone; D: Glucose:peptone (1:1); E: Sodium acetate:peptone (1:1). |
|||||
通过16S rRNA基因高通量测序技术对活性污泥微生物群落结构进行分析,结果如表 4和图 6所示。不同碳源条件下,5个样品的序列数在22 091− 122 658个,OTU数在1 272−3 390个,Good’s coverage在97.22%−98.90%。活性污泥微生物群落主要由变形菌门、放线菌门和拟杆菌门等组成,这与Yadav等[27]的报道一致,但其相对丰度具有较大的差别。以葡萄糖和乙酸钠为单一碳源时,其优势菌门分别为放线菌门 (Actionbacteria,62.94%) 和变形菌门 (Proteobacteria,56.18%),含有蛋白胨为碳源的反应器,Candidatus Saccharibacteria门的含量得到了提升。此外,对比不同反应器可知,存在乙酸钠为碳源的条件下,促进了Beta变形菌和拟杆菌门含量的上升,而葡萄糖和蛋白胨则主要促进了放线菌门的累积。此外,以乙酸钠:蛋白胨 (1:1) 为碳源时,未分类菌门 (Unclassified) 占到了27.3%,相比于其他碳源条件下占比 (3.6%−10%) 具有显著的提升。活性污泥法中短 ( < 5 d)、中 (10−15 d) 和长 ( > 20 d) 污泥龄分别用于COD去除、硝化反硝化脱氮和除磷,本研究选用中等的污泥龄 (10 d)。污泥龄是影响微生物群落结构的重要因素,刘娜[28]采用DGGE法分析污泥龄对SBR系统处理模拟废水微生物群落结构的影响时,发现污泥龄在20−30 d时DGGE指纹图谱中所得的条带数最多,即微生物种类最为丰富。关于不同碳源条件下污泥龄的变化对微生物群落结构的影响需进一步地研究。
| 反应器编号 Reactor code |
序列数 Sequence number |
OTU | Good’s coverage (%) |
香农威尔指数 Shannon-Wiener index |
| A | 22 091 | 1 272 | 97.22 | 3.65 |
| B | 72 620 | 2 616 | 98.42 | 4.25 |
| C | 58 907 | 2 268 | 98.29 | 4.96 |
| D | 36 970 | 1 953 | 97.64 | 5.09 |
| E | 122 658 | 3 390 | 98.90 | 4.99 |
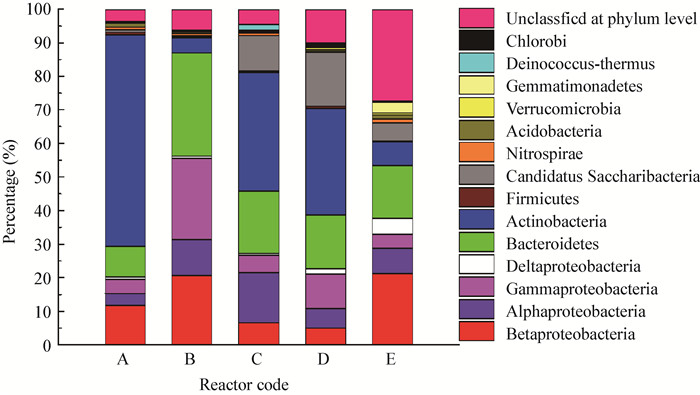
|
| 图 6 第40天微生物群落结构 (门级别和变形菌纲) Figure 6 Abundances of different phyla and the classes in Proteobacteria of microorganisms at the 40th day 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: Sodium acetate; C: Peptone; D: Glucose:peptone (1:1); E: Sodium acetate:peptone (1:1). |
|
|
如图 7所示,在属水平上,各反应器污泥微生物群落结构差异较大。葡萄糖为碳源时,优势菌属主要包括Nakamurella (54.33%) 和Micropruina (17.59%),这是由于葡萄糖是一种简单且易被微生物利用的糖类,而Nakamurella和Micropruina能在细胞内储存大量的糖类聚合物[29-30],进而成为优势菌。Nakamurella和Micropruina的细胞膜PLFA主要由支链脂肪酸组成[30-31],这与PLFA结果相吻合。乙酸钠为碳源时,Dechloromonas和Flavobacterium的含量分别增加到27.46%和40.35%,成为优势菌,这与Xin等[32]的研究结果相符合;并且出现了该反应器所特有的菌属Arenimonas (6.35%) 和Paracoccus (1.7%),Paracoccus是一类常见的反硝化菌。蛋白胨为碳源时,Microbacterium、Subdivision3_genera_ incertae_sedis和Sphingomonas的含量分别为18.67%、16.61%和12.73%,成为优势菌。已有文献报道,Microbacterium和Sphingomonas在处理结构复杂有机物方面具有突出的贡献[33-34]。反应器D和E中,Saccharibacteria_genera_incertae_sedis的含量分别骤然增加至26.75% (D) 和15.54% (E)。根据Aira等[35]的报道,在以组成复杂的牛粪为底物的土壤微生物中Saccharibacteria_genera_incertae_ sedis得到了累积。可能是由于反应器D和E的碳源组成相比于A、B和C的组成更为复杂,造成了Saccharibacteria_genera_incertae_sedis的累积。如表 4所示,含有蛋白胨为碳源时微生物群落多样性指数均较大 (4.96−5.09)。相比于葡萄糖和乙酸钠,含有蛋白胨为碳源的反应器底物组成更为复杂,且经胞外蛋白酶的水解含有较多有机氮类以及微生物可利用的氨基酸[36],有机氮组分的微生物降解、吸收、利用等均使其多样性得到了增加。蛋白胨也含有一些维生素和糖类,能够提供更多种类的微生物生长代谢所需要的因子。底物为葡萄糖:蛋白胨 (1:1) 和乙酸钠:蛋白胨 (1:1) 时,底物中既包括易被微生物利用的碳源同时也提供了较多种类的微生物生长代谢所需要的因子。张斌等[37]的研究表明,进水中相对丰富的底物 (综合污水相比于洗浴污水) 组成可使MBR系统中微生物群落多样性得到增加。此外,细菌单个基因组内经常有16S rRNA基因的多样性,利用不同区域的序列进行分子生态学研究会造成不同程度的多样性高估。Sun等[38]的研究指出,V4−V5区域显示了最低的高估程度 (约为3.0%),而V6区域的高估程度最高 (约为13%)。本研究中采用V1−V2区,这可能会导致所得结果的物种多样性的高估。

|
| 图 7 活性污泥微生物属水平群落结构热图 Figure 7 Heat map of genera of activated sludge microorganisms 注:A:葡萄糖;B:乙酸钠;C:蛋白胨;D:葡萄糖:蛋白胨 (1:1);E:乙酸钠:蛋白胨 (1:1). Note: A: Glucose; B: Sodium acetate; C: Peptone; D: Glucose:peptone (1:1); E: Sodium acetate:peptone (1:1). |
|
|
分析微生物群落结构的变化,可以解释不同碳源影响PLFA组成和出水水质的原因,本文采用RDA分析,结果如图 8所示。RDA1和RDA2分别可以代表49.8%和32.1%的总差异。COD去除率与Thauera和Dechloromonas显著正相关 (p < 0.05);Peak A与Nakamurella、Micropruina显著负相关和Sphingopyxis、Arthrobacter显著正相关 (p < 0.05);Peak B与Pelomonas显著正相关 (p < 0.05);Peak C与Sphingomonas、Microbacterium和Arthrobacter显著正相关 (p < 0.05)。饱和脂肪酸 (SFA) 与Flavobacterium显著正相关 (p < 0.05);反式异构脂肪酸 (AFA) 与Nakamurella和Micropruina显著正相关 (p < 0.05);异构脂肪酸 (IFA) 与Thauera、Dechloromonas以及Flavobacterium显著负相关 (p < 0.05)。这些菌属随着碳源的不同,其含量均发生了较大的变化 (图 6)。且已有研究表明,Nakamurella和Micropruina在以葡萄糖为碳源时成为优势菌[27-28];乙酸钠为碳源时Dechloromonas和Flavobacterium得到了显著增加[30]。综上可以看出,不同碳源驯化出不同的微生物群落,进而对微生物细胞膜PLFA组成产生了影响,两者的变化是影响出水水质的重要原因。
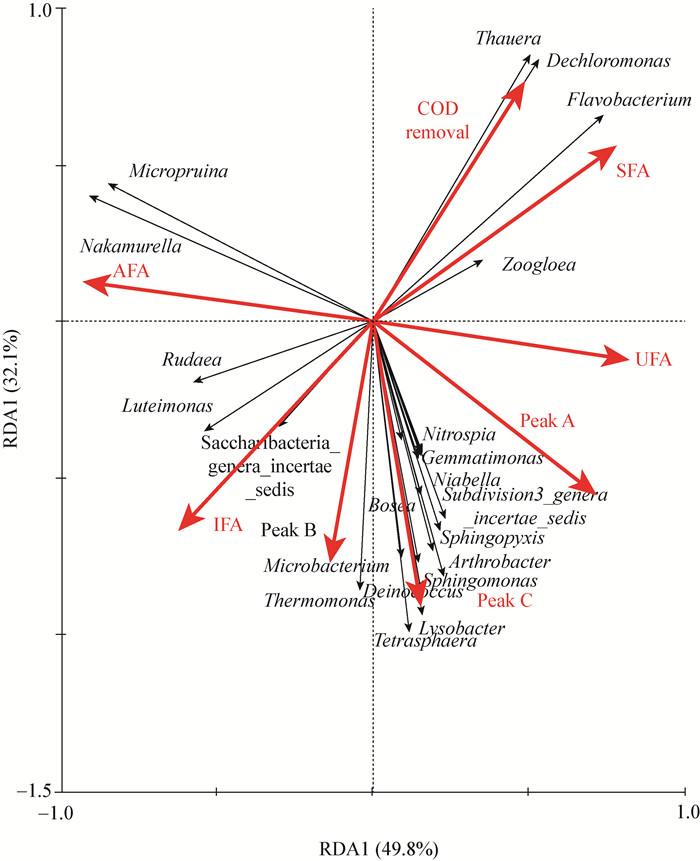
|
| 图 8 RDA分析微生物群落与膜磷脂和出水水质关系 Figure 8 RDA analysis of microbial community in relation to phospholipid and effluent quality 注:SFA、UFA、AFA、IFA:饱和、不饱和、反式异构和异构脂肪酸;Peak A、Peak B、Peak C:类芳香族蛋白峰、类微生物产物蛋白峰、类腐殖酸峰. Note: SFA, UFA, AFA and IFA represent saturated, unsaturated, anteiso and iso fatty acid; Peak A, B and C represent the fluorescence intensity of aromatic protein-like, souble microbial products-like and humic acid-like substance, respectively. |
|
|
(1) 微生物表面粘附力方面,含有蛋白胨为碳源时活性污泥表面粘附力得到了增大,且以蛋白胨为单一碳源时污泥粘附力最大,为38.7±3.6 nN。
(2) 细胞膜PLFA组成和流动性方面,含有蛋白胨为碳源时污泥支链脂肪酸和不饱和脂肪酸的总含量较为相似,细胞膜磷脂流动性得到了增强。葡萄糖促进了15:0anteiso的增多,乙酸钠促进了16:1ω7c的增多。PCA分析结果显示,含有蛋白胨为碳源的反应器细胞膜PLFA组成表现出相似性。
(3) 微生物群落结构方面,蛋白胨的出现增加了活性污泥微生物群落结构多样性。葡萄糖和乙酸钠为单一碳源时其优势菌门分别为放线菌门和变形菌门,含有蛋白胨为碳源时促进了Candidatus Saccharibacteria门的累积。
(4) 不同碳源会导致微生物合成PLFA的差异,进而影响细胞膜PLFA组成;此外,碳源的不同改变了微生物群落结构,也对微生物细胞膜PLFA组成产生了影响。
| [1] | Yang X, Peng YZ, Song JC, et al. Effect of influent carbohydrates with different molecule-size on sludge settleability[J]. China Environmental Science, 2015, 35(2) : 448–456. (in Chinese) 杨雄, 彭永臻, 宋姬晨, 等. 进水中碳水化合物分子大小对污泥沉降性能的影响[J]. 中国环境科学, 2015, 35(2) : 448–456. |
| [2] | Wu CY, Peng YZ, Peng Y, et al. Influence of carbon source on biological nutrient removal in A2O process[J]. Environmental Science, 2009, 30(3) : 798–802. (in Chinese) 吴昌永, 彭永臻, 彭轶, 等. 碳源类型对A2O系统脱氮除磷的影响[J]. 环境科学, 2009, 30(3) : 798–802. |
| [3] | Guerrero J, Guisasola A, Baeza JA. The nature of the carbon source rules the competition between PAO and denitrifiers in systems for simultaneous biological nitrogen and phosphorus removal[J]. Water Research, 2011, 45(16) : 4793–4802. DOI:10.1016/j.watres.2011.06.019 |
| [4] | Lopez-Vazquez CM, Oehmen A, Hooijmans CM, et al. Modeling the PAO-GAO competition: effects of carbon source, pH and temperature[J]. Water Research, 2009, 43(2) : 450–462. DOI:10.1016/j.watres.2008.10.032 |
| [5] | Liu X. A comparative study of extracellular polymeric substance of activated sludge and biofilm, and their effects on sludge characteristics[D]. Shanghai: Doctoral Dissertation of Fudan University, 2009(in Chinese) 刘翔. 活性污泥和生物膜的胞外聚合物性质及其对污泥性能影响的比较研究[D]. 上海: 复旦大学博士学位论文, 2009 |
| [6] | Liao BQ, Lin HJ, Langevin SP, et al. Effects of temperature and dissolved oxygen on sludge properties and their role in bioflocculation and settling[J]. Water Research, 2011, 45(2) : 509–520. DOI:10.1016/j.watres.2010.09.010 |
| [7] | Carvalheira M, Oehmen A, Carvalho G, et al. The impact of aeration on the competition between polyphosphate accumulating organisms and glycogen accumulating organisms[J]. Water Research, 2014, 66 : 296–307. DOI:10.1016/j.watres.2014.08.033 |
| [8] | Niu C, Geng JJ, Ren HQ, et al. The strengthening effect of a static magnetic field on activated sludge activity at low temperature[J]. Bioresource Technology, 2013, 150 : 156–162. DOI:10.1016/j.biortech.2013.08.139 |
| [9] | Ramos JL, Duque E, Gallegos MT, et al. Mechanisms of solvent tolerance in Gram-negative bacteria[J]. Annual Review of Microbiology, 2002, 56 : 743–768. DOI:10.1146/annurev.micro.56.012302.161038 |
| [10] | Nenninger A, Mastroianni G, Robson A, et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli[J]. Molecular Microbiology, 2014, 92(5) : 1142–1153. DOI:10.1111/mmi.2014.92.issue-5 |
| [11] | Zhou LN, Su RH, Ma SJ, et al. Effects of nitrite, nitrate and ammonia nitrogen on anaerobic microbial community characterized by using phospholipid fatty acid PLFA method[J]. Acta Scientiae Circumstantiae, 2016, 36(2) : 499–505. (in Chinese) 周莉娜, 苏润华, 马思佳, 等. 基于PLFA法分析亚硝氮、硝氮和氨氮对厌氧微生物细菌群落的影响[J]. 环境科学学报, 2016, 36(2) : 499–505. |
| [12] | Fang JS, Lyon DY, Wiesner MR, et al. Effect of a fullerene water suspension on bacterial phospholipids and membrane phase behavior[J]. Environmental Science & Technology, 2007, 41(7) : 2636–2642. |
| [13] | Fang JS, Lovanh N, Alvarez PJJ. The use of isotopic and lipid analysis techniques linking toluene degradation to specific microorganisms: applications and limitations[J]. Water Research, 2004, 38(10) : 2529–2536. DOI:10.1016/j.watres.2004.03.006 |
| [14] | Ingram LO. Adaptation of membrane lipids to alcohols[J]. Journal of Bacteriology, 1976, 125(2) : 670–678. |
| [15] | Ahmed Z, Lim BR, Cho J, et al. Biological nitrogen and phosphorus removal and changes in microbial community structure in a membrane bioreactor: effect of different carbon sources[J]. Water Research, 2008, 42(1/2) : 198–210. |
| [16] | Hagman M, Nielsen JL, Nielsen PH, et al. Mixed carbon sources for nitrate reduction in activated sludge-identification of bacteria and process activity studies[J]. Water Research, 2008, 42(6/7) : 1539–1546. |
| [17] | Wang TX, Ma XY, Wang MM, et al. A comparative study of microbial community compositions in thermophilic and mesophilic sludge anaerobic digestion systems[J]. Microbiology China, 2016, 43(1) : 26–35. (in Chinese) 王滕旭, 马星宇, 王萌萌, 等. 中高温污泥厌氧消化系统中微生物群落比较[J]. 微生物学通报, 2016, 43(1) : 26–35. |
| [18] | Ministry of Environment Protection of China. Standard methods for the examinations of water and wastewater[M].4th Edition. Beijing: China Environmental Science Press, 2002 . (in Chinese) 国家环境保护局. 水和废水监测分析方法[M].第4版. 北京: 中国环境科学出版社, 2002 . |
| [19] | Bradford MM. A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2) : 248–254. |
| [20] | Huang H, Ren HQ, Ding LL, et al. Aging biofilm from a full-scale moving bed biofilm reactor: characterization and enzymatic treatment study[J]. Bioresource Technology, 2014, 154 : 122–130. DOI:10.1016/j.biortech.2013.12.031 |
| [21] | Zhu Y, Zhang Y, Ren HQ, et al. Physicochemical characteristics and microbial community evolution of biofilms during the start-up period in a moving bed biofilm reactor[J]. Bioresource Technology, 2015, 180 : 345–351. DOI:10.1016/j.biortech.2015.01.006 |
| [22] | Mullineaux CW, Nenninger A, Ray N, et al. Diffusion of green fluorescent protein in three cell environments in Escherichia coli[J]. Journal of Bacteriology, 2006, 188(10) : 3442–3448. DOI:10.1128/JB.188.10.3442-3448.2006 |
| [23] | Schwartz JL, Snapp E, Kenworthy A. Studying protein dynamics in living cells[J]. Nature Reviews Molecular Cell Biology, 2001, 2 : 444–456. |
| [24] | Li YY, Wang X, Hayden AO, et al. Universal quantifier derived from AFM analysis links cellular mechanical properties and cell-surface integration forces with microbial deposition and transport behavior[J]. Environmental Science & Technology, 2014, 48(3) : 1769–1778. |
| [25] | Pussak D, Ponader D, Mosca S, et al. Specific adhesion of carbohydrate hydrogel particles in competition with multivalent inhibitors evaluated by AFM[J]. Langmuir, 2014, 30(21) : 6142–6150. DOI:10.1021/la5010006 |
| [26] | Liu DH. Polypeptide distribution of bone peptone and its influence of fermentation[D]. Harbin: Master's Thesis of Heilongjiang University, 2011(in Chinese) 刘定杭. 牛骨蛋白胨中多肽分布及对工业菌株发酵的影响[D]. 哈尔滨: 黑龙江大学硕士学位论文, 2011 |
| [27] | Yadav TC, Khardenavis AA, Kapley A. Shifts in microbial community in response to dissolved oxygen levels in activated sludge[J]. Bioresource Technology, 2014, 165 : 257–264. DOI:10.1016/j.biortech.2014.03.007 |
| [28] | Liu N. The effects of SRT on the characteristics of the biochemical treatment system[D]. Chongqing: Master's Thesis of Chongqing University, 2013(in Chinese) 刘娜. SRT对生化处理系统运行特性的影响[D]. 重庆: 重庆大学硕士学位论文, 2013 |
| [29] | Begum SA, Batista JR. Microbial selection on enhanced biological phosphorus removal systems fed exclusively with glucose[J]. World Journal of Microbiology and Biotechnology, 2012, 28(5) : 2181–2193. DOI:10.1007/s11274-012-1024-3 |
| [30] | Tice H, Mayilraj S, Sims D, et al. Complete genome sequence of Nakamurella multipartita type strain (Y-104T)[J]. Standards in Genomic Sciences, 2010, 2(2) : 168–175. DOI:10.4056/sigs.721316 |
| [31] | Shintani T, Liu WT, Hanada S, et al. Micropruina glycogenica gen. nov., sp. nov., a new Gram-positive glycogen-accumulating bacterium isolated from activated sludge[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1) : 201–207. DOI:10.1099/00207713-50-1-201 |
| [32] | Xin XD, He JG, Wang YF, et al. Role of aeration intensity on performance and microbial community profiles in a sequencing batch reaction kettle (SBRK) for wastewater nutrients rapid removal[J]. Bioresource Technology, 2016, 201 : 140–147. DOI:10.1016/j.biortech.2015.11.053 |
| [33] | Mulla SI, Hu A, Wang YW, et al. Degradation of triclocarban by a triclosan-degrading Sphingomonas sp. strain YL-JM2C[J]. Chemosphere, 2016, 144 : 292–296. DOI:10.1016/j.chemosphere.2015.08.034 |
| [34] | Pérez MC, lvarez-Hornos FJ, Engesser KH, et al. Removal of 2-butoxyethanol gaseous emissions by biotrickling filtration packed with polyurethane foam[J]. New Biotechnology, 2016, 33(2) : 263–272. DOI:10.1016/j.nbt.2015.11.006 |
| [35] | Aira M, Olcina J, Pérez-Losada M, et al. Characterization of the bacterial communities of casts from Eisenia andrei fed with different substrates[J]. Applied Soil Ecology, 2016, 98 : 103–111. DOI:10.1016/j.apsoil.2015.10.002 |
| [36] | Liu Z, Yang SB, Song XM, et al. Effect on microbial growth and activity of amino acid nutrition[J]. Heilongjiang Agricultural Sciences, 2010(5) : 13–15. (in Chinese) 刘政, 杨绍斌, 宋小美, 等. 氨基酸类营养对微生物生长及活性的影响[J]. 黑龙江农业科学, 2010(5) : 13–15. |
| [37] | Zhang B, Sun BS, Liu HN, et al. Comparison of microbial community structure in MBRs treating different wastewater[J]. Environmental Science, 2008, 29(10) : 2944–2949. (in Chinese) 张斌, 孙宝盛, 刘慧娜, 等. 处理不同废水MBR系统中微生物群落结构的比较[J]. 环境科学, 2008, 29(10) : 2944–2949. |
| [38] | Sun DL, Jiang X, Wu QL, et al. Intragenomic heterogeneity of 16S rRNA genes causes overestimation of prokaryotic diversity[J]. Applied and Environmental Microbiology, 2013, 79(19) : 5962–5969. DOI:10.1128/AEM.01282-13 |
 2017, Vol. 44
2017, Vol. 44




