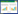扩展功能
文章信息
- 谢永丽, Renato D’Ovidio, Stefania Masci, 范晶, 李云龙
- XIE Yong-Li, Renato D’Ovidio, Stefania Masci, FAN Jing, LI Yun-Long
- 几株解纤维素生防芽孢杆菌的分子鉴定及其抗逆促生特性分析
- Molecular identification of cellulose-degrading bio-control Bacillus strains and their stress-resistance and growth-promoting characteristics
- 微生物学通报, 2017, 44(2): 348-357
- Microbiology China, 2017, 44(2): 348-357
- DOI: 10.13344/j.microbiol.china.160099
-
文章历史
- 收稿日期: 2016-01-27
- 接受日期: 2016-03-21
- 优先数字出版日期(www.cnki.net): 2016-05-24
2. Faculty of Agriculture, University of Tuscia, Laboratory of Agricultural biology and Agricultural chemistry, Viterbo, Itally 01100, Italy
2. Faculty of Agriculture, University of Tuscia, Laboratory of Agricultural biology and Agricultural chemistry, Viterbo, Itally 01100, Italy
农牧业是青海省重要的经济支柱产业,青藏高原海拔高,温度低,秋冬季节草场枯黄,干草或加工饲料是家畜的重要饲粮来源;利用有益微生物提高牧草养份的释放效率,提高牲畜对饲草料的消化吸收效率,是农牧业发展中重要的研究课题。因此,筛选适合高原生态环境的纤维素降解菌至关重要。芽孢杆菌属(Bacillus spp.)细菌能产生对热、紫外、干旱、盐碱等有抗性的芽孢,具有很强的环境适应性,在农业、畜牧业、工业、食品业、医学等方面都扮演着极其重要的角色,是越来越引起人们重视和研究的微生物资源[1]。
芽孢杆菌的抗逆芽孢壁中有皮质层,与营养细胞相比,芽孢对热、紫外及抗菌素等具有很强的抗性,可以耐受饲料加工、储藏和牲畜胃的酸性环境,饲用后在肠道酸性环境中具有高度的稳定性。芽孢杆菌制剂以内生孢子形式存在,当孢子进入肠道后可迅速复活,产生有益代谢产物,提高动物机体免疫力,因此,芽孢杆菌在饲料加工业具有研究和应用潜力[2]。大量研究表明:芽孢杆菌可产生内切纤维素酶、外切纤维素酶、葡萄糖苷酶、甘露聚糖酶等纤维素活性酶,可以有效降解牧草及饲草料中的纤维素成分[3]。此外,芽孢杆菌可通过非核糖体肽途径(Nonribosomal)合成具有抑真菌、细菌、病毒、菌原体、抗肿瘤等生物活性的脂肽化合物(Lipopeptide)和聚酮化合物(Polyketide),对环境友好、对人畜安全[4-6]。利用可产生降解纤维素酶类的生防芽孢杆菌,应用于饲料加工生产或作物秸秆还田,通过芽孢杆菌产生的纤维素降解酶来加速草料或秸秆纤维素的分解,使养分得到最有效的释放;同时,作为生防菌的芽孢杆菌还兼具对病原微生物的拮抗活性,可有效预防牲畜疾病[7-8]和控制植物病害发生风险,有益于生态畜牧业及生态农业。
本研究自青海互助北山桦树根围分离筛选到几株芽孢杆菌菌株,均表现出显著的纤维素降解活性及拮抗病原真菌及病原细菌的活性。通过BOX-PCR指纹图谱分析、16S rRNA基因及gyrB基因序列分析鉴定其种属。测定菌株抗盐性、耐低温性、促生特性,为高原生态农业及畜牧业生产筛选优质抗逆性解纤维素生防芽孢杆菌资源。
1 材料与方法 1.1 供试菌株芽孢杆菌菌株BS11、BS12、BS13、BS14、BS15分离自青海互助北山红桦(Betula albo-sinensis Burk)根围;油菜菌核病菌(Sclerotinia sclerotiorum)、瓜类枯萎病菌(Fusarium oxysporum)、水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae)、植物梨火疫病菌(Erwinia amylovora)由青海大学高原草地资源与生态省部共建实验室保存。
1.2 培养基细菌LB培养基、NA培养基参考Wu等[9]方法配制;真菌PDA培养基参考薛鹏琦等[10]方法配制;低温1C培养基参考刘芳等[11]方法配制;CMC培养基配制参考张楠等[12]方法配制。
1.3 主要试剂和仪器引物由南京金斯瑞生物技术有限公司合成;PCR扩增反应试剂,TaKaRa公司;PCR产物纯化试剂盒(Axygen DNA凝胶回收试剂盒AP-GX-50),爱思进生物技术(杭州)有限公司。Applied Biosystems PCR仪(2720型),美国Applied Biosystems公司。
1.4 芽孢杆菌分子鉴定1.4.1 BOX-PCR指纹图谱:基因组DNA提取方法参照Wu等[9]方法。BOX-PCR扩增引物为BOXA1R:5′-CTACGGCAAGGCGACGCTGACG- 3′。反应体系(25 μL):10×rTaq buffer 2.5 μL,dNTP Mixture (各2.5 mmol/L) 2 μL,MgCl2 (25 mmol/L) 2.5 μL,DNA模板1.5 μL,引物(20 μmol/L) 2.5 μL,Takara rTaq酶(5 u/μl) 0.5 μL,ddH2O 13.5 μL。扩增条件为:95 ℃ 7 min;94 ℃ 1 min,53 ℃ 1 min,65 ℃ 8 min,34个循环;65 ℃ 16 min。对BOX-PCR扩增产物进行电泳检测,在2.0% (质量体积比)的LE-琼脂糖凝胶中,85 V电泳4 h,检测扩增效果,获得凝胶成像图谱[13]。
1.4.2 16S rRNA基因序列鉴定:16S rRNA基因扩增正向引物27F:5′-AGAGTTTGATCMTGGCTC AG-3′,反向引物1492R:5′-GGYTACCTTGTTA CGACTT-3′。反应体系(25 μL):10×ExTaq buffer 2.5 μL,dNTP Mixture (各2.5 mmol/L) 2 μL,MgCl2 (25 mmol/L) 2 μL ,DNA模板0.5 μL,正向引物 (20 μmol/L) 0.5 μL,反向引物(20 μmol/L) 0.5 μL,Takara ExTaq酶(5 U/μL) 0.25 μL,ddH2O 16.75 μL。PCR扩增条件为:95 ℃ 4 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,34个循环;72 ℃ 10 min[14]。将16S rRNA基因扩增产物回收纯化后测序,测序所得序列通过NCBI数据库进行BLAST比对,通过MEGA 3.1软件[15]对分离的芽孢杆菌及模式菌(B. pumilus ATCC7061、B. licheniformis ATCC14580、B. thuringiensis HD868、B. licheniformis ATCC8480、B. cereus GP、B. atrophaeus BCRC17530、B. subtilis 168及B. amyloliquefaciens FZB42)序列进行系统发育分析。
1.4.3 gyrB基因序列鉴定:gyrB基因扩增引物序列,正向引物UP1:5′-GAAGTCATCATGACCGT TCTGCAYGCNGGNGGNAARTTYGA-3′,反向引物UP2r:5′-AGCAGGGTACGGATGTGCGAGCC RTCNACRTCNGCRTCNGTCAT-3′。反应体系 (25 μL):10×ExTaq buffer 2.5 μL,dNTP Mixture (各2.5 mmol/L) 2 μL,MgCl2 (25 mmol/L) 2 μL,DNA模板0.5 μL,正向引物(20 μmol/L) 0.5 μL,反向引物(20 μmol/L) 0.5 μL,Takara ExTaq酶(5 u/μL) 0.25 μL,ddH2O16.75 μL。PCR扩增程序:95 ℃ 4 min;98 ℃ 10 s,62 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 8 min[16]。将gyrB基因扩增产物纯化测序,测序所得序列通过NCBI数据库进行BLAST比对,通过MEGA 3.1软件[15]对分离的芽孢杆菌及模式菌序列进行系统发育分析。
1.5 降解纤维素活性测定在CMC筛选培养基平板上,呈“十”字形分布的4个接种点,放置直径4 mm滤纸小圆片。将供试菌株在LB液体培养基中37 ℃、200 r/min培养12 h后,取待测菌液5 μL点于滤纸片中央,每个处理重复3次,将平板倒置于37 ℃恒温培养箱中培养2 d后,将革兰氏碘染液(Gram iodime)注入并淹没平板表面,盖上平皿盖,静置4 min后,倒去染液,观测并记录实验结果。测定并记录透明圈直径,菌落直径,并计算两者比值A[17]。
1.6 拮抗活性测定1.6.1 拮抗病原真菌活性:分别将在26 ℃培养箱中活化的油菜菌核菌PDA平板、瓜类枯萎病菌PDA平板边缘打取直径为0.7 cm的菌碟,接种在新的PDA平板中央。在距离菌块2.5 cm处,呈“十”字形分布的4个接种点,放置直径4 mm的滤纸小圆片。将供试菌株接种于LB液体培养基,37 ℃、200 r/min培养14 h后,吸取菌液5 μL,接种于滤纸片,每个处理重复3次,放入26 ℃恒温培养箱中培养2-3 d后,取出观测并记录抑菌结果[18]。
1.6.2 拮抗病原细菌活性:将水稻白叶枯病菌、植物梨火疫病菌按比例(1:30)加入冷却到50 ℃左右的NA液体培养基中混匀,制成含菌平板,在距离平板中心呈“十”字形分布的4个接种点,放置直径4 mm滤纸小圆片。将供试菌株接种于LB液体培养基,37 ℃、200 r/min条件下培养14 h后,吸取菌液5 μL,接种于滤纸片,每个处理重复3次。置于28 ℃培养箱培养2-3 d,观察并记录结果[18]。
1.7 芽孢杆菌耐逆性测定1.7.1 耐盐性测定:将供试菌株分别接种到含NaCl浓度为3%、5%、7%、9%、11%、13%、15%的LB培养基中培养过夜达12 h,吸取50 μL菌液涂平板于含NaCl浓度分别为3%、5%、7%、9%、11%、13%、15%的LB培养基平板上,37 ℃培养,每个处理3个重复,5 d时间为限,每天观察并记录菌株生长情况。
1.7.2 低温适生性测定:将供试菌株接种到低温1C液体培养基中培养过夜达12 h,取10 μL菌液点于1C固体培养基平板上,设置4个温度梯度4、10、14、18 ℃进行培养,每个处理3次重复。每天观察并记录生长情况,5 d时间为限,测定菌株的耐低温特性。
1.8 芽孢杆菌促生实验1.8.1 芽孢杆菌菌悬液制备:挑取芽孢杆菌单菌落接种到LB液体培养基中,37 ℃、200 r/min培养12 h,将培养好的菌液在4 ℃、8 000 r/min离心 5 min,弃上清,用无菌水洗菌体1-2次,后用无菌水悬浮菌体,将菌悬液细胞浓度调整至106 cfu/mL,制备成芽孢杆菌菌悬液。
1.8.2 促水稻种子萌发:选择种皮完好的水稻种子,在20%次氯酸钠溶液中处理20 min,无菌水冲洗3-4次。将水稻种子在芽孢杆菌菌悬液(细胞浓度106 CFU/mL)中浸种24 h,无菌水处理作对照。将浸种后的种子播于铺有滤纸的培养皿中,置于光照培养箱中培养(28 ℃,光期16 h/暗期8 h) 5 d后,测定种子萌发后的平均芽长、根长、鲜重(每个处理3次重复,每个重复8枚种子)。
1.8.3 水稻促生:同上所述,将消毒并清洗好的水稻种子于无菌水浸种48 h,以芽孢杆菌菌悬液(细胞浓度106 CFU/mL)浸种2 h,无菌水处理作对照。将种子包裹于直径15 cm定性滤纸中,每张滤纸包裹8枚种子。滤纸卷竖直放入盛有水的塑料杯中,水面不超过种子所在位置,在光照培养箱中培养(28 ℃,光期16 h/暗期8 h) 10 d后,测定水稻幼苗平均株高、根长及鲜重,每个处理3次重复,每个重复以8株幼苗为测定单位。
2 结果与分析 2.1 菌株分子鉴定2.1.1 BOX-PCR指纹图谱分析:分别提取菌株BS11、BS12、BS13、BS14、BS15的基因组DNA,进行BOX-PCR扩增,扩增到大小在200-5 000 bp之间的连续条带,得到BOX-PCR指纹图谱。扩增结果表明(图 1):菌株BS11、BS12、BS13、BS14、BS15具有完全相同的BOX-PCR指纹图谱,为同种芽孢杆菌。
|
| 图 1 分离菌株的 BOX-PCR 指纹图谱 Figure 1 BOX-PCR fingerprints of isolates 注:菌株BS11、BS12、BS13、BS14、BS15具有完全相同的BOX-PCR指纹图谱. Note: Isolates BS11,BS12,BS13,BS14,BS15 presented identical BOX-PCR fingerprint. |
|
|
2.1.2 gyrB 基因及 16S rRNA 基因序列分析:以菌株BS11、BS12的基因组DNA为模板扩增16S rRNA基因,扩增到大小约1 500 bp的PCR特征性条带,与芽孢杆菌16S rRNA基因的理论值基本相符,将测序结果在NCBI中与已知序列进行BLAST比对,比对结果表明:菌株BS11与解淀粉芽孢杆菌Bacillus amyloliquefaciens M34 (GenBank登录号:GQ340497.1)、菌株BS12与B. amyloliquefaciensEA1-10 (GenBank登录号:JF496398.1)的16S rRNA基因的序列相似(或一致)性均为99%。以菌株BS11、BS12基因组DNA为模板扩增gyrB基因,扩增到大小约1 300 bp的PCR特征性条带,与芽孢杆菌gyrB基因的理论值基本相符,将测序结果在NCBI中,用BLAST软件将所测菌株序列与GenBank中己知序列进行比较,比对结果表明:菌株BS11、BS12与B. amyloliquefaciens FZB42 (GenBank登录号:JN575339.1)的gyrB基因序列相似(或一致)分别为99%和97%。
通过BOX-PCR指纹图谱分析、16S rRNA基因及gyrB基因序列比对分析结果,菌株BS11、BS12、BS13、BS14、BS15鉴定为解淀粉芽孢杆菌B. amyloliquefaciens (表 1)。
| 菌株 Strains |
透明圈直径 Transparent zone diameter (D,mm) |
菌落直径 Colony diameter (d,mm) |
A值 A value (D/d) |
菌株鉴定结果 Identification result |
| BS11 | 26 | 8.3 | 3.13 | B. amyloliquefaciens |
| BS12 | 25 | 8.1 | 3.08 | B. amyloliquefaciens |
| BS13 | 26 | 7.4 | 3.51 | B. amyloliquefaciens |
| BS14 | 25 | 7.8 | 3.20 | B. amyloliquefaciens |
| BS15 | 26 | 8.1 | 3.20 | B. amyloliquefaciens |
通过CMC法检测菌株BS11、BS12、BS13、BS14、BS15降解纤维素的活性,结果表明:5株菌株均可在CMC培养基上产生透明圈,表明菌株可产生纤维素酶降解CMC-Na,使其在革兰氏碘液(Gram iodine)染色后无法附着染料而被洗脱形成透明圈。透明圈直径大小可初步反映菌株降解纤维素活性(图 2),测定结果:菌株BS11、BS12、BS13、BS14、BS15形成的透明圈直径分别为26、25、26、25、26 mm,A值分别为3.13、3.08、3.51、3.20、3.20,表明5株菌株均具有显著的降解纤维素活性(图 2,表 1)。

|
| 图 2 芽孢杆菌降解纤维素形成的透明圈 Figure 2 Transparent zone of cellulose degradation produced by Bacillus strain |
|
|
2.3.1 拮抗病原真菌活性:分别以油菜菌核菌(Sclerotinia sclerotiorum)及瓜类枯萎病菌(Fusarium oxysporum)为病原真菌指示菌,测定菌株拮抗病原真菌活性。实验结果表明:5株菌株拮抗油菜菌核菌的抑菌圈半径≥13 mm;拮抗瓜类枯萎病菌抑菌圈半径≥12 mm;均具有显著的拮抗病原真菌活性(图 3,表 2)。

|
| 图 3 菌株拮抗病原真菌及病原细菌活性 Figure 3 Antagonistic activity of Bacillus strains to pathogenic fungus and bacteria 注:A:拮抗油菜菌核菌;B:拮抗瓜类枯萎病菌;C:拮抗水稻白叶枯病菌;D:拮抗植物梨火疫病菌. Note: A: Antagonistic activity to Sclerotinia sclerotiorum; B: Antagonistic activity to Fusarium oxysporum; C: Antagonistic activity to Xanthomonas oryzae pv. oryzae; D: Antagonistic activity to Erwinia amylovora. |
|
|
2.3.2 拮抗病原细菌活性:以水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae)和植物梨火疫病菌(Erwinia amylovora)为病原细菌指示菌,检测菌株BS11、BS12、BS13、BS14、BS15拮抗病原细菌活性。实验结果表明:5株菌株拮抗水稻白叶枯病菌的抑菌圈半径≥10 mm,拮抗植物梨火疫病菌抑菌圈半径≥10 mm,均表现显著拮抗病原细菌活性(图 3,表 2)。
|
菌株 Strains |
抑油菜菌核病菌 Antagonistic towards S. s |
抑瓜类枯萎病菌 Antagonistc towards F. o |
抑水稻白叶枯病菌 Antagonistic towards X. oo |
抑植物梨火疫病菌 Antagonistic towards E. a |
|||||||
| 抑菌圈半径 Inhibition zone radius (mm) |
抑菌活性 Antagonistic activity | 抑菌圈半径 Inhibition zone radius (mm) |
抑菌活性 Antagonistic activity | 抑菌圈半径 Inhibition zone radius (mm) |
抑菌活性 Antagonistic activity | 抑菌圈半径 Inhibition zone radius (mm) |
抑菌活性 Antagonistic activity |
||||
| BS11 | 14 | +++ | 14 | +++ | 10 | +++ | 11 | +++ | |||
| BS12 | 14 | +++ | 14 | +++ | 10 | +++ | 11 | +++ | |||
| BS13 | 15 | ++++ | 14 | +++ | 12 | +++ | 10 | +++ | |||
| BS14 | 13 | +++ | 14 | +++ | 11 | +++ | 10 | +++ | |||
| BS15 | 13 | +++ | 12 | +++ | 12 | +++ | 11 | +++ | |||
| 注:+:抑菌圈直径0-5 mm;++:抑菌圈直径5-10 mm;+++:抑菌圈直径10-15 mm;++++:抑菌圈直径≥15 mm. | |||||||||||
| Note: +: Inhibition zone radius 0-5 mm; ++: Inhibition zone radius 5-10 mm; +++: Inhibition zone radius 10-15 mm; ++++: Inhibition zone radius≥15 mm. | |||||||||||
2.4.1 芽孢杆菌低温适生性:测定菌株BS11、BS12、BS13、BS14、BS15分别在4、10、14、18 ℃低温条件下生长情况。结果显示:在14、18 ℃条件下,5株菌株培养1 d后均长出菌圈;10 ℃低温条件下,5株菌株正常生长,培养2 d后即出现明显的菌苔;4 ℃低温条件,5株菌株均无法生长。5株分离菌株可在10 ℃低温条件下正常生长(表 3)。
|
菌株 Strains |
菌株耐盐性 Salt-resistance character | 菌株低温适生性 low-temperature adaptability | ||||||||||
| 3% | 5% | 7% | 9% | 11% | 13% | 15% | 18 ℃ | 14 ℃ | 10 ℃ | 4 ℃ | ||
| BS11 | +++ | +++ | +++ | +++ | ++ | - | - | +++ | +++ | ++ | - | |
| BS12 | +++ | +++ | +++ | +++ | ++ | - | - | +++ | +++ | ++ | - | |
| BS13 | +++ | +++ | +++ | +++ | ++ | - | - | +++ | +++ | ++ | - | |
| BS14 | +++ | +++ | +++ | +++ | ++ | - | - | +++ | +++ | ++ | - | |
| BS15 | +++ | +++ | +++ | +++ | ++ | - | - | +++ | +++ | ++ | - | |
| 注:+++:生长良好;++:正常生长;+:缓慢生长;-:不能生长. | ||||||||||||
| Note: +++: Growth well; ++: Growth normal; +: Growth slowly; -: Nonviable. | ||||||||||||
2.4.2 芽孢杆菌耐盐性:测定菌株的耐盐性,将5株菌株的菌液分别涂板于含NaCl浓度为3%、5%、7%、9%、11%、13%、15%的LB固体培养基上,置于37 ℃条件下培养。结果显示:5株菌株均可在含NaCl浓度为3%、5%、7%、9%的LB培养基上生长良好,在含NaCl浓度11%的LB培养基上可以生长,在含NaCl浓度为13%、15%的培养基上不能生长。5株菌株可耐受的盐浓度为11% (表 3)。
2.5 芽孢杆菌促生作用2.5.1 促水稻种子萌发:以菌株BS11、BS12菌悬液(细胞浓度106 CFU/mL)浸种24 h后播种,测定菌株促水稻种子萌发效果。结果表明:菌株BS11处理种子萌发后的平均芽长、根长分别为2.525、 2.725 cm,与对照相比分别增加了48.5%和30.5%,主根增长,侧根明显增多,平均鲜重增加了27.4%。菌株BS12处理水稻种子,萌发后幼苗的平均芽长、根长分别为2.288 cm和2.633 cm,与对照相比分别增加34.6%和27%,平均鲜重增加了23.3%;菌株BS11、BS12表现出显著的催芽效果(表 4)。
|
菌株 Strains |
地上部分 Aboveground part | 地下部分 Underground part |
鲜重 Fresh weight (g) |
鲜重增加 Fresh weight increased (%) |
|||
| 芽长 Sprout length (cm) |
催芽效果 Accelerating germination effect (%) | 根长 Root length (cm) |
催芽效果Accelerating germination effect (%) |
||||
| BS11 | 2.525±0.054 | 48.5 | 2.725±0.018 | 30.5 | 0.432±0.009 | 27.4 | |
| BS12 | 2.288±0.046 | 34.6 | 2.633±0.028 | 27.0 | 0.414±0.011 | 23.3 | |
| CK | 1.700±0.036 | 0.0 | 2.088±0.022 | 0.0 | 0.339±0.005 | 0.0 | |
| 注:CK为未经处理的水稻种子. | |||||||
| Note: CK means control. | |||||||
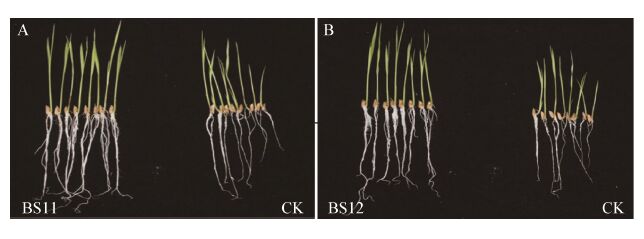
2.5.2 促水稻幼苗生长:测定菌株BS11、BS12对水稻幼苗促生效果。结果显示:与对照相比,芽孢杆菌菌悬液浸种后的水稻幼苗的株高、根长均显著性提高(图 4,表 5)。其中,BS11菌液浸种处理后,水稻幼苗的平均株高、根长分别达到8.76 cm和10.32 cm,与对照相比分别增加41.3%和18.6%,平均鲜重增加34.9%。BS12菌液处理的水稻幼苗平均株高和根长分别为9.10 cm和9.77 cm,与对照相比分别增加了46.7%和12.3%,平均鲜重增加31.5%;菌株BS11、BS12表现出显著的促生效果。
|
| 图 4 芽孢杆菌促水稻幼苗生长 Figure 4 Effect of Bacillus strains on rice growth 注:A:菌株BS11促水稻幼苗生长;B:菌株BS12促水稻幼苗生长. Note: A: Effect of strain BS11 on rice growth; B: Effect of strain BS12 on rice growth. |
|
|
|
菌株 Strains |
地上部分Aboveground part | 地下部分Underground part |
幼苗鲜重(8株) Fresh weight of seedling (g) |
增重效果 Weight increased effect (%) |
|||
| 平均株高 Average plant height (cm) |
促生效果 Growth promoting effect (%) | 平均根长 Average root length (cm) |
促生效果 Growth promoting effect (%) |
||||
| BS11 | 8.76±0.041 | 41.3 | 10.32±0.051 | 18.6 | 3.98±0.028 | 34.9 | |
| BS12 | 9.10±0.033 | 46.7 | 9.77±0.037 | 12.3 | 3.88±0.033 | 31.5 | |
| CK | 6.20±0.024 | 0.0 | 8.70±0.031 | 0.0 | 2.95±0.022 | 0.0 | |
| 注:CK:未经菌液处理的水稻. | |||||||
| Note: CK: untreated rice seeds. | |||||||
芽孢杆菌在畜牧业中具有重要的研究和应用价值。芽孢杆菌可通过非核糖体肽途径合成具有抑细菌、病毒、真菌效果的脂肽化合物和聚酮化合物,芽孢杆菌抗逆性强、耐高温高压、耐酸碱盐、易贮存等优良特性,被认为是理想的微生态制剂和微生物饲料添加剂。现在许多国家已大量使用芽孢杆菌作为饲料添加剂,并取得了丰硕的成果,Deng等[7]研究发现分离自青藏高原的B. subtilis RJGP16具有促进新生仔猪小肠细胞免疫和体液免疫作用,菌株可通过胞外成分激活小肠TLR9的表达,诱导细胞因子IL-6的分泌,促进IgA分泌细胞数量增加来提高仔猪免疫力[7]。芽孢杆菌对环境友好、对人畜安全,是理想的饲料添加剂和微生态制剂的研发菌源,在畜牧业生产中极具研究和应用潜力。
在青藏高原,农作物秸秆常作为牲畜秋冬季节的饲料来源,传统农业中秸秆资源不经过处理直接用作饲料,利用效率低。通过有益微生物作为饲料添加剂去分解秸秆中的纤维素等多糖,使之降解为容易被动物机体吸收和利用的单糖、寡糖成分,可有效增强秸秆营养成分的释放效率,提高牲畜对养分的吸收。此外,秸秆还田也是目前青海省积极推广的生态农业实施方法,秸秆还田可有效改善土壤物理性状,增加土壤养分含量。研究表明,作物秸秆还田会对农田土壤环境及农田小气候产生影响,要求秸秆中的添加菌株具有良好的环境适应能力[19],芽孢杆菌本身良好的抗逆特性及可分泌胞外纤维素酶的特性,具备纤维素降解菌的先天优势。
高原特殊生境孕育适应高原生境的芽孢杆菌资源,本研究自青海互助桦树根围分离筛选到几株芽孢杆菌菌株,在CMC平板上形成纤维素降解透明圈直径≥20 mm,具有显著的纤维素降解活性;BOX-PCR指纹图谱分析、gyrB基因及16S rRNA基因序列分析将几株芽孢杆菌鉴定为解淀粉芽孢杆菌B. amyloliquefaciens;几株菌株对油菜菌核病原真菌(Sclerotinia sclerotiorum)、瓜类枯萎病菌(Fusarium oxysporum)、水稻白叶枯病原细菌(Xanthomonas oryzae pv. oryzae)及植物梨火疫病菌(Erwinia amylovora)均有显著拮抗活性;可在含NaCl浓度为11%的LB平板上正常生长,在10 ℃低温条件下生长,具备一定的耐盐性和低温适生性。几株解纤维素芽孢杆菌兼具对病原菌的拮抗活性,同时具有耐低温、耐盐的抗逆特性,适应高原特殊生态环境,如应用于饲料加工或秸秆还田,既可降低植物病害发生,又可提高饲料的卫生品质,在高原生态农业及畜牧业中具有很好的研究意义和应用潜力。
目前,芽孢杆菌的防病及促生特性在农业生产中得到了广泛的应用,诸多学者研究芽孢杆菌的抗病促生机制,筛选抗病促生效果显著的芽孢杆菌应用于农业生产及生物防治,如Hu等[20]利用枯草芽孢杆菌防治油菜菌核病并对油菜种子进行催芽,陈志谊等[21]利用枯草芽孢杆菌B-916防治水稻纹枯病,张霞等[22]利用枯草芽孢杆菌B931防治植物病害并促进植物生长,取得了一定的成效。本研究中分离筛选的纤维素降解菌株B. amyloliquefaciens BS11、BS12具备显著催芽、促生及拮抗病原菌活性,并适应高原特殊生态环境,作为生物菌肥和生物农药研发菌源在高原农业生产及生态植被恢复中同样具有一定的应用潜力。
| [1] | Xie YL, Gao XW. Screening and identification of low temperature-adapted antagonistic Bacillus isolated from Kekexili region of West China and the analysis of the isolates lipopeptide compounds[J]. Chinese Journal of Applied Ecology 2013, 24(1) : 149–155. (in Chinese) 谢永丽, 高学文. 可可西里低温适生拮抗芽孢杆菌的筛选鉴定及脂肽化合物分析[J]. 应用生态学报 2013, 24(1) : 149–155. |
| [2] | Wang W, Qin Y, Li S, et al. Research progress on microecological preparation of Bacillus subtilis[J]. China Animal Husbandry &Veterinary Medicine 2013, 40(11) : 217–220. (in Chinese) 王苇, 秦瑶, 李爽, 等. 枯草芽孢杆菌微生态制剂的研究进 展[J]. 中国畜牧兽医 2013, 40(11) : 217–220. |
| [3] | Wang Y, Liu YG, Xi XM, et al. Lignocellulose degrading ability of Bacillus subtilis and its enzyme production[J]. Journal of Microbiology 2008, 28(4) : 1–6. (in Chinese) 王毅, 刘云国, 习兴梅, 等. 枯草芽胞杆菌降解木质纤维素能力及产酶研究[J]. 微生物学杂志 2008, 28(4) : 1–6. |
| [4] | Gao XW, Yao SY, Huong P, et al. Lipopeptide antibiotics produced by the engineered strain Bacillus subtilis GEB3 and detection of its bioactivity[J]. Scientia Agricultura Sinica 2003, 36(12) : 1496–1501. (in Chinese) 高学文, 姚仕义, HuongP, 等. 基因工程菌枯草芽孢杆菌GEB3产生的脂肽类抗生素及其生物活性研究[J]. 中国农业科学 2003, 36(12) : 1496–1501. |
| [5] | Romero D, de Vicente A, Rakotoaly RH, et al. The iturin and fengycin families of lipopeptides are key factors in antagonism of Bacillus subtilis toward Podosphaera fusca[J]. Molecular Plant-microbe Interactions 2007, 20(4) : 430–440. DOI:10.1094/MPMI-20-4-0430 |
| [6] | Xie YL, Gao XW. Screening and identification of bio-control Bacillus strains isolated from rhizosphere of altiplaino meadow and its lipopeptide compounds[J]. Chinese Journal of Biological Control 2012, 28(3) : 367–374. (in Chinese) 谢永丽, 高学文. 高寒草甸根围拮抗芽孢杆菌筛选鉴定及脂肽化合物分析[J]. 中国生物防治学报 2012, 28(3) : 367–374. |
| [7] | Deng J, Li YF, Zhang JH, et al. Co-administration of Bacillus subtilis RJGP16 and Lactobacillus salivarius B1 strongly enhances the intestinal mucosal immunity of piglets[J]. Research in Veterinary Science 2013, 94(1) : 62–68. DOI:10.1016/j.rvsc.2012.07.025 |
| [8] | Wu CB, Qiu JJ, Guan X. Bacillus thuringiensis and its applications in animal diseases control[J]. Chinese Agricultural Science Bulletin 2008, 24(7) : 17–21. (in Chinese) 吴昌标, 邱津津, 关雄. 苏云金芽孢杆菌及其在动物疾病防治上的应用[J]. 中国农学通报 2008, 24(7) : 17–21. |
| [9] | Wu HJ, Wang S, Qiao JQ, et al. Expression of HpaGXooc protein in Bacillus subtilis and its biological functions[J]. Journal of Microbiology & Biotechnology 2009, 19(2) : 194–203. |
| [10] | Xue PQ, Liu F, Qiao JQ, et al. Screening of Bacillus strains with high inhibition on rape Sclerotinia disease and its lipopeptide compounds detection[J]. Journal of Plant Protection 2011, 38(2) : 127–132. (in Chinese) 薛鹏琦, 刘芳, 乔俊卿, 等. 油菜菌核病生防芽孢杆菌的分离鉴定及其脂肽化合物分析[J]. 植物保护学报 2011, 38(2) : 127–132. |
| [11] | Liu F, Xue PQ, Qiao JQ, et al. Isolation and identification of a low-temperature-adapted Bacillus in Tibet and its antagonistic and growth-promoting effect[J]. Chinese Journal of Biological Control 2010, 26(4) : 453–460. (in Chinese) 刘芳, 薛鹏琦, 乔俊卿, 等. 西藏低温适生芽孢杆菌的分离鉴定及其抗菌和促生作用[J]. 中国生物防治 2010, 26(4) : 453–460. |
| [12] | Zhang N, Yang XM, Xu YC, et al. Screening, cellulase activity measurement and identification of cellulose-decomposing bacteria[J]. Journal of Nanjing Agricultural University 2010, 33(3) : 82–87. (in Chinese) 张楠, 杨兴明, 徐阳春, 等. 高温纤维素降解菌的筛选和酶活性测定及鉴定[J]. 南京农业大学学报 2010, 33(3) : 82–87. |
| [13] | Xie YL, Ma LZ, Xu ZW, et al. Identification of low-temperature adapting PGPR strains isolated from frozen desert area and their antimicrobial and growth-promoting activity[J]. Chinese Journal of Biological Control 2014, 30(1) : 94–100. (in Chinese) 谢永丽, 马莉贞, 徐志伟, 等. 冻土荒漠区分离低温适生PGPR菌的鉴定及其抗菌促生特性[J]. 中国生物防治学报 2014, 30(1) : 94–100. |
| [14] | Bavykin SG, Lysov YP, Zakhariev V, et al. Use of 16S rRNA, 23S rRNA, and gyrB gene sequence analysis to determine phylogenetic relationships of Bacillus cereus group microorganisms[J]. Journal of Clinical Microbiology 2004, 42(8) : 3711–3730. DOI:10.1128/JCM.42.8.3711-3730.2004 |
| [15] | Kumar S, Tamura K, Nei M. MEGA3: integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics 2004, 5(2) : 150–163. DOI:10.1093/bib/5.2.150 |
| [16] | Yamamoto S, Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains[J]. Applied and Environmental Microbiology 1995, 61 : 1104–1109. |
| [17] | Cui HY, Cheng SW, Huang TH, et al. Screening and identifying of Bacillus amyloliquefaciens for cellulase production and its enzymatic characters[J]. Journal of Food Science and Technology 2014, 32(3) : 43–47. (in Chinese) 崔海洋, 程仕伟, 黄田红, 等. 产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究[J]. 食品科学技术学报 2014, 32(3) : 43–47. |
| [18] | Xie YL, Ma LZ, Xu ZW, et al. Molecular identification of Bacillus strains isolated from extreme dry-sand environment in Qinghai Chaidamu region and its lipopeptide compound analysis[J]. Microbiology China 2012, 39(8) : 1079–1086. (in Chinese) 谢永丽, 马莉贞, 徐志伟, 等. 柴达木极端干旱沙地分离芽孢杆菌的分子鉴定及拮抗活性分析[J]. 微生物学通报 2012, 39(8) : 1079–1086. |
| [19] | Trivedi N, Gupta V, Kumar M, et al. An alkali-halotolerant cellulase from Bacillus flexus isolated from green seaweed Ulva lactuca[J]. Carbohydrate Polymers 2011, 83(2) : 891–897. DOI:10.1016/j.carbpol.2010.08.069 |
| [20] | Hu XJ, Roberts DP, Jiang ML, et al. Decreased incidence of disease caused by Sclerotinia sclerotiorum and improved plant vigor of oilseed rape with Bacillus subtilis Tu-100[J]. Applied Microbiology and Biotechnology 2005, 68(6) : 802–807. DOI:10.1007/s00253-005-1938-x |
| [21] | Chen ZY, Gao TD, Yan DF, et al. Result of controlling sheath blight of rice with antagonistic bacteria (Bacillus subtilis 916) under field conditions[J]. Chinese Journal of Biological Control 1997, 13(2) : 75–78. (in Chinese) 陈志谊, 高太东, 严大富, 等. 枯草芽孢杆菌B-916防治水稻纹枯病的田间试验[J]. 中国生物防治 1997, 13(2) : 75–78. |
| [22] | Zhang X, Tang WH, Zhang LQ, et al. Biological control of plant diseases and plant growth promotion by Bacillus subtilis B931[J]. Acta Agronomica Sinica 2007, 33(2) : 236–241. (in Chinese) 张霞, 唐文华, 张力群. 枯草芽孢杆菌B931防治植物病害和促进植物生长的作用[J]. 作物学报 2007, 33(2) : 236–241. |
 2017, Vol. 44
2017, Vol. 44