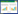扩展功能
文章信息
- 张明阳, 张娟, 刘龙, 堵国成, 陈坚
- ZHANG Ming-Yang, ZHANG Juan, LIU Long, DU Guo-Cheng, CHEN Jian
- 精氨酸代谢途径抗酸关键基因对乳酸乳球菌 Lactococcus lactis NZ9000 胁迫抗性的影响
- Influence of key acid-resistant genes in arginine metabolism on stress tolerance in Lactococcus lactis NZ9000
- 微生物学通报, 2017, 44(2): 314-324
- Microbiology China, 2017, 44(2): 314-324
- DOI: 10.13344/j.microbiol.china.160119
-
文章历史
- 收稿日期: 2016-01-31
- 接受日期: 2016-04-11
- 优先数字出版日期(www.cnki.net): 2016-07-19
2. 江南大学生物工程学院 江苏 无锡 214122;
3. 江南大学 糖化学与生物技术教育部重点实验室 江苏 无锡 214122;
4. 江南大学 粮食发酵工艺与技术国家工程实验室 江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China;
3. Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi, Jiangsu 214122, China;
4. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi, Jiangsu 214122, China
乳酸菌(Lactic acid bacteria,LAB)是一类兼性厌氧、能够代谢糖类产乳酸且不产芽孢的革兰氏阳性菌[1]。由于LAB被普遍认为是安全的(GRAS)并具有突出的益生作用,被广泛用于食品、药品、饮料发酵、微生态菌剂生产、风味产生等[2-4]。在上述应用中乳酸菌可能遭遇到各种各样的环境胁迫,比如高温、冷冻、酸、渗透压、氧以及饥饿等[5]。为了发挥其工业应用价值和益生作用,在加工处理环节或人体胃肠道的胁迫中,必须保证其具有充足数量和存活能力的菌体细胞[6]。目前,相关策略如保护剂的添加[7-8]、预适应及交叉保护[9-11]、适应性进化[12-13]、过量表达胁迫应激蛋白[14-16]、引入外源物质合成途径[17-19]等被用于提高乳酸菌的胁迫抗性。
多种胁迫之中,酸胁迫是影响存活能力最严重的胁迫之一[20]。目前已证实的酸胁迫抗性机制研究包括胞内pH的动态平衡调节、细胞膜功能性调节、上调胁迫响应蛋白等[21]。同时,氨基酸代谢调节在胞内pH调节中发挥着至关重要的作用,如谷氨酸脱羧酶系统、ADI途径[22-23]。ADI途径作为酸胁迫响应在乳酸菌中被广泛报道[24-25],此途径可以代谢精氨酸并产生NH3和ATP,有利于中和H+以及泵出质子[5, 26-27]。Senouci-Rezkallah等[23]发现精氨酸的添加可以提高Bacillus cereus ATCC14579在pH 4.0酸胁迫环境中的存活率。虽然ADI途径及精氨酸对酸性环境中细胞存活的保护机制已经被广泛了解,但是精氨酸代谢途径中与酸胁迫相关的关键因素的确认及其相关控制策略尚无报道。在前期研究中,本团队首次发现了Lactobacillus casei Zhang酸耐受突变株中精氨酸的合成前体天冬氨酸的显著积累[12]。后续研究发现,外源添加天冬氨酸可以提高L. casei Zhang酸胁迫条件下的存活率[28]。蛋白质组学数据分析发现,酸胁迫条件下L. casei Zhang中精氨酰琥珀酸合成酶(ASS,EC: 6.3.4.5)和精氨酰琥珀酸裂解酶(ASL,EC: 4.3.2.1)的表达上调,而且外源添加天冬氨酸实验也发现酸环境中argG和argH基因的转录水平上调[28-29]。ASS由argG基因编码,可以催化瓜氨酸、天冬氨酸和ATP产生精氨酰琥珀酸,是精氨酸合成和尿素循环的限速酶;ASL由argH基因编码,可以催化精氨酰琥珀酸产生精氨酸,是尿素循环相关的重要酶,两个蛋白的合成均受到ArgR蛋白的调控[30-32]。有研究表明外源添加精氨酸可以提高菌株酸胁迫抗性[23],而精氨酸代谢显著影响菌株酸胁迫条件下的存活能力[33-34]。本研究拟通过在L. lactis NZ9000中分别过量表达ASS和ASL,确定精氨酸代谢途径中相关蛋白对细胞胁迫抗性及发酵性能的影响。本研究将会为精氨酸代谢中影响酸胁迫抗性的关键因素的发掘以及其在提高工业生产菌株耐酸性能的应用提供研究基础。
1 材料与方法 1.1 菌株、质粒及生长环境所用的菌株为Lactobacillus casei Zhang (CGMCC1697)和Lactococcus lactis NZ9000 [LN,CP002094荷兰NIZO Food Research (Kernhemseweg,Netherlands)]。L. caseiZhang (内蒙古农业大学的张和平教授惠赠)作为基因供体,37 ℃静置培养于MRS培养基中。L. lactis NZ9000和pNZ8148分别作为异源表达ASS、ASL的宿主和载体。L. lactis NZ9000培养条件:GM17培养基(M17肉汤添加5 g/L葡萄糖),30 ℃静置培养。为了便于筛选,培养基中可以添加10 mg/L的氯霉素或者5 mg/L的红霉素。
1.2 主要试剂和仪器M17肉汤培养基、MRS培养基购自Oxoid公司;GeneJET PCR纯化试剂盒、SpeⅠ、SphⅠ内切酶购自Thermo Scientific公司;DNA连接酶、Prime STAR DNA聚合酶、PrimeScriptTM Reagent Kit、SYBR® Premix ExTaqTM购自大连宝生物工程有限公司;Nisin、缬氨霉素、尼日利亚菌素、荧光探针BCECF AM购自sigma公司;BCA蛋白测定试剂盒、RNAprep Pure Cell/Bacteria Kit购自天根生化科技有限公司;NuPAGE 10% Bis-Tris Gel购自life公司;ATP Assay Kit购自碧云天生物技术研究所;Ammonia Assay Kit购自美国ScienCell公司;H+-ATPase Assay Kit购自上海杰美基因科技有限公司;其他化学试剂均为国产分析纯。SBA-40E生物传感器购自山东省科学院生物研究所;LightCycler®480 system购自罗氏公司;Agilent 1260高效液相色谱仪购自安捷伦科技(中国)有限公司;Multiskan FC多功能酶标仪购自Thermo Scientific公司。
1.3 表达载体构建及转化以L. caseiZhang基因组DNA为模板,以argGF、argGR、argHF和argHR (表 1)为引物进行PCR获得argG和argH基因。反应体系:2×Prime STAR HS (Premix) 25.0 μL,上下游引物(10 μmol/L)各2.0 μL,DNA模板2.0 μL,灭菌超纯水19.0 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 5 s,56 ℃ 5 s,72 ℃ 90 s,共35个循环。设计引物时包含SpeⅠ和SphⅠ酶切位点(引物中划线部分),将PCR扩增产物和质粒pNZ8148用SpeⅠ和SphⅠ双酶切,经GeneJET PCR纯化试剂盒纯化后,使用DNA连接酶过夜连接。将连接产物和空质粒通过电转化转入L. lactis NZ9000[35],筛选氯霉素抗性菌株并验证,获得重组菌L. lactis NZ9000(pNZ8148-ASS)、L. lactis NZ9000(pNZ8148-ASL)和对照菌L. lactisNZ9000(pNZ8148)。
| 引物 Primers |
序列 Sequence (5′→3′) |
| argGF | ACATGCATGCATATGACAGAAAAAATCGTACTGGC |
| argGR | GGACTAGTTCAGTCATGTTGTTTTTCCTCGG |
| argHF | ACATGCATGCATATGACTGATAAGTTATGGGGC |
| argHR | GGACTAGTCTAGTGAGAAGCAATCATTTCCTC |
将3株菌分别以2%接种量接种于含有10 mg/L氯霉素的GM17培养基中。培养至600 nm处吸光度(OD600)达到0.4-0.5,向培养基中加入10 μg/L Nisin诱导培养8 h。4 ℃、10 000 r/min离心5 min收集细胞,用50 mmol/L Tris-HCl缓冲液(pH 7.4)洗涤、重悬。使用超声破碎仪在冰上将细胞破碎,4 ℃、10 000 r/min离心10 min除去细胞碎片收集得到细胞提取液。测定细胞提取液蛋白浓度并使用NuPAGE 10% Bis-Tris Gel进行SDS-PAGE 分析。
1.5 多种胁迫条件下胁迫抗性分析为了考察菌株在不同环境胁迫条件下的生长性能。将Nisin诱导的种子培养液以2%接种量接入不同胁迫条件下的GM17培养基(10 mg/L氯霉素,10 μg/L Nisin)中,胁迫条件分别为:酸胁迫(pH 5.0,乳酸调节)、盐胁迫(3% NaCl)和乙醇胁迫(5%乙醇)。同时测定非胁迫条件(30 ℃)下生长性能作为对照。每隔一定时间取样,测量其600 nm处的吸光值,平行实验重复3次。
为了比较菌株的胁迫存活能力,将菌株培养至对数生长期中后期,4 ℃、8 000 r/min离心3 min后用0.85%的生理盐水洗涤菌体,并重悬于酸胁迫(pH 4.0,乳酸调节)下的GM17培养基中。分别在胁迫0、2、4、5 h进行取样,通过平板菌落计数法计算存活细胞及存活率。
1.6 胁迫条件下发酵性能分析将Nisin诱导种子液接种至新鲜的pH 5.5的GM17培养基(补充10 mg/L氯霉素,10 μg/L Nisin)中,间隔一定时间取样并测定发酵液的细胞干重、葡萄糖残余浓度及乳酸浓度。葡萄糖残余浓度及乳酸浓度由SBA-40E生物传感器测定。
1.7 胞内 pH (pHi) 的测定将细胞在初始pH 7.0的GM17培养基中培养至对数中期,洗涤细胞并用新鲜的GM17 (pH 5.0)培养基等体积重悬,30 ℃培养5 h。以Wu等[29]改进的荧光探针法[36]进行pHi的测定。
1.8 胞内氨基酸浓度的确定将重组菌和对照菌培养至对数中期,收集细胞并将其在pH 5.0条件下胁迫5 h。将胁迫和非胁迫条件下培养液进行离心收集细胞,50 mmol/L磷酸盐缓冲液(PBS,pH 7.0)洗涤并超声破碎。12 000 r/min离心5 min收集上清液,并加入等体积的5%三氯乙酸,混匀后室温静置10 min。将混合物在12 000 r/min转速下离心10 min,上清液利用HPLC方法分析胞内氨基酸浓度[37]。
1.9 荧光定量 PCR定量PCR所用引物根据L. lactisNZ9000序列设计,见表 2。为了提取细胞总RNA,将3菌株培养至对数中期,收集细胞并在pH 5.0条件下胁迫5 h。收集胁迫前后的菌体,液氮速冻后并液氮研磨,然后按照RNAprep Pure Cell/Bacteria Kit的方法提取总RNA,并立即按照PrimeScriptTM Reagent Kit的方法进行反转录得到cDNA。以cDNA为模板,以16S rRNA基因作为内参基因进行定量PCR。反应体系:2×SYBR Premix ExTaqTM 10.0 μL,上下游引物(10 μmol/L)各0.8 μL,DNA模板2.0 μL,灭菌超纯水6.4 μL。定量PCR反应条件:95 ℃ 5 min;95 ℃ 5 s,55 ℃ 20 s,共50个循环。
| 引物 Primers |
序列 Sequence (5′→3′) |
| arcAF | CATTCAATCAAGTCAAGTTCTG |
| arcAR | ATTCTTCGTCCTGGTCAA |
| arcBF | AGTGAATCTGGAGCAACA |
| arcBR | TGGTGATGGTCGTAACAA |
| asnHF | ACCGTATTCTTCGTAACC |
| asnHR | TCGCCTGAGTATTATTGAC |
| argRF | GACTTCTGGCAACTCTAA |
| argRR | GTTCGTCATCTAAAGCATTT |
| glnAF | AAGCCTTAACCGCATTGT |
| glnAR | CTATGTGATGACTGAAGAAGAAC |
| argJF | TTGGCTAAGGACTGACAA |
| argJR | GTGGATGGAGATACTTCAAC |
| aspBF | TCAATCATTCATCCAATCCT |
| aspBR | TTACGACAGCCATTCTTG |
| gltBF | TCGTGACAGGAAGAGATG |
| gltBR | GATACAACCAATCGCAACT |
| purAF | TCAGCAAGATAAGCGATT |
| purAR | CTTCACCTCATTCCATCA |
| thrAF | GCAGACAATATCCACAACTT |
| thrAR | GACTCGGTAAGCCAGAAT |
| 16S rRNAF | GCTAATACCGCATAATAACTT |
| 16S rRNAR | TATGTATCATCGCCTTGG |
将细胞诱导培养8 h后,使用超声破碎仪在冰上将细胞破碎,4 ℃、10 000 r/min离心10 min除去细胞碎片收集得到细胞提取液,使用细胞提取液进行ASS和ASL酶活力分析。ASS酶活力测定参照Cruz等[38]和Brasse-Lagnel等[39]的方法。酶活单位定义:每分钟催化1 μmol瓜氨酸的酶量为一个酶活单位。
ASL酶活力的测定参照Hwang等[40]和Alberty等[41]的方法。酶活单位定义:每小时产生1 μmol富马酸的酶量为一个酶活单位。
胞内ATP浓度利用萤火虫荧光素酶的原理按照ATP Assay Kit的方法测定。而氨水平使用AmmoniaAssay Kit通过NADPH氧化速率进行分析。
H+-ATPase按照H+-ATPase Assay Kit的方法进行测定,酶活单位定义为每分钟每毫克蛋白氧化 1 nmol NADH为1 U。
2 结果与讨论 2.1 在L. lactis中异源表达ASS和ASL前期研究表明L. casei Zhang的酸胁迫抗性与ASS和ASL的表达有关[28-29],本研究中为了检验ASS和ASL对胁迫耐受性的影响,在L. lactis NZ9000中表达了来源于L. casei Zhang的ASS和ASL。SDS-PAGE实验结果显示,重组菌株经Nisin诱导后,L. lactisNZ9000(pNZ8148-ASS)和L. lactis NZ9000(pNZ8148-ASL)在约45 kD和52 kD处的条带明显多于对照菌L. lactisNZ9000(pNZ8148) (图 1),与ASS和ASL分子质量一致,说明重组菌株中成功表达了ASS和ASL。
|
| 图 1 L. lactis表达ASS和ASL的SDS-PAGE分析 Figure 1 SDS-PAGE analysis of the expression of ASS and ASL in L. lactis 注:M:蛋白标准marker;ASS:NZ9000(pNZ8148-ASS);ASL:NZ9000(pNZ8148-ASL);Vec:NZ9000(pNZ8148). 蛋白Marker的分子量标注于左侧;箭头指示相应的蛋白. Note: M: Protein standard marker; ASS: NZ9000(pNZ8148-ASS); ASL: NZ9000(pNZ8148-ASL); Vec: NZ9000(pNZ8148). The positions of the molecular mass markers are shown on the left side of the panel. Arrows indicate the corresponding proteins. |
|
|
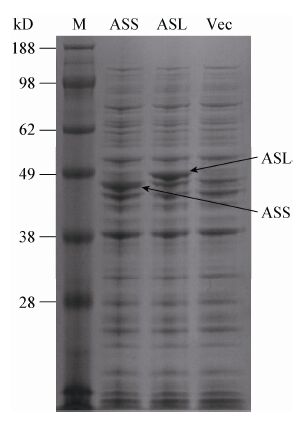
为进一步确定ASS和ASL在L. lactisNZ9000中的表达,测定了重组菌和对照菌株中ASS和ASL的活性,结果如图 2所示,相对于对照菌,NZ9000 (pNZ8148-ASS)中ASS酶活提高了30.65%,而NZ9000(pNZ8148-ASL)中ASL酶活提高了57.06%。说明ASS和ASL在L. lactis NZ9000成功表达。
|
| 图 2 ASS 和 ASL 酶活 Figure 2 Enzyme activities of ASS and ASL |
|
|
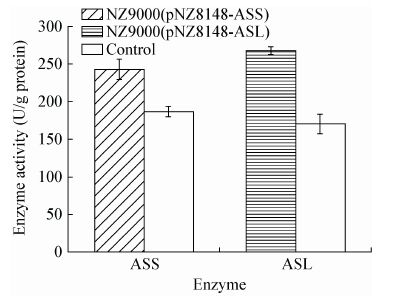
为了比较重组菌和对照菌的胁迫抗性,测定了菌株在不同环境胁迫中的生长性能。在酸胁迫(pH 5.0)、盐胁迫(3% NaCl)、乙醇胁迫(5%)条件下,生长性能较非胁迫环境中明显下降(图 3)。与对照菌相比,NZ9000(pNZ8148-ASS)在酸胁迫(pH 5.0)、盐胁迫(3% NaCl)、乙醇胁迫(5%)条件下生长性能分别提高了5.29%、28.22%、25.79%;而NZ9000 (pNZ8148-ASL)则分别提高了24.03%、19.91%、21.16%。结果表明重组菌酸胁迫、盐胁迫、乙醇胁迫条件下生长性能明显高于对照菌。
|
| 图 3 重组菌株在环境胁迫下生长性能 Figure 3 Growth performance of recombinant strains during various environmental stresses 注:A:pH 5.0;B:3% NaCl;C:5%乙醇;D:30 ℃. 误差线表示3次实验的标准差. Note: A: pH 5.0; B: 3% NaCl; C: 5% ethanol; D: 30 ℃. Error bars indicate standard deviations (n=3). |
|
|
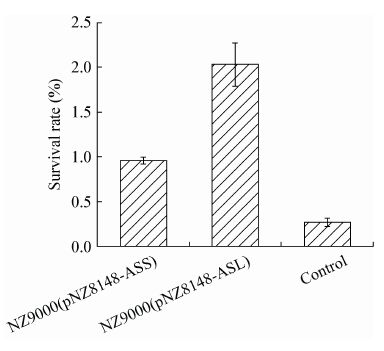
基于生长性能的研究结果,考察了菌株在酸胁迫(pH 4.0)条件下存活率的差异。如图 4所示,酸胁迫5 h后存活率明显下降,NZ9000(pNZ8148-ASS)和NZ9000(pNZ8148-ASL)的存活率分别为对照菌的3.54倍和7.50倍。因此,重组菌酸胁迫下的存活能力明显高于对照。
|
| 图 4 重组菌株在酸胁迫下的存活率 Figure 4 Survival rate of recombinant strains during acid stress |
|
|
由于重组菌在酸胁迫下的生长性能和存活能力明显提高,因此测定了酸胁迫(pH 5.5)条件下的发酵性能。非胁迫条件下,三菌株的发酵性能没有明显的差异;而在pH 5.5环境中,菌株之间发酵性能的差距较明显,重组菌的DCW、葡萄糖消耗、乳酸产量均高于对照菌;NZ9000(pNZ8148-ASS)和NZ9000(pNZ8148-ASL)的乳酸产量分别比对照菌高31.58%和44.74%。酸胁迫和非胁迫条件下的具体发酵数据如表 3所示。可以看出,NZ9000 (pNZ8148-ASS)的细胞干重(DCW)、最大乳酸产量和乳酸生产强度分别为对照菌株的1.33、1.32和1.30倍;NZ9000(pNZ8148-ASL)分别为对照菌株的1.30、1.45和1.40倍,因此,重组菌的发酵性能有所提高。
|
参数 Parameters |
pH 7.0 | pH 5.5 | |||||
| NZ9000(pNZ 8148-ASS) |
NZ9000(pNZ 8148-ASL) |
Control | NZ9000(pNZ 8148-ASS) |
NZ9000(pNZ 8148-ASL) |
Control | ||
| 发酵时间 Fermentation time (h) | 9 | 9 | 9 | 20 | 20 | 20 | |
| 细胞干重 DCW (g/L) | 0.88±0.02 | 0.89±0.01 | 0.86±0.01 | 0.36±0.01 | 0.35±0.01 | 0.27±0.01 | |
| 葡萄糖消耗 Glucose consumption (g/L) |
4.56±0.06 | 4.45±0.06 | 4.55±0.06 | 3.00±0.28 | 3.20±0.28 | 2.30±0.71 | |
| 乳酸产量 Lactic acid production (g/L) | 4.43±0.10 | 4.33±0.10 | 4.53±0.15 | 2.50±0.28 | 2.75±0.07 | 1.90±0.14 | |
| 菌体对葡萄糖得率 Biomass yield (g/g glucose ) |
0.20±0.01 | 0.20±0.01 | 0.19±0.01 | 0.12±0.01 | 0.11±0.01 | 0.12±0.03 | |
| 乳酸对葡萄糖得率 Lactic acid yield (g/g glucose) |
0.97±0.01 | 0.97±0.01 | 0.99±0.02 | 0.83±0.02 | 0.86±0.05 | 0.86±0.20 | |
| 乳酸生产强度 Lactic acid productivity (g/(L·h)) |
0.49±0.01 | 0.48±0.01 | 0.50±0.02 | 0.13±0.01 | 0.14±0.01 | 0.10±0.03 | |
基因argG和argH编码的ASS和ASL催化天冬氨酸转化为精氨酸,因此考察了ASS和ASL对氨基酸代谢的影响。本研究中通过定量PCR对氨基酸代谢中相关基因的转录水平做了分析,表 4表明了酸胁迫环境中过量表达ASS和ASL对氨基酸代谢基因的转录水平有显著的影响。重组菌精氨酸代谢基因arcA、arcB和argR的转录水平均被加强。ArcA和ArcB蛋白为ADI途径中两个重要的酶,能够分解精氨酸并产生氨和ATP,从而抵抗酸胁迫[42]。但是ArgR蛋白对精氨酸代谢有阻遏作用[43]。天冬氨酸合成代谢基因aspB转录水平上调;天冬氨酸分解代谢相关基因中,purA、asnH基因的转录下调,基因thrA转录水平上调;有利于重组菌株中天冬氨酸的合成,而天冬氨酸为精氨酸合成的前体,有利于精氨酸合成。谷氨酸代谢相关基因glnA、gltB和argJ被诱导。
| 基因 Genes |
NZ9000 (pNZ8148-ASS) |
NZ9000 (pNZ8148-ASL) |
| glnA | 1.43 | 1.99 |
| gltB | 1.21 | 1.64 |
| argJ | 0.95 | -0.08 |
| thrA | 0.61 | 1.38 |
| purA | -9.24 | -10.07 |
| asnH | -7.90 | -3.80 |
| aspB | 1.39 | 1.66 |
| arcA | 3.17 | 3.15 |
| arcB | 1.70 | 2.40 |
| argR | 0.67 | 1.54 |
| 注:R:酸胁迫前后L. lactis中基因转录水平的比值. | ||
| Note: R: Ratio of transcription level of genes in L. lactis before or after acid treatment. | ||
为了验证定量PCR的实验结果,测定了酸胁迫下重组菌的氨基酸浓度。如表 5所示,ASS和ASL的表达引起了胞内氨基酸的显著改变。酸胁迫5 h后,重组菌中谷氨酸族氨基酸精氨酸、瓜氨酸、鸟氨酸水平高于对照菌,而谷氨酸的水平却低于对照;可能与glnA、gltB和argJ被诱导以及ASS、ASL的表达有关。天冬氨酸族和丙酮酸族氨基酸中除甲硫氨酸外,大多数氨基酸均低于重组菌。甘油磷酸族和芳香族氨基酸中,丙氨酸和苯丙氨酸低于对照菌,但是半胱氨酸和酪氨酸高于对照菌。结果表明,ADI途径中氨基酸浓度明显提高,而以天冬氨酸、丙酮酸为前体的天冬氨酸族和丙酮酸族大部分氨基酸水平均下降。
| 氨基酸 Amino acid |
NZ9000 (pNZ8148-ASS) |
NZ9000 (pNZ8148-ASL) |
| 谷氨酸 Glutamate | 0.75±0.04 | 0.87±0.02 |
| 精氨酸 Arginine | 1.54±0.12 | 1.32±0.02 |
| 瓜氨酸 Citrulline | 8.60±0.48 | 2.57±0.42 |
| 鸟氨酸 Ornithine | 1.96±0.48 | 1.41±0.28 |
| 脯氨酸 Proline | 1.05±0.28 | 1.97±0.21 |
| 天冬氨酸 Aspartate | 0.73±0.09 | 0.89±0.02 |
| 苏氨酸 Threonine | 0.80±0.09 | 0.82±0.02 |
| 丙氨酸 Alanine | 0.82±0.05 | 0.86±0.06 |
| 异亮氨酸 Isoleucine | 0.84±0.13 | 0.83±0.03 |
| 亮氨酸 Leucine | 0.74±0.20 | 0.92±0.09 |
| 缬氨酸 Valine | 0.77±0.01 | 0.75±0.07 |
| 甲硫氨酸 Methionine | 1.39±0.35 | 3.68±0.12 |
| 半胱氨酸 Cysteine | 1.23±0.23 | 1.16±0.02 |
| 甘氨酸 Glycine | 0.74±0.03 | 0.83±0.12 |
氨基酸代谢机制如图 5所示。过量表达ASS和ASL引起了aspB、arcA和arcB基因转录上调,进而导致了天冬氨酸合成、天冬氨酸转化为精氨酸以及ADI途径的代谢流量增加。重组菌中purA和asnH基因转录下调,使天冬氨酸到天冬酰胺和腺苷酸琥珀酸代谢流量降低。在天冬氨酸添加提高胁迫抗性实验中有同样的结果[28]。代谢流量的改变使细胞内天冬氨酸、精氨酸浓度增加,ADI途径代谢流量增加产生更多的ATP和NH3。而NH3可以中和细胞内的质子,产生的ATPH+-ATPase提供能量从而排出H+[44-45]。因此,ASS和ASL影响了氨基酸代谢,有利于胞内pH平衡的调节,防止细胞受到酸胁迫的伤害。

|
| 图 5 L. lactis 中氨基酸代谢机制图 Figure 5 Schematic representation of the amino acid pathway in L. lactis |
|
|
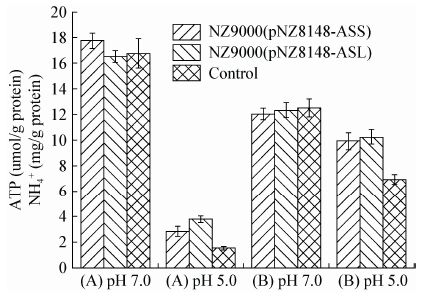
图 6考察了重组菌在酸环境下胞内ATP和NH4+水平的变化。酸胁迫条件下,胞内ATP含量随着胁迫时间延长不断下降;非胁迫环境中,三菌株细胞中ATP含量差别不大,在酸胁迫环境中重组菌ATP水平高于对照菌,且差距随时间不断扩大。对于NH4+水平,pH 5.0胁迫5 h后,重组菌NH4+水平较高,而且NH4+水平的减少量小于对照。
|
| 图 6 重组菌株胞内 ATP 和 NH4+ 浓度 Figure 6 Intracellular ATP pool and NH4+ concentration in recombinant strains 注:A:胞内ATP浓度;B:胞内NH4+浓度. Note: A: Intracellular ATP concentration; B: Intracellular NH4+ concentration. |
|
|
ADI途径是乳酸菌胞内pH自我调控的一种重要机制。ADI途径中酶催化精氨酸转化为鸟氨酸并产生ATP和NH3,NH3的中和作用以及ATP为质子泵提供能量排出质子都有助于细胞内pH的维持。因此,精氨酸代谢流量的上调使重组菌维持了较高的ATP和NH4+水平,对于菌株维持pHi的稳定有促进作用。
2.6 酸胁迫环境中胞内 pH 和 H+-ATPase 的分析由于重组菌ATP和NH4+水平均高于对照菌,有利于维持pHi的稳定,而ATP能够促进H+-ATPase排出质子,因此对胞内pH和H+-ATPase活性进行了测定。图 7展示了酸胁迫(pH 5.0)中胞内pH和H+-ATPase活性。pH 5.0环境中H+-ATPase活性明显提高;酸胁迫5 h后,重组菌H+-ATPase活性高于对照,若以对照菌酶活性的提高值为1.00,则NZ9000(pNZ8148-ASS)、NZ9000(pNZ8148-ASL) 的酶活性的提高值分别为1.76和1.42。对于胞内pH,酸胁迫后重组菌的胞内pH高于对照,NZ9000 (pNZ8148-ASS)、NZ9000(pNZ8148-ASL)胞内pH分别下降1.06和1.11,而对照下降了1.44。说明精氨酸代谢的上调使重组菌维持了较高的H+-ATPase活性和胞内pH。

|
| 图 7 重组菌株中胞内 pH 和 H+-ATPase 活性 Figure 7 Intracellular pH and H+-ATPase activity in recombinant strains 注:A:胞内pH;B:H+-ATPase活性. Note: A: Intracellular pH; B: Activity of H+-ATPase. |
|
|
据研究报道,LAB对酸胁迫的敏感性主要取决于pHi,pHi的降低影响菌体生长、代谢以及关键酶的活性等[46-47]。酸胁迫条件下,重组菌胞内ATP、氨浓度、H+-ATPase活性均高于对照菌,这些因素都有利于胞内pH的维持,而且重组菌胞内pH高于对照,因此,对酸胁迫中L. lactis起到保护作用。
3 结论本研究利用基因工程手段,将ASS和ASL在L. lactisNZ9000重组表达,且重组菌株中ASS和ASL的比酶活均有提高。重组菌L. lactis NZ9000 (pNZ8148-ASS)和L. lactis NZ9000(pNZ8148-ASL)在酸胁迫条件下的生长性能、耐受性以及发酵性能均优于对照菌。氨基酸代谢分析发现,重组菌中天冬氨酸转化为精氨酸途径以及ADI途径中的基因argG、argH、arcA和arcB转录水平上调,同时ADI途径中精氨酸、瓜氨酸、鸟氨酸浓度均高于对照菌株,表明过量表达ASS和ASL引起了精氨酸代谢流量的增加。精氨酸代谢流量的增加可以产生更多的ATP和NH3,有利于胞内pH的维持。精氨酸合成途径广泛存在于多种微生物中,本研究结果将为通过调整精氨酸代谢通路提高工业微生物的胁迫抗性提供新的思路。
| [1] | Kandler O. Carbohydrate metabolism in lactic acid bacteria[J]. Antonie van Leeuwenhoek 1983, 49(3) : 209–224. DOI:10.1007/BF00399499 |
| [2] | Komiyama M, Nishikawa M, Kan M, et al. Endovascular treatment of intractable oronasal bleeding associated with severe craniofacial injury[J]. The Journal of Trauma 1998, 44(2) : 330–334. DOI:10.1097/00005373-199802000-00017 |
| [3] | Bermúdez-Humarán LG, Aubry C, Motta JP, et al. Engineering lactococci and lactobacilli for human health[J]. Current Opinion in Microbiology 2013, 16(3) : 278–283. DOI:10.1016/j.mib.2013.06.002 |
| [4] | Papagianni M. Metabolic engineering of lactic acid bacteria for the production of industrially important compounds[J]. Computational and Structural Biotechnology Journal 2012, 3(4) : 1–8. |
| [5] | Sanders JW, Venema G, Kok J. Environmental stress responses in Lactococcus lactis[J]. FEMS Microbiology Reviews 1999, 23(4) : 483–501. DOI:10.1111/j.1574-6976.1999.tb00409.x |
| [6] | Corcoran BM, Stanton C, Fitzgerald G, et al. Life under stress: the probiotic stress response and how it may be manipulated[J]. Current Pharmaceutical Design 2008, 14(14) : 1382–1399. DOI:10.2174/138161208784480225 |
| [7] | Zhang J, Li Y, Chen W, et al. Glutathione improves the cold resistance of Lactobacillus sanfranciscensis by physiological regulation[J]. Food Microbiology 2012, 31(2) : 285–292. DOI:10.1016/j.fm.2012.04.006 |
| [8] | Cusumano ZT, Caparon MG. Citrulline protects Streptococcus pyogenes from acid stress using the arginine deiminase pathway and the F1Fo-ATPase[J]. Journal of Bacteriology 2015, 197(7) : 1288–1296. DOI:10.1128/JB.02517-14 |
| [9] | Jin JH, Qin Q, Guo HY, et al. Effect of Pre-stressing on the acid-stress response in Bifidobacterium revealed using proteomic and physiological approaches[J]. PLoS One 2015, 10(2) : e0117702. DOI:10.1371/journal.pone.0117702 |
| [10] | Khan AU, Forney RB, Hughes FW. Stress of shocking stimulus on plasma free fatty acids in rats[J]. Archives Internationales de Pharmacodynamie et de Therapie 1964, 151 : 459–465. |
| [11] | De Angelis M, Di Cagno R, Huet C, et al. Heat shock response in Lactobacillus plantarum[J]. Applied and Environmental Microbiology 2004, 70(3) : 1336–1346. DOI:10.1128/AEM.70.3.1336-1346.2004 |
| [12] | Zhang J, Wu CD, Du GC, et al. Enhanced acid tolerance in Lactobacillus casei by adaptive evolution and compared stress response during acid stress[J]. Biotechnology and Bioprocess Engineering 2012, 17(2) : 283–289. DOI:10.1007/s12257-011-0346-6 |
| [13] | Teusink B, Wiersma A, Jacobs L, et al. Understanding the adaptive growth strategy of Lactobacillus plantarum by in silico optimisation[J]. PLoS Computational Biology 2009, 5(6) : e1000410. DOI:10.1371/journal.pcbi.1000410 |
| [14] | Wu CD, Zhang J, Du GC, et al. Heterologous expression of Lactobacillus casei RecO improved the multiple-stress tolerance and lactic acid production in Lactococcus lactis NZ9000 during salt stress[J]. Bioresource Technology 2013, 143 : 238–241. DOI:10.1016/j.biortech.2013.05.050 |
| [15] | Tian HT, Tan JX, Zhang LF, et al. Increase of stress resistance in Lactococcus lactis via a novel food-grade vector expressing a shsp gene from Streptococcus thermophilus[J]. Brazilian Journal of Microbiology 2012, 43(3) : 1157–1164. DOI:10.1590/S1517-83822012000300043 |
| [16] | Almarza O, Núez D, Toledo H. The DNA-binding protein HU has a regulatory role in the acid stress response mechanism in Helicobacter pylori[J]. Helicobacter 2015, 20(1) : 29–40. DOI:10.1111/hel.2014.20.issue-1 |
| [17] | Zhang J, Fu RY, Hugenholtz J, et al. Glutathione protects Lactococcus lactis against acid stress[J]. Applied and Environmental Microbiology 2007, 73(16) : 5268–5275. DOI:10.1128/AEM.02787-06 |
| [18] | Branduardi P, Fossati T, Sauer M, et al. Biosynthesis of vitamin C by yeast leads to increased stress resistance[J]. PLoS One 2007, 2(10) : e1092. DOI:10.1371/journal.pone.0001092 |
| [19] | Trip H, Mulder NL, Lolkema JS. Improved acid stress survival of Lactococcus lactis expressing the histidine decarboxylation pathway of Streptococcus thermophilus CHCC1524[J]. The Journal of Biological Chemistry 2012, 287(14) : 11195–11204. DOI:10.1074/jbc.M111.330704 |
| [20] | Parvez S, Malik KA, Ah Kang S, et al. Probiotics and their fermented food products are beneficial for health[J]. Journal of Applied Microbiology 2006, 100(6) : 1171–1185. DOI:10.1111/jam.2006.100.issue-6 |
| [21] | Wu CD, Huang J, Zhou RQ. Progress in engineering acid stress resistance of lactic acid bacteria[J]. Applied Microbiology and Biotechnology 2014, 98(3) : 1055–1063. DOI:10.1007/s00253-013-5435-3 |
| [22] | Schwenk WS, Donovan TM. A multispecies framework for landscape conservation planning[J]. Conservation Biology 2011, 25(5) : 1010–1021. DOI:10.1111/j.1523-1739.2011.01723.x |
| [23] | Senouci-Rezkallah K, Schmitt P, Jobin MP. Amino acids improve acid tolerance and internal pH maintenance in Bacillus cereus ATCC14579 strain[J]. Food Microbiology 2011, 28(3) : 364–372. DOI:10.1016/j.fm.2010.09.003 |
| [24] | Budin-Verneuil A, Maguin E, Auffray Y, et al. Genetic structure and transcriptional analysis of the arginine deiminase (ADI) cluster in Lactococcus lactis MG1363[J]. Canadian Journal of Microbiology 2006, 52(7) : 617–622. DOI:10.1139/w06-009 |
| [25] | Poolman B, Driessen AJ, Konings WN. Regulation of arginine-ornithine exchange and the arginine deiminase pathway in Streptococcus lactis[J]. Journal of Bacteriology 1987, 169(12) : 5597–5604. DOI:10.1128/jb.169.12.5597-5604.1987 |
| [26] | Marquis RE, Bender GR, Murray DR, et al. Arginine deiminase system and bacterial adaptation to acid environments[J]. Applied and Environmental Microbiology 1987, 53(1) : 198–200. |
| [27] | Bender GR, Sutton SV, Marquis RE. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci[J]. Infection and Immunity 1986, 53(2) : 331–338. |
| [28] | Wu CD, Zhang J, Du GC, et al. Aspartate protects Lactobacillus casei against acid stress[J]. Applied Microbiology and Biotechnology 2013, 97(9) : 4083–4093. DOI:10.1007/s00253-012-4647-2 |
| [29] | Wu CD, Zhang J, Chen W, et al. A combined physiological and proteomic approach to reveal lactic-acid-induced alterations in Lactobacillus casei Zhang and its mutant with enhanced lactic acid tolerance[J]. Applied Microbiology and Biotechnology 2012, 93(2) : 707–722. DOI:10.1007/s00253-011-3757-6 |
| [30] | Lemke CT, Howell PL. Substrate induced conformational changes in argininosuccinate synthetase[J]. The Journal of Biological Chemistry 2002, 277(15) : 13074–13081. DOI:10.1074/jbc.M112436200 |
| [31] | Cao YL, Li GL, Wang KT, et al. Crystallization and preliminary X-ray analysis of argininosuccinate lyase from Streptococcus mutans[J]. Acta Crystallographica Section F Structural Biology and Crystallization Communications 2011, 67(6) : 682–684. DOI:10.1107/S1744309111011377 |
| [32] | Zhao QQ, Luo YC, Dou WF, et al. Controlling the transcription levels of argGH redistributed L-arginine metabolic flux in N-acetylglutamate kinase and ArgR-deregulated Corynebacterium crenatum[J]. Journal of Industrial Microbiology & Biotechnology 2016, 43(1) : 55–66. |
| [33] | Ryan S, Begley M, Gahan CGM, et al. Molecular characterization of the arginine deiminase system in Listeria monocytogenes: regulation and role in acid tolerance[J]. Environmental Microbiology 2009, 11(2) : 432–445. DOI:10.1111/emi.2009.11.issue-2 |
| [34] | Budin-Verneuil A, Maguin E, Auffray Y, et al. An essential role for arginine catabolism in the acid tolerance of Lactococcus lactis MG1363[J]. Lait 2004, 84(1/2) : 61–68. |
| [35] | Holo H, Nes IF. High-frequency transformation, by electroporation, of Lactococcus lactis subsp. cremoris grown with glycine in osmotically stabilized media[J]. Applied and Environmental Microbiology 1989, 55(12) : 3119–3123. |
| [36] | Breeuwer P, Drocourt J, Rombouts FM, et al. A novel method for continuous determination of the intracellular pH in bacteria with the internally conjugated fluorescent probe 5 (and 6-)-carboxyfluorescein succinimidyl ester[J]. Applied and Environmental Microbiology 1996, 62(1) : 178–183. |
| [37] | Fountoulakis M, Lahm HW. Hydrolysis and amino acid composition analysis of proteins[J]. Journal of Chromatography A 1998, 826(2) : 109–134. DOI:10.1016/S0021-9673(98)00721-3 |
| [38] | Cruz C, Egsgaard H, Trujillo C, et al. Enzymatic evidence for the key role of arginine in nitrogen translocation by arbuscular mycorrhizal fungi[J]. Plant Physiology 2007, 144(2) : 782–792. DOI:10.1104/pp.106.090522 |
| [39] | Brasse-Lagnel C, Lavoinne A, Fairand A, et al. IL-1β stimulates argininosuccinate synthetase gene expression through NF-κB in Caco-2 cells[J]. Biochimie 2005, 87(5) : 403–409. DOI:10.1016/j.biochi.2005.01.009 |
| [40] | Hwang ID, Lee Y, Kim SG, et al. Enzyme activities of canavanine metabolism in Canavalia lineata L. Callus[J]. Journal of Plant Physiology 1996, 149(5) : 194–500. |
| [41] | Alberty RA, Massey V, Frieden C, et al. Studies of the enzyme fumarase. III.1 The dependence of the kinetic constants at 25° upon the concentration and pH of phosphate buffers[J]. Journal of the American Chemical Society 1954, 76(9) : 2485–2493. DOI:10.1021/ja01638a053 |
| [42] | Vrancken G, Rimaux T, Wouters D, et al. The arginine deiminase pathway of Lactobacillus fermentum IMDO 130101 responds to growth under stress conditions of both temperature and salt[J]. Food Microbiology 2009, 26(7) : 720–727. DOI:10.1016/j.fm.2009.07.006 |
| [43] | Larsen R, Kok J, Kuipers OP. Interaction between ArgR and AhrC controls regulation of arginine metabolism in Lactococcus lactis[J]. The Journal of Biological Chemistry 2005, 280(19) : 19319–19330. DOI:10.1074/jbc.M413983200 |
| [44] | Burne RA, Marquis RE. Alkali production by oral bacteria and protection against dental caries[J]. FEMS Microbiology Letters 2000, 193(1) : 1–6. DOI:10.1111/fml.2000.193.issue-1 |
| [45] | Casiano-Colón A, Marquis RE. Role of the arginine deiminase system in protecting oral bacteria and an enzymatic basis for acid tolerance[J]. Applied and Environmental Microbiology 1988, 54(6) : 1318–1324. |
| [46] | Cook GM, Russell JB. The effect of extracellular pH and lactic acid on pH homeostasis in Lactococcus lactis and Streptococcus bovis[J]. Current Microbiology 1994, 28(3) : 165–168. DOI:10.1007/BF01571059 |
| [47] | O’Sullivan E, Condon S. Intracellular pH is a major factor in the induction of tolerance to acid and other stresses in Lactococcus lactis[J]. Applied and Environmental Microbiology 1997, 63(11) : 4210–4215. |
 2017, Vol. 44
2017, Vol. 44