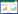扩展功能
文章信息
- 朱春玲, 赵雪芹, 王磊, 李梅, 夏小静, 王青, 徐彦召, 杭柏林, 孙亚伟, 胡建和
- Zhu Chun-Ling, ZHAO Xue-Qin, WANG Lei, Li Mei, XIA Xiao-Jing, WANG Qing, XU Yan-Zhao, HANG Bo-Lin, SUN Ya-Wei, HU Jian-he
- 抗菌肽JH-3治疗沙门氏菌感染的效果评价
- Evaluation of therapeutic efficacy of antimicrobial peptide JH-3 in Salmonella infection
- 微生物学通报, 2017, 44(12): 2981-2987
- Microbiology China, 2017, 44(12): 2981-2987
- DOI: 10.13344/j.microbiol.china.170384
-
文章历史
- 收稿日期: 2017-05-26
- 接受日期: 2017-08-23
- 优先数字出版日期(www.cnki.net): 2017-09-07
沙门氏菌(Salmonella)是重要的人畜共患传染病原菌,其感染是引起世界性胃肠疾病的主要因素,临床上主要以伤寒沙门氏菌(Salmonella typhimurium)和副伤寒沙门氏菌为主[1]。沙门氏菌耐药问题随着抗生素的大量使用越发严峻,从Morocco (摩洛哥)食物中分离出的464株沙门氏菌有39.6%的比例至少对一种抗生素有耐受性,对萘啶酮酸和磺酰胺类药物的耐受率最高,分别达27.1%和25.0%[2]。近年来从巴西地区分离到耐超广谱β-内酰胺的沙门氏菌,其可表达CTX-M-8和CTX-M-2基因,且检出率高达40%以上[3]。Martha等对美国1996-2013年间人、零售肉类和食品动物中沙门氏菌感染情况进行调查,发现头孢曲松耐受性沙门氏菌在未成年人中比例高达40%,并且这种耐受性在牛肉和家禽肉品中也广泛存在[4]。环丙沙星是临床上治疗沙门氏菌感染的主要药物之一,但是目前已经存在大量沙门氏菌对环丙沙星有耐受性[5]。因此,开发不易产生耐药性、活性高、安全可靠的新型抗沙门氏菌感染的药物十分必要。
抗菌肽(Antimicrobial peptides,AMPs)是机体先天性免疫系统的重要组成部分,构成机体的第一道防线,具有抗菌、抗病毒、抗肿瘤和免疫调节等活性。与抗生素相比,抗菌肽的抗菌机制独特、不易诱发耐药性、安全性较高,因此,抗菌肽是抗生素的理想替代品之一。本实验室前期研究发现牛红细胞源抗菌肽P3细胞毒性较小、杀菌活性强,具有很好的临床开发前景[6],通过对其氨基酸序列进行改造获得JH-3,其氨基酸序列更短(18个氨基酸),杀菌和抑菌活性更强[7],本研究发现JH-3在小鼠感染前3 d预防性注射JH-3能有效抵抗沙门氏菌对小鼠的致死性攻击,为临床治疗沙门氏菌感染以及新型抗菌药物的开发奠定基础。
1 材料与方法 1.1 材料抗菌肽JH-3序列(RRFKLLSHSLLVTLA SHL,分子量2 091.51 D,脂溶性指数151.67,电荷数12)是由本实验室分离纯化的原始抗菌肽P3经人工优化改造其氨基酸序列获得[8],研究用抗菌肽JH-3是由上海吉尔生化有限公司合成,经反相高效液相色谱纯化和质谱鉴定纯度 > 98%。鼠伤寒沙门氏菌CVCC541和环丙沙星(Ciprofloxacin,CPFX,批号H010105,含量99.8%)均购自中国兽医药品监察所。BALB/c小鼠购自郑州大学实验动物中心(No. 41003100003647);BHI (Brain Heart Infusion)培养基购自BD公司;PBS缓冲液购自HyClone公司。其他试剂为国产分析纯。
5417R型冷冻高速离心机,德国Eppendorf公司;RM2016型病理切片机、DM3000正置显微镜与DFC420拍照系统,德国Leica公司;JJ-12J型组织脱水机、JB-P5型石蜡包埋机,武汉俊杰电子有限公司。
1.2 方法 1.2.1 小鼠感染实验: 将沙门氏杆菌在BHI液体培养基上37 ℃、180 r/min培养至对数生长期,8 000 r/min室温离心3 min,PBS重悬细菌,重复洗涤3次,PBS稀释至1×107 CFU/mL,用于小鼠感染实验。小鼠随机分为6组,每组10只,包括对照组(PBS)、单独感染组(CVCC541)、抗菌肽JH-3预防组(B3d-JH-3)、抗菌肽JH-3治疗组(P3d-JH-3)、环丙沙星预防组(B3d-CPFX)、环丙沙星治疗组(P3d-CPFX)。预防组在感染前3 d分别连续腹腔注射100 μL抗菌肽JH-3和环丙沙星,共计40 mg/kg;治疗组为感染后3 d连续腹腔注射100 μL抗菌肽JH-3和环丙沙星,共计40 mg/kg;后3组均以腹腔注射的途径感染沙门氏菌,感染剂量为106 CFU/只;对照组腹腔注射200 μL的PBS。小鼠感染和抗菌肽给药时间分布如图 1所示。
|
| 图 1 小鼠感染和抗菌肽给药时间分布 Figure 1 Time distribution of CVCC541 infection and antimicrobial peptide treatment in mice |
|
|
小鼠脏器细菌载量的测定采用菌落计数法,即无菌条件下取出小鼠脾脏进行称重,根据脾脏重量加入20倍体积的PBS,无菌环境中进行组织匀浆,后对匀浆液进行倍比稀释,稀释梯度为10-3、10-4、10-5,分别吸取100 μl进行涂板和计数。
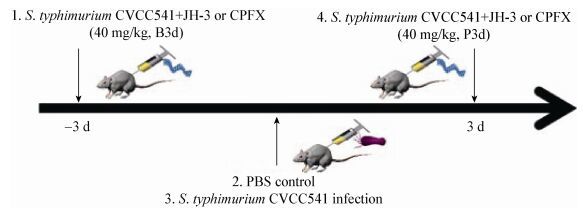
1.2.4 数据统计: 使用Graphpad Prism5数据处理软件对实验结果进行数据统计及差异性分析(One-Way ANOVA或Two-Way ANOVA),P≤0.05为差异显著(文中标注*:P≤0.05;**:P≤0.01;***:P≤0.001)。 2 结果与分析 2.1 小鼠临床症状与脾脏载菌量结果对CVCC541感染后不同处理的小鼠临床症状观察发现:单独感染CVCC541组临床症状最为严重,感染后1 d出现食欲减退、精神萎靡等临床症状,感染后第4天症状最严重,第7天单独感染组10只小鼠全部死亡。抗菌肽治疗组(P3d-JH-3) 3 d时小鼠出现食欲减退、精神萎靡、被毛松乱、弓背、聚众扎堆等临床症状,给药后能够抑制小鼠体重的降低(图 2A),临床症状未见明显好转(图 2B),7 d时小鼠死亡率为70% (图 2C)。抗菌肽预防组(B3d-JH-3)在前3天临床症状较轻,临床症状评分低于实验对照组,而且小鼠体重显著高于单独感染组,第5天小鼠临床症状显示正常,小鼠保护率达100% (图 2C)。环丙沙星预防组(B3d-CPFX)效果最佳,小鼠体重未见显著降低,临床症状评分最低,小鼠保护率为100% (图 2A-C);环丙沙星治疗组(P3d-CPFX)效果相对较差,但仍好于抗菌肽治疗组和未治疗组。阴性对照组未出现不良反应,体重也无明显的变化(图 2A、B)。
|
| 图 2 不同处理组小鼠临床症状、保护率和脾脏载菌量结果 Figure 2 Clinical symptoms, percent survival and cacteria load in spleen for mice with different treatments 注:A:不同处理组小鼠体重变化;B:不同处理组小鼠临床症状评分结果;C:不同处理组小鼠存活率差异结果;D:不同处理组小鼠脾脏载菌量结果. Note: A: The changes of weight in mice; B: Clinical symptoms for mice with different treatments; C: Percent survival for mice with different treatments; D: Bacteria load in spleen for mice with different treatments. |
|
|
对单独感染组和预防、治疗组小鼠脾脏细菌载量进行测定,发现单独感染组小鼠脾脏中CVCC541的载菌量约为1×108 CFU/g,抗菌肽治疗组(P3d-JH-3)细菌载量降低20倍以上,约为5×106 CFU/g (p < 0.05,图 2D),抗菌肽预防组(B3d-JH-3)小鼠脾脏中CVCC541的载菌量极显著低于单独感染组,约为1×105 CFU/g (p < 0.001,图 2D),与环丙沙星治疗组(P3d-CPFX)效果相当。环丙沙星预防组(B3d-CPFX)小鼠脾脏中细菌含量最低,约为1×104 CFU/g (p < 0.001,图 2D)。结果表明预防性给药JH-3和环丙沙星均能够有效抵抗CVCC541对小鼠的致死性攻击,降低病原菌在小鼠脾脏的定殖。
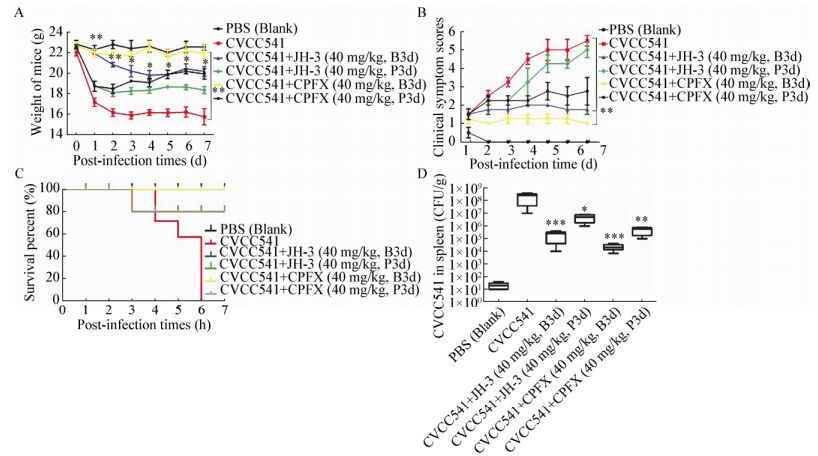
2.2 小鼠脏器外观病理变化结果对小鼠进行剖检发现:单独CVCC541感染组小鼠肺脏、脾脏、肠道病变较为明显。肺脏淤血肿大,呈暗红色,切面有较多血样泡沫液体渗出;脾脏肿大,呈紫黑色,被膜紧张,边缘钝圆,质地柔软,切面隆起并富有凝固不良的血液;肠管黏连,病变主要集中在小肠段,十二指肠、空肠、回肠有不同程度淤血,肠段松软、塌陷,肠壁变薄,剖开肠管肠黏膜稀薄、脱落,肠腔内有黄色粘稠状液体(图 3,CVCC541列)。另外单独感染组还有不同程度的腹腔积液。预防组(B3d)小鼠脏器病理变化则较轻,在CVCC541感染初期肺脏、脾脏、肠道呈局部充血状态,到第5天开始好转,脏器外观病理变化与PBS对照组无明显差别(图 3,JH-3 (B3d)列)。3 d后治疗组(P3d)随时间的延长(1周),出现实验组相同的病变症状,但病变程度较实验组弱(图 3,JH-3 (P3d)列),2周再次进行剖检时则无眼观病变。环丙沙星预防组和治疗组小鼠肠道和脾脏均未见显著病理变化,未见充血和出血的现象,而CPFX (P3d)组小鼠出现肺脏不同程度的损伤,表现在肺脏局部充血和出血(图 3,CPFX (B3d)和CPFX (P3d)列)。
|
| 图 3 不同处理组小鼠肺脏、脾脏和消化道的病理变化结果 Figure 3 Pathological changes of lung, spleen and intestinal in mice with different treatments |
|
|
不同处理组小鼠脏器经HE染色,发现单独感染组小鼠肺脏呈现出支气管、呼吸性细支气管等部位不同程度出血,上皮细胞坏死、脱落,肺泡毛细血管扩张,嗜中性粒细胞浸润使肺泡隔增宽增厚,肺泡囊减小(图 4,CVCC541,Lung);脾脏出现出血性脾炎,表现为脾脏红细胞、嗜中性粒细胞浸润,脾小结完整性受损、动脉周围淋巴鞘边缘区分界模糊(图 4,CVCC541,Spleen);小鼠空肠肠腔内大量纤维素渗出,肠绒毛不同程度破损、脱落,黏膜脱落至肠腔,与渗出的大量纤维素凝结在一起形成不易剥离的固膜。固有层血管明显扩张,血管内有大量红细胞,黏膜肌及黏膜下层变薄,大量嗜中性粒细胞浸润(图 4,CVCC541,Intestinal)。

|
| 图 4 不同处理组小鼠肺脏、脾脏和空肠的病理变化HE染色结果 Figure 4 Pathological changes of lung, spleen and jejunum in mice with different treatments by HE staining |
|
|
抗菌肽与环丙沙星治疗效果发现:抗菌肽3 d后治疗组肺脏和脾脏的损伤程度相对轻[图 4,Lung,Spleen,JH-3 (P3d)],但空肠完整性受损,病变较严重,呈现出与单独感染组相似的病理变化[图 4,Intestinal,JH-3 (P3d)]。抗菌肽预防组小鼠病理变化较轻,肺脏轻微充血,伴有少量的嗜中性粒细胞浸润,脾脏轻微充血,脾小结、动脉周围淋巴鞘轮廓清晰,与PBS阴性对照组无差别,空肠肠绒毛完整性良好,伴有轻微充血现象[图 4,Lung,Spleen,Intestinal,JH-3 (B3d)]。环丙沙星治疗组和预防组小鼠均表现出较为轻微的病理变化,预防组效果最佳,治疗组小鼠肺脏出现局部充血和炎性细胞浸润,肠腔肠粘膜局部脱落[图 4,Lung,Spleen,Intestinal,CPFX (B3d)和(P3d)],结果表明预防性给药JH-3能够有效缓解CVCC541对小鼠脏器不同程度的损伤。
3 讨论沙门氏菌是重要的人畜共患传染病原菌,其感染是引起世界性胃肠疾病的主要因素[1],近年来,由于传统抗生素的不合理使用,造成多种细菌耐药和药物残留问题日渐突出,对人类健康造成了极大的威胁[11]。在寻找传统抗生素替代品的过程中,抗菌肽以其分布广、不易产生耐药性、药物残留少等优点而受到广泛关注[12]。本实验室前期研究发现JH-3对沙门氏菌标准菌株CVCC541具有很好的杀菌作用,并获得其最小抑菌浓度。本研究发现JH-3的预防治疗(B3d)效果较好,可显著保护小鼠免受致死剂量CVCC541的攻击,小鼠存活率高达100%,临床症状评分、血液和脏器荷菌数降低,小肠段病理变化减轻。本研究系统评价了抗菌肽JH-3不同给药时间对沙门氏菌感染的治疗效果,预防性给药的方式抗菌作用最佳,与环丙沙星治疗效果相当,为新型抗菌药物的研究提供参考。
针对沙门氏菌抗菌肽的研究成为新热点:抗菌肽Bac7能够在体内和体外均具有抗S. typhimurium的活性,Benincasa等在BALB/c小鼠上研究发现Bac7体内注射(30 mg/kg)对小鼠具有非常低的毒性,另外可以有效抵抗致死剂量S. typhimurium感染[13]。人源抗菌肽LL-37能够抑制胶原蛋白的合成,降低真皮成纤维细胞纤维化反应。Yoo等证实LL-37能够通过活化MAPK信号通路抑制沙门氏菌感染结肠成纤维细胞,以及胶原蛋白的表达和合成,从而降低沙门氏菌感染引起的纤维素性结肠炎[14]。Dong等对S. typhimurium感染小鼠后用抗菌肽VRW3进行治疗,发现VRW3能够缓解小鼠腹膜炎的发生,降低S. typhimurium在小鼠体内定殖,提高小鼠存活率[15]。Wu等发现改造后的抗菌肽DP7对S. typhimurium的抗菌活性提高4-8倍,提示氨基酸残基的改变和修饰已成为一种有效提高抗菌肽活性的方法[16]。本研究中所用的抗菌肽JH-3也是通过对原始抗菌肽P3进行氨基酸修饰获得的新抗菌肽,其抗菌活性和抗菌谱均有所提高[7],丰富了沙门氏菌新型抗菌肽的研究。
抗菌肽功效的发挥与给药时间密切相关:艰难梭状芽胞杆菌(C. difficile)感染小鼠能够通过释放toxin A诱导小鼠产生肠炎,感染前1 d和感染后连续3 d结肠抗菌肽Cathelicidin给药,能够显著降低C. difficile对C57/BL6小鼠结肠的损伤,降低toxin A介导的肠道炎症[17]。感染前1 d和感染后连续6 d分别进行抗菌肽Coprisin饮水,能够缓解C. difficile引起的小鼠炎性腹泻和假膜性结肠炎[18]。昆虫肽Copa3提前1周连续饮水给药,能够有效预防C. difficile感染,促进结肠上皮细胞增殖,增强肠道黏膜屏障功能,改善肠道炎症[19]。在感染金黄色葡萄球菌(ATCC 25923)的CD1小鼠4 h后立即进行抗菌肽Peptoid 1的给药,能够显著降低病原菌在小鼠体内的定殖[20]。马源抗菌肽eCATH1在用于治疗小鼠感染马红球菌时,采用感染后1 d进行抗菌肽给药,连续给药7 d,治疗效果较好[21]。绿脓杆菌15159感染小鼠30 min和2 h后进行抗菌肽FFF21治疗,能够显著降低绿脓杆菌在小鼠脾脏、肾脏和肝脏的定殖,提高小鼠存活率[22]。本研究采用感染前3 d连续腹腔注射抗菌肽JH-3 (40 mg/kg)和感染后3 d连续注射JH-3 (40 mg/kg)进行治疗,发现40 mg/kg的JH-3能够显著降低S. typhimurium对小鼠肠道病理性损伤,预防组存活率达100%,较好于后期治疗组,进一步证实抗菌肽在使用过程中应尽早给药或者预防性给药效果较好,为抗菌肽的研发提供理论基础。
| [1] |
Herikstad H, Motarjemi Y, Tauxe RV. Salmonella surveillance: a global survey of public health serotyping[J]. Epidemiology and Infection, 2002, 129(1): 1-8. |
| [2] |
Amajoud N, Bouchrif B, Maadoudi ME, et al. Prevalence, serotype distribution, and antimicrobial resistance of Salmonella isolated from food products in Morocco[J]. Journal of Infection in Developing Countries, 2017, 11(2): 136-142. DOI:10.3855/jidc.8026 |
| [3] |
Fernandes SA, Camargo CH, Francisco GR, et al. Prevalence of extended-spectrum β-lactamases CTX-M-8 and CTX-M-2-producing Salmonella serotypes from clinical and nonhuman isolates in Brazil[J]. Microbial Drug Resistance, 2016, 23(5): 580-589. |
| [4] |
Martha I, Jared R, Karp BE, et al. Ceftriaxone-resistant nontyphoidal Salmonella from humans, retail meats, and food animals in the United States, 1996-2013[J]. Foodborne Pathogens and Disease, 2017, 14(2): 74-83. DOI:10.1089/fpd.2016.2180 |
| [5] |
Correia S, Nunes-Miranda JD, Pinto L, et al. Complete proteome of a quinolone-resistant Salmonella typhimurium phage type dT104B clinical strain[J]. International Journal of Molecular Sciences, 2014, 15(8): 14191-14219. DOI:10.3390/ijms150814191 |
| [6] |
Hu JH, Xu ML, Hang BL, et al. Isolation and characterization of an antimicrobial peptide from bovine hemoglobin α-subunit[J]. World Journal of Microbiology and Biotechnology, 2011, 27(4): 767-771. DOI:10.1007/s11274-010-0514-4 |
| [7] |
Zhang QZ, Xu YZ, Wang Q, et al. Potential of novel antimicrobial peptide P3 from bovine erythrocytes and its analogs to disrupt bacterial membranes in vitro and display activity against drug-resistant bacteria in a mouse model[J]. Antimicrobial Agents and Chemotherapy, 2015, 59(5): 2835-2841. DOI:10.1128/AAC.04932-14 |
| [8] |
Zhang QH. Screening of analog JH-3 and antimicrobial action of P3[D]. Xinxiang: Master's Thesis of Henan Institute of Science and Technology, 2015 (in Chinese) 张庆华. 抗菌肽P3类似物JH-3的筛选及抗菌作用研究[D]. 新乡: 河南科技学院硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10467-1015562734.htm |
| [9] |
Özkaya H, Akcan AB, Aydemir G, et al. Salmonella typhimurium infections in BALB/c mice: a comparison of tissue bioluminescence, tissue cultures and mice clinical scores[J]. New Microbiologica, 2012, 35(1): 53-59. |
| [10] |
Chen YJ, Chen A, Wang CJ, et al. Effect of antimicrobial compounds of Kluyveromyces marxianus in Koumiss on immune function and caecal microflora in mice challenged with pathogenic Escherichia coli O8[J]. Microbiology China, 2015, 42(12): 2386-2395. 陈玉洁, 敖日格乐, 王纯洁, 等. 酸马奶提取Kluyveromyces marxianus代谢抗菌复合物对感染致病性Escherichia coli O8小鼠的免疫机能及其盲肠菌群的影响[J]. 微生物学通报, 2015, 42(12): 2386-2395. |
| [11] |
Penesyan A, Gillings M, Paulsen IT. Antibiotic discovery: combatting bacterial resistance in cells and in biofilm communities[J]. Molecules, 2015, 20(4): 5286-5298. DOI:10.3390/molecules20045286 |
| [12] |
Brown KL, Poon GFT, Birkenhead D, et al. Host defense peptide LL-37 selectively reduces proinflammatory macrophage responses[J]. The Journal of Immunology, 2011, 186(9): 5497-5505. DOI:10.4049/jimmunol.1002508 |
| [13] |
Benincasa M, Pelillo C, Zorzet S, et al. The proline-rich peptide Bac7(1-35) reduces mortality from Salmonella typhimurium in a mouse model of infection[J]. BMC Microbiology, 2010, 10: 178. DOI:10.1186/1471-2180-10-178 |
| [14] |
Yoo JH, Ho S, Tran DH, et al. Anti-fibrogenic effects of the anti-microbial peptide cathelicidin in murine colitis-associated fibrosis[J]. Cellular and Molecular Gastroenterology and Hepatology, 2015, 1(1): 55-74. DOI:10.1016/j.jcmgh.2014.08.001 |
| [15] |
Dong N, Ma QQ, Shan AS, et al. Strand length-dependent antimicrobial activity and membrane-active mechanism of arginine-and valine-rich β-Hairpin-like antimicrobial peptides[J]. Antimicrobial Agents and Chemotherapy, 2012, 56(6): 2994-3003. DOI:10.1128/AAC.06327-11 |
| [16] |
Wu XZ, Wang ZL, Li XL, et al. In vitro and in vivo activities of antimicrobial peptides developed using an amino acid-based activity prediction method[J]. Antimicrobial Agents and Chemotherapy, 2014, 58(9): 5342-5349. DOI:10.1128/AAC.02823-14 |
| [17] |
Hing TC, Ho S, Shih DQ, et al. The antimicrobial peptide cathelicidin modulates Clostridium difficile-associated colitis and toxin A-mediated enteritis in mice[J]. Gut, 2013, 62(9): 1295-1305. DOI:10.1136/gutjnl-2012-302180 |
| [18] |
Kang JK, Hwang JS, Nam HJ, et al. The insect peptide coprisin prevents clostridium difficile-mediated acute inflammation and mucosal damage through selective antimicrobial activity[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(10): 4850-4857. DOI:10.1128/AAC.00177-11 |
| [19] |
Kim DH, Hwang JS, Lee IH, et al. The insect peptide CopA3 increases colonic epithelial cell proliferation and mucosal barrier function to prevent inflammatory responses in the gut[J]. Journal of Biological Chemistry, 2016, 291(7): 3209-3223. DOI:10.1074/jbc.M115.682856 |
| [20] |
Czyzewski AM, Jenssen H, Fjell CD, et al. In vivo, in vitro, and in silico characterization of peptoids as antimicrobial agents[J]. PLoS One, 2016, 11: e0135961. DOI:10.1371/journal.pone.0135961 |
| [21] |
Schlusselhuber M, Torelli R, Martini C, et al. The equine antimicrobial peptide eCATH1 is effective against the facultative intracellular pathogen Rhodococcus equi in mice[J]. Antimicrobial Agents and Chemotherapy, 2013, 57(10): 4615-4621. DOI:10.1128/AAC.02044-12 |
| [22] |
Papareddy P, Kalle M, Bhongir RKV, et al. Antimicrobial effects of helix D-derived peptides of human antithrombin Ⅲ[J]. Journal of Biological Chemistry, 2014, 289(43): 29790-29800. DOI:10.1074/jbc.M114.570465 |
 2017, Vol. 44
2017, Vol. 44