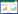扩展功能
文章信息
- 李汉雄, 刘瑞宁, 张芳, 朱杰, 侯桂先, 陈颖钰, 陈建国, 郭爱珍
- LI Han-Xiong, LIU Rui-Ning, ZHANG Fang, ZHU Jie, HOU Gui-Xian, CHEN Ying-Yu, CHEN Jian-Guo, GUO Ai-Zhen
- 重组病毒BoHV-1 gG−/tk−/gD+和BoHV-1 gG−/tk−/gD5+的兔体内安全性和免疫原性
- Safety, immunogenicity of BoHV-1 gG−/tk−/gD+ and BoHV-1 gG−/tk−/gD5+ in rabbits
- 微生物学通报, 2017, 44(12): 2967-2980
- Microbiology China, 2017, 44(12): 2967-2980
- DOI: 10.13344/j.microbiol.china.170534
-
文章历史
- 收稿日期: 2017-07-14
- 接受日期: 2017-11-16
- 优先数字出版日期(www.cnki.net): 2017-11-16
2. 华中农业大学动物医学院 湖北 武汉 430070
2. College of Veterinary Medicine, Huazhong Agricultural University, Wuhan, Hubei 430070, China
牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV),又称牛疱疹病毒Ⅰ型(Bovine herpesvirus-1,BoHV-1),只有一种血清型。使用限制性内切酶分析,该病毒可分为1.1、1.2a和1.2b等3种基因型。BoHV-1感染牛后可引起牛传染性鼻气管炎(Infectious bovine rhinotracheitis,IBR),该病是以高热、上呼吸道黏膜炎症为主要特征的一种急热性、接触性传染病[1]。同时,BoHV-1是牛呼吸疾病综合征(Bovine respiratory disease complex,BRDC)重要的病原之一,感染牛后可潜伏在三叉神经,不定期激活。1956年Madin等首次从患病牛中分离出BoHV-1[2],1964年Huck等确认BoHV-1属于疱疹病毒[3]。随后,世界上许多国家和地区从事BoHV-1研究的学者均有相关报道,并从病牛的不同组织如流产胎儿、眼结膜和大脑等分离到了BoHV-1。BoHV-1主要对牛群肥育率、产奶量和繁殖带来极大的影响,给世界养牛业造成巨大的经济损失,仅美国每年就可造成30亿美元的经济损失[4]。
牛疱疹病毒5型(Bovine herpesvirus-5,BoHV-5),曾称BoHV-1.3,后更名为BoHV-5,感染牛后主要引起脑炎,初次感染后可建立潜伏感染[5]。BoHV-5具有神经毒性,神经症状严重时可引起死亡[6]。BoHV-1和BoHV-5具有一定的血清学交叉反应,发生BoHV-5感染的国家通常使用BoHV-1疫苗进行预防,但BoHV-1疫苗对BoHV-5感染的交叉保护力有待提高[6]。目前我国尚无BoHV-5感染的报道,但由于近年来进口牛贸易非常活跃,因此需防患于未然。
目前,已有奥地利、挪威、丹麦、德国、芬兰和瑞士等几个国家通过禁止疫苗接种、捕杀血清阳性牛、控制移动等综合措施根除了此病,但采取捕杀血清阳性牛的方法耗资巨大,只能应用于阳性率较低的国家或地区。因此,在一些阳性率较高的国家或地区则采用疫苗接种等防控策略[7]。基因缺失疫苗具有接种标识,可区分野毒感染和疫苗接种,因此已成为IBR根除计划中重要的疫苗。缺失标记主要针对病毒的毒力基因和非必需的免疫原性基因。
BoHV-1能编码产生12个包膜蛋白,其中有10种糖蛋白(gB、gC、gD、gE、gG、gH、gI、gL、gM和gK),另外2种包膜蛋白gN和Us9没有被糖基化修饰。这12种包膜蛋白中,仅gB、gD、gH、gL和gK 5种蛋白为病毒生长所必需的,其余7种蛋白虽然在病毒侵袭、生长和致病方面发挥作用,但均属于生长非必需蛋白,成为候选的标记分子[8-9]。目前应用较广泛的标识基因有gE[10-11]、gG[12-13]、tk[14]等。gD基因为BoHV-1体外增殖必需基因,与其他几种相关糖蛋白相比,针对糖蛋白gD产生的抗体对病毒中和效果最好[15]。在牛和鼠上的免疫实验证明,糖蛋白gD能够引起比gB、gC更强并且更持久的细胞免疫[16]。
本实验室前期通过对BoHV-1 gG和tk基因进行缺失,使其致病和潜伏感染的能力减弱,牛体实验证明,BoHV-1 gG-/tk-基因缺失株可以产生良好的免疫保护力[17]。为进一步提高其免疫原性和对BoHV-5的交叉保护力,分别将两型病毒糖蛋白gD的胞外区序列分别插入BoHV-1 gG-/tk-的tk位置,成功构建了重组病毒BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+。本研究的目的在于评估BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+在兔体内的安全性和免疫原性,并确定重组病毒对BoHV-5感染的交叉保护力。
1 材料与方法 1.1 实验材料 1.1.1 病毒毒株、细胞和实验动物: 重组病毒BoHV-1 gG-/tk-/gD5+和BoHV-1 gG-/tk-/gD+、基因缺失毒株BoHV-1 gG-/tk-、wt BoHV-1 (GenBank登录号:AJ004801)、wt BoHV-5 (GenBank登录号:AY261359)均由本实验室保存。BoHV-1 gG-/tk-中tk基因为部分缺失,基因位置为63 260-64 339 nt (1 080 bp),其中的缺失区域为63 441-64 073 nt,共633 bp;BoHV-1 gG-/tk-中gG基因为全基因缺失,基因位置为117 337-118 671 nt (1 335 bp),缺失区域为117 337-118 671 nt,共1 335 bp;BoHV-1 gG-/tk-/gD+中gD基因为wt BoHV-1 gD胞外区序列,基因位置为118 896-120 149 nt (1 254 bp),扩增区域为118 896-119 975 nt,共1 080 bp;BoHV-1 gG-/tk-/gD5+中gD5基因为wt BoHV-5 gD胞外区序列,基因位置为121 129-122 382 nt (1 254 bp),扩增区域为121 129-122 208 nt,共1 080 bp。BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+中的gD基因位于重组病毒的tk位置63 441-64 073 nt。牛肾细胞系MDBK,由本实验室保存。
体重1.5 kg左右的雌性SPF级日本大耳白兔30只,购自湖北省实验动物研究中心。实验地点为华中农业大学实验动物中心,华中农业大学伦理道德委员会批准号为HZAUBO-2015-005。
1.1.2 主要试剂和仪器: DNA Marker、PrimeSTAR HS DNA聚合酶、dNTP Mixture和5×PrimeSTAR Buffer,中国宝生物工程(大连)有限公司;羊抗兔IgG HRP,美国Southern Biotech公司;牛传染性鼻气管炎标准阴阳性血清,中国兽医药品监察所;低熔点琼脂糖,美国Amresco公司;新生牛血清,中国杭州四季青生物工程材料有限公司;胎牛血清和伴刀豆凝集素A (Concanavalin A,Con A),美国Sigma-Aldrich公司;病毒DNA提取试剂盒,天根生化科技(北京)有限公司;BCA蛋白测定试剂盒,中国南京诺唯赞生物科技有限公司;人淋巴细胞分离管,达科为生物技术股份有限公司;XTT细胞增殖检测试剂盒,Abnova公司。超净台、生物安全柜和细胞培养箱,北京东联哈尔仪器制造有限公司;PCR扩增仪,北京东胜创新生物科技有限公司;超纯水仪,密理博中国有限公司;凝胶成像系统,美国ProteinSimple公司;离心机,艾本德中国有限公司;超速离心机,美国贝克曼库尔特有限公司;电泳仪,北京六一生物科技有限公司;酶标仪,瑞士Tecan公司。
1.2 动物实验方法 1.2.1 接种和攻毒: 将30只日本大耳白兔随机分成6组,其中接种和攻毒途径均是鼻腔接种,具体方案如表 1所示。| 组别 Groups |
接种材料 Inoculative material |
数量 Number |
剂量 Dose (PFU) |
攻毒材料 Challenging material |
数量 Number |
剂量 Dose (PFU) |
| 1 | BoHV-1 gG-/tk-/gD+ | 6 | 4×107 | wt BoHV-1 | 3 | 4×107 |
| wt BoHV-5 | 3 | 4×107 | ||||
| 2 | BoHV-1 gG-/tk-/gD5+ | 6 | 4×107 | wt BoHV-1 | 3 | 4×107 |
| wt BoHV-5 | 3 | 4×107 | ||||
| 3 | BoHV-1 gG-/tk- | 6 | 4×107 | wt BoHV-1 | 3 | 4×107 |
| wt BoHV-5 | 3 | 4×107 | ||||
| 4 | wt BoHV-1 | 3 | 4×107 | - | - | - |
| 5 | DMEM (阴性对照) | 6 | - | wt BoHV-1 | 3 | 4×107 |
| wt BoHV-5 | 3 | 4×107 | ||||
| 6 | DMEM (空白对照) | 3 | - | DMEM | 3 | - |
| 注:兔子在免疫后28 d进行攻毒. Note: The rabbits were challenged at the 28th day after vaccination. |
||||||
| 引物名称 Primer |
引物序列来源 Source |
引物序列 Sequence (5′→3′) |
GenBank登录号 GenBank accession No. |
引物在基因组中的位置 Location of primer (nt) |
基因在基因组中的位置 Location of gene (nt) |
缺失区域 Location of deleted gene (nt) |
| BoHV-1gG 引物 BoHV-1 gG primer |
BoHV-1 gG上下游序列 |
P1: CCGACCGCCTCCTACACCAGATGCT | AJ004801 | 117 102-117 126 | 117 337-118 671 | 117 337-118 671 |
| P2: GGGTGTAGGCAAGCTCACCGCAACG | AJ004801 | 118 937-118 961 | ||||
| BoHV-1 tk引物 BoHV-1 tk primer |
BoHV-1 tk未缺失部分 |
P3: ACGGGCTGGGAAAGACAACAACGG | AJ004801 | 63 315-63 338 | 63 260-64 339 | 63 441-64 073 |
| P4: GCGGACACGTCCAGCACGAACA | AJ004801 | 64 161-64 182 |
取组织盲传产物,使用病毒DNA提取试剂盒提取DNA,操作步骤按照试剂盒说明书进行,DNA提取后进行PCR鉴定。PCR阳性对照为BoHV-1 gG-/tk-;阴性对照为ddH2O。PCR反应体系为:模板2.0 μL,5×Prime STAR buffer (Mg2+ plus) 5 μL,dNTP mixture (各2.5 mmol/L) 2 μL,上下游引物(10 mmol/L)各0.5 μL,PrimeSTAR HS DNA Polymerase (2.5 U/μL) 0.25 μL,加ddH2O至25 μL。PCR反应条件为:95 ℃ 5 min;94 ℃ 1 min,60 ℃ 45 s,72 ℃ 3.5 min,35个循环;72 ℃ 10 min,16 ℃ 20 min。PCR结束后进行1%琼脂糖凝胶电泳鉴定。
1.3.4 兔肺组织石蜡包埋切片制备方法: 攻毒21 d后剖杀兔体取肺,4%多聚甲醛固定24 h以上。将目的部位组织修平整,放于脱水盒内,75%酒精4 h,85%酒精2 h,90%酒精2 h,95%酒精1 h,无水乙醇Ⅰ 30 min,无水乙醇Ⅱ 30 min,醇苯5-10 min,二甲苯Ⅰ 5-10 min,二甲苯Ⅱ 5-10 min,蜡Ⅰ 1 h,蜡Ⅱ 1h,蜡Ⅲ 1 h。将融化的蜡放入包埋框,待蜡凝固之前将组织从脱水盒内取出按照包埋面的要求放入包埋框并贴上对应的标签。于-20 ℃冷冻台冷却,蜡凝固后将蜡块从包埋框中取出并修整蜡块。将修整好的蜡块置于石蜡切片机上切片,片厚4 µm。切片漂浮于摊片机40 ℃温水上将组织展平,用载玻片将组织捞起,并放进60 ℃烘箱内烤片。待水烤干、蜡烤化后取出常温保存备用。 1.3.5 鼻腔排毒检测: 从-80 ℃中取出鼻拭子,冻融2次后,5 000 r/min离心3 min取上清,按比例稀释接种至MDBK细胞孵育2 h。弃病毒液,2%低熔点琼脂糖和2×DMEM (1:1)混合液覆盖,待混合液凝固后,在CO2培养箱中培养48 h,甲醛固定2 h。弃去孔中覆盖物和甲醛,结晶紫染色0.5 h,对病毒空斑进行计数。 1.3.6 中和抗体的检测: 采用常规微量细胞病变法检测血清中病毒中和抗体[18],其中中和实验所用病毒为wt BoHV-1或wt BoHV-5,细胞为MDBK。优化实验条件,设置细胞对照:每孔加细胞悬液100 µL,稀释液100 µL,共4孔;病毒回归对照:配置100、10、1、0 TCID50/50 µL病毒悬液,每个稀释度接种2孔,每孔加入病毒悬液50 µL,细胞悬液100 µL,稀释液50 µL;阳(阴)性对照:每孔加牛传染性鼻气管炎标准阳(阴)性血清和100 TCID50/50 µL病毒悬液各50 µL,细胞悬液100 µL,共4孔;血清毒性对照:每个梯度的血清设1孔,每孔加同稀释度血清50 µL、稀释液50 µL和细胞悬液100 µL。在各项对照均成立的条件下,按照Reed-Muench法计算被检血清中和抗体效价,以能抑制50%细胞发生病变的血清最高稀释度为该血清的中和抗体效价。 1.3.7 间接ELISA检测BoHV抗体: 参考间接ELISA建立程序[19],通过条件优化,确定用于本研究的检测条件如下:通过方阵滴定法测得wt BoHV-1和wt BoHV-5最佳包被浓度分别为3.2 ng/孔和1.6 ng/孔,一抗最佳稀释度为1:400,孵育时间为1 h,二抗稀释度为1:20 000;使用包被液稀释病毒粒子,100 µL/孔,4 ℃过夜,洗涤液洗3次×3 min;加5%脱脂奶封闭,200 µL/孔,37 ℃封闭1 h,弃封闭液,洗涤同上;加稀释好的待检测血清,同时设空白对照,100 µL/孔,37 ℃放置1 h,洗涤同上;加入1:20 000倍稀释的二抗,100 µL/孔,37 ℃温育30 min,洗涤同上;加入TMB底物A和B,每孔各50 µL,避光显色10 min,加终止液50 µL/孔,630 nm波长下测定OD630值。 1.3.8 外周血单核细胞增殖水平的检测: 使用人淋巴细胞分离管对全血进行PBMCs分离,按照BCA蛋白测定试剂盒说明书进行灭活wt BoHV-1病毒粒子浓度的测定。将wt BoHV-1病毒粒子加入96孔板进行抗原刺激,使每孔病毒粒子的浓度为20 µL/mL,同时设置阳性对照:每孔浓度为1 µg/mL的Con A,阴性对照:RPMI-1640培养基,抗原刺激、阳性对照及阴性对照均做2个重复,之后将96孔板放置37 ℃培养箱(5% CO2)培养72 h[20]。培养72 h后使用XTT细胞增殖检测试剂盒对刺激后的96孔板PBMCs进行检测。 1.4 统计学分析方法数据统计学分析使用GrapHpad prism 5.0软件包中的方差分析程序(Two-Way ANOVA等)分析。其中:P > 0.05表示差异不显著,P < 0.05表示差异显著(*),P < 0.01(**)和P < 0.001(***)表示差异极显著。
2 结果与分析 2.1 重组病毒形态观察为了研究重组病毒的病毒形态是否正常,将病毒样本进行了负染和电镜观察,结果显示,重组病毒BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+、亲本病毒BoHV-1 gG-/tk-和wt BoHV-1的病毒粒子均呈球形,部分病毒粒子有囊膜,形态不一,被膜和囊膜之间有无定形材料,部分病毒粒子的核衣壳可清晰观察到正六边形结构,病毒粒子的大小均在165 nm左右,均符合BoHV-1病毒粒子的基本特征(图 1)。
|
| 图 1 负染病毒粒子的透射电子显微镜观察 Figure 1 Observation of recombinant viral particles with transmission electron microscope after negative staining 注:A:BoHV-1 gG-/tk-/gD+;B:BoHV-1 gG-/tk-/gD5+;C:BoHV-1 gG-/tk-;D:wt BoHV-1.其中红色箭头指的是囊膜完整的病毒粒子,蓝色箭头指的是没有囊膜或是囊膜不完整的病毒粒子. Bar=200 nm. Note: A: BoHV-1 gG-/tk-/gD+; B: BoHV-1 gG-/tk-/gD5+; C: BoHV-1 gG-/tk-; D: wt BoHV-1. The red arrow refers to intact envelope of the virus particles; The blue arrow refers to no envelope or incomplete envelope of the virus particles. Bar=200 nm. |
|
|
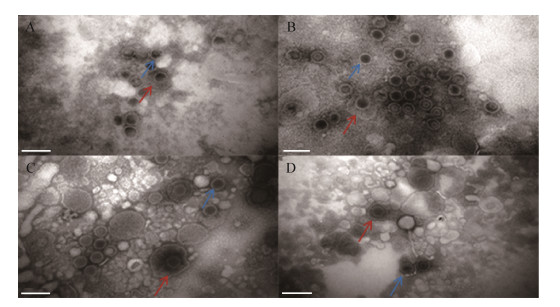
兔体接种重组病毒后,wt BoHV-1攻毒对照组在第8天体温为38.8 ℃,低于兔群体温平均值0.5 ℃以上,其余各时间点各组兔体体温均在群体平均值0.5 ℃上下限值内,体温波动不显著(P > 0.05) (图 2)。接种BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+后无明显的其他临床症状,采食和饮水正常;接种BoHV-1 gG-/tk-后有一只兔体分别在接种后第3天、第5天和第7天鼻腔有白色或淡黄色分泌物,采食和饮水正常,精神状态正常。
|
| 图 2 兔接种后的体温变化 Figure 2 Rectal temperature changes in rabbits after infection |
|
|
接种后对6组兔第1–9天的鼻拭子进行毒价测定,6组兔体鼻拭子样本均未检测到排毒。
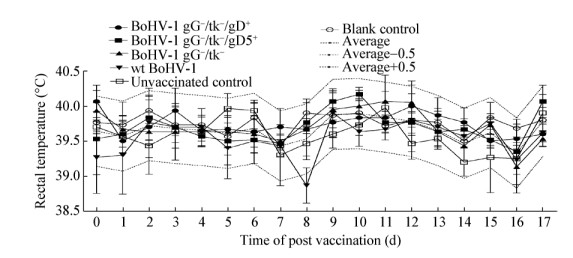
2.3 重组毒免疫抵抗野毒感染能力研究 2.3.1 抵抗同型病毒wt BoHV-1感染: 攻击wt BoHV-1后,BoHV-1 gG-/tk-/gD5+接种组在第2、20和21天体温分别为39.0、39.0和38.9 ℃,低于兔群体温平均值0.5 ℃以上,BoHV-1 gG-/tk-/gD+接种组在第9天体温为40.5 ℃,高于兔群体温平均值0.5 ℃以上,其余时间点各组兔体体温均在群体平均值0.5 ℃上下限值内,体温波动不显著(P > 0.05) (图 3)。攻毒后,各组的临床症状主要包括体温升高、流鼻涕等(表 3)。整体说来,与未免疫攻毒组相比,重组病毒免疫攻毒组症状轻微,BoHV-1 gG-/tk-/gD+、BoHV-1 gG-/tk-/gD5+和BoHV-1 gG-/tk- 3种病毒免疫攻毒后出现临床症状的总时间分别为4、10和8 d,说明双拷贝同源gD的免疫效果高于异源gD。攻击wt BoHV-1后在6组兔均未检测到有鼻腔排毒现象。兔体剖杀后6组兔的心、肝、脾、肺、肾、脑和三叉神经节进行PCR鉴定,结果均未检测到病毒。
|
| 图 3 兔体野毒wt BoHV-1攻毒后的体温变化曲线 Figure 3 Rectal temperature changes in rabbits after challenge with wt BoHV-1 注:攻毒当天为第0天,结果显示各组体温差异不显著(P > 0.05). Note: The day of virus challenge was 0 d. The difference of body temperature in each group was not significant (P > 0.05). |
|
|
| 组别 Groups |
编号 Serial number |
临床症状出现时间 Time of clinical sign occurrence (d) |
临床症状持续时间 Clinical sign duration (d) |
| BoHV-1 gG-/tk-/gD+接种组 BoHV-1 gG-/tk-/gD+ vaccination group |
1 | 12 | 4 |
| 2 | 0 | 0 | |
| 3 | 0 | 0 | |
| BoHV-1 gG-/tk-/gD5+接种组 BoHV-1 gG-/tk-/gD5+ vaccination group |
1 | 5 | 9 |
| 2 | 17 | 1 | |
| 3 | 0 | 0 | |
| BoHV-1 gG-/tk-接种组 BoHV-1 gG-/tk- vaccination group |
1 | 14 | 4 |
| 2 | 17 | 4 | |
| 3 | 0 | 0 | |
| 未免疫攻毒组 DMEM gourp |
1 | 2 | 4 |
| 2 | 7 | 3 | |
| 3 | 0 | 0 | |
| 空白对照组 Blank control group |
1 | 0 | 0 |
| 2 | 0 | 0 | |
| 3 | 0 | 0 |
在wt BoHV-1攻毒21 d后,将兔体剖杀后取其肺脏组织进行甲醛固定,并作组织病理学观察。结果显示,BoHV-1 gG-/tk-/gD+接种组肺泡结构几乎保持完整,肺泡壁基本没有受到破坏,肺泡无淋巴样细胞(图 4A)。BoHV-1 gG-/tk-/gD5+接种组和BoHV-1 gG-/tk-接种组肺泡结构有轻微的破坏,肺泡壁略微增厚(图 4B和4C)。未接种重组病毒的攻毒组的正常肺泡结构已经消失,有大量坏死的细胞和炎性细胞在肺泡腔内(图 4D)。正常对照组肺泡结构保持完整,肺泡无淋巴样细胞(图 4E)。

|
| 图 4 野毒wt BoHV-1攻毒后肺脏组织的病理学观察(苏木素-伊红染色) Figure 4 Histopathological examination of lungs after challenge with wtBoHV-1 (HE stain) 注:A:BoHV-1 gG-/tk-/gD+接种组;B: BoHV-1 gG-/tk-/gD5+接种组;C:BoHV-1 gG-/tk-接种组;D:未接种疫苗的攻毒组;E:空白对照组.染色结果:细胞核蓝色,细胞质红色. Note: A: BoHV-1 gG-/tk-/gD+ vaccination group; B: BoHV-1 gG-/tk-/gD5+ vaccination group; C: BoHV-1 gG-/tk- vaccination group; D: DMEM group; E: Blank control group. Dyeing results: Nucleus was blue, cytoplasm was red. |
|
|
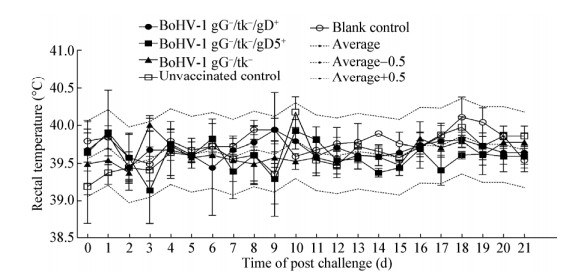
|
| 图 5 野毒wt BoHV-5攻毒后的体温变化曲线 Figure 5 Rectal temperature changes in rabbits after challenge with wt BoHV-5 注:攻毒当天为第0天,结果显示各组体温差异不显著(P > 0.05). Note: The day of virus challenge was 0 d. The difference of body temperature in each group was not significant (P > 0.05). |
|
|
| 组别 Groups |
编号 Serial number |
临床症状出现时间 Time of clinical sign occurrence (d) |
临床症状持续时间 Clinical sign duration (d) |
| BoHV-1 gG-/tk-/gD+接种组 BoHV-1 gG-/tk-/gD+ vaccination group |
1 | 9 | 1 |
| 2 | 0 | 0 | |
| 3 | 0 | 0 | |
| BoHV-1 gG-/tk-/gD5+接种组 BoHV-1 gG-/tk-/gD5+ vaccination group |
1 | 0 | 0 |
| 2 | 0 | 0 | |
| 3 | 0 | 0 | |
| BoHV-1 gG-/tk-接种组 BoHV-1 gG-/tk- vaccination group |
1 | 7 | 5 |
| 2 | 7 | 9 | |
| 3 | 0 | 0 | |
| 未免疫攻毒组 DMEM gourp |
1 | 3 | 6 |
| 2 | 1 | 10 | |
| 3 | 0 | 0 | |
| 空白对照组 Blank control group |
1 | 0 | 0 |
| 2 | 0 | 0 | |
| 3 | 0 | 0 |
wt BoHV-5攻毒21 d后,将兔体剖杀后取其肺脏组织进行甲醛固定,并做组织病理学观察。结果显示,BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+接种组肺泡结构完整,肺泡壁略微增厚(图 6A和6B)。BoHV-1 gG-/tk-接种组肺泡结构破坏较为严重,肺泡壁较厚,肺泡融合区较大(图 6B和6C)。未接种重组病毒的wt BoHV-5攻毒组的正常肺泡壁严重增厚,肺泡结构破坏明显(图 6D)。空白对照组肺泡结构完整,肺泡壁薄,呈单细胞层,无淋巴样细胞浸润(图 6E)。
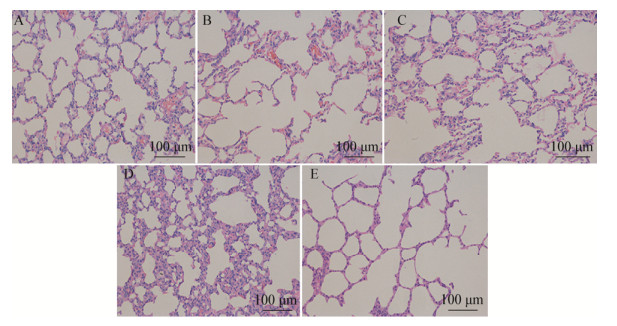
|
| 图 6 野毒wt BoHV-5攻毒后肺脏组织的病理学观察(苏木素-伊红染色) Figure 6 Histopathological examination of of lungs after challenge with wtBoHV-5 (HE stain) 注:A:BoHV-1 gG-/tk-/gD+接种组;B: BoHV-1 gG-/tk-/gD5+接种组;C:BoHV-1 gG-/tk-接种组;D:未接种疫苗的攻毒组;E:空白对照组.染色结果:细胞核蓝色,细胞质红色. Note: A: BoHV-1 gG-/tk-/gD+ vaccination group; B: BoHV-1 gG-/tk-/gD5+ vaccination group; C: BoHV-1 gG-/tk- vaccination group; D: DMEM group; E: Blank control group. Dyeing results: Nucleus was blue, cytoplasm was red. |
|
|
将研磨后的组织接种MDBK,盲传2次,BoHV-1 gG-/tk-接种组有一只兔体在肺部分离到病毒,如图 7泳道6所示,使用BoHV-1 gG鉴定引物(P1/P2)对其进行鉴定,该细胞盲传产物扩增到一条524 bp大小的特异性病毒条带,与阳性对照BoHV-1 gG-/tk-结果相符。
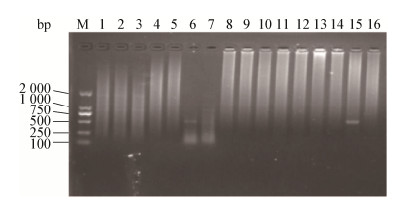
|
| 图 7 PCR检测兔肺组织盲传产物的病毒核酸 Figure 7 Detection of viral nucleic acid in blind passage culture of rabbit lung tissues with PCR 注:M:DL2000 marker;1-3:BoHV-1 gG-/tk-/gD+接种组肺组织盲传样本;4-6:BoHV-1 gG-/tk-接种组肺组织盲传样本;7-9:BoHV-1 gG-/tk-/gD5+接种组肺组织盲传样本;10-12:未接种疫苗攻毒组肺组织盲传样本;13-14:空白对照组肺组织盲传样本;15:阳性对照BoHV-1 gG-/tk-;16:ddH2O. Note: M: DL2000 marker; 1-3: BoHV-1 gG-/tk-/gD+ vaccination group blind passage culture of lung tissues; 4-6: BoHV-1 gG-/tk- vaccination group blind passage culture of lung tissues; 7-9: BoHV-1 gG-/tk-/gD5+ vaccination group blind passage culture of lung tissues; 10-12: DMEM group blind passage culture of lung tissues; 13-14: Blank control group blind passage culture of lung tissues; 15: Positive control BoHV-1 gG-/tk-; 16: ddH2O. |
|
|
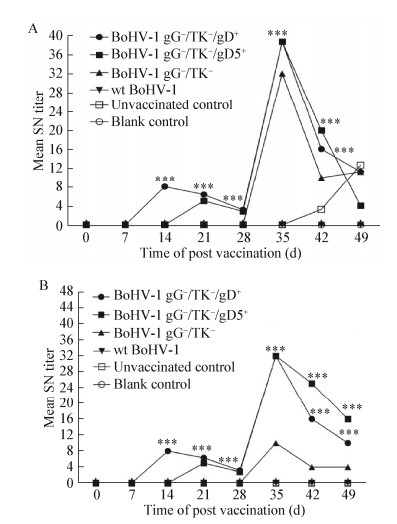
|
| 图 8 兔体中和抗体水平 Figure 8 Neutralization antibody levels in the rabbits 注:A:兔体接种28 d后攻击wt BoHV-1;B:兔体接种28 d后攻击wt BoHV-5.接种后,BoHV-1 gG-/tk-/gD+接种组和BoHV-1 gG-/tk-/gD5+接种组比BoHV-1 gG-/tk-接种组可较早地检测到中和抗体,且差异显著(P < 0.001);攻击BoHV-1和BoHV-5后,各组中和抗体水平保持差异显著(P < 0.001). Note: A: Rabbits were challenged with wt BoHV-1 at the 28th day after vaccination; B: Rabbits were challenged with wt BoHV-5 at the 28th day after vaccination. Neutralizing antibodies were detected earlier in BoHV-1 gG-/tk-/gD+ and BoHV-1 gG-/tk-/gD5+ vaccination group than BoHV-1 gG-/tk- after vaccination (P < 0.001). The level of neutralizing antibody in each group remained significantly different after BoHV-1 or BoHV-5 challenge (P < 0.001). |
|
|
攻击wt BoHV-1后,BoHV-1 gG-/tk-/gD+、BoHV-1 gG-/tk-/gD5+和BoHV-1 gG-/tk-接种组的BoHV-1特异性抗体平均OD630值最高达到0.793 5、0.717 8和0.697 7,差异不显著(P > 0.05)。攻击wt BoHV-5后,BoHV-1 gG-/tk-/gD+、BoHV-1 gG-/tk-/gD5+和BoHV-1 gG-/tk-接种组的BoHV-5特异性抗体平均OD630值最高达到1.368 0、1.038 0和0.949 0。BoHV-1 gG-/tk-/gD+接种组的BoHV-5特异性抗体水平呈上升趋势,显著高于BoHV-1 gG-/tk-/gD5+和BoHV-1 gG-/tk-接种组(P < 0.001) (图 9)。
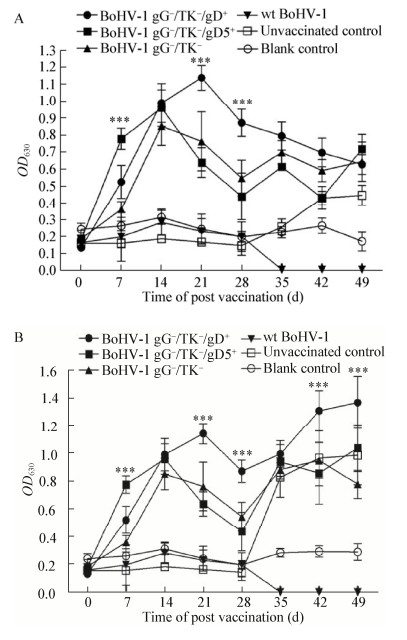
|
| 图 9 ELISA检测兔体抗BoHV-1和抗BoHV-5抗体水平 Figure 9 Anti-BoHV-1 and Anti-BoHV-5 antibody levels in rabbits detected with ELISA 注:A:兔体接种28 d后攻击wt BoHV-1;B:兔体接种28 d后攻击wt BoHV-5.结果显示,接种后BoHV-1 gG-/tk-/gD+接种组和BoHV-1 gG-/tk-/gD5+接种组产生的BoHV-1抗体显著高于BoHV-1 gG-/tk-接种组(P < 0.001);攻击BoHV-5后,BoHV-1 gG-/tk-/gD+接种组的BoHV-5抗体显著高于BoHV-1 gG-/tk-接种组(P < 0.001). Note: A: Rabbits were challenged with wt BoHV-1 at the 28th day after vaccination; B: Rabbits were challenged with wt BoHV-5 at the 28th day after vaccination. The result showed that BoHV-1 antibodies produced by BoHV-1 gG-/tk-/gD+ and BoHV-1 gG-/tk-/gD5+ vaccination group were significantly higher than BoHV-1 gG-/tk- after vaccination (P < 0.001). After BoHV-5 challenge, BoHV-5 antibodies in BoHV-1 gG-/tk-/gD+ vaccination group were significantly higher than BoHV-1 gG-/tk- (P < 0.001). |
|
|
攻击wt BoHV-1后第14天,BoHV-1 gG-/tk-/gD+、BoHV-1 gG-/tk-/gD5+和BoHV-1 gG-/tk-接种组的外周血单核细胞增殖水平平均OD630值分别为0.67、0.77和0.24,BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+接种组显著高于BoHV-1 gG-/tk-接种组(P < 0.001);攻击wtBoHV-5后BoHV-1 gG-/tk-/gD+、BoHV-1 gG-/tk-/gD5+和BoHV-1 gG-/tk-接种组的外周血单核细胞增殖水平平均OD630值最高分别为0.53、0.60和0.12,BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+在攻毒后第14天和第21天均显著高于BoHV-1 gG-/tk-接种组(P < 0.001) (图 10)。
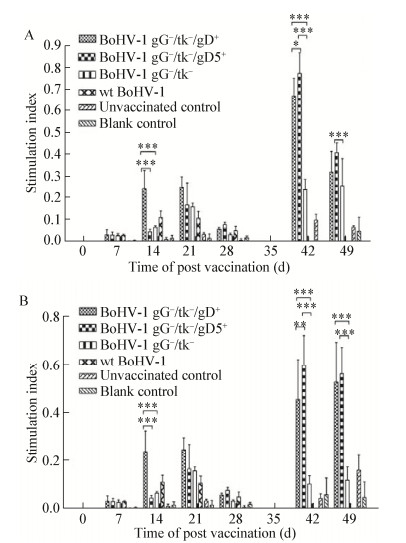
|
| 图 10 兔体外周血单核细胞的增殖水平 Figure 10 The stimulation index of PBMCs from rabbits after stimulation 注:A:兔体接种28 d后攻击wt BoHV-1;B:兔体接种28 d后攻击wt BoHV-5.结果显示,接种后BoHV-1 gG-/tk-/gD+接种组和BoHV-1 gG-/tk-/gD5+接种组淋巴细胞的增殖水平显著高于BoHV-1 gG-/tk-接种组(P < 0.001);攻击BoHV-1和BoHV-5后,各组淋巴细胞的增殖水平差异显著(P < 0.001). Note: A: Rabbits were challenged with wt BoHV-1 at the 28th day after vaccination; B: Rabbits were challenged with wt BoHV-5 at the 28th day after vaccination. The result showed that the level of lymphocyte proliferation in BoHV-1 gG-/tk-/gD+ and BoHV-1 gG-/tk-/gD5+ vaccination group was significantly higher than that in BoHV-1 gG-/tk- (P < 0.001). After challenge with BoHV-1 and BoHV-5, the difference of lymphocyte proliferation level in each group was significant (P < 0.001). |
|
|
gD是BoHV-1免疫原性最好的蛋白,能够诱导机体产生体液免疫和细胞免疫[21],因此许多研究者将其应用于BoHV-1疫苗的研究,其中包括DNA疫苗、亚单位疫苗和载体疫苗[22]。BoHV-1糖蛋白gD胞外区具有良好的免疫原性,不仅可为BoHV-1感染提供保护力[23],而且能为BoHV-5感染提供交叉保护力[6]。本研究基于前期构建的BoHV-1 gG-/tk-病毒,在重组病毒基因组中增加一拷贝BoHV-1或BoHV-5 gD基因,希望能提高病毒对同源1型和异源5型的免疫保护力。兔体试验基本证实了该假设。
3.1 双拷贝糖蛋白gD提高了重组病毒的免疫原性BoHV-1和BoHV-5的糖蛋白gD由大约417个氨基酸组成,其一致性为79.9%[24]。本实验结果表明,将免疫原性最好的糖蛋白gD胞外区序列[25]插入BoHV-1 gG-/tk-的tk位置后,BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+的免疫原性提高,表现为双拷贝gD病毒接种后,能更早检测到中和抗体;其外周血单核细胞增殖水平,尤其是攻毒后的增殖水平显著高于其亲本株BoHV-1 gG-/tk-;组织学变化也证实双拷贝gD重组病毒接种组对攻毒后的肺组织保护作用最好,略好于其亲本株BoHV-1 gG-/tk-。综上所述,双拷贝gD重组病毒的免疫原性增强。在双拷贝gD重组病毒中,含同源1型gD的BoHV-1重组病毒的免疫原性好于异源5型gD的BoHV-1重组病毒,而且能为5型病毒提供良好的交叉保护。
3.2 双拷贝糖蛋白gD重组病毒对兔体的安全性兔体接种BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+与亲本株BoHV-1 gG-/tk-后,各时间点兔体体温均在群体平均值0.5 ℃上下限值内,没有鼻腔分泌物增多等临床症状,而且没有排毒现象,说明BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+的安全性良好。取接种兔组织进行病毒分离时,仅一只BoHV-1 gG-/tk-接种兔的肺组织在细胞盲传过程中分离到病毒,其培养物检测到BoHV-1 gG-/tk-病毒核酸。说明gD双拷贝重组病毒的安全性良好。
综上所述,BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+安全性良好,与BoHV-1 gG-/tk-相比,BoHV-1 gG-/tk-/gD+和BoHV-1 gG-/tk-/gD5+对兔体的免疫原性显著提高,同时对BoHV-5提供较好的交叉保护力,从而有望作为IBR的新型疫苗候选株,具有一定的应用前景。
| [1] |
Li HT, Miao LG, Zhu YZ, et al. Establishment of a calf infection model of infectious bovine rhinotracheitis virus strain IBRV/JZ06-8[J]. Progress in Veterinary Medicine, 2015, 36(6): 115-118. 李海涛, 苗利光, 朱言柱, 等. 牛传染性鼻气管炎病毒JZ06-8株犊牛感染模型的建立[J]. 动物医学进展, 2015, 36(6): 115-118. |
| [2] |
Madin SH, York CJ, McKergher DG. Isolation of the infectious bovine rhinotracheitis virus[J]. Science, 1956, 124(3225): 721-722. DOI:10.1126/science.124.3225.721 |
| [3] |
Huck RA, Cartwright SF. Isolation and classification of viruses from cattle during outbreaks of mucosal or respiratory disease and from herds with reproductive disorders[J]. Journal of Comparative Pathology and Therapeutics, 1964, 74: 346-365. DOI:10.1016/S0368-1742(64)80041-2 |
| [4] |
Jones C, Chowdhury S. A review of the biology of bovine herpesvirus type 1 (BHV-1), its role as a cofactor in the bovine respiratory disease complex and development of improved vaccines[J]. Animal Health Research Reviews, 2007, 8(2): 187-205. DOI:10.1017/S146625230700134X |
| [5] |
Meyer G, Lemaire M, Ros C, et al. Comparative pathogenesis of acute and latent infections of calves with bovine herpesvirus types 1 and 5[J]. Archives of Virology, 2001, 146(4): 633-652. DOI:10.1007/s007050170136 |
| [6] |
Del Médico Zajac MP, Ladelfa MF, Kotsias F, et al. Biology of bovine herpesvirus 5[J]. The Veterinary Journal, 2010, 184(2): 138-145. DOI:10.1016/j.tvjl.2009.03.035 |
| [7] |
Ackermann M, Engels M. Pro and contra IBR-eradication[J]. Veterinary Microbiology, 2006, 113(3/4): 293-302. |
| [8] |
Brideau AD, Banfield BW, Enquist LW. The Us9 gene product of pseudorabies virus, an alphaherpesvirus, is a phosphorylated, tail-anchored type Ⅱ membrane protein[J]. Journal of Virology, 1998, 72(6): 4560-4570. |
| [9] |
Butchi NB, Jones C, Perez S, et al. Envelope protein Us9 is required for the anterograde transport of bovine herpesvirus type 1 from trigeminal ganglia to nose and eye upon reactivation[J]. Journal of NeuroVirology, 2007, 13(4): 384-388. DOI:10.1080/13550280701375433 |
| [10] |
Kaashoek MJ, Moerman A, Madić J, et al. An inactivated vaccine based on a glycoprotein E-negative strain of bovine herpesvirus 1 induces protective immunity and allows serological differentiation[J]. Vaccine, 1995, 13(4): 342-346. DOI:10.1016/0264-410X(95)98254-8 |
| [11] |
Strube W, Auer S, Block W, et al. A gE deleted infectious bovine rhinotracheitis marker vaccine for use in improved bovine herpesvirus 1 control programs[J]. Veterinary Microbiology, 1996, 53(1/2): 181-189. |
| [12] |
Bryant NA, Davis-Poynter N, Vanderplasschen A, et al. Glycoprotein G isoforms from some alphaherpesviruses function as broad-spectrum chemokine binding proteins[J]. The EMBO Journal, 2003, 22(4): 833-846. DOI:10.1093/emboj/cdg092 |
| [13] |
Kaashoek MJ, Rijsewijk FAM, van Oirschot JT. Persistence of antibodies against bovine herpesvirus 1 and virus reactivation two to three years after infection[J]. Veterinary Microbiology, 1996, 53(1/2): 103-110. |
| [14] |
Kit S, Oavi H, Gaines JD, et al. Thymidine kinase-negative bovine herpesvirus type 1 mutant is stable and highly attenuated in calves[J]. Archives of Virology, 1985, 86(1/2): 63-83. |
| [15] |
Hanon E, Keil G, van Drunen Littel-van Den Hurk S, et al. Bovine herpesvirus 1-induced apoptotic cell death: role of glycoprotein D[J]. Virology, 1999, 257(1): 191-197. DOI:10.1006/viro.1999.9620 |
| [16] |
Hutchings DL, van Drunen Little-van Den Hurk S, Babiuk LA. Lymphocyte proliferative responses to separated bovine herpesvirus 1 proteins in immune cattle[J]. Journal of Virology, 1990, 64(10): 5114-5122. |
| [17] |
Zhang MM, Fu SL, Deng ML, et al. Attenuation of bovine herpesvirus type 1 by deletion of its glycoprotein G and tk genes and protection against virulent viral challenge[J]. Vaccine, 2011, 29(48): 8943-8950. DOI:10.1016/j.vaccine.2011.09.050 |
| [18] |
Wu Y, Zhang P, Zhou LZ, et al. Development of a micro-cytopathic method for determination of neutralizing antibody titer against human cytomegalovirus[J]. Chinese Journal of Blood Transfusion, 2015, 28(9): 1099-1103. 吴燕, 张佩, 周兰贞, 等. 微量细胞病变法检测人巨细胞病毒中和抗体效价方法的建立[J]. 中国输血杂志, 2015, 28(9): 1099-1103. |
| [19] |
Yan BF. Development of indirect ELISA for detection for specific antibodies against infectious bovine rhinotracheitis virus and application in epidemiological investigation[D]. Wuhan: Master's Thesis of Huazhong Agricultural University, 2007 (in Chinese) 颜邦芬. 牛传染性鼻气管炎病毒抗体间接ELISA的建立及其在流行病学研究中的应用[D]. 武汉: 华中农业大学硕士学位论文, 2007 http://cdmd.cnki.com.cn/article/cdmd-10504-2007209802.htm |
| [20] |
Wei H, He J, Paulsen DB, et al. Bovine herpesvirus type 1 (BHV-1) mutant lacking U L 49.5 luminal domain residues 30-32 and cytoplasmic tail residues 80-96 induces more rapid onset of virus neutralizing antibody and cellular immune responses in calves than the wild-type strain Cooper[J]. Veterinary Immunology and Immunopathology, 2012, 147(3/4): 223-229. |
| [21] |
Brownlie R, Kumar P, Babiuk LA, et al. Recombinant bovine adenovirus-3 co-expressing bovine respiratory syncytial virus glycoprotein G and truncated glycoprotein gD of bovine herpesvirus-1 induce immune responses in cotton rats[J]. Molecular Biotechnology, 2015, 57(1): 58-64. DOI:10.1007/s12033-014-9801-x |
| [22] |
Quattrocchi V, Soria I, Langellotti CA, et al. A DNA vaccine formulated with chemical adjuvant provides partial protection against bovine herpes virus infection in cattle[J]. Frontiers in Immunology, 2017, 8: 37. |
| [23] |
Khattar SK, Collins PL, Samal SK. Immunization of cattle with recombinant Newcastle disease virus expressing bovine herpesvirus-1 (BHV-1) glycoprotein D induces mucosal and serum antibody responses and provides partial protection against BHV-1[J]. Vaccine, 2010, 28(18): 3159-3170. DOI:10.1016/j.vaccine.2010.02.051 |
| [24] |
Gabev E, Tobler K, Abril C, et al. Glycoprotein D of bovine herpesvirus 5 (BoHV-5) confers an extended host range to BoHV-1 but does not contribute to invasion of the brain[J]. Journal of Virology, 2010, 84(11): 5583-5593. DOI:10.1128/JVI.00228-10 |
| [25] |
Alves Dummer L, Pereira Leivas Leite F, van Drunen littel-van den Hurk S. Bovine herpesvirus glycoprotein D: a review of its structural characteristics and applications in vaccinology[J]. Veterinary Research, 2014, 45: 111. DOI:10.1186/s13567-014-0111-x |
 2017, Vol. 44
2017, Vol. 44