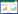扩展功能
文章信息
- 周海生, 张美红, 田雪, 武奇, 邵红霞, 钱琨, 叶建强, 秦爱建
- ZHOU Hai-Sheng, ZHANG Mei-Hong, TIAN Xue, WU Qi, SHAO Hong-Xia, QIAN Kun, YE Jian-Qiang, QIN Ai-Jian
- 我国2002-2016年间鸡传染性支气管炎病毒基因组序列重组分析
- Recombination analysis of genomic sequences of infectious bronchitis viruses from 2002-2016 in China
- 微生物学通报, 2017, 44(12): 2942-2950
- Microbiology China, 2017, 44(12): 2942-2950
- DOI: 10.13344/j.microbiol.china.170488
-
文章历史
- 收稿日期: 2017-07-04
- 接受日期: 2017-08-30
- 优先数字出版日期(www.cnki.net): 2017-08-30
鸡传染性支气管炎(Infectious bronchitis,IB)是由鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的一种急性、高度接触性传染病。IBV感染发病后临床症状与病理变化主要集中在呼吸道、肾脏及生殖道,进而造成家禽肉料比降低,产蛋量与产蛋品质下降,继发感染后死亡率增加,给我国养禽业带来巨大经济损失[1]。IBV在我国最早于20世纪80年代初被分离报道,随后在我国广泛流行。虽然IBV疫苗(Mass、4/91及tl/CH/LDT3/03型疫苗)广泛使用,但IB仍然频繁暴发,IBV不断被分离报道[2]。
IBV属于冠状病毒科冠状病毒亚科的Gamma冠状病毒,病毒为有囊膜不分节段单股正链RNA病毒。IBV复制依赖RNA聚合酶,然而RNA聚合酶缺乏校正能力。因此,病毒的这种复制机制使得病毒很容易发生变异或重组。IBV不同毒株间自然重组可以产生新的毒株,进而导致新的基因型或血清型的出现[3-6]。值得注意的是,近年来以CK/CH/2010/JT1分离株为代表的IBV重组病毒在我国开始流行。研究还发现,该重组病毒CK/CH/2010/JT1可引起雏鸡严重的呼吸道症状、肾脏病变及高死亡率;而且能逃脱疫苗株H120与4/91产生的免疫应答[7]。因此,在IBV流行病学监测中对重组病毒的监测、来源追踪与致病性分析对制定IB有效免疫防控策略尤为重要。本研究根据GenBank公布的我国IBV分离株基因序列,与参考毒株进行了分子进化及重组分析,旨在了解我国IBV流行株的分子流行病学规律及基因重组情况,为IBV的有效防控提供依据和打下基础。
1 材料与方法 1.1 序列来源从GenBank数据库中收集我国2002-2016年间92个IBV分离株和20个参考株S1基因序列以及55个IBV分离株和14个参考株基因组序列。各毒株基因组序列GenBank登录号见表 1。
| 毒株 Strain |
分离年份 Year of isolation |
GenBank登录号 GenBank accession No. |
| SC021202 | 2002 | EU714029 |
| ck/CH/LSHH/03II | 2003 | KX252772 |
| CQ04-1 | 2004 | HM245924 |
| DK/CH/HN/ZZ2004 | 2004 | JF705860 |
| ck/CH/LJL/04I | 2004 | KX302866 |
| GX-YL5 | 2005 | HQ848267 |
| ck/CH/LDL/05III | 2005 | KX348114 |
| ck/CH/LJL/05I | 2005 | KX252778 |
| CK/CH/LSD/05I | 2005 | EU637854 |
| ck/CH/LSD/07I | 2007 | KX252777 |
| ck/CH/IBWF/2007 | 2007 | KF663560 |
| ck/CH/LHLJ/07VII | 2007 | JF274479 |
| ck/CH/LHLJ/08-6 | 2008 | KX252788 |
| ck/CH/LJL/08-1 | 2008 | KX236005 |
| ck/CH/LSD/09091 | 2009 | KX302864 |
| ck/CH/LDL/091022 | 2009 | JX195175 |
| ck/CH/LGD/090907 | 2009 | KP118894 |
| CK/CH/LGX/091109 | 2009 | KF411041 |
| ck/CH/LHLJ/090510 | 2009 | KX252783 |
| ck/CH/LHLJ/091205 | 2009 | KJ425504 |
| Sczy3 | 2009 | JF732903 |
| CK/CH/SD09/005 | 2009 | KF668605 |
| YX10 | 2010 | JX840411 |
| ck/CH/LHB/100801 | 2010 | JF330898 |
| ck/CH/LHLJ/100902 | 2010 | JF828980 |
| CK/CH/LLN/111169 | 2011 | KF411040 |
| ck/CH/LSD/110857 | 2011 | KP118885 |
| ck/CH/LSD/111219 | 2011 | KJ435283 |
| ck/CH/LSD/111235 | 2011 | KP118886 |
| ck/CH/LSD/1112150 | 2011 | KJ435286 |
| ck/CH/LZJ/111113 | 2011 | JX195176 |
| ck/CH/LJL/110302 | 2011 | KC136209 |
| ck/CH/LJL/111054 | 2011 | KC506155 |
| ck/CH/IBYZ/2011 | 2011 | KF663561 |
| ck/CH/LDL/110931 | 2011 | KJ425485 |
| Ck/CH/LGD/120723 | 2012 | KC013541 |
| Ck/CH/LGD/120724 | 2012 | KC119407 |
| CK/CH/SD/121220 | 2012 | KJ128295 |
| SDIB821/2012 | 2012 | KF574761 |
| ck/CH/IBTZ/2012 | 2012 | KF663559 |
| CK/CH/LJL/130908 | 2013 | KP868573 |
| ck/CH/LJL/130925 | 2013 | KP036505 |
| ck/CH/LHB/130578 | 2013 | KP118890 |
| ck/CH/LHB/130598 | 2013 | KJ425497 |
| ck/CH/LGX/130530 | 2013 | KP343691 |
| ck/CH/LHB/130573 | 2013 | KJ425496 |
| ck/CH/LHB/130575 | 2013 | KP118889 |
| CK/CH/LDL/140520 | 2014 | KP790143 |
| CK/CH/LHLJ/140756 | 2014 | KP790144 |
| CK/CH/LHLJ/140901 | 2014 | KP790146 |
| ck/CH/LHLJ/140906 | 2014 | KP036502 |
| CK/CH/LHLJ/141105 | 2014 | KP790145 |
| ck/CH/LDL/150434-Ⅱ | 2015 | KT736032 |
| ck/CH/LJL/150430 | 2015 | KX302867 |
| gammaCoV/ck/China/I110116 | 2016 | KY620116 |
| H120_vaccine | Vaccine strain | FJ888351 |
| H52_vaccine | Vaccine strain | EU817497 |
| Connecticut_vaccine | Vaccine strain | KF696629 |
| 4/91_vaccine | Vaccine strain | KF377577 |
| LDT3-A_vaccine | Vaccine strain | KR608272 |
| M41 | 1956 | DQ834384 |
| A2 | 1996 | EU526388 |
| ck/CH/LDL/97I | 1997 | JX195177 |
| TW2575/98 | 1998 | DQ646405 |
| LX4_Chinese QX-type | 1999 | AY338732 |
| tl/CH/LDT3/03 | 2003 | KT852992 |
| CK/SWE/0658946/10_European QX-type | 2010 | JQ088078 |
| BJ | Unknown | AY319651 |
| SAIBK | Unknown | DQ288927 |
利用DNAStar中MegAlign程序对病毒的全基因组序列或S1基因进行序列比对,并应用MEGA 6.0软件对所有病毒株的S1基因序列进行遗传进化分析。应用RDP4软件分析病毒的S1基因或全基因组序列中的基因重组情况,重组事件的检测方法参考已发表文献[7],运用SimPlot软件分析重组序列同源性,并通过在线网址http://blast.ncbi.nlm.nih.gov/Blast.cgi对基因序列进行BLASTn分析。
2 结果与分析 2.1 我国2002-2016年间IBV S1基因的多样性S1基因核苷酸序列比对分析表明92株IBV之间一致性为64.2%-100%,其中以ck/CH/LSD/ 1112134与ck/CH/LHLJ/131216间相似性最高达100%,CK/CH/Chongqing/0908与SDIB781/2012间的相似性最低为64.2%,与20株参考株的相似性为63.9%-100%。92个IBV毒株的S1基因序列普遍存在碱基插入、缺失以及突变。S1基因核苷酸序列进化树分析结果(图 1)表明,我国2002-2016年间92个IBV分离株可分为13个基因型。36株IBV与参考株QXIBV、LX4划为一个基因型,属于世界范围内广泛流行的QX型IBV。Mass、4/91及tl/CH/LDT3/03型疫苗虽然在我国广泛使用,但这3个基因型毒株在我国仍有分离报道,分别包含8、5与8个分离株。11株IBV与台湾型TW-Ⅰ参考株3051/02同属一个基因分支,且2株病毒与台湾型TW-Ⅱ参考株T07/02同属一个分支。CK/CH/LSC/ 99I、Ck/CH/LDL/97I及TC07-2基因型分支分别含有3、2及3个分离株。分离株Ck/CH/Shaanxi/ 2009/W09、Ck/CH/Shaanxi/2012/WN与澳大利亚N1/62及日本JP8443参考株同属一个分支。值得注意的是,ck/CH/LSD/110712株IBV与美国Arkansas、ArkDPI11参考株属于一个基因分支,该型病毒之前在我国未见发病报道。11株IBV分离株与参考株没有划分为同一基因型,而是独立进化成两个不同的新的基因型分支,其中5株病毒包括本课题组前期分离到的CK/CH/2010/JT-1株IBV,在进化树中单独成一个分支New-Ⅰ[7],而其他6株同样形成一个新的分支New-Ⅱ。New-Ⅱ分支与其他参考株的亲缘关系较远,但分支内部间一致性达97.9%-99.4%,而与其他毒株间只有65.2%-92.9%的同源性。这一结果表明我国2002-2016年间流行IBV S1基因呈现多样性,而且基因型众多。
|
| 图 1 2002-2016年IBV分离株与参考株(▲标注)的S1基因序列系统进化树 Figure 1 Phylogenetic tree of the S1 gene of IBV strains isolated during 2002-2016 and reference strains (Marked with ▲) 注:括号内数值为毒株在GenBank中的登录号;分支点上的数字表示自展支持值;标尺代表5%的序列分歧. Note: Numbers in parentheses are GenBank accession numbers; Numbers at nodes are bootstrap values; The scale bar represents 5% sequence divergence. |
|
|
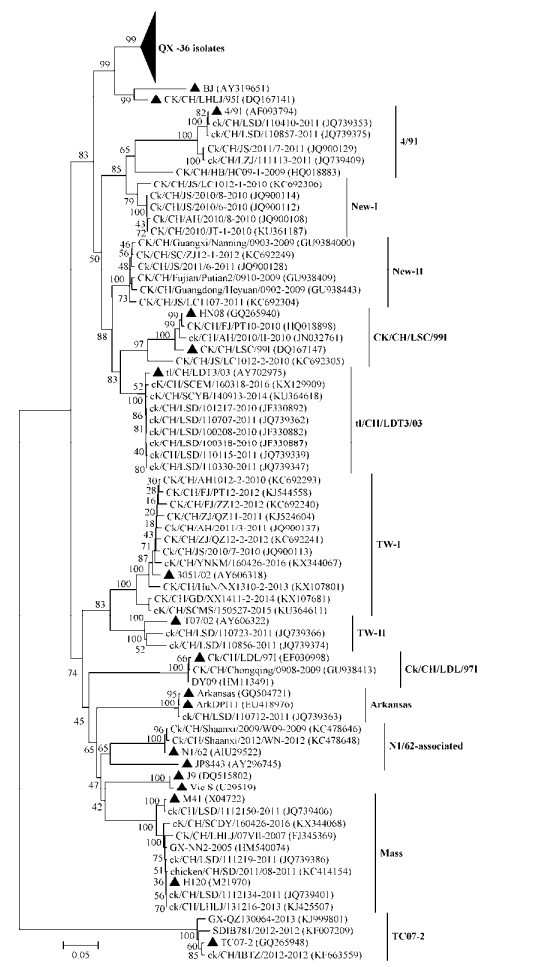
应用RDP4软件对New-Ⅱ基因型分离株S1基因序列进行重组分析,结果表明New-Ⅱ分支毒株CK/CH/Guangxi/Nanning/0903、CK/CH/SC/ZJ12-1、Ck/CH/JS/2011/6、CK/CH/JS/LC1107、CK/CH/Fujian/ Putian2/0910与CK/CH/Guangdong/Heyuan/0902的S1基因中都检测出一个基因重组事件,其中检测的重组概率(p值)均很高(图 2)。该型毒株S1基因来源于tl/CH/LDT3/03型毒株tl/CH/LDT3/03和QX型野毒株CK/CH/LSD/07X的重组,重组区域分别位于其S1基因1 055-1 401、1 055-1 428、1 042-1 423及1 042-1 423 bp片段。这一结果说明新分支New-Ⅱ基因型IBV S1基因来源于tl/CH/LDT3/03型和QX基因型IBV重组。
|
| 图 2 New-Ⅱ基因型病毒S1基因RDP4软件重组分析结果 Figure 2 Recombination analysis results of the S1 gene of New-Ⅱ genotype isolates using RDP4 Note: A: CK/CH/Fujian/Putian2/0910; B: Ck/CH/JS/2011/6; C: CK/CH/JS/LC1107; D: CK/CH/Guangdong/Heyuan/0902; E: CK/CH/Guangxi/Nanning/0903; F: CK/CH/SC/ZJ12-1. |
|
|
应用RDP4软件对我国2002-2016年IBV基因组序列进行重组分析,结果显示,在55株中有52株病毒检测到基因重组事件,其中25株IBV中检测到疫苗型毒株与野毒株之间的基因重组(表 2)。值得注意的是,在2002-2009年分离株中,疫苗型毒株序列参与的重组毒株比例为27.27%,而这一数据在2010-2016年的IBV分离株中达到57.58%,提示过分依赖疫苗可能导致了疫苗株参与IBV基因重组频率的增加,进而导致IBV新的变异株不断出现。
| 年份 Years |
疫苗型毒株参与重组事件数量/总重组事件数量 Number of recombination events which the vaccine strains acted as minor parental strain/Number of all recombination events |
疫苗型毒株参与重组毒株数量/总重组毒株数量 Number of IBV strains which have transferred fragments from vaccine strains/Number of all IBV strains |
| 2002-2009 | 10/105 | 6/22 |
| 2010-2016 | 38/177 | 19/33 |
| Total | 48/282 | 25/55 |
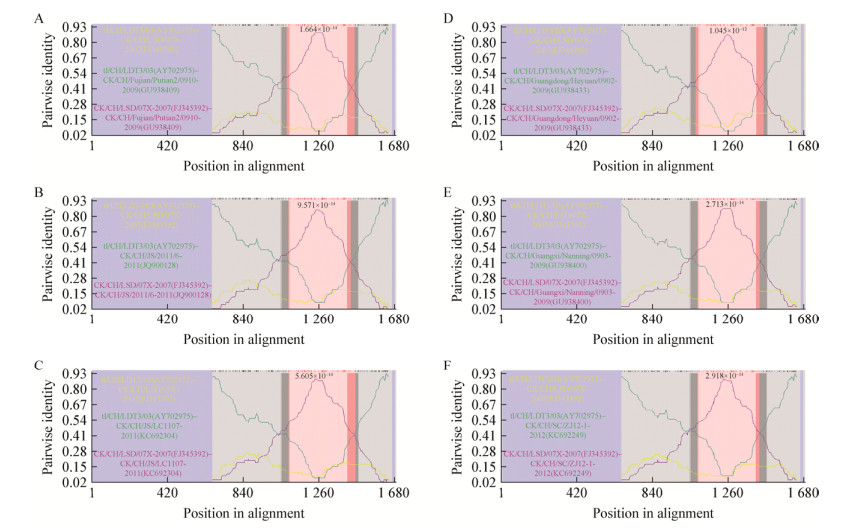
为了进一步验证RDP4软件鉴定的疫苗型毒株参与的重组事件,研究随机抽取3株IBV (ck/CH/LGX/130530、DK/CH/HN/ZZ2004和CK/ CH/LSD/05I),对其运用SimPlot软件进行同源性分析。结果显示,在ck/CH/LGX/130530、DK/CH/ HN/ZZ2004和CK/CH/LSD/05I分别检测到6、3和3个重组事件,而在这些重组事件中分别有1、1和2个重组事件的重组序列来源于4/91型疫苗株4/91、tl/CH/LDT3/03型疫苗株LDT3-A和Mass型Connecticut疫苗株(表 3)。这些重组事件中重组序列信号进一步在SimPlot分析中得到确认(图 3)。这些结果显示近些年部分IBV分离株中重组了疫苗株基因片段。
| 毒株 Strain |
重组片段断点 Breakpoints |
重组基因 Recombinant genes |
主要亲本株a Major parent |
重组片段亲本株b Minor parent |
|
| 起点 Start |
终点 End |
||||
| ck/CH/LGX/130530 | 1 344 | 4 311c | nsp2, 3 | M41 | 4/91_vaccine |
| 4 223 | 9 939 | nsp3-5 | M41 | ck/CH/LDL/97I | |
| 17 060 | 27 301 | nsp14-16, S, 3a, 3b, E, M, 5a, 5b, N, 3′UTR | ck/CH/LDL/97I | tl/CH/LDT3/03 | |
| 17 066 | 21 681c | nsp14-16, S | H52_vaccine | tl/CH/LDT3/03 | |
| 20 917 | 21 681c | S | ck/CH/LDL/091022_Chinese QX-type | SAIBK | |
| 24 548 | 25 564 | M, 5a | ck/CH/LDL/091022_Chinese QX-type | SAIBK | |
| DK/CH/HN/ZZ2004 | 556 | 2 918 | nsp2, 3 | Connecticut_vaccine | ck/CH/LDL/091022_Chinese QX-type |
| 20 168 | 20 994c | nsp16, S | ck/CH/LDL/97I | LDT3-A_vaccine | |
| 20 711 | 22 685 | S | ck/CH/LDL/091022_Chinese QX-type | SAIBK | |
| CK/CH/LSD/05I | 1 755 | 3 758 | nsp2, 3 | TW2575/98 | Connecticut_vaccine |
| 3 759c | 4 712 | nsp3 | SAIBK | ck/CH/LSD/111219 | |
| 24 588 | 27 205 | M, 5a, 5b, N, 3’UTR | TW2575/98 | Connecticut_vaccine | |
| 注:a:“主要亲本株”指重组片段周围基因序列来源毒株;b:“重组片段亲本株”指重组片段基因序列来源毒株;c:断点位置未精确确认,表中为RDP4软件检测的最为可能的断点位置. Note: a: The “major parent” is the sequence closely related to that from which the greater part of the recombinant’s sequence may have been derived; b: The “minor parent” is the sequence closely related to that from which sequences in the proposed recombinant region may have been derived; c: The actual breakpoint position is undetermined. Most likely it was overprinted by RDP4. |
|||||
|
| 图 3 ck/CH/LGX/130530 (A)、DK/CH/HN/ZZ2004 (B)及CK/CH/LSD/05I (C)全基因组序列SimPlot分析 Figure 3 SimPlot analysis of the complete genomic sequences of strains ck/CH/LGX/130530 (A), DK/CH/HN/ZZ2004 (B) and CK/CH/LSD/05I (C) |
|
|
自IB在我国首次发生之后,该病在我国广泛流行,给我国养禽业带来巨大经济损失。本研究对我国2002-2016年分离的92株IBV S1基因分型显示,这些毒株可以分为13个基因型,其中QX型IBV是我国主流基因型,本研究中该型IBV毒株分离比例达到39.13%。QX毒株于1997年报道,随后在亚洲、欧洲及非洲等许多国家开始流行[8-11]。虽然Mass、4/91及tl/CH/LDT3/03型疫苗在我国广泛使用,但本研究发现22.82%的分离株属于我国目前广泛使用的疫苗基因型,弱毒疫苗在免疫鸡群后存在被再次分离的可能性,但序列比对发现分离毒株与疫苗株基因序列并非完全一致,暗示这些毒株可能不是疫苗毒株。
由于IBV很容易通过基因突变和重组发生变异,这导致IBV进化过程中新的血清型、基因型或变异株的出现。本课题组前期分离到一株IBV肾型强毒株CK/CH/2010/JT-1,该毒株就是通过基因重组而来,而且这类毒株俨然已经进化为一个新的基因分支[7]。此外,本研究鉴定出另一个新的基因分支New-Ⅱ型。New-Ⅱ型S1基因也是来源于QX和tl/CH/LDT3/03型IBV基因重组。New-Ⅱ型IBV 6株S1基因序列BLASTn分析显示该毒株与GenBank中43株IBV S1基因一致性达到98%以上,其余都是低于95%。在这43株IBV中有37株病毒分离自广东和广西两个省份,而且这些毒株中最早是2005年分离于广东省的,提示该型IBV可能来源于两广地区。值得注意的是,重组来源的QX和tl/CH/LDT3/03型IBV可以引起鸡群产生严重的肾脏病变及高死亡率[12-13],提示该型病毒可能也是肾型强毒株。所以,在IBV流行病学监测中我们要注意对该型病毒的流行情况、抗原与致病特征进行追踪调查。
IBV病毒基因重组不仅可以发生在野毒株之间[14],同样也可以发生在疫苗株和野毒株之间[15-16]。因此,本研究利用RDP4软件对IBV疫苗株参与IBV基因重组情况进行调查。分析过程中采用7种检测方法,分别为RDP、GENECONV、BootScan、MaxChi、Chimaera、SiScan及3Seq,而且对重组事件确定要求至少有5种检测方法检测的重组概率p值均小于1×10–12。由于病毒在重组后仍然在不断变异,因此在一些重组事件中,重组基因片段断点可能还不能精确确定。为了确定这些重组的基因片段,本研究进一步应用SimPlot软件进行同源性分析确定我国分离的野毒株存在疫苗株和野毒株之间重组。在分析病毒基因重组过程中,我们发现疫苗株基因序列与野毒IBV基因重组的频率有所增加。我国养禽业目前过分依赖使用IBV弱毒活苗,包括Mass型疫苗Ma5与H120、4/91型疫苗4/91、Connecticut-like疫苗28/86及tl/CH/LDT3/03型LDT3-A等,一些养殖场甚至同时使用两种疫苗[2, 17-18],这也可能是近些年疫苗株参与重组频率有所增加的原因。不仅如此,像H9N2病毒在机体持续的抗体压下容易产生变异而产生逃逸株,从而导致鸡群发病[19-21]。同样IBV在持续的抗体压下也容易产生变异而产生变异株,导致IB不断暴发[22]。因此,我国养禽业在防控IB中过分依赖疫苗会增加病毒的基因变异与重组,进而加速病毒的进化。
综上所述,近年来我国IBV存在多个基因型的共同流行,基因重组可导致新基因型的出现,疫苗的过分依赖会导致病毒的基因变异与重组,从而加速IBV的进化。提示养禽业在防控IB时要合理使用IBV疫苗,应弄清该地区流行的IBV的血清型,针对特定地区流行的特定型的IBV疫苗进行免疫接种。
| [1] |
Cook JK, Jackwood M, Jones RC. The long view: 40 years of infectious bronchitis research[J]. Avian Pathology, 2012, 41(3): 239-250. DOI:10.1080/03079457.2012.680432 |
| [2] |
Han ZC, Sun CY, Yan BL, et al. A 15-year analysis of molecular epidemiology of avian infectious bronchitis coronavirus in China[J]. Infection Genetics and Evolution, 2011, 11(1): 190-200. DOI:10.1016/j.meegid.2010.09.002 |
| [3] |
Thor SW, Hilt DA, Kissinger JC, et al. Recombination in avian gamma-coronavirus infectious bronchitis virus[J]. Viruses, 2011, 3(9): 1777-1799. |
| [4] |
Toro H, van Santen VL, Jackwood MW. Genetic diversity and selection regulates evolution of infectious bronchitis virus[J]. Avian Disease, 2012, 56(3): 449-455. DOI:10.1637/10072-020212-Review.1 |
| [5] |
Lim TH, Lee HJ, Lee DH, et al. An emerging recombinant cluster of nephropathogenic strains of avian infectious bronchitis virus in Korea[J]. Infection Genetics and Evolution, 2011, 11(3): 678-685. DOI:10.1016/j.meegid.2011.01.007 |
| [6] |
Lim TH, Youn HN, Yuk SS, et al. Successful cross-protective efficacy induced by heat-adapted live attenuated nephropathogenic infectious bronchitis virus derived from a natural recombinant strain[J]. Vaccine, 2015, 33(51): 7370-7374. DOI:10.1016/j.vaccine.2015.07.043 |
| [7] |
Zhou HS, Zhang MH, Tian X, et al. Identification of a novel recombinant virulent avian infectious bronchitis virus[J]. Veterinary Microbiology, 2017, 199: 120-127. DOI:10.1016/j.vetmic.2016.12.038 |
| [8] |
Wang YD, Wang YL, Zhang ZC, et al. Isolation and identification of glandular stomach type IBV (QX IBV) in chickens[J]. China Animal Health Inspection, 1998, 15(1): 1-3. 王玉东, 王永玲, 张子春, 等. 鸡腺胃型传染性支气管炎病毒(QXIBV)的分离与鉴定[J]. 中国动物检疫, 1998, 15(1): 1-3. |
| [9] |
Amin OG, Valastro V, Salviato A, et al. Circulation of QX-like infectious bronchitis virus in the Middle East[J]. Veterinary Record, 2012, 171(21): 530. |
| [10] |
Toffan A, Monne I, Terregino C, et al. QX-like infectious bronchitis virus in Africa[J]. Veterinary Record, 2011, 169(22): 589. |
| [11] |
Worthington KJ, Currie RJW, Jones RC. A reverse transcriptase-polymerase chain reaction survey of infectious bronchitis virus genotypes in Western Europe from 2002 to 2006[J]. Avian Pathology, 2008, 37(3): 247-257. DOI:10.1080/03079450801986529 |
| [12] |
Liu SW, Chen JF, Chen JD, et al. Isolation of avian infectious bronchitis coronavirus from domestic peafowl (Pavo cristatus) and teal (Anas)[J]. Journal of General Virology, 2005, 86(3): 719-725. DOI:10.1099/vir.0.80546-0 |
| [13] |
Shi XM, Zhao Y, Gao HB, et al. Evaluation of recombinant fowlpox virus expressing infectious bronchitis virus S1 gene and chicken interferon-gamma gene for immune protection against heterologous strains[J]. Vaccine, 2011, 29(8): 1576-1582. DOI:10.1016/j.vaccine.2010.12.102 |
| [14] |
Mardani K, Noormohammadi AH, Ignjatovic J, et al. Naturally occurring recombination between distant strains of infectious bronchitis virus[J]. Archives of Virology, 2010, 155(10): 1581-1586. DOI:10.1007/s00705-010-0731-z |
| [15] |
Ovchinnikova EV, Bochkov YA, Shcherbakova LO, et al. Molecular characterization of infectious bronchitis virus isolates from Russia and neighbouring countries: identification of intertypic recombination in the S1 gene[J]. Avian Pathology, 2011, 40(5): 507-514. DOI:10.1080/03079457.2011.605782 |
| [16] |
Zhang Y, Wang HN, Wang T, et al. Complete genome sequence and recombination analysis of infectious bronchitis virus attenuated vaccine strain H120[J]. Virus Genes, 2010, 41(3): 377-388. DOI:10.1007/s11262-010-0517-0 |
| [17] |
Feng KY, Xue Y, Wang JL, et al. Development and efficacy of a novel live-attenuated QX-like nephropathogenic infectious bronchitis virus vaccine in China[J]. Vaccine, 2015, 33(9): 1113-1120. DOI:10.1016/j.vaccine.2015.01.036 |
| [18] |
Zou NL, Zhao FF, Wang YP, et al. Genetic analysis revealed LX4 genotype strains of avian infectious bronchitis virus became predominant in recent years in Sichuan area, China[J]. Virus Genes, 2010, 41(2): 202-209. DOI:10.1007/s11262-010-0500-9 |
| [19] |
Sun YP, Pu J, Fan LH, et al. Evaluation of the protective efficacy of a commercial vaccine against different antigenic groups of H9N2 influenza viruses in chickens[J]. Veterinary Microbiology, 2012, 156(1/2): 193-199. |
| [20] |
Wan ZM, Ye JQ, Xu LL, et al. Antigenic mapping of the hemagglutinin of an H9N2 avian influenza virus reveals novel critical amino acid positions in antigenic sites[J]. Journal of Virology, 2014, 88(7): 3898-3901. DOI:10.1128/JVI.03440-13 |
| [21] |
Wan ZM, Ye JQ, Sang JJ, et al. Identification of amino acids in H9N2 influenza virus neuraminidase that are critical for the binding of two mouse monoclonal antibodies[J]. Veterinary Microbiology, 2016, 187: 58-63. DOI:10.1016/j.vetmic.2016.03.011 |
| [22] |
Lee CW, Jackwood MW. Origin and evolution of Georgia 98 (GA98), a new serotype of avian infectious bronchitis virus[J]. Virus Research, 2001, 80(1/2): 33-39. |
 2017, Vol. 44
2017, Vol. 44