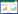扩展功能
文章信息
- 鲍春彤, 计群, 刘建方, 朱日宁, 雷连成
- BAO Chun-Tong, JI Qun, LIU Jian-Fang, ZHU Ri-Ning, LEI Lian-Cheng
- 胸膜肺炎放线杆菌三聚体自转运黏附素茎部功能区表达及其与猪肺组织结合蛋白的筛选分析
- Functional region expression and its binding protein analysis of trimeric autotransporter adhesin in Actinobacillus pleuropneumoniae
- 微生物学通报, 2017, 44(12): 2923-2932
- Microbiology China, 2017, 44(12): 2923-2932
- DOI: 10.13344/j.microbiol.china.170446
-
文章历史
- 收稿日期: 2017-06-22
- 接受日期: 2017-10-26
- 优先数字出版日期(www.cnki.net): 2017-11-15
猪传染性胸膜肺炎是由胸膜肺炎放线杆菌引起的一种高度致死性、传染性呼吸道疾病,主要引起以纤维素性和出血性坏死性为特征的胸膜炎、肺炎,给世界养猪业造成了巨大的经济损失[1]。胸膜肺炎放线杆菌感染宿主时,黏附是其侵袭宿主的第一步,因此黏附素成为研究细菌致病机制的重要突破口之一。
三聚体自转运黏附素(TAA)是由革兰氏阴性菌分泌产生的具有黏附作用的蛋白,不仅介导细菌间的相互作用,导致细菌自凝及生物被膜的形成,更在细菌对宿主细胞或组织的黏附过程中起重要作用[2]。TAA的C端为跨膜的锚定结构域,N端为承载区。承载区由具有黏附功能的头部结构域和起连接不同结构域作用的颈部区及序列重复的茎部区域构成。其中茎部区域将头部功能区展示在细菌表面,由于茎部是一段连接头部的、具有高度氨基酸重复序列的结构域,并且茎部的重复结构使TAA蛋白的整体结构较长,因此茎部在TAA发挥黏附作用时起到了重要的作用[3]。
实验室前期研究发现,TAA茎部的BD3对肺脏上皮细胞具有黏附作用[4]。在此基础上,本实验原核表达并纯化了TAA茎部具有黏附功能的BD3蛋白,将其作为诱饵蛋白,通过免疫共沉淀的方法捕获了与其结合的猪肺组织蛋白,经质谱分析和比对找出结合蛋白的种类。但因其基因序列未知,因此通过构建cDNA文库的方法获取含该基因序列的阳性克隆,测序后获得该结合蛋白的核苷酸序列并对其进行生物信息学分析,对于全面了解TAA在黏附宿主细胞过程中的机制具有重要意义。
1 材料与方法 1.1 质粒、菌株、实验动物pGEX-4T-1载体购自Pharmacia公司;pMD18-T购自TaKaRa公司。大肠杆菌DH5α和Rosetta(DE3)表达菌株由本实验室保存于-80 ℃。
45日龄长白猪(军牧一号)仔猪,购买于吉林大学种猪场。
1.2 主要试剂和仪器限制性内切酶Sal Ⅰ和EcoR Ⅰ、基因序列扩增材料ExTaq、dNTPs、IPTG、X-gal、Amp等购自Takara公司;DNA Marker购自天根公司;胰蛋白胨、酵母提取物购自OXOID公司;Glutathione Sepharose 4B蛋白纯化柱和Time Saver cDNA Synthesis Kit试剂盒购自GE Healthcare公司;Protein G Agarose购自碧云天公司;AxyPrep Plasmid Miniprep Kit质粒提取试剂盒购自长春维特洁生化产品经销部;TRIZOL试剂购自Invitrogen公司,兔抗GST-BD3蛋白多克隆抗体由本实验保存。
PHS-4CT精密酸度计,上海大中分析仪器厂;高速台式离心机,SORVALLPico公司;Fluor-chem SP (8900)凝胶成像分析系统,Alpha Innotech公司;超声波细胞粉碎机JY92-2D,宁波新芝科技研究所;PCR仪、核酸蛋白测定仪,Bio-Rad公司;SDS-聚丙烯酰胺电泳垂直电泳槽和紫外分光光度计,UNIC公司。
1.3 BD3菌株的鉴定以本实验室保存的含BD3基因的大肠杆菌DH5α菌株[4]为模板,利用特异性引物(BD3-F:5′-CGGAAT TCGCAAGCAATACCGTCAG-3′;BD3-R:5′-GCGT CGACTTATAAGCCGATTTGAAGTG-3′)对BD3基因进行PCR扩增。PCR反应体系(25 μL):10×ExTaq buffer 2.5 μL,dNTPs (2.5 mmol/L) 2 μL,上、下游引物(100 μmol/L)各0.2 μL,BD3菌株1.5 μL,ExTaq酶(5 U/μL) 0.2 μL,ddH2O 18.4 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 1 min,48 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 10 min。取5 μL PCR产物经1%琼脂糖凝胶电泳后,观察条带大小以评价目的基因扩增效果。
将Rosetta(DE3)菌株活化后以1%转接到5 mL含氨苄青霉素抗性的LB液体培养基[4]中,37 ℃、180 r/min培养过夜,按照AxyPrep Plasmid Miniprep Kit说明书提取质粒。对提取的质粒进行EcoR Ⅰ和Sal Ⅰ双酶切鉴定,取5 μL酶切反应液与相对应的质粒做1%琼脂糖凝胶电泳分析。
1.4 蛋白表达与纯化对GST-BD3融合蛋白进行原核表达及亲和层析纯化,具体实验操作参见文献[5]。
1.5 猪肺组织全蛋白的提取取出仔猪肺脏,用预冷的PBS溶液洗涤肺脏表面血液与黏液,立即用无菌镊子与剪刀剪碎肺组织置于50 mL离心管内,用组织匀浆器在冰水浴中研磨组织直至呈匀浆状态。4 ℃、3 000 r/min离心10 min弃上清,获取匀浆后分散组织。向烧杯中加入分散组织和细胞组织快速裂解液Radio immunoprecipitation assay (RIPA),于冰水混合条件下超声破碎,超声功率为100 W,超声条件为超5 s停15 s。每超声30 min后添加苯甲基磺酰氟(PMSF),直至细胞悬液呈均一状态。将超声完成后的组织悬液于4 ℃、12 000 r/min离心10 min,小心吸取上清转移至新的预冷EP管内,分装后-20 ℃保存备用。将获得的蛋白经SDS-PAGE检测提取量。
1.6 免疫共沉淀筛选结合蛋白在预冷的5个平行1.5 mL EP管中分别加入不同样品(表 1),其浓度分别为:组织蛋白2.5 mg、多抗2 μg。将各组平行样品置于冰水混合浴中,4 ℃、175 r/min孵育过夜。孵育后样品在4 ℃、2 500 r/min离心2 min,小心吸除上清(注意,可留下少量上清,但不能吸出Protein G agarose)。使用预冷的PBS 1 mL/次洗涤沉淀5次后去除上清,加入20-40 μL的1×SDS-PAGE电泳上样缓冲液进行电泳[6]。
| Component | 1 | 2 | 3 | 4 | 5 |
| Tissue protein | + | + | - | - | - |
| GST-BD3 | + | + | + | - | - |
| Polyclonal antibody | + | - | - | - | + |
| GST | - | - | - | + | + |
| Protein G agarose | + | + | - | + | + |
| Note: +: Added; –: Not added. | |||||
对SDS-PAGE电泳获得的疑似条带进行观察,并小心截取目的条带后送至上海博苑生物科技有限公司进行ABI 4800 Plus MALDI TOF/TOF基质辅助激光解离飞行时间质谱分析。该质谱主要测定蛋白质的肽质量指纹图谱(PMF)、源后裂解(PSD)碎片离子图谱,通过结合质谱网络数据库检索获取蛋白序列。
1.8 文库的构建及筛选APP 5b血清型具有较为完整的茎部结构,并且毒力较强[7],本实验以APP 5b血清型感染后的仔猪肺脏mRNA为模板,参照文献[8]经反转录PCR合成cDNA,与pMD18-T载体连接后转化入E. coli DH5α受体菌,获得阳性克隆,得到组织细胞的cDNA文库。
1.9 结合蛋白编码基因的克隆与分析通过质谱获得的肽段序列与该蛋白家族的保守区比较,选择关键保守序列,推导该序列的氨基酸序列设计引物。上游引物:5′-AAGTCACTCA ACAACCAA-3′;下游引物:5′-GTCAATGAAGGAG GCAAA-3′,由生工生物工程(上海)股份有限公司合成。以获得的cDNA文库菌株为模板,筛选阳性克隆菌株。PCR反应体系(25 μL):10×ExTaq buffer 2.5 μL,dNTPs (2.5 mmol/L) 2 μL,上、下游引物(100 μmol/L)各0.2 μL,cDNA文库菌株1.5 μL,ExTaq酶(5 U/μL) 0.5 μL,ddH2O 18.4 μL。PCR反应条件:95 ℃ 10 min;94 ℃ 1 min,48 ℃ 40 s,72 ℃ 40 s,共30个循环;72 ℃ 10 min。PCR产物经2%琼脂糖凝胶电泳检测。将PCR鉴定为阳性的菌株在37 ℃、180 r/min恒温培养18 h,保存甘油菌,送北京华大基因生物公司进行序列测定,获取目的序列。
1.10 生物信息学分析软件使用生物软件DNAStar中MegAlign功能,ClustalW方法分析核苷酸同源性。DNAStar中的MegAline功能绘制CK1sw进化树。根据ExPASy数据库及在线分析功能,提交CK1sw蛋白序列,预测获得蛋白基本信息:等电点、分子量、氨基酸组成和不稳定系数等数据结果;使用DNAStar的Protean功能分析序列的疏水性,与在线分析结果比较。CBS的TMHMM在线预测软件分析CK1sw蛋白是否存在跨膜区,使用GOR进行在线二级结构预测,MyHits进行蛋白质轮廓序列分析。Smart和ExPASy在线分析软件预测该蛋白的结构功能域。
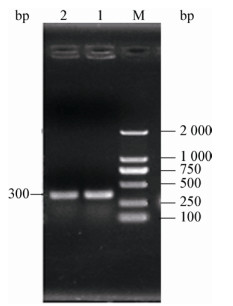
2 结果与分析 2.1 TAA功能区的表达、纯化以本实验室前期构建的含BD3基因的大肠杆菌菌株为模板,经PCR扩增获得大小在300 bp左右的BD3目的基因片段,符合预期结果(图 1)。活化后的Rosetta(DE3)菌株在终浓度0.8 mmol/L IPTG、25 ℃低温诱导6 h的最佳表达条件下原核表达后经Glutathione Sepharose 4B纯化柱亲和层析纯化,在39 kD处出现与预期大小一致的目的条带(图 2),说明已成功纯化出目的蛋白BD3。
|
| 图 1 BD3 PCR鉴定图 Figure 1 Analysis of BD3 PCR 注:1、2:BD3的PCR产物;M:DL2000 marker. Note: 1, 2: PCR produelt of BD3; M: DL2000 marker. |
|
|
|
| 图 2 SDS-PAGE检测GST-BD3蛋白纯化电泳图 Figure 2 SDS-PAGE analysis protein purification of GST-BD3 注:1:纯化后GST-BD3蛋白;M:低分子量蛋白Marker. Note: Purified GST-BD3 protein; M: Low molecular weight protein marker. |
|
|
为了便于肺组织结合蛋白的筛选,首先利用纯化的BD3蛋白制备了兔多克隆抗体,并通过免疫共沉淀的方法获得了BD3的结合蛋白(图 3),对泳道1分析结果显示,该泳道除了出现正常结合的抗体重链、轻链及GST-BD3诱饵蛋白链,在66 kD处出现清晰可见条带,该条带除了可能存在于组织蛋白外,不存在于其他成分,因此可能作为与GST-BD3的结合蛋白。将获得的条带切下后经质谱分析,分析后获得的肽段序列经数据库搜寻比对后,网页检索结果显示,Keratin 1为BD3可能的结合蛋白(图 4)。

|
| 图 3 SDS-PAGE检测蛋白互作结果 Figure 3 SDS-PAGE analysis protein interaction 注:1:添加特异性兔多克隆抗体的免疫共沉淀反应;2:没有添加抗体的免疫共沉淀反应;3:纯化后的GST-BD3蛋白;4、5:对照组. Note: 1: Immunoprecipitation with adding rabbit specific polyclonal antibodies; 2: Immunoprecipitation without adding rabbit specific polyclonal antibodies; 3: Purified GST-BD3 protein; 4, 5: Control group. |
|
|

|
| 图 4 网页检索结果 Figure 4 Results of Mascot search |
|
|
提取后的RNA用RNase-free H2O稀释50倍后测定浓度及纯度,结果显示含量为86.6 μg/mL,OD260/OD280值为1.91;OD260/OD230值为2.34。说明该RNA中蛋白、核酸污染程度低,完整性好,同时也满足浓度要求,可以用于下一步cDNA文库构建。本实验中用于cDNA第一链合成的RNA含量约为5 μg,显示洗脱柱最佳添加体积为10 μL/5 μg RNA。将获得的cDNA洗脱液均重组转化到大肠杆菌DH5α后,最终获得513株重组菌株。对获得的部分菌株使用探针引物PCR鉴定,72个菌株中有45个在200 bp处出现阳性条带。将对应的阳性菌株交由北京华大基因生物公司进行测序,获得该结合蛋白的基因序列。
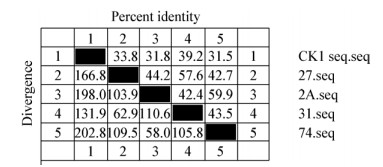
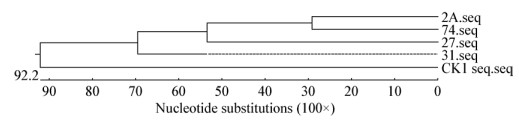
2.3.2 肺组织中结合蛋白的结构分析: 对获得的结合蛋白的核苷酸序列进行种间、种内同源性分析和遗传进化树分析(图 5-8)。结果显示种内核苷酸一致性在31.5%-39.2%之间,其他角蛋白一致性在42.4%-59.9%之间,表明同一物种中角蛋白一致性低,这与角蛋白的组织特异性分布有关,同时也说明角蛋白家族具有广泛的配体特征。猪源角蛋白1与人源角蛋白的一致性在27.5%-33.1%之间,这说明角蛋白在不同种间存在很大差异性,同时该蛋白在种内同源性高于种间。进化树分析结果显示获得的细胞角蛋白1作为一个单独的进化分支,与其他角蛋白差异较大。
|
| 图 5 CK1sw与猪角蛋白同源性分析 Figure 5 Homology analysis of CK1sw with swine keratins |
|
|

|
| 图 6 CK1sw与人角蛋白同源性分析 Figure 6 Homology analysis of CK1sw with human keratins |
|
|
|
| 图 7 CK1sw与猪角蛋白进化树分析 Figure 7 Phylogenetic tree of CK1sw with swine keratins |
|
|

|
| 图 8 CK1sw与人角蛋白进化树分析 Figure 8 Phylogenetic tree of CK1sw with human keratins |
|
|
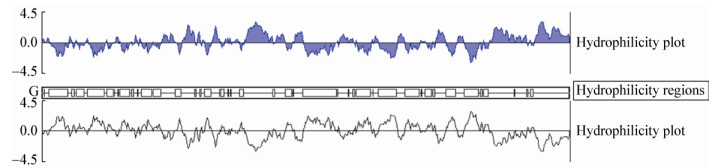
对获得的结合蛋白进行蛋白水平的相关分析,结果显示CK1sw由601个氨基酸组成,蛋白理论分子量为68 317.54 Da;理论等电点(pI)为9.37。不稳定系数(Ⅱ)为49.76,表明该蛋白不稳定。亲水区域主要位于230-265 aa和510-600 aa处;疏水区域位于8-140、300-340、480-510 aa处。结合Expasy数据库的分析,显示该蛋白的总平均亲水性(GRAVY)值为-0.041,说明该蛋白具有一定的亲水性(图 9)。
|
| 图 9 CK1sw疏水性预测 Figure 9 Hydrophobic prediction of CK1sw |
|
|
信号肽一般位于起始密码子后的一段疏水序列,预测结果表明CK1sw蛋白并不具有信号肽。这一方面可能与该蛋白本身疏水性弱有关;其次也说明该蛋白靶向胞膜可能需要一些伴侣蛋白辅助其功能的发挥。TMHMM预测结果显示CK1sw在8-100 aa处存在一个跨膜区(图 10)。

|
| 图 10 CK1sw跨膜区预测 Figure 10 Transmembrane prediction of CK1sw |
|
|
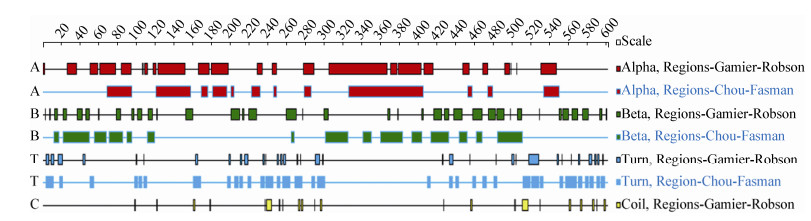
DNAStar软件分析结果显示,CK1sw的二级结构元件以α螺旋、β折叠为主,其次为Turn,Coil结构最少。其中,α螺旋主要出现在120-200 aa和300-400 aa处;β折叠主要出现在420-500 aa处,Turn结构主要出现在200-280 aa和500-600 aa处(图 11)。这种结构分布决定了CK1sw蛋白的高级构象与其功能的发挥密切相关。
|
| 图 11 CK1sw二级结构原件预测 Figure 11 Secondary structural elements prediction of CK1sw |
|
|
Motif Scan轮廓分析结果显示,编码CK1sw序列的氨基酸中,主要包括一个N-糖基化位点、一个酪蛋白激酶Ⅱ磷酸化位点和一个蛋白激酶C磷酸化位点。其中,蛋白激酶C和酪蛋白激酶Ⅱ磷酸化位点主要集中在100-200 aa及300 aa附近。经SMART在线分析后,获得CK1sw的蛋白结构功能区。结果显示,该蛋白的跨膜区位于13-32 aa处,序列为FFFFFGSGIVCNVFVTETHL;在17-76 aa处有一个细胞核激素受体c4锌指结构,该结构与细胞分化和内稳态等多种生理功能有关;28-89 aa处存在一个DDT区域,该区域被认为是DNA结合区域;82-362 aa处存在一个G蛋白(鸟嘌呤核苷酸结合蛋白) α亚单位,该亚单位能与β、γ亚单位结合形成异源三聚体的G蛋白,G蛋白同G蛋白偶联受体(GPCRs)形成哺乳动物中最常见的信号系统;280-391 aa处存在一个具有细菌转录激活因子作用的BTAD区域;在515-552 aa处的TSP1区域(凝血酶敏感蛋白1型重复区域)能够结合并活化TGF-β,凝血酶敏感蛋白是一种多聚化的多重区域糖蛋白,在细胞表面和胞外基质环境中发挥作用,并且与补体途径、细胞间结合、抑制凋亡有关。
3 讨论TAA是革兰氏阴性菌表面的一类庞大的蛋白家族,在多种细菌表面存在,并且在细菌的自凝、生物被膜形成、黏附、侵袭及致病过程中发挥着举足轻重的作用。Hia可以介导流感嗜血杆菌对呼吸道上皮细胞的黏附[9];洋葱伯克霍尔德杆菌TAA可以直接与呼吸道上皮和肺细胞表面受体结合,形成“纳米弹簧”样结构,促进细菌黏附细胞和定殖[10];Usp A1可以通过茎部结构域与人CEACAM1受体结合,促进卡他莫拉菌的侵袭作用[11-12]。布鲁氏菌中发现的TAA、BtaE参与了布鲁氏菌与透明质酸的结合,并可黏附到HeLa细胞和人肺泡上皮细胞系A549[13]。最近发现细胞表面的多种受体参与到与TAAs的相互作用中,如Nad A可以通过与β1-整合素和热休克蛋白90 (Hsp90)作用,促进脑膜炎奈瑟氏菌侵袭宿主细胞[14-16]。TAA蛋白家族除了其保守的C端锚定区域外,其茎部序列复杂且多样[2],黏附素受体也存在多样性的特点,为黏附素受体的研究带来很大困难。TAA除了具有多样性的特点外,还具有宿主专一性的特征[3],因此,研究其与特异性宿主的受体相结合成为该蛋白研究的主要突破点。
本课题组前期研究已经证实,BD3参与APP对细胞的黏附作用,并且作用效果极其明显[4]。在研究TAA与宿主细胞结合时,多数研究认为其头部及茎部末端是其结合的主要部位。本研究中的BD3基因位于TAA的2 464-2 574 aa部位,是茎部的中后区域,这为研究TAA与受体结合部位提供了新的补充。
为获得猪肺组织蛋白中与胸膜肺炎放线杆菌TAA结合的蛋白,本研究原核表达并纯化了TAA茎部功能区GST-BD3蛋白,提取猪肺组织全蛋白后通过免疫共沉淀的方法筛选出了能与BD3发生结合的结合蛋白;通过对该蛋白的质谱分析及数据库搜寻获知该蛋白种类为细胞角蛋白1,该蛋白在结合过程中发挥作用的关键部位大多数是某些特定的氨基酸基序。角蛋白1在与人相关的疾病中研究较多,尤其在癌症过程中会发生明显变化[17]。这类疾病在哺乳动物猪中并不常见,所以关于猪源的角蛋白1研究相对较少。据分析,猪的角蛋白1中大约存在9个外显子,使得推测序列显示出很大的不可靠性。因此,构建含有该蛋白的cDNA文库对于下一步研究其与TAA的结合具有重要意义。通过将质谱肽段序列与角蛋白保守区比较,以共有序列为基础设计核酸探针引物,能够有效获得含有目的基因的序列。本实验成功从猪肺组织中提取出符合构建cDNA文库标准的RNA,合成cDNA经纯化后插入连接子,与载体连接并转入大肠杆菌,扩增获得cDNA文库。对文库利用特异性引物进行PCR检测,并将阳性菌株测序以获得猪源细胞角蛋白1的基因序列。
使用生物信息学技术,利用计算机数据库和建立的程序算法分析目的蛋白质、基因,获取其结构与功能、致病机制及进化信息,为实验结果提供客观参考及预测。本实验以测序获得的基因序列为基础,参考数据库中已有资源,通过生物信息学角度拟合,分析细胞角蛋白与TAA结合,为结合蛋白鉴定及研究提供依据。
细胞角蛋白(Cytokeratin,CK)是细胞骨架蛋白中间丝蛋白家族成员[18],该家族大约包括20个分子量在40-60 kD之间的蛋白。细胞角蛋白一般成对出现,形成异源二聚体、四聚体,然后再形成原纤维丝和中间纤维丝,从而具备维持细胞力学完整性及调节细胞周期的作用[19]。细胞角蛋白作为黏附素的特异性受体,在研究肺炎球菌黏附素时认为CK4作为丝氨酸重复序列(SRRP)中NR的结合配体[20],CK10与BR发生特异性结合[21],这些研究表明CK结合受体存在多样性。本研究中BD3主要基序为IsNeck和其后的Trp-ring。研究结果显示CK蛋白能够与多种基序结合,这是由于CK蛋白家族本身具有多样性,同时蛋白本身结构复杂。
目前发现细胞角蛋白1与多种疾病有关,癌症[17, 22]和皮肤类疾病(如银屑病)患者细胞角蛋白1高表达[23],可作为这些疾病的检测指标或治疗靶标;而在炎症性肠病发生时,小肠上皮细胞上的角蛋白1表达显著降低,可能在维持上皮屏障的过程中起着重要作用,并与炎症性肠病的进展相关[24]。本研究发现猪肺组织细胞角蛋白1是胸膜肺炎放线杆菌三聚体自转运黏附素茎部BD3的结合蛋白,该结合蛋白的发现为进一步研究胸膜肺炎放线杆菌三聚体自转运黏附素与猪肺脏上皮细胞的结合及信号传递过程提供参考,为三聚体自转运黏附素与肺组织细胞黏附的机制研究奠定基础,这对于揭示APP专嗜肺组织的致病机制具有重要意义。
| [1] |
Chiers K, de Waele T, Pasmans F, et al. Virulence factors of Actinobacillus pleuropneumoniae involved in colonization, persistence and induction of lesions in its porcine host[J]. Veterinary Research, 2010, 41(5): 65. DOI:10.1051/vetres/2010037 |
| [2] |
Qin WH, Wang L, Lei LC. New findings on the function and potential applications of the trimeric autotransporter adhesin[J]. Antonie van Leeuwenhoek, 2015, 108(1): 1-14. DOI:10.1007/s10482-015-0477-4 |
| [3] |
Kaiser PO, Linke D, Schwarz H, et al. Analysis of the BadA stalk from Bartonella henselae reveals domain-specific and domain-overlapping functions in the host cell infection process[J]. Cellular Microbiology, 2012, 14(2): 198-209. DOI:10.1111/cmi.2012.14.issue-2 |
| [4] |
Xiao LW, Zhou L, Sun CJ, et al. Apa is a trimeric autotransporter adhesin of Actinobacillus pleuropneumoniae responsible for autoagglutination and host cell adherence[J]. Journal of Basic Microbiology, 2012, 52(5): 598-607. DOI:10.1002/jobm.v52.5 |
| [5] |
Wang L, Qin WH, Yang SX, et al. The Adh adhesin domain is required for trimeric autotransporter Apa1-mediated Actinobacillus pleuropneumoniae adhesion, autoaggregation, biofilm formation and pathogenicity[J]. Veterinary Microbiology, 2015, 177(1/2): 175-183. |
| [6] |
Wang L. The mechanisms of trimeric autotransporter adhesion Adh in the interaction between Actinobacillus pleuropneumoniae and host PAMs[D]. Changchun: Doctoral Dissertation of Jilin University, 2015 (in Chinese) 王磊. 三聚体自转运黏附素Adh参与胸膜肺炎放线杆菌与宿主PAMs互作的机制研究[D]. 长春: 吉林大学博士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10183-1015590933.htm |
| [7] |
Wang Y. The study of sequence analysis and adhesion activity of Actinobacillus pleuropneumoniae[D]. Shihezi: Master's Thesis of Shihezi University, 2011 (in Chinese) 王瑜. 胸膜肺炎放线杆菌自转运黏附素序列分析及其黏附活性研究[D]. 石河子: 石河子大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/article/cdmd-10759-1011247754.htm |
| [8] |
Sambrook J, Russell DW. Molecular Cloning[M]. Translated by Huang PT. Beijing: Science Press, 2002: 889-894 (in Chinese) 萨姆布鲁克J, 拉塞尔DW. 分子克隆实验指南[M]. 黄培堂, 译. 北京: 科学出版社, 2002: 889-894 |
| [9] |
Laarmann S, Cutter D, Juehne T, et al. The Haemophilus influenzae hia autotransporter harbours two adhesive pockets that reside in the passenger domain and recognize the same host cell receptor[J]. Molecular Microbiology, 2002, 46(3): 731-743. DOI:10.1046/j.1365-2958.2002.03189.x |
| [10] |
El-Kirat-Chatel S, Mil-Homens D, Beaussart A, et al. Single-molecule atomic force microscopy unravels the binding mechanism of a Burkholderia cenocepacia trimeric autotransporter adhesin[J]. Molecular Microbiology, 2013, 89(4): 649-659. DOI:10.1111/mmi.2013.89.issue-4 |
| [11] |
Hill DJ, Edwards AM, Rowe HA, et al. Carcinoembryonic antigen-related cell adhesion molecule: (CEACAM)-binding recombinant polypeptide confers protection against infection by respiratory and urogenital pathogens[J]. Molecular Microbiology, 2005, 55(5): 1515-1527. DOI:10.1111/j.1365-2958.2005.04487.x |
| [12] |
Conners R, Hill DJ, Borodina E, et al. The Moraxella adhesin UspA1 binds to its human CEACAM1 receptor by a deformable trimeric coiled-coil[J]. The EMBO Journal, 2008, 27(12): 1647-1789. DOI:10.1038/emboj.2008.102 |
| [13] |
Ruiz-Ranwez V, Posadas DM, van der Henst C, et al. BtaE, an adhesin that belongs to the trimeric autotransporter family, is required for full virulence and defines a specific adhesive pole of Brucella suis[J]. Infection and Immunity, 2013, 81(3): 996-1007. DOI:10.1128/IAI.01241-12 |
| [14] |
Cecchini P, Tavano R, de Laureto PP, et al. The soluble recombinant Neisseria meningitidis adhesin NadA△351-405 stimulates human monocytes by binding to extracellular Hsp90[J]. PLoS One, 2011, 6(9): e25089. DOI:10.1371/journal.pone.0025089 |
| [15] |
Montanari P, Bozza G, Capecchi B, et al. Human heat shock protein (Hsp) 90 interferes with Neisseria meningitidis adhesion A (NadA)-mediated adhesion and invasion[J]. Cellular Microbiology, 2012, 14(3): 368-385. DOI:10.1111/j.1462-5822.2011.01722.x |
| [16] |
Bozza G, Capitani M, Montanari P, et al. Role of ARF6, Rab11 and external Hsp90 in the trafficking and recycling of recombinant-soluble Neisseria meningitidis adhesin A (rNadA) in human epithelial cells[J]. PLoS One, 2014, 9(10): e110047. DOI:10.1371/journal.pone.0110047 |
| [17] |
Ratushny V, Gober MD, Hick R, et al. From keratinocyte to cancer: the pathogenesis and modeling of cutaneous squamous cell carcinoma[J]. The Journal of Clinical Investigation, 2012, 122(2): 464-472. DOI:10.1172/JCI57415 |
| [18] |
Schweizer J, Bowden PE, Coulombe PA, et al. New consensus nomenclature for mammalian keratins[J]. The Journal of Cell Biology, 2006, 174(2): 169-174. DOI:10.1083/jcb.200603161 |
| [19] |
Coulombe PA, Wong P. Cytoplasmic intermediate filaments revealed as dynamic and multipurpose scaffolds[J]. Nature Cell Biology, 2004, 6(8): 699-706. DOI:10.1038/ncb0804-699 |
| [20] |
Samen U, Eikmanns BJ, Reinscheid DJ, et al. The surface protein Srr-1 of Streptococcus agalactiae binds human keratin 4 and promotes adherence to epithelial HEp-2 cells[J]. Infection and Immunity, 2007, 75(11): 5405-5414. DOI:10.1128/IAI.00717-07 |
| [21] |
Shivshankar P, Sanchez C, Rose LF, et al. The Streptococcus pneumoniae adhesin PsrP binds to Keratin 10 on lung cells[J]. Molecular Microbiology, 2009, 73(4): 663-679. DOI:10.1111/mmi.2009.73.issue-4 |
| [22] |
Soudy R, Etayash H, Bahadorani K, et al. Breast cancer targeting peptide binds keratin 1: a new molecular marker for targeted drug delivery to breast cancer[J]. Molecular Pharmaceutics, 2017, 14(3): 593-604. DOI:10.1021/acs.molpharmaceut.6b00652 |
| [23] |
Arul S, Dayalan H, Jegadeesan M, et al. Induction of differentiation in psoriatic keratinocytes by propylthiouracil and fructose[J]. BBA Clinical, 2016, 6: 82-86. DOI:10.1016/j.bbacli.2016.06.002 |
| [24] |
Dong XQ, Liu ZC, Lan DF, et al. Critical role of Keratin 1 in maintaining epithelial barrier and correlation of its down-regulation with the progression of inflammatory bowel disease[J]. Gene, 2017, 608: 13-19. DOI:10.1016/j.gene.2017.01.015 |
 2017, Vol. 44
2017, Vol. 44