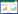扩展功能
文章信息
- 宋祥军, 李春晓, 祁克宗, 涂健, 薛媚, 尹磊
- SONG Xiang-Jun, LI Chun-Xiao, QI Ke-Zong, TU Jian, XUE Mei, YIN Lei
- pagP基因对禽致病性大肠杆菌抗菌肽抗性和致病性的影响
- Effects of pagP gene of avian pathogenic Escherichia coli on its antimicrobial peptide resistance and pathogenicity
- 微生物学通报, 2017, 44(12): 2888-2895
- Microbiology China, 2017, 44(12): 2888-2895
- DOI: 10.13344/j.microbiol.china.170383
-
文章历史
- 收稿日期: 2017-05-26
- 接受日期: 2017-10-09
- 优先数字出版日期(www.cnki.net): 2017-10-16
禽致病性大肠杆菌(Avian pathogenic Escherichia coli,APEC)是肠外致病性大肠杆菌,可以导致禽类出现全身性感染,严重影响全球的养禽业。基因水平研究发现,APEC与人源肠外致病性大肠杆菌基因相似性较高,并有一些共同的毒力基因[1-2]。此外,APEC可以通过食源性途径传播给人类,是人源肠外致病性大肠杆菌毒力基因的潜在贮存宿主[3]。加强对APEC研究,不仅有助于养禽业的发展,也具有较大的公共卫生学意义[4]。
防御素作为最重要的一类抗菌肽,分为α-防御素、β-防御素和θ-防御素,其抗菌谱广,不易产生耐药性[5]。鸡β-防御素2 (Avian beta-defensins 2,AVBD2)是β-防御素家族的重要一员,是一类具有良好应用前景的抗生素替代品。pagP基因广泛存在于各种细菌中,参与调控细菌对抗菌肽的敏感性,Guo等[6]研究发现pagP基因缺失会导致革兰氏阴性菌对多粘菌素B的敏感性增加,Yang等[7]研究发现大肠杆菌pagP基因缺失株对抗菌肽LL-37的抵抗力下降。pagP是棕榈酰转移酶基因,可以对细菌外膜LPS的类脂A进行棕榈酰化[8],类脂A的这种棕榈酰化与细菌的致病性密切相关[9-10]。AVBD2对APEC有较强的抗菌活性[11],但APEC的pagP基因对AVBD2的敏感性以及细菌毒力的作用尚不清楚。本研究利用Red重组系统构建禽致病性大肠杆菌pagP基因缺失株,研究pagP基因缺失后APEC对抗菌肽AVBD2的敏感性的变化,以及细菌致病性的影响,为进一步研究pagP基因在APEC与抗菌肽互作和致病中的作用提供理论依据。
1 材料与方法 1.1 载体、菌株、细胞和试验动物禽致病性大肠杆菌AE17菌株为安徽临床分离株,O2血清型[12]。大肠杆菌DH5α感受态细胞、鸡胚成纤维细胞(DF-1)、pKD3、pKD46、pCP20、pSTV-28a、pZero-back载体均由安徽农业大学兽医病理生物学与疫病防控安徽省重点实验室保存;罗曼鸡购自安徽省安禽禽业有限公司。
1.2 主要药物、试剂、培养基和仪器氯霉素、氨苄青霉素、多粘菌素B、酵母提取物、胰蛋白胨、氯化钠、琼脂糖、质粒小量提取纯化试剂盒和双抗储存液均购自生工生物工程(上海)股份有限公司;AVBD2通过本实验室建立的方法制备[12];L-阿拉伯糖购自Sigma公司;SYBR Green PCR Master Mix、RNA反转录试剂盒购于美国Promega公司;2×PCR Mix、高保真PCR Mix、DNA Marker均购自宝生物工程(大连)有限公司;DMEM基本培养液购自Life公司;胎牛血清购自HyClone公司。
磷酸盐缓冲液(PBS,g/L):NaCl 8.0,KCl 0.2,KH2PO4 0.2,pH 7.2,1×105 Pa高压灭菌15 min。LB培养基(g/L):NaCl 10.0,胰蛋白胨10.0,酵母提取物5.0,pH 7.4,固体培养基加入终浓度为1.5% (质量体积比)的琼脂,1×105 Pa高压灭菌15 min。运动性培养基(g/L):胰蛋白胨10.0,NaCl 5.0,葡萄糖8.0,琼脂3.0,刚果红0.05,0.8×105 Pa高压灭菌30 min。
高速冷冻离心机,德国Sigma公司;PCR扩增仪,美国Bio-Rad公司;凝胶成像系统,北京新技术公司;电转化仪,美国BTX公司;紫外分光光度计,日本岛津公司;核酸蛋白分析仪,美国Thermo Fisher公司;荧光分光光度计,日本HITACHI公司。
1.3 引物设计根据NCBI GenBank公布的禽致病性大肠杆菌pagP基因序列,利用Premier 5.0软件分别设计引物(表 1):pagP基因上下游序列的2对引物pagP-UF/pagP-UR和pagP-DF/pagP-DR;扩增氯霉素抗性基因的引物Cat-lap-pagP-F/Cat-lap-pagP-R;构建pagP基因回复株的引物pagP-C-BamH Ⅰ-F/pagP-C-Hind Ⅲ-R;鉴定pagP基因缺失株和回复株引物pagP-R/pagP-F、pagP-out-F/pagP-out-R、pagP-IF/pagP-IR、pagP-UF/Cat-lap-pagP-R。通过M13-R/M13-F鉴定含有pagP回复片段与pSTV-28a载体是否连接成功。其中pagP-UR、pagP-DR、pagP-DF/pagP-DR与Cat-lap-pagP-F/Cat-lap-pagP-R引物5′端均带有用于进行重叠PCR (Overlap-PCR)的反向互补的20个碱基。
| 引物 Primers |
序列 Sequence (5′→3′) |
大小 sizes (bp) |
| pagP-UF | GCGAGCTACACCCACAAT | 787 |
| pagP-UR | AAGCAGCTCCAGCCTACAAATGTTCAGGCTGT | |
| Cat-lap-pagP-F | GGCAACAGCCTGAACATTTGTAGGCTGGAGCT | 1 013 |
| Cat-lap-pagP-R | GCATCCAGGCAAAGTACACATATGAATATCCT | |
| pagP-DF | AGGATATTCATATGTGTACTTTGCCTGGATGC | 940 |
| pagP-DR | CACCTCCTGTCAGAGTCGTA | |
| pagP-IF | GATTTATATATTCCTGCCATCACCT | 384 |
| pagP-IR | CCCGGAATGTAGGTCATCTGA | |
| pagP-out-F | ACCAGAATAGTGATGATG | 2 961 |
| pagP-out-R | CATCAACGAGCCACAAATCT | |
| pagP-C-BamH Ⅰ-F | CGCGGATCCCGATGAACGTGAGTAAATATG | 1 249 |
| pagP-C-Hind Ⅲ-R | CCCAAGCTTGTCAGCCGTCTTCCGGAGT | |
| pagP-UF | GCGAGCTACACCCACAAT | 1 155 |
| Cat-lap-pagP-R | GCGTGTTACGGTGAAAACCTGGCCTAT | |
| pagP-F | ATGAACGTGAGTAAATA | 547 |
| pagP-R | GCATCCAGGCAAAGTACA | |
| M13-R | TTGTAAAACGACGGCCAG | 918 |
| M13-F | CAGGAAACAGCTATGACC |
扩增pagP基因上下游同源臂序列以及氯霉素抗性片段,使用Overlap-PCR的方法扩增出含有氯霉素抗性基因的pagP同源重组片段。将同源重组片段电转化导入含有pKD46的AE17的感受态细胞[13]。氯霉素阳性重组子进行PCR鉴定后,电转导入pCP20质粒,在含有双抗性LB平板上28 ℃培养48 h。将阳性转化子42 ℃、200 r/min培养过夜后,PCR鉴定氯霉素抗性是否消除并测序。鉴定成功的阳性重组子菌株命名为ΔpagP。
1.5 回复株的构建以AE17菌株基因组为模板,扩增出含有启动子的pagP基因回复片段,进行Hind Ⅲ和BamH Ⅰ双酶切,与pSTV-28a载体连接,转化E. coli DH5α,PCR鉴定并测序。提取pSTV-28a-pagP质粒,提取的质粒电转化导入pagP基因缺失株ΔpagP中,鉴定成功的菌株命名为CpagP。
1.6 生长曲线测定平板上挑取AE17 (野生株)、ΔpagP (缺失株)和CpagP (回复株)的单菌落接种到LB液体培养基中,37 ℃、200 r/min条件下培养,每间隔1 h取样测定OD600数值,根据OD600数值绘制出细菌的生长曲线。上述试验重复3次。
1.7 运动性测定从平板上挑取AE17、ΔpagP和CpagP的单菌落接种到LB液体培养基中,在对数期3 000 r/min离心5 min,弃上清后PBS洗涤。分别将AE17、ΔpagP和CpagP的菌液调到OD600为1.0,取10 µL滴于运动性培养基中央,然后在37 ℃培养箱中培养过夜,次日记录菌圈大小。上述试验重复3次。
1.8 细胞的黏附和入侵试验DF-1细胞接种于24孔细胞培养板中,将AE17、ΔpagP和CpagP按MOI为200加入24孔细胞培养板中。500 r/min离心5 min,细胞培养箱中37 ℃、5% CO2条件下孵育1.5 h,PBS洗涤。黏附细胞试验组加入0.5% Triton X-100 (200 µL/孔),室温作用10 min,采用平板计数法[14]进行细菌计数。入侵细胞试验组每孔加入1 mL DMEM完全培养液,二氧化碳细胞培养箱中37 ℃培养1 h,PBS洗涤,加入0.5% Triton X-100裂解细胞(200 µL/孔),平板计数法进行细菌计数[14]。以上试验重复3次。
1.9 生物被膜形成能力检测将AE17、ΔpagP和CpagP菌株培养至对数中期,采用改良结晶紫半定量法[15]。检测生物被膜形成能力:将菌液稀释到OD600为0.1,每孔加入200 µL菌液,LB培养基作为对照,置于37 ℃培养30 h,弃去培养液,PBS洗3次,自然风干;每孔100 µL 0.1%结晶紫,室温染色30 min,PBS洗3次,自然风干;加入乙醇,酶标仪测定OD595。以上试验重复3次。
1.10 外膜渗透性的测定细菌外膜渗透性的检测采用NPN探针法[16],将37 ℃、200 r/min培养过夜的AE17、ΔpagP和CpagP菌液转接至LB液体培养基(30 mL),培养至OD600为1.2。3 000 r/min离心5 min收集菌体,PBS洗涤后重悬(OD600为0.5)。分别取AE17、ΔpagP和CpagP菌株1.92 mL的菌悬液、NPN溶液(1 mmol/L) 80 μL,加入石英比色皿迅速混匀,测量其荧光吸收值。以上试验重复3次。
1.11 抗菌肽的敏感性检测从培养平板分别挑取AE17、ΔpagP和CpagP菌株的单菌落,37 ℃、200 r/min培养过夜后取10 µL培养的菌液,加入待凝固的LB固体培养基中,混匀后倒平板。用7 mm打孔器打孔。孔内分别点接等体积的多粘菌素B (2.5 μg/mL)、AVBD2[17](32 μg/mL),对照组加入PBS。置于37 ℃培养24 h,记录抑菌圈的直径。试验重复3次。
1.12 半数致死量(LD50)的测定7日龄罗曼鸡,随机分为6组,每组8只。将AE17、ΔpagP和CpagP培养至对数期,PBS洗涤后重悬。采用腿部肌肉注射进行攻毒1 mL,攻毒剂量分别为:1×107、1×106、1×105、1×104、1×103 CFU/mL。攻毒后连续观察7 d,记录发病死亡情况,采用改良寇氏法[18]计算半数致死量(LD50)。
1.13 统计分析试验数据采用SPSS 17.0软件进行单因素方差分析,所得结果以“平均值±标准误”表示。P < 0.01为差异极显著,P < 0.05为差异显著,有统计学意义。
2 结果与分析 2.1 pagP缺失株和回复株的鉴定采用Red同源重组的方法构建pagP基因缺失株,通过特异性引物进行PCR鉴定。以pagP-R/pagP-F为引物,AE17野生菌株扩增出547 bp的pagP基因片段,pagP基因缺失株(ΔpagP)扩增不出目的片段(图 1A)。以pagP-out-R/pagP-out-F为引物,AE17、ΔpagP菌株分别扩增出2 961 bp和2 570 bp的目的片段(图 1A),测序表明pagP基因缺失株ΔpagP成功构建。将pagP基因回复片段连接到pSTV-28a载体,电转导入pagP缺失株,以M13-R/M13-F对电转后CpagP进行PCR鉴定(图 1B),扩增出918 bp的目的条带,PCR产物测序结果显示成功构建CpagP基因回复株。

|
| 图 1 PCR鉴定缺失株ΔpagP (A)和回复株CpagP (B) Figure 1 PCR analysis of mutant strain ΔpagP (A) and complementary strain CpagP (B) 注:A:M:DL5000 DNA相对分子质量标准;1:AE17菌株pagP-R/pagP-F引物鉴定;2:缺失株pagP-R/pagP-F引物鉴定;3:pagP-out-R/pagP-out-F引物阴性对照;4:AE17菌株pagP-out-R/pagP-out-F引物鉴定;5:ΔpagP缺失株pagP-out-R/pagP-out-F引物鉴定. B:M:DL2000 DNA相对分子质量标准;1:M13-R/M13-F为引物阴性对照;2:CpagP菌株M13-R/M13-F引物鉴定. Note: A: M: DNA marker DL5000; 1: Identification of AE17 using pagP-R/pagP-F primers; 2: Identification of mutant strain using pagP-R/pagP-F primers; 3: Negative control of pagP-R/pagP-F primers; 4: Identification of AE17 using pagP-out-R/pagP-out-F primers; 5: Identification of ΔpagP mutant strain using pagP-out-R/pagP-out-F. B: M: DNA marker DL2000; 1: Negative control of M13-R/M13-F primers; 2: Identification of CpagP using M13-R/M13-F primers. |
|
|
用LB培养基培养AE17、ΔpagP和CpagP,进行生长曲线测定,结果如图 2A所示,3株菌都是经历0−2 h的延滞期后,在第2 h进入对数生长期,12 h进入稳定期。与野生株(或回复株)相比,缺失株ΔpagP的在3−14 h生长速度显著降低(P < 0.01),野生株(AE17)和回复株(CpagP)在生长速度上无明显变化(P > 0.05),结果表明pagP基因缺失降低APEC的生长速度。运动能力检测(图 2B)发现ΔpagP的运动性能力较AE17均没有变化(P > 0.05)。
|
| 图 2 生长曲线、运动性能力的测定 Figure 2 Analysis of growth curve and bacterial motility assay 注:A:生长曲线;B:运动性能力的测定. Note: A: Growth curves; B: Motility assay. |
|
|
使用DF-1细胞检测3株菌对DF-1细胞的粘附和入侵能力,结果如图 3所示,缺失株(ΔpagP)与野生株(或回复株)相比,粘附能力和入侵能力均无明显变化(P > 0.05),表明pagP基因不影响APEC对鸡胚成纤维细胞的粘附和入侵能力。
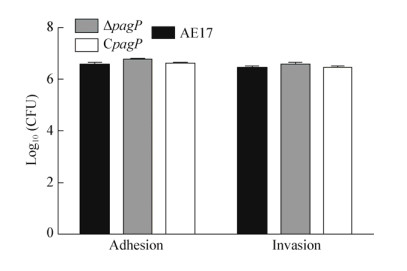
|
| 图 3 pagP缺失株粘附和入侵DF-1细胞能力的比较 Figure 3 The comparision of pagP mutation strains adhesion and invasion of DF-1 cells |
|
|
用改良结晶紫半定量法检测AE17、ΔpagP和CpagP生物被膜形成能力,图 4结果发现缺失株ΔpagP生物被膜形成能力显著高于野生株(P < 0.01),也显著高于回复株(P < 0.01),表明pagP基因缺失株生物被膜形成能力增强。

|
| 图 4 缺失株与野生株生物被膜形成 Figure 4 Biofilm formation of mutants and wild strains |
|
|
利用多粘菌素B和AVBD2检测pagP基因对抗菌肽抑菌效果的作用,如图 5A所示,多粘菌素B试验组的pagP缺失株抑菌圈直径是野生株的1.73倍(P < 0.01),pagP缺失株抑菌圈直径是回复株的1.52倍(P < 0.01);如图 5B所示,AVBD2试验组的pagP缺失株抑菌圈直径是野生株的1.75倍(P < 0.01),pagP缺失株抑菌圈直径是回复株的1.33倍(P < 0.01)。结果表明pagP缺失株对抗菌肽多粘菌素B和AVBD2的敏感性增加。

|
| 图 5 抑菌试验 Figure 5 Antibacterial test 注:A:多粘菌素B抑菌试验;B:AVBD2抑菌试验. Note: A: Antibacterial test using Polymyxin B; B: Antibacterial test using AVBD2. |
|
|
NPN是一种敏感度较高的荧光探针分子,被广泛应用于革兰氏阴性菌细胞外膜渗透性的测定[19]。为了筛选NPN的添加量,分别加入终浓度为10、20、30、40、50 μmol/L的NPN,检测结果(图 6A)表明,30 μmol/L为NPN最适添加终浓度。使用30 μmol/L终浓度的NPN检测AE17、ΔpagP和CpagP相对荧光吸收值(图 6B),pagP缺失株的荧光吸收值是野生株的2.26倍(P < 0.01),pagP缺失株的荧光吸收值是回复株的2.15倍(P < 0.01)。表明pagP基因缺失株外膜通透性增加。

|
| 图 6 不同菌株的荧光吸收值 Figure 6 Fluorescence absorption of E. coli strains 注:A:NPN浓度筛选;B:荧光吸收值检测. Note: A: Screening concentration of NPN; B: Fluorescence absorption assay. |
|
|
通过半数致死量检测pagP基因对APEC致病性的影响,结果如表 2所示,AE17、ΔpagP和CpagP对罗曼蛋雏鸡的半数致死量分别为3.164×104、1.000×106、5.624×104 CFU/mL。表明ΔpagP缺失株的致病性减弱,CpagP回复株的毒力恢复。
| 菌株 Strains |
稀释度Dilutability (CFU/mL) | 生理盐水 Normal saline |
半数致死量 LD50(CFU/mL) |
||||
| 1×107 | 1×106 | 1×105 | 1×104 | 1×103 | |||
| AE17 | 8/8 | 8/8 | 5/8 | 3/8 | 0/8 | 0/8 | 3.164×104 |
| ΔpagP | 8/8 | 8/8 | 4/8 | 0/8 | 0/8 | 0/8 | 1.000×106 |
| CpagP | 8/8 | 8/8 | 4/8 | 2/8 | 0/8 | 0/8 | 5.624×104 |
研究表明pagP基因影响细菌的抗菌肽抗性和致病性,但pagP在禽致病性大肠杆菌中的作用尚不清楚,为研究pagP基因在APEC中的作用,本研究通过Red同源重组的方法构建pagP基因缺失株,并构建pagP基因回复株。生物学特性检测发现缺失株的运动性、DF-1细胞的粘附和入侵能力未发生改变,这是由于PagP是棕榈酰转移酶,对LPS的类脂A进行修饰发挥作用,不影响细菌的粘附和入侵能力。此外,鞭毛是大肠杆菌的运动器官[20],pagP基因缺失并不影响鞭毛的结构和运动特性,因此缺失株运动性未发生变化。pagP缺失株的生长速度降低,这可能是由于大肠杆菌pagP可以对外膜成分LPS的类脂A进行棕榈酰化[21],pagP基因缺失后会影响APEC外膜结构成分的合成,降低了APEC的生长速度。
大肠杆菌细胞壁中LPS为细菌提供了一个保护性的屏障,对菌体起到保护作用。LPS主要由类脂A、核心多糖和O抗原组成,其中类脂A是LPS的疏水基团,可以将亲水性的核心多糖和O抗原粘附在细菌的外表面构成完整的细胞壁[21]。类脂A的修饰在细菌体内受到严格的调控,PagP通过棕榈酰化,将一条十六碳脂肪酸链转移到类脂A上,增加类脂A分子脂肪酸链的数目[4]。研究发现LPS脂肪酸链数目的改变会增强细胞外膜的流动性,影响大肠杆菌的细胞外膜通透性[22],因此禽致病大肠杆菌pagP基因缺失引起LPS脂肪酸链数目的改变,导致细胞外膜的流动性增加,APEC外膜通透性增加。外膜通透性增加会提高细菌往细胞外分泌大分子的量,进一步提高生物被膜的形成量[23],这与本实验中结晶紫法检测发现pagP基因缺失APEC导致生物被膜形成能力增强的结果是一致的。
PagP对类脂A棕榈酰化可以增加外膜的疏水性和范德华力,干扰阳离子抗菌肽的插入,对细菌具有保护作用[8]。因此,pagP基因缺失将影响类脂A棕榈酰化,增加带正电的抗菌肽与带负电荷的类脂A相结合活性。本研究利用阳离子抗菌肽(多粘菌素B和AVBD2)进行试验,发现pagP缺失株对多粘菌素B和鸡β-防御素(AVBD2)敏感性均增加,说明pagP与APEC抗菌肽抗性密切相关。半数致死量的测定发现pagP缺失株的致病性减弱,一方面是由于pagP基因缺失后影响内毒素LPS的合成,引起APEC的毒力减弱;另一方面是由于pagP基因缺失后对鸡体内产生的β-防御素的抵抗力降低。但pagP影响抗菌肽抗性和致病性的具体分子机制有待进一步研究。
| [1] |
Johnson TJ, Kariyawasam S, Wannemuehler Y, et al. The genome sequence of avian pathogenic Escherichia coli strain O1:K1:H7 shares strong similarities with human extraintestinal pathogenic E. coli genomes[J]. Journal of Bacteriology, 2007, 189(8): 3228-3236. DOI:10.1128/JB.01726-06 |
| [2] |
Mora A, López C, Dabhi G, et al. Extraintestinal pathogenic Escherichia coli O1:K1:H7/NM from human and avian origin: detection of clonal groups B2 ST95 and D ST59 with different host distribution[J]. BMC Microbiology, 2009, 9: 132. DOI:10.1186/1471-2180-9-132 |
| [3] |
Ewers C, Antão EM, Diehl I, et al. Intestine and environment of the chicken as reservoirs for extraintestinal pathogenic Escherichia coli strains with zoonotic potential[J]. Applied and Environmental Microbiology, 2009, 75(1): 184-192. DOI:10.1128/AEM.01324-08 |
| [4] |
Johnson TJ, Wannemuehler Y, Kariyawasam S, et al. Prevalence of avian-pathogenic Escherichia coli strain O1 genomic islands among extraintestinal and commensal E. coli isolates[J]. Journal of Bacteriology, 2012, 194(11): 2846-2853. DOI:10.1128/JB.06375-11 |
| [5] |
Wu X, Zhang SQ. Molecular mechanisms of antibacterial peptides against bacterium[J]. Progress in Biochemistry and Biophysics, 2005, 32(12): 1109-1113. 吴希, 张双全. 抗菌肽对细菌杀伤作用的分子机制[J]. 生物化学与生物物理进展, 2005, 32(12): 1109-1113. DOI:10.3321/j.issn:1000-3282.2005.12.002 |
| [6] |
Guo L, Lim KB, Poduje CM, et al. Lipid A acylation and bacterial resistance against vertebrate antimicrobial peptides[J]. Cell, 1998, 95(2): 189-198. DOI:10.1016/S0092-8674(00)81750-X |
| [7] |
Yang H, Fu JY, Zhao YY, et al. Escherichia coli PagP enzyme-based de novo design and in vitro activity of antibacterial peptide LL-37[J]. Medical Science Monitor, 2017, 23: 2558-2564. DOI:10.12659/MSM.902095 |
| [8] |
Bishop RE. The lipid A palmitoyltransferase PagP: molecular mechanisms and role in bacterial pathogenesis[J]. Molecular Microbiology, 2005, 57(4): 900-912. DOI:10.1111/j.1365-2958.2005.04711.x |
| [9] |
Iyer BR, Mahalakshmi R. Distinct structural elements govern the folding, stability, and catalysis in the outer membrane enzyme PagP[J]. Biochemistry, 2016, 55(35): 4960-4970. DOI:10.1021/acs.biochem.6b00678 |
| [10] |
Preston A, Maxim E, Toland E, et al. Bordetella bronchiseptica PagP is a Bvg-regulated lipid A palmitoyl transferase that is required for persistent colonization of the mouse respiratory tract[J]. Molecular Microbiology, 2003, 48(3): 725-736. DOI:10.1046/j.1365-2958.2003.03484.x |
| [11] |
Wei HT, Qi KZ, Wang EQ, et al. Constitutive expression of chicken β-defensin 2 in Pichia pastoris and optimization of its fermentation conditions[J]. Chinese Veterinary Science, 2015, 45(7): 693-699. 魏海婷, 祁克宗, 王尔群, 等. 鸡β防御素2在毕赤酵母中的组成型表达及其发酵条件的优化[J]. 中国兽医科学, 2015, 45(7): 693-699. |
| [12] |
Shao Y, Tu J, Wang XY, et al. The relationship between the core gene irp2、fyuA deletion of the high pathogenicity island and the pathogenicity of APEC[J]. Chinese Journal of Veterinary Science, 2014, 34(4): 564-570. 邵颖, 涂健, 汪雪雁, 等. APEC强毒力岛核心基因irp2、fyuA敲除对其致病性影响的研究[J]. 中国兽医学报, 2014, 34(4): 564-570. |
| [13] |
Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12): 6640-6645. DOI:10.1073/pnas.120163297 |
| [14] |
Han XA, Bai H, Liu L, et al. The luxS gene functions in the pathogenesis of avian pathogenic Escherichia coli[J]. Microbial Pathogenesis, 2013, 55: 21-27. DOI:10.1016/j.micpath.2012.09.008 |
| [15] |
Wang Y, Zhang W, Wu ZF, et al. Reduced virulence is an important characteristic of biofilm infection of Streptococcus suis[J]. FEMS Microbiology Letters, 2011, 316(1): 36-43. DOI:10.1111/fml.2011.316.issue-1 |
| [16] |
Je JY, Kim SK. Antimicrobial action of novel chitin derivative[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2006, 1760(1): 104-109. DOI:10.1016/j.bbagen.2005.09.012 |
| [17] |
Shi SQ, Wei HT, Qi KZ, et al. Tandem expression of chicken β-defensin 2 and analysis of its antimicrobial activity[J]. Chinese Veterinary Science, 2016, 46(4): 516-523. 石水琴, 魏海婷, 祁克宗, 等. 鸡β-防御素2在大肠杆菌中的串联表达及抗菌活性分析[J]. 中国兽医科学, 2016, 46(4): 516-523. |
| [18] |
Reed LJ, Muench H. A simple method of estimating fifty percent endpoints[J]. American Journal of Epidemiology, 1938, 27(3): 493-497. DOI:10.1093/oxfordjournals.aje.a118408 |
| [19] |
Helander IM, Mattila-Sandholm T. Fluorometric assessment of Gram-negative bacterial permeabilization[J]. Journal of Applied Microbiology, 2000, 88(2): 213-219. DOI:10.1046/j.1365-2672.2000.00971.x |
| [20] |
Li RF, He QG, Zhou R, et al. The research advances on the bacterial flagella[J]. Microbiology China, 2005, 32(6): 124-127. 李任峰, 何启盖, 周锐, 等. 细菌鞭毛研究概况及进展[J]. 微生物学通报, 2005, 32(6): 124-127. |
| [21] |
Raetz CRH, Reynolds CM, Trent MS, et al. Lipid a modification systems in gram-negative bacteria[J]. Annual Review of Biochemistry, 2007, 76: 295-329. DOI:10.1146/annurev.biochem.76.010307.145803 |
| [22] |
Lau PCY, Lindhout T, Beveridge TJ, et al. Differential lipopolysaccharide core capping leads to quantitative and correlated modifications of mechanical and structural properties in Pseudomonas aeruginosa biofilms[J]. Journal of Bacteriology, 2009, 191(21): 6618-6631. DOI:10.1128/JB.00698-09 |
| [23] |
Carty SM, Sreekumar KR, Raetz CRH. Effect of cold shock on lipid A biosynthesis in Escherichia coli. Induction at 12 ℃ of an acyltransferase specific for palmitoleoyl-acyl carrier protein[J]. The Journal of Biological Chemistry, 1999, 274(14): 9677-9685. DOI:10.1074/jbc.274.14.9677 |
 2017, Vol. 44
2017, Vol. 44