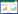扩展功能
文章信息
- 郭芳芳, 王雅蕾, 李忍, 吴晓敏, 黄建国, 杨兵, 徐福洲
- GUO Fang-Fang, WANG Ya-Lei, LI Ren, WU Xiao-Min, HUANG Jian-Guo, YANG Bing, XU Fu-Zhou
- 鸡源和猪源乳杆菌胆盐水解酶的表达及酶学性质比较
- Expression and characterization of bile salt hydrolase from chicken and porcine Lactobacillus
- 微生物学通报, 2017, 44(12): 2871-2877
- Microbiology China, 2017, 44(12): 2871-2877
- DOI: 10.13344/j.microbiol.china.170407
-
文章历史
- 收稿日期: 2017-06-07
- 接受日期: 2017-08-30
- 优先数字出版日期(www.cnki.net): 2017-09-07
为提高畜禽的生产效率,抗生素生长促进剂(Antibiotic growth promoters,AGPs)广泛应用于饲料中,对提高饲料转化率、降低疫病发生率等方面发挥了重要作用[1]。但是AGPs的长期使用产生了一系列问题,如细菌耐药性增加、畜产品抗生素药物残留等,直接威胁人类的健康和食品安全,因此欧盟国家率先禁止了AGPs在动物饲料中的添加[2-3]。目前世界范围内逐渐限制和禁止在动物饲料中添加AGPs已是大势所趋。
随着AGPs的限用和禁用,近年来抗生素替代品的研究成为热点,而揭示AGPs作用机制成为研制抗生素替代品的关键。研究发现,AGPs可显著降低肠道中胆盐水解酶(Bile salt hydrolase,BSH)的活性,促进肠道中脂类的代谢和利用水平,提高了饲料转化率[4]。
BSH是由肠道菌群合成的一种酶,这些肠道菌群包括乳杆菌、双歧杆菌、肠球菌、梭菌、多形杆菌等[5],AGPs既可通过抑制肠道菌群来降低BSH活性,又可直接作用于BSH。BSH的主要功能是水解结合状态的牛磺胆酸盐和甘氨酸胆盐形成氨基酸和游离胆汁酸,游离的胆酸在低pH条件下可与胆固醇结合形成沉淀并被排出体外,从而降低了机体对胆固醇的吸收[6]。然而结合胆盐在肠道中脂类代谢和吸收方面发挥关键作用,BSH的分泌降低了结合胆盐的功能,因此有效的BSH抑制物可能是研制AGPs替代物的一个重要方向,通过抑制BSH提高结合胆盐对脂类代谢的作用[4]。
本试验拟对鸡源BSH[7]和猪源BSH[8]分别进行原核蛋白表达,并通过酶学性质的比较,分析不同来源BSH在酶学性质方面的差异,为鉴定BSH抑制物进而研制AGPs替代物奠定基础。
1 材料与方法 1.1 重组表达质粒分别包含鸡源胆盐水解酶(BSHc)和猪源胆盐水解酶(BSHp)编码基因的重组表达质粒pET21b-BSHc和pET21b-BSHp由美国田纳西大学林军教授惠赠,其中BSHc来自鸡源唾液乳杆菌(Lactobacillus salivarius),BSHp来自猪源嗜酸乳杆菌(Lactobacillus acidophilus)。
1.2 主要试剂和仪器甘氨胆酸(glycocholic acid,GCA)、甘氨脱氧胆酸(glycodeoxycholic acid,GDCA)、甘氨鹅脱氧胆酸(glycochenodeoxycholic acid,GCDCA)、牛磺胆酸(taurocholic acid,TCA)、牛磺脱氧胆酸(taurodeoxycholic acid,TDCA)、牛磺鹅去氧酸(taurochenodeoxycholic acid,TCDCA)购自Sigma-Aldrich公司。蛋白纯化预装柱HisTrap FF 1 mL、HisTrap Desalting 5 mL、AKTA purifier蛋白纯化系统购自GE公司;Mini Trans-blot半干转印仪购自Bio-Rad公司。
1.3 重组蛋白的诱导表达重组表达质粒pET21b-BSHc和pET21b-BSHp分别转化入BL21(DE3)中进行表达。具体表达过程为:重组表达菌株接种于5 mL含100 μg/mL氨苄青霉素的Luria-Bertani (LB)培养基[7]中,37 ℃、180 r/min振荡培养过夜,再以体积比1:100的比例转接于25 mL含100 μg/mL氨苄青霉素的LB培养基中,培养至OD600值为0.6−0.8时,加入IPTG至终浓度为1 mmol/L,37 ℃、180 r/min振荡培养3 h。离心收集细菌沉淀,按体积比10:1加入PBS缓冲液(pH 7.5),超声破碎细菌,经4 ℃、10 000×g离心10 min,分别收集上清和沉淀,SDS-PAGE电泳分析蛋白表达情况。
1.4 SDS-PAGE和Western blot将含有重组表达质粒pET21b-BSHc、pET21b-BSHp及空质粒pET21b的BL21(DE3)培养菌液经超声破碎后进行SDS-PAGE电泳,采用12%分离胶和5%的浓缩胶,电泳后进行考马斯亮蓝染色,鉴定表达情况。将未染色的蛋白电泳胶利用Mini Trans-blot半干转印仪转印至PVDF膜上,经洗膜、封闭后与1:1 000稀释的anti-His单抗反应,再与1:5 000稀释的HRP标记的羊抗鼠二抗反应后进行显色和拍照。
1.5 重组蛋白的纯化将HisTrap FF 1 mL预装柱连接在AKTA purifier蛋白纯化系统,依次泵入10 mL 20%乙醇溶液、纯水和Loading buffer (10 mmol/L咪唑、300 mmol/L NaCl、50 mmol/L Na2HPO4,pH 7.0)用于清洗和平衡柱子;表达菌沉淀经超声处理并离心后取上清液进行0.45 μm滤膜过滤,泵入蛋白纯化系统;然后泵入15 mL Washing buffer (60 mmol/L咪唑,300 mmol/L NaCl,50 mmol/L Na2HPO4,10%甘油,pH 7.0);最后泵入5 mL Elution buffer (300 mmol/L咪唑,300 mmol/L NaCl,50 mmol/L Na2HPO4,10%甘油,pH 7.0)进行蛋白洗脱。根据紫外检测数据收集洗脱液中的表达蛋白。对收集的表达蛋白液进行脱盐处理,首先将HisTrap Desalting 5 mL预装柱连接到纯化系统中,泵入25 mL Dialyzing buffer (50 mmol/L Na2HPO4,10%甘油,pH 7.0),然后加入上述收集的表达蛋白液,根据紫外检测数据收集流出液,SDS-PAGE电泳检测蛋白纯化效果。
1.6 BSH酶活力测定BSH酶活力测定方法参照Wang等[7]方法,即取178 μL 0.1 mol/L PBS缓冲液(pH 6.0),加入100 mmol/L BSH酶解底物10 μL、1 mol/L DTT 2 μL、1 μg/μL BSH蛋白纯化溶液10 μL,振荡混匀后置37 ℃水浴反应30 min。取50 μL反应液加入50 μL 15%三氯乙酸充分混匀终止反应,室温10 000×g离心5 min,所得溶液为酶反应液。取酶反应液50 μL加入950 μL茚三酮混合溶液(溶于0.5 mol/L柠檬酸钠盐缓冲液pH 5.5的1%茚三酮250 μL,甘油600 μL,0.5 mol/L柠檬酸钠盐缓冲液100 μL),沸水浴14 min后置于冰水中冷却3 min,室温下静置5 min,测定OD570吸光值。
1.7 酶学动力学标准曲线的绘制在上述酶活力测定过程中,BSH酶解底物浓度分别设定为10、20、40、60、80、100 mmol/L,测定BSH酶解反应液的OD570吸光值,绘制OD570吸光值和BSH酶解底物浓度的标准曲线,测定结果利用origin软件Hill方程计算相应的Vmax和Km数值。
1.8 温度对BSH酶活力的影响在酶活力测定过程中,酶解底物GCA反应混合液分别置于25、30、35、40、42、45、50、55、60 ℃水浴中进行酶解反应,测定OD570吸光值,鉴定不同反应温度对酶活力的影响。
1.9 pH值对BSH酶活力的影响在酶活力测定过程中,将酶解底物GCA反应混合液中PBS缓冲液的pH值分别设定为3.0、3.4、4.0、4.4、5.0、5.4、6.0、6.5、7.0、7.5、8.0,进行酶解反应,测定OD570吸光值,鉴定反应缓冲液不同pH值对酶活力的影响。
1.10 金属离子对BSH酶活力的影响在酶活力测定过程中,首先将BSH蛋白酶液分别与金属盐KCl、MgSO4、MnSO4、Na2SO4、MnCl2、ZnSO4、ZnCl2、CuCl2、CuSO4、MgCl2、FeCl3、CaCl2、KI混匀后37 ℃水浴反应30 min,反应液中金属离子终浓度为10 mmol/L,然后加入酶解底物GCA进行酶解反应,同时以不添加金属盐的酶解反应作为对照,测定OD570吸光值。以不添加金属盐的酶活力为100%,金属盐对酶活力的抑制百分率(%)=100×(不添加金属盐的酶活力平均值−添加金属盐的酶活力平均值)/不添加金属盐的酶活力平均值,通过计算抑制百分率鉴定不同金属离子对酶活力的影响。
2 结果与分析 2.1 BSH原核表达与蛋白纯化结果BSHc基因长度为975 bp,编码324 aa,分子量大小约为37 kD;BSHp基因长度为951 bp,编码316 aa,分子量大小约为35 kD。BSHc和BSHp基因片段在原核表达载体pET21b中表达及纯化产物经SDS-PAGE电泳分析结果如图 1A (BSHc)和图 1B (BSHp)所示,结果显示两个基因片段均表达良好;表达蛋白与anti-His单抗进行的Western blot检测结果显示BSHc和BSHp在相应位置均与anti-His单抗反应显示单一的条带(图 1C),结果提示携带His标签的表达蛋白大小与预期一致。
|
| 图 1 BSH原核表达、纯化及Western blot结果 Figure 1 Prokaryotic expression, product purification and Western blot of BSH 注:A:BSHc基因表达及纯化结果. M:蛋白Marker;1−4:不同洗脱收集管中的纯化产物;5:诱导前的细菌裂解液;6−9:诱导后3、4、5、6 h的细菌裂解液. B:BSHp基因表达及纯化结果. M:蛋白Marker;1:上柱纯化前的表达产物;2:诱导前的细菌裂解液;3−6:诱导后3、4、5、6 h的细菌裂解液;7−10:不同洗脱收集管中的纯化产物. C:Western blot检测结果. M1:预染Marker;1:pET21b;2:BSHc;3:BSHp. Note: A: Prokaryotic expression and product purification of BSHc. M: Protein marker; 1−4: Purified products in different elution collection tubes; 5: Bacterial lysate before induction; 6−9: Bacterial lysates at 3, 4, 5, 6 h after induction. B: Prokaryotic expression and product purification of BSHp. M: Protein Marker; 1: Bacterial lysate for purification; 2: Bacterial lysate before induction; 3-6: Bacterial lysates at 3, 4, 5, 6 h after induction; 7-10: Purified products in different elution collection tubes. C: Detection result of Western blot. M1: Pre-stained protein marker; 1: pET21b; 2: BSHc; 3: BSHp. |
|
|
分别测定了BSHc和BSHp对6种胆盐底物GCA、GDCA、GCDCA、TCA、TDCA、TCDCA的酶活力,并绘制不同底物浓度下的酶学动力学标准曲线,利用origin软件Hill方程计算相应的Vmax和Km数值,计算结果如表 1所示。结果显示,BSHc和BSHp对甘氨结合胆盐的水解效率显著高于牛磺结合胆盐;BSHc对甘氨结合胆盐的水解效率较BSHp高。
| 底物 Substrate |
Vmax (µmol/(min·mg)) | Km (mmol/L) | |||
| BSHc | BSHp | BSHc | BSHp | ||
| GCA | 118.95 | 91.30 | 41.62 | 35.72 | |
| GDCA | 115.06 | 80.86 | 40.29 | 30.82 | |
| GCDCA | 95.99 | 63.89 | 39.32 | 46.89 | |
| TCA | 41.05 | 52.59 | 61.35 | 52.97 | |
| TDCA | 39.32 | 46.30 | 57.72 | 68.34 | |
| TCDCA | 46.42 | 27.47 | 37.61 | 59.52 | |
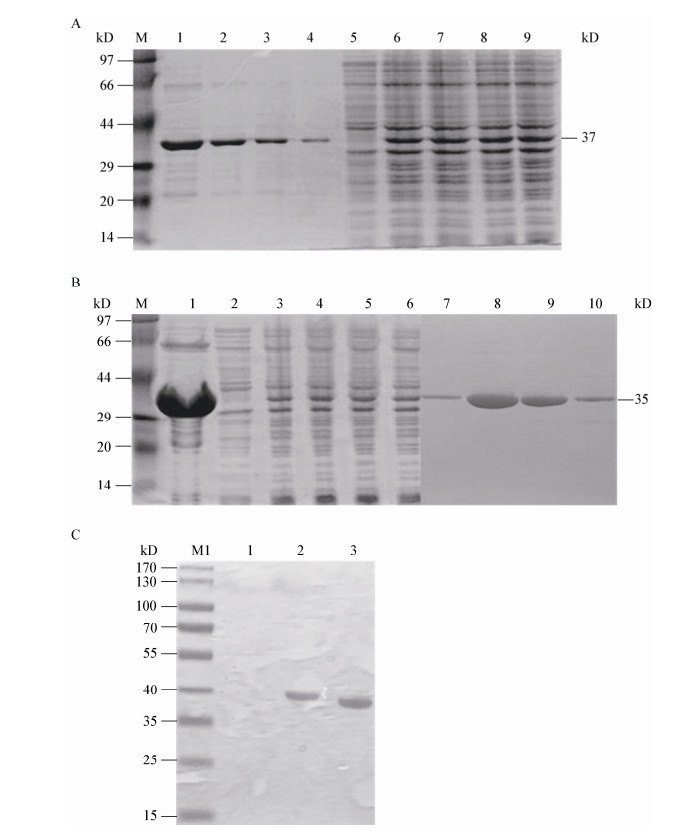
温度对BSHc和BSHp酶活力影响的测定结果如图 2所示。结果显示,BSHc在温度介于35−50 ℃之间时酶活力较高,45 ℃时达到最高;而BSHp在温度介于35−45 ℃之间时酶活力较高,42 ℃时达到最高。在35−55 ℃之间,温度为42 ℃时BSHc和BSHp酶活力无显著差异,而其它温度时BSHc的酶活力高于BSHp,特别是在45 ℃时两者差异显著,这可能是由于鸡肠道内的正常温度显著高于猪,鸡源BSH在此温度下可发挥更高酶活力的原因。
|
| 图 2 温度对BSH酶活力的影响 Figure 2 Effect of temperature on BSH activity |
|
|
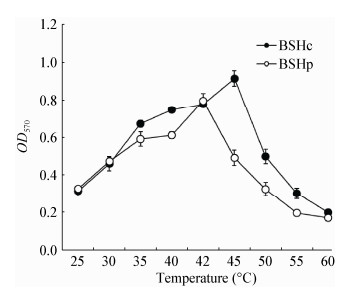
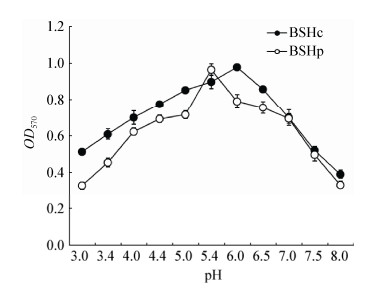
pH值对BSHc和BSHp酶活力影响的测定结果如图 3所示。结果显示,BSHc在pH值介于4.0−7.0之间时酶活力较高,pH 6.0时酶活力最高;BSHp同样在pH值介于4.0−7.0之间时酶活力较高,pH 5.4时酶活力最高。结果提示在pH值为4.0−7.0的胃酸环境中BSHc和BSHp均可保持较高的酶活力。
|
| 图 3 pH值对胆盐水解酶的酶活力影响 Figure 3 Effect of pH on BSH activity |
|
|
为测定不同种类的金属离子对BSH酶活力的影响,本试验选择含有Na+、K+、Cu2+、Mg2+、Mn2+、Zn2+、Fe3+、Ca2+的14种金属盐类添加至酶反应液中,通过与未添加金属盐的酶活力进行比较计算出不同金属离子对BSH酶活力的抑制百分率,测定结果如表 2所示。结果显示,含有Cu2+、Fe3+、Mn2+和Zn2+的金属盐对BSHc和BSHp的酶活力均具有不同程度的抑制作用,特别是Cu2+和Fe3+抑制作用比较强;含有Na+、K+、Mg2+和Ca2+的金属盐对BSHc和BSHp酶活力的抑制作用相对较弱或无抑制作用,但也有例外,如KIO3对BSHc和BSHp酶活力的抑制作用最强,KI和CaCl2对BSHp酶活力也具有较强的抑制作用。结果提示BSHc和BSHp在与金属离子相互作用的酶活性位点方面存在差异。
| 金属盐 Compound |
BSHc抑制率 inhibition of BSHc (%) |
BSHp抑制率 inhibition of BSHp (%) |
| KIO3 | 89.89 | 78.51 |
| CuCl2 | 89.72 | 76.69 |
| CuSO4 | 89.08 | 77.52 |
| FeCl3 | 75.81 | 50.91 |
| MnSO4 | 36.89 | 23.31 |
| ZnSO4 | 35.92 | 42.64 |
| MnCl2 | 29.05 | 17.85 |
| ZnCl2 | 22.01 | 23.64 |
| MgSO4 | 11.08 | -4.46 |
| KCl | 9.06 | -13.72 |
| KI | -1.46 | 61.65 |
| Na2SO4 | -1.78 | -21.82 |
| MgCl2 | -3.32 | -0.17 |
| CaCl2 | -8.82 | 46.94 |
在肠道微环境中,能够分泌BSH的微生物均可接触到胆盐,这些微生物主要包括乳杆菌和双歧杆菌等[5, 9],目前已在多种乳杆菌中鉴定了BSH的酶活性并对其编码基因进行了研究[7-8, 10-11]。研究还发现,乳杆菌基因组中可以编码1−4种BSH酶,其长度通常为316−338 aa之间,不同BSH酶在酶活性和性质方面存在显著差异[5]。本试验利用鸡源唾液乳杆菌和猪源嗜酸乳杆菌中获取的BSH基因进行表达和纯化后比较其酶学性质,结果也显示两种BSH在酶活性、温度、pH和抑制物方面均存在一些差异。
本试验分别测定了BSHc和BSHp对6种胆盐底物的酶活力,利用origin软件Hill方程计算相应的Vmax和Km数值,数据拟合符合Hill方程,推测BSH属于变构酶,底物可能与酶的一个亚基上的活性中心结合后,通过构象的改变,增强其它亚基活性中心与底物的结合。此外,本试验在反应体系中加入DTT会使动力学曲线的S型消失,需要通过数据拟合,符合米式动力学,提示DTT影响催化活性中心半胱氨酸的巯基作用,从而阻碍了底物与酶的活性中心结合而造成其它亚基构象改变,最终底物与酶之间的正协同效应消失。
在酶反应体系中温度和pH值均是非常重要的影响因素。Oh等[8]对嗜酸乳杆菌BSH测定结果显示最适温度和pH值分别为40 ℃和6.0;Wang等[7]对唾液乳杆菌BSH测定结果显示最适温度和pH分别为41 ℃和5.5。本试验对BSHc和BSHp测定得出相似的结果,BSHc在温度40 ℃、pH 6.0时酶活力较高;BSHp在温度30 ℃、pH 7.0时酶活力较高;而在温度超过50 ℃或低于30 ℃、pH高于9.0或低于3.0等条件下酶活力急剧降低。
利用BSH在人和动物脂类和胆固醇代谢方面发挥的重要作用[5],将BSH研究与人类控制体重及减肥[6, 12]结合在一起,已成为目前的研究热点,如在小鼠中过量表达BSH来提高其酶活性可显著降低小鼠的体重、血清中胆固醇以及肝脏甘油三酯的含量[6]。除过量表达BSH来控制体重外,通过抑制BSH活性筛选AGPs替代物也是目前的一个研究热点[4]。由于AGPs可显著降低肠道中BSH的活性,更多的结合态胆盐参与脂类代谢和吸收,促进肠道中脂类利用水平,提高饲料转化率,因而通过筛选BSH抑制剂来研制AGPs替代物将具有重要意义[13]。本试验结果显示,含有Cu2+、Fe3+、Mn2+和Zn2+的金属盐对BSH酶活力均具有不同程度的抑制作用,特别是Cu2+和Fe3+抑制作用比较强;其它研究报道也得出类似的结论[7]。进一步研究显示,利用高通量药物筛选系统对BSH抑制剂进行筛选,不但常用的AGPs如四环素、洛克沙胂等被鉴定具有较好的BSH抑制效果,而且一些新的BSH抑制剂如核黄素、CAPE等也被鉴定出来[14]。
目前,我们已对BSHc进行了晶体结构解析[15],对BSH与底物或抑制物结合的机制研究也在进行中,利用筛选的BSH抑制剂进行鸡生长试验,初步显示具有明显的促生长效果,在这些研究结果的基础上对筛选的BSH抑制剂进一步深入研究,将具有发展成为AGPs替代物的潜力。
| [1] |
Dibner JJ, Richards JD. Antibiotic growth promoters in agriculture: history and mode of action[J]. Poultry Science, 2005, 84(4): 634-643. DOI:10.1093/ps/84.4.634 |
| [2] |
Wegener HC. Antibiotics in animal feed and their role in resistance development[J]. Current Opinion in Microbiology, 2003, 6(5): 439-445. DOI:10.1016/j.mib.2003.09.009 |
| [3] |
Millet S, Maertens L. The European ban on antibiotic growth promoters in animal feed: From challenges to opportunities[J]. The Veterinary Journal, 2011, 187(2): 143-144. DOI:10.1016/j.tvjl.2010.05.001 |
| [4] |
Lin J. Antibiotic growth promoters enhance animal production by targeting intestinal bile salt hydrolase and its producers[J]. Frontiers in Microbiology, 2014, 5: 33. |
| [5] |
Begley M, Hill C, Gahan CGM. Bile salt hydrolase activity in probiotics[J]. Applied and Environmental Microbiology, 2006, 72(3): 1729-1738. DOI:10.1128/AEM.72.3.1729-1738.2006 |
| [6] |
Joyce SA, macSharry J, Casey PG, et al. Regulation of host weight gain and lipid metabolism by bacterial bile acid modification in the gut[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(20): 7421-7426. DOI:10.1073/pnas.1323599111 |
| [7] |
Wang Z, Zeng XM, Mo YM, et al. Identification and characterization of a bile salt hydrolase from Lactobacillus salivarius for development of novel alternatives to antibiotic growth promoters[J]. Applied and Environmental Microbiology, 2012, 78(24): 8795-8802. DOI:10.1128/AEM.02519-12 |
| [8] |
Oh HK, Lee JY, Lim SJ, et al. Molecular cloning and characterization of a bile salt hydrolase from Lactobacillus acidophilus PF01[J]. Journal of Microbiology and Biotechnology, 2008, 18(3): 449-456. |
| [9] |
Patel AK, Singhania RR, Pandey A, et al. Probiotic bile salt hydrolase: current developments and perspectives[J]. Applied Biochemistry and Biotechnology, 2010, 162(1): 166-180. DOI:10.1007/s12010-009-8738-1 |
| [10] |
Gu XC, Luo XG, Wang CX, et al. Cloning and analysis of bile salt hydrolase genes from Lactobacillus plantarum CGMCC No.8198[J]. Biotechnology Letters, 2014, 36(5): 975-983. DOI:10.1007/s10529-013-1434-9 |
| [11] |
Jones BV, Begley M, Hill C, et al. Functional and comparative metagenomic analysis of bile salt hydrolase activity in the human gut microbiome[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(36): 13580-13585. DOI:10.1073/pnas.0804437105 |
| [12] |
Joyce SA, Shanahan F, Hill C, et al. Bacterial bile salt hydrolase in host metabolism: Potential for influencing gastrointestinal microbe-host crosstalk[J]. Gut Microbes, 2014, 5(5): 669-674. DOI:10.4161/19490976.2014.969986 |
| [13] |
Lin J, Negga R, Zeng XM, et al. Effect of bile salt hydrolase inhibitors on a bile salt hydrolase from Lactobacillus acidophilus[J]. Pathogens, 2014, 3(4): 947-956. DOI:10.3390/pathogens3040947 |
| [14] |
Smith K, Zeng X, Lin J. Discovery of bile salt hydrolase inhibitors using an efficient high-throughput screening system[J]. PLoS One, 2014, 9(1): e85344. DOI:10.1371/journal.pone.0085344 |
| [15] |
Xu FZ, Guo FF, Hu XJ, et al. Crystal structure of bile salt hydrolase from Lactobacillus salivarius[J]. Aca Crystallographica Section F, 2016, 72(5): 376-381. |
 2017, Vol. 44
2017, Vol. 44