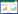扩展功能
文章信息
- 孙翠丽, 程汝佳, 张阁, 程君生, 朱良全, 蒋卉, 丁家波
- SUN Cui-li, CHENG Ru-jia, ZHANG Ge, CHENG Jun-sheng, ZHU Liang-quan, JIANG Hui, DING Jia-bo
- 布鲁氏菌病荧光偏振抗体检测方法的建立
- Development of fluorescence polarization method in Brucellosis antibody detection
- 微生物学通报, 2017, 44(12): 2822-2829
- Microbiology China, 2017, 44(12): 2822-2829
- DOI: 10.13344/j.microbiol.china.170482
-
文章历史
- 收稿日期: 2017-07-03
- 接受日期: 2017-10-30
- 优先数字出版日期(www.cnki.net): 2017-11-01
2. 山东农业大学动物科技学院 山东 泰安 271018
2. College of Animal Science and Veterinary Medicine, Shandong Agriculture University, Taian, Shandong 271018, China
布鲁氏菌(Brucella)是一种胞内寄生革兰氏阴性菌,能引起人和多种动物的急性和慢性感染[1],布鲁氏菌病(简称“布病”)以流产和发热为特征[2],能够导致母畜流产、早产、不孕不育和产奶量下降,以及公畜睾丸炎和个体瘦弱等临床症状[3]。更严重的是,人感染布鲁氏菌后往往难以治愈,从而造成严重的公共卫生问题。近年来,布病感染病例呈回升态势,早期快速检测是治疗和预防布病的关键环节[4]。
布病检测的常规方法包括细菌学和血清学方法。细菌学方法是布病流行、疫情判定及临床诊断中最直接的证据,但存在安全隐患且耗时长,在人群之间病例的检查及暴发调查等紧急情况下并不适用[5]。自Weight在1897年建立了试管凝集反应后,血清学检测技术得到快速的发展和改进,包括各种凝集反应、沉淀反应、补体结合反应、试纸试验、标记抗体技术以及20世纪70年代发展起来的高灵敏度酶联免疫吸附试验[6]。其中补体结合试验(Complement fixation test,CFT)是公认的确诊方法,但其实验条件复杂苛刻[7],结果判断也具有一定主观性,目前在国内很少被采用。试管凝集反应(Serum agglutination test,SAT)敏感性较高,但单独使用时特异性较差,而且部分感染动物的抗体滴度达不到诊断水平,因而也易造成误诊和漏诊[8]。高灵敏度、简便、快速的检测技术正在取代现有的常规测试。
荧光偏振方法(Fluorescence polarisation assay,FPA)是以荧光素标记物作为示踪剂[9]来检测抗原/抗体相互作用的一种简便技术[10],该方法属于同源性分析,分析物不需进行分离,因而该法简便快捷。FPA诊断布鲁氏菌的特异性和敏感性几乎和竞争ELISA (Competitive enzyme-linked immunosorbent assay,C-ELISA)相同[11],一次检测仅需15 min,即可完成上百份样品的检测,可应用于动物群体布鲁氏菌病的检疫、筛查和净化。FPA检测方法在某些发达国家已经得到了大量应用,并经研制开发了商品化FPA检测试剂盒。而我国对FPA检测方法的研究起步较晚,目前尚无商品化FPA检测试剂盒,进出口贸易中牛、羊布鲁氏菌病FPA检测方法均依赖于使用进口试剂盒,因此开发布鲁氏菌荧光偏振抗体检测方法有其现实意义。
本研究使用异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的布鲁氏菌光滑型LPS的小分子片段脂多糖-O-链(O-polysaccharide,OPS)作为抗原,通过对标记抗原、反应条件、结果判断标准等多方面条件的优化,建立敏感性和特异性良好的布鲁氏菌荧光偏振方法,为多种动物布病检测提供快速高通量的新技术手段。
1 材料与方法 1.1 材料 1.1.1 菌种: 猪布鲁氏菌S2菌株(CVCC 70502)由本实验室保存。 1.1.2 实验用血清: 布鲁氏菌病阳性血清国家标准品由本实验保存,布鲁氏菌病阴、阳性血清样本由本实验采集并保存。 1.1.3 主要试剂和仪器: 布鲁氏菌荧光偏振试剂盒购自Diachemix公司;胰大豆肉汤(TSB)和胰大豆琼脂(TSA)购自美国BD公司;异硫氰酸荧光素(FITC)、表面活性剂脱氧胆酸钠(Sodium deoxycholate)、三乙胺购自Sigma公司;SDS-PAGE凝胶制备试剂盒购自康为世纪公司。低温离心机购自Sigma公司;超声破碎仪购自新芝生物科技有限公司;Powerpac Universal通用型电源购自美国Bio-rad公司。 1.2 方法 1.2.1 OPS的提取及标记: (1) OPS提取。鉴定合格的B. suis 2株二级种子,大量培养并灭活,参照世界动物卫生组织(OIE)编著的《陆生动物诊断试验和疫苗手册》[12]提取OPS。上清液置100倍蒸馏水透析过夜,用PEG 8000浓缩40倍,再次置于蒸馏水透析过夜,收集透析袋内容物,分装成2 ml/瓶冻干保存,此即提纯的OPS。(2) OPS鉴定与标记。参照徐先栋等[13]改良的脂多糖快速银染方法对其进行银染。银染鉴定的OPS进行标记,步骤如下:将4 mg OPS加入到2 ml 0.5% (体积比)的三乙胺溶液中,置4超声处理15 min,超声后加入200 μl 100 mmol/L的EDTA溶液,并用10 μl 1 mol/L的盐酸将溶液pH调为5.0。取20 mg FITC (异构体Ⅰ)溶解于800 μl 0.25 mol/L的硼酸溶液(pH 10.5)中,然后全部加入到OPS溶液中,继续超声处理1 min。加入1 ml 1.6%脱氧胆酸钠溶液,37搅拌孵育18 h。4 10 000×g离心30 min,浓缩,透析,将透析物用PD-10柱脱盐,收集所有FITC-OPS标记物,合并后再浓缩,透析,收集透析后产物4保存,即为标记抗原原液。
1.2.2 FPA试剂盒条件优化: (1) FPA步骤。取反应板,将待检血清、阳性对照血清和阴性对照血清分别加入到ELISA板中,20 μl/孔,其中阳性对照血清加1孔(孔1)和阴性对照血清各加3孔(孔2、3、4)。加样过程要注意避免产生气泡。每孔加180 μl样品稀释液,充分混匀。室温下孵育反应板3-5 min。读取每孔的空白值。每孔立即加入10 μl荧光标记抗原,充分混匀。室温下孵育反应板3-5 min。读取每孔偏振值。(2) 布鲁氏菌荧光偏振(FPA)检测试剂盒阴、阳性对照血清的制备。采用虎红平板凝集试验、试管凝集试验及补体结合试验检测临床牛。3种方法均检测为阴性的牛作为制备阴性血清的候选牛。对3种方法均检测为阳性的牛进行强毒株M28免疫,当效价超过800 IU/ml时制备阳性血清。
(3) 布鲁氏菌荧光偏振试剂盒(FPA)标记抗原浓度及稀释液的选择。棋盘法分别采用阴性和阳性血清各两份,通过稀释抗原浓度与选用不同的样品稀释液确定该方法的抗原稀释浓度和最佳样品稀释液。
1.2.3 临界值的确定: 取经虎红平板凝集试验、试管凝集试验、补体结合试验检测均为阳性的血清148份、阴性血清155份,测定偏振值。采用SPSS17.0软件对检测结果进行分析。使用非参数法构建ROC曲线,并以Youden指数最大的切点作为阴性和阳性判断的临界点,同时确定该试剂盒的敏感性和特异性。 1.2.4 重复性试验及保存期试验: 制作3批试剂盒(分别命名为201506、201507、201508),使用由本实验室采集并保存的阳性血清测定试剂盒批内和批间的重复性。 1.2.5 临床样本检验: 将临床采集的400份样品分别使用本实验建立的FPA方法和进口FPA试剂盒进行检测,比较其差异性。 2 结果与分析 2.1 布鲁氏菌S2特性细菌接种后,经37培养2-4 d后在TSA平板上可见菌落边缘整齐、圆润,露滴状,斜光照射逆光观察微带蓝色乳光。革兰氏染色为阴性,显微镜下观察为球杆菌,单个散在。菌落传代培养后进行PCR鉴定的扩增产物用1.5%琼脂糖凝胶进行电泳,出现2条特异性PCR条带,大小分别为178 bp和285 bp (图 1)。
|
| 图 1 布鲁氏菌S2的凝胶电泳图 Figure 1 Gel electrophoresis of Brucella S2 注:M:Marker;1:猪种布鲁氏菌S1330;2:猪种布鲁氏菌S2. Note: M: Marker; 1: Brucella suis S1330; 2: Brucella suis S2. |
|
|
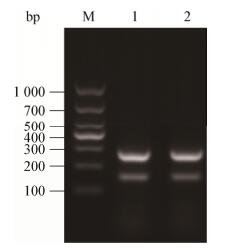
OPS提取物与参照OIE手册提取的LPS比较,主要条带清晰且位置相同,分子量约为10 kD,可与异硫氰酸荧光素结合并用作荧光偏振示踪剂(图 2)。
|
| 图 2 布鲁氏菌S2的OPS银染图 Figure 2 OPS silver staining of Brucella S2 注:M:Marker;1-3:脂多糖;4-5:脂多糖-O-链. Note: M: Marker; 1-3: LPS; 4-5: OPS. |
|
|
二免14 d后采血,观察血清制品色泽为淡黄或微红色澄明液体。按现行《中华人民共和国兽药典》附录进行检验,为无菌生长。测定试管凝集效价,912、936和963号牛进行二次免疫后采用试管凝集试验测定的效价分别为1:900、1:1 000、1:1 200。进一步用阴性对照血清将分离的阳性血清按比例稀释到预期效价为1:320,加入ProClin 300 (SUPELCO公司)至终浓度为0.05%,无菌分装,-20保存备用,作为试剂盒中布病阳性血清。
2.4 阴性对照血清制备血清制品色泽为淡黄或微红色澄明液体。按现行《中华人民共和国兽药典》附录进行检验,为无菌生长。经虎红平板凝集试验、试管凝集试验及补体结合试验检测均为阴性。无菌分装,-20保存备用,作为试剂盒中布病阴性血清。
2.5 样品稀释液选择结果通过对3种样品稀释液的比较,阳性血清反应δmP值最高者作为效果最好的稀释液,结果可知0.5%蔗糖的磷酸缓冲液阳性血清反应δmP值最高。表明含0.5%蔗糖的磷酸缓冲液作为稀释液的稀释效果最好,结果见表 1。
| 样品稀释液 Sample diluent |
阳性血清1 Positive serum1 |
阳性血清2 Positive serum2 |
阴性血清1 Negative serum1 |
阴性血清2 Negative serum2 |
| 碳酸盐缓冲液 Carbonate buffer solution |
96 | 91 | 0 | 4 |
| 磷酸盐吐温缓冲液 PBST |
88 | 84 | -4 | -1 |
| 0.5%蔗糖的磷酸缓冲液 0.5% sucrose phosphate buffer solution |
112 | 109 | -2 | 3 |
| 注:δmP=样品的mP-阴性血清mP的平均值. Note: δmP=Sample mP-negative serum mP. | ||||
标记抗原原液用抗原保护剂(商品化)稀释至250、500、1 000、2 000倍,随着抗原浓度的降低,FPA检测的敏感性逐步提高;当标记抗原作1:1 000倍稀释时,FPA检测方法的灵敏度为5 IU/ml,结果见表 2;与ELISA方法和布鲁氏菌抗体检测试纸条灵敏度一致,因此确定最佳抗原稀释浓度为1:1 000。稀释抗原即为FPA试剂盒标记抗原,于4棕色瓶避光保存,并且标记抗原为无色透明液体,按现行《中华人民共和国兽药典》附录进行检验,无菌生长。
| 血清 serum |
抗原稀释倍数 Antigen dilution factor |
|||
| 1:250 | 1:500 | 1:1 000 | 1:2 000 | |
| 阳性血清1 Positive serum1 |
96 | 46 | 21 | 18 |
| 阳性血清2 Positive serum2 |
90 | 42 | 20 | 15 |
| 阴性血清1 Negative serum1 |
-4 | -2 | 0 | 2 |
| 阴性血清2 Negative serum2 |
-2 | 0 | 1 | 3 |
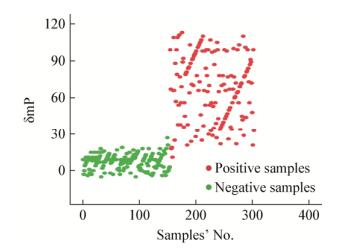
对148份阳性血清和155份阴性血清进行检测,结果阳性血清和阴性血清在2个明显不同的范围之内(图 3)。得到敏感性和特异性相关的ROC曲线(图 4)。
|
| 图 3 148份阳性血清和155份阴性血清检测的结果分布图 Figure 3 Scattergram of detection result for the 148 Brucella positive samples and 155 Brucella negative samples |
|
|

|
| 图 4 ROC曲线 Figure 4 Receiver operating characteristic curve |
|
|
从ROC曲线相关的一系列有关敏感性与特异性的数值中,选择Youden指数最大值作为本方法的临界值。本研究中Youden指数最大值为0.997,所对应的δmP值为20,最终临界值确定为20,此临界值对应的敏感性为98.6%,特异性为98.7%。
2.8 重复性实验3批FPA试剂盒检测梯度稀释阳性对照血清的结果一致,血清效价均检测至1:64倍(δmP值≥20),结果见表 3。3批FPA试剂盒检测已知148份阳性血清的敏感性均为98.0%,说明建立的方法具有良好的重复性,结果见表 4。3批FPA试剂盒检测已知155份阴性血清,特异性均为98.7%,结果见表 5。
| 稀释倍数 Dilution factor |
批号Batch number | |||||||
| 201506 | 201507 | 201508 | ||||||
| δmP值 δmP value |
结果判定 Result determination |
δmP值δmP value | 结果判定 Result determintion |
δmP值δmP value | 结果判定 Result determination |
|||
| 1:2 | 100 | + | 96 | + | 101 | + | ||
| 1:4 | 93 | + | 88 | + | 95 | + | ||
| 1:8 | 80 | + | 82 | + | 81 | + | ||
| 1:16 | 71 | + | 71 | + | 75 | + | ||
| 1:32 | 40 | + | 53 | + | 56 | + | ||
| 1:64 | 34 | + | 30 | + | 36 | + | ||
| 1:128 | 7 | - | 14 | - | 10 | - | ||
| 1:256 | 0 | - | 7 | - | 0 | - | ||
| 1:512 | -2 | - | -1 | - | 2 | - | ||
| 阳性对照mP值 Positive control mP value |
183 | / | 187 | / | 184 | / | ||
| 阳性对照δmP值 Positive control δmP value |
108 | / | 110 | / | 112 | / | ||
| 阴性对照mP平均值 Negative control mP average value |
75 | / | 77 | / | 72 | / | ||
| 注:布鲁氏菌荧光偏振(FPA)检测试剂盒的判定标准为:样本δmP≥20时,布鲁氏菌抗体阳性(标为“+”);样本δmP值< 20时,为布鲁氏菌抗体阴性(标为“-”). Note: Criteria of Brucella fluorescence polarization (FPA) detection kit: sample δmP≥20, Brucella antibody positive (marked “+”); sample δmP < 20, Brucella antibody negative (labeled “-”). | ||||||||
| 201506 | 201507 | 201508 | |
| Di Positive number/total (positive rate, %) |
145/148 (98.0) | 145/148 (98.0) | 145/148 (98.0) |
| 201506 | 201507 | 201508 | |
| 阴性数/总数(阴性率) Negative number/total (negative rate, %) |
153/155 (98.7) | 153/155 (98.7) | 153/155 (98.7) |
在临床检测的400份牛血清样本中,FPA检测试剂盒检测出207份阳性和193份阴性;进口FPA试剂盒检测出209份阳性和191份阴性。检测结果不符的样本为16份,两种试剂盒的总符合率为94%。具体结果见表 6。结果可知两试剂盒符合率较高,说明本试剂盒检测结果较好,弥补了国内FPA试剂盒空缺。
| Brucella FPA | ||||
| P | N | Total | ||
| 荧光偏振试剂盒 FPA kit |
P | 105+95=200 | 3+4=7 | 207 |
| N | 3+6=9 | 88+96=184 | 193 | |
| Total | 209 | 191 | 400 | |
| 符合率 Coincidence rate |
(200+184)/200=94% | |||
由于传统布病诊断方法(如RBPT、SAT、CFT)存在各种缺陷,使其逐步被迅速、简便、特异性和敏感性良好的血清学检测方法(ELISA或FPA)所取代。其中FPA方法简便、快速、通量大、特异性和敏感性都较高,极适合于大批量牛布鲁菌病检疫、筛查和疫病监控,被OIE收录为布鲁氏菌病检测方法之一[14]。在Nielsen等最早建立了检测布鲁氏菌病的FPA检测方法后[15],近年来有许多学者报道建立了对布鲁氏菌病的FPA检测方法。而目前我国布病FPA检测试剂盒研制仍为空白,该方法的样品检测完全依赖进口。本实验建立的FPA方法在特异性、敏感性、稳定性和可操作性方面均达到国际水平,有效解决了我国布病FPA试剂盒依赖进口、价格昂贵的困境。
我国目前使用的布鲁氏菌疫苗主要有3种(均为光滑型):牛种A19、羊种M5、猪种S2[16],其中以S2疫苗株使用最为广泛[17]。猪种布鲁氏菌S2株是目前已知毒力最弱的光滑型布鲁氏菌疫苗株,利用该疫苗株制备FPA抗原,大大降低了细菌培养和OPS制备过程的生物安全风险,减少了生产成本,因此选择提取S2疫苗株的OPS作为标记抗原,以期检测不同种布鲁氏菌的抗体。
检测方法临界值直接影响检测结果的准确性。在统计学上,检测方法的特异性和敏感性往往会呈现矛盾。有学者指出,提高临界值会使特异性提高,减少假阳性的出现,但同时会引起灵敏度的下降[18]。所以,确定合适的临界值对于FPA方法的建立以及后期结果判断十分重要。本研究中,为了客观评价试剂盒的特异性和敏感性,选择了343份RBPT初步检测为布病阳性的田间样本,再用SAT和CFT检测,共确定了148份3种方法均检测为布病阳性的血清作为阳性参照血清,并用同样的方法确定了155份布病阴性参照血清。用建立的FPA方法检测上述背景清楚、数量充足的样本,结果阳性血清和阴性血清基本落在2个明显不同的范围内,说明本方法能够有效区分布病阴、阳性血清;对检测结果进行生物统计分析,得到敏感性和特异性相关的ROC曲线。从ROC曲线相关的一系列有关于敏感性与特异性的数值中,选择Youden指数最大值作为本方法的临界值。本研究中Youden指数最大值为0.997,所对应的δmP值为20,最终临界值确定为20,此临界值对应的敏感性为98.6%,特异性为98.7%。通过向上调整截止值,特异性可以增加到100%,但损失灵敏度。在这种类型的分析中,选择在特定情况下使用的最合适的临界值,取决于特异性和灵敏度要求。
FPA检测方法的敏感性为2-8 IU/ml时,FPA诊断布鲁氏菌的特异性和敏感性几乎和竞争ELISA相同,比较合理。最终确定标记抗原作1:1 000倍稀释时,FPA方法的检测灵敏度与ELISA方法和布鲁氏菌抗体检测试纸条一致,敏感性均为5 IU/ml。
本实验建立了一种布鲁氏菌抗体高通量检测技术,其核心是将提纯的布鲁氏菌光滑型LPS的小分子片段OPS标记上异硫氰酸荧光素,用作抗原。加到待检血清或全血,用于检测多种动物血清中的光滑型布鲁氏菌抗体。检测92份样品,不需要重复洗涤未结合的反应物,可在15 min内完成,大大缩短了高通量检测所需的时间,因此该方法具有极其广阔的应用前景[19]。
4 结论本实验通过抗原、反应条件、结果判定标准多方面条件的优化建立的布鲁氏菌荧光偏振试剂盒具有良好的敏感性和特异性,其敏感性和特异性分别达到98.6%和98.7%。与国内相关布鲁氏菌检测试剂盒相比,本试剂盒具有方便、省时等优点。
| [1] |
Mei JJ, Shi HY. Progress on surface antigens of Brucella spp.[J]. Progress in Veterinary Medicine, 2005, 26(10): 13-18. 梅建军, 石慧英. 布鲁氏菌表面抗原研究进展[J]. 动物医学进展, 2005, 26(10): 13-18. |
| [2] |
Ding JB, Cheng JS, Mou W, et al. Construction of a WboA-deficient Brucella suis S2 strain and its immune effect[J]. Scientia Agricultura Sinica, 2008, 41(8): 2448-2453. 丁家波, 程君生, 牟巍, 等. 布鲁氏菌S2 WboA基因缺失株的构建及免疫效果[J]. 中国农业科学, 2008, 41(8): 2448-2453. |
| [3] |
Wang JL, Hu S, Zheng XH, et al. Preparation and identification of the monoclonal antibody against smooth Brucella LPS[J]. Chinese Journal of Preventive Veterinary Medicine, 2009, 31(8): 642-645, 649. 王加兰, 胡森, 郑孝辉, 等. 光滑型布鲁氏菌LPS单克隆抗体的制备及鉴定[J]. 中国预防兽医学报, 2009, 31(8): 642-645, 649. |
| [4] |
Zi ZC, Kang WH, Ma Y, et al. Fluorescence polarisation assay for detection of brucellosis[J]. Chinese Journal of Zoonoses, 2014, 30(10): 1057-1061. 訾占超, 亢文华, 马英, 等. 荧光偏振技术在布鲁氏菌病检测中的应用[J]. 中国人兽共患病学报, 2014, 30(10): 1057-1061. DOI:10.3969/cjz.j.issn.1002-2694.2014.10.015 |
| [5] |
Zhong YH, Wang P, Song ZZ. Research progress of brucellosis detection[J]. Chinese Journal of Control of Endemic Diseases, 2012, 27(2): 90-93. 钟佑宏, 王鹏, 宋志忠. 布鲁杆菌病检测研究进展[J]. 中国地方病防治杂志, 2012, 27(2): 90-93. |
| [6] |
Weight AE. On the application of the serum test to the differential diagnosis of typhoid and Malta fever: and on the further application of the method of serum diagnosis to the elucidation of certain problems in connexion with the duration of immunity and the geographical distribution of disease[J]. The Lancet, 1897, 149(3836): 656-659. DOI:10.1016/S0140-6736(00)49007-0 |
| [7] |
Nielsen K. Diagnosis of brucellosis by serology[J]. Veterinary Microbiology, 2002, 90(1/4): 447-459. |
| [8] |
Zeng RX, Su YH. Comparison of various detection methods of Brucella[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2006(5): 65-70. 曾瑞霞, 苏玉虹. 布鲁氏杆菌各类检测方法的比较[J]. 现代畜牧兽医, 2006(5): 65-70. |
| [9] |
Nielsen K, Gall D, Jolley M, et al. A homogeneous fluorescence polarization assay for detection of antibody to Brucella abortus[J]. Journal of Immunological Methods, 1996, 195(1/2): 161-168. |
| [10] |
Millet DB, Guenther A, Siegel DA, et al. Global atmospheric budget of acetaldehyde: 3-D model analysis and constraints from in-situ and satellite observations[J]. Atmospheric Chemistry and Physics, 2009, 10(7): 3405-3425. |
| [11] |
Zhao C, Zhang L, Ni Y. Development of fluorescence polarization in life sciences[J]. Progress in Modern Biomedicine, 2010, 10(16): 3154-3156. 赵晨, 张亮, 倪原. 荧光偏振技术在生命科学中的研究进展[J]. 现代生物医学进展, 2010, 10(16): 3154-3156. |
| [12] |
International Office of Epizootics. Biological Standards Commission, International Office of Epizootics. International Committee. Manual of diagnostic tests and vaccines for terrestrial animals: mammals, birds and bees[S]. Office international des épizooties, 2008
|
| [13] |
Xu XD, Xie ZY, Wang SF, et al. A modified Silver-staining method for lipopolysaccharides detection[J]. Biotechnology Bulletin, 2009(3): 95-97. 徐先栋, 谢珍玉, 王世锋, 等. 脂多糖快速银染检测方法的改良[J]. 生物技术通报, 2009(3): 95-97. |
| [14] |
Dajer A, Luna-Martínez E, Zapata D, et al. Evaluation of a fluorescence-polarization assay for the diagnosis of bovine brucellosis in México[J]. Preventive Veterinary Medicine, 1999, 40(1): 67-73. DOI:10.1016/S0167-5877(99)00004-5 |
| [15] |
Nielsen K, Gall D, Smith P, et al. Fluorescence polarization assay for the diagnosis of bovine brucellosis: adaptation to field use[J]. Veterinary Microbiology, 2001, 80(2): 163-170. DOI:10.1016/S0378-1135(00)00386-2 |
| [16] |
Wang XG, Lin PF, Li Y, et al. Brucella suis vaccine strain 2 induces endoplasmic reticulum stress that affects intracellular replication in goat trophoblast cells in vitro[J]. Frontiers in Cellular and Infection Microbiology, 2016, 6: 19. |
| [17] |
Mustafa AA, Abusowa M. Field-oriented trial of the Chinese Brucella suis strain 2 vaccine on sheep and goats in Libya[J]. Veterinary Research, 1993, 24(5): 422-429. |
| [18] |
Lucero NE, Foglia L, Ayala SM, et al. Competitive enzyme immunoassay for diagnosis of human brucellosis[J]. Journal of Clinical Microbiology, 1999, 37(10): 3245-3248. |
| [19] |
Wang YL, Li BW, Liu HM. Sensitivity and specificity evaluation of fluorescence polarization detection methods of bovine brucellosis[J]. Chinese Journal of Veterinary Medicine, 2012, 48(11): 25-26. 王玉玲, 李丙文, 刘红梅. 牛布鲁菌病荧光偏振检测方法敏感性和特异性评估[J]. 中国兽医杂志, 2012, 48(11): 25-26. DOI:10.3969/j.issn.0529-6005.2012.11.008 |
 2017, Vol. 44
2017, Vol. 44