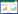扩展功能
文章信息
- 王洋, 吴芷慧, 薛春宜, 曹永长
- WANG Yang, WU Zhi-Hui, XUE Chun-Yi, CAO Yong-Chang
- 应用跨膜区置换的血凝素蛋白建立H7N9禽流感病毒抗体间接ELISA检测方法
- Establishment of an indirect ELISA for detecting H7N9 subtype avian influenza virus antibodies applied with hemagglutinin containing a replaced transmembrane domain
- 微生物学通报, 2017, 44(12): 2812-2821
- Microbiology China, 2017, 44(12): 2812-2821
- DOI: 10.13344/j.microbiol.china.170335
-
文章历史
- 收稿日期: 2017-04-28
- 接受日期: 2017-09-04
- 优先数字出版日期(www.cnki.net): 2017-09-07
2013年3月,我国首次报道了人感染H7N9流感病毒的病例[1],之后H7N9流感病毒在我国反复流行,至今已发生了5次流行[2]。H7N9流感病毒在鸡群中表现为低致病性,但2017年初广东省疾病预防控制中心报道:新分离的H7N9流感病毒毒株血凝素(Hemagglutinin,HA)蛋白的裂解位点具有多个碱性氨基酸的插入,暗示已经出现了高致病性H7N9禽流感病毒毒株[3]。疫苗是禽流感病毒防控的主要手段之一,并且研究表明H7亚型禽流感病毒灭活疫苗[4-5]和H7N9病毒样颗粒(VLP)疫苗[6]等对鸡群具有良好的免疫原性,因此对鸡群进行H7N9禽流感疫苗的免疫是一个趋势。然而鸡群在疫苗免疫后,需要一种可靠的抗体检测方法。
目前禽流感病毒抗体检测的常用方法主要包括血凝抑制(HI)试验和酶联免疫吸附试验(ELISA)[7]。HI试验检测对象为阻断HA蛋白与受体结合的功能性抗体,而基于HA蛋白的间接ELISA可以检测所有结合HA蛋白的抗体,在保留亚型特异性的同时具有更高的灵敏性[8]。ELISA具有简便、高效、可用于高通量检测和结果判定客观的优点[9],因此本研究旨在提供一种基于HA蛋白的H7N9亚型禽流感病毒抗体间接ELISA检测方法。
H7N9 HA蛋白在流行过程中发生了迅速变异,形成了长江三角洲系(Yangtze River Delta,YRD)和珠江三角洲系(Pearl River Delta,PRD)两个系(Lineage)[3],这两个系又可以进一步分为至少6个分支(Clade),包括W1、W2-A、W2-B、W2-C、W3-A和W3-B分支[10-11]。为了建立检测多个分支HA蛋白抗体的ELISA检测方法,我们分别表达和纯化了属于W1、W2-A和W2-B 3个分支的3个H7N9毒株全长HA蛋白作为ELISA抗原。我们之前的研究显示跨膜区(Transmembrane domain,TM)替换为H3 HA TM的H7-53TM蛋白(W2-B分支)具有更好的稳定性,因此同时表达、纯化了H7-53TM作为抗原,比较跨膜区置换对HA蛋白检测H7N9禽流感病毒抗体的影响,并建立一种可靠的H7N9亚型禽流感病毒抗体间接ELISA检测方法。
1 材料与方法 1.1 毒株和基因片段H7N9流感病毒毒株A/Chicken/Guangdong/53/ 2014(H7N9) (H7N9-53)、A/Hangzhou/1/2013(H7N9) (H7N9-HZ13)和A/Chicken/Guangdong/MCX/ 2014(H7N9) (H7N9-MCX)的HA基因:H7-53WT (Genbank登录号:KY221841)、H7-HZ13 (Genbank登录号:KC853766.1)和H7-MCX (Genbank登录号:KY221844)分别由Thermo Fisher Scientific公司或华大基因公司合成,同时合成来源自H7-53WT基因、跨膜区置换为H3 HA TM的H7-53TM基因片段。内部基因来源于A/Puerto Rico/8/34(H1N1),NA基因来源于H7N9-53毒株,HA基因分别来源于H7N9-53、H7N9-HZ13和H7N9-MCX的重组H7N9流感病毒rH7N9-53WT、rH7N9-HZ13和rH7N9-MCX,由本实验室制备并保存[12]。
1.2 主要试剂和仪器Sf9昆虫细胞、pFastBac1质粒由本实验室保存;大肠杆菌DH5α、DH10Bac感受态由本实验室制备并保存;H1N1流感病毒、H5N1禽流感病毒、H9N2禽流感病毒、禽传染性支气管炎病毒(IBV)、新城疫病毒(NDV)单因子阳性SPF鸡血清由实验室制备并保存。Sf900Ⅱ无血清培养基购自Thermo Fisher Scientific公司;H7N9亚型流感病毒HA蛋白兔IgG单克隆抗体购自义翘神州公司;HRP (辣根过氧化物酶)标记羊抗兔IgG(H+L)、HRP标记驴抗鸡IgY(H+L)以及Cy3标记的羊抗兔IgG(H+L)购自Proteintech公司;H7N9禽流感病毒HI抗原购自哈尔滨维科公司。
激光共聚焦显微镜(Leica TCS-SP5),德国徕卡显微系统有限公司;流式细胞仪(FACSCalibur),BD Biosciences公司;全自动酶标仪(ELx800),BioTek公司。
1.3 重组质粒和重组杆状病毒的构建 1.3.1 重组质粒的构建: 以1.1中合成的4个基因片段为模板,通过PCR扩增出相应的HA基因,并分别插入pFastBac1质粒中[12]。所构建的重组质粒通过双酶切和测序进行鉴定。 1.3.2 重组杆状病毒的构建: 分别将4个重组质粒转化至含有杆状病毒基因组转座子(Bacmid)的大肠杆菌DH10Bac,含有HA基因的重组转座子(rBacmid)通过M13引物进行PCR鉴定。将鉴定正确的rBacmid转染至Sf9细胞,28±2 ℃培养72 h后收集(4 ℃、3 000×g离心5 min)转染上清,即为重组杆状病毒(rBV)种毒。 1.4 蛋白表达、纯化与检测 1.4.1 蛋白表达与纯化: 分别将含有4个HA基因的重组杆状病毒以感染复数(MOI)为1感染Sf9细胞,感染65 h后收集(室温500×g离心5 min)细胞进行表达的检测或者进行蛋白纯化。所表达的4种HA蛋白通过离子交换层析方法进行纯化[13],纯化的HA蛋白用于间接ELISA包被抗原。 1.4.2 SDS-PAGE与Western blot: 取细胞裂解液或者纯化的蛋白通过10%的聚丙烯酰胺凝胶进行SDS-PAGE电泳。将电泳分离后的凝胶转印至PVDF膜,PVDF膜经过封闭后,分别以H7N9 HA单抗为一抗、HRP标记的羊抗兔IgG为二抗进行孵育,最后通过ECL进行显色。 1.4.3 间接免疫荧光(IFA): 分别将感染4种rBV或野生杆状病毒(wt-BV)的Sf9细胞进行固定后,用3%牛血清白蛋白(BSA)封闭,以H7N9 HA单抗为一抗、Cy3标记的羊抗兔IgG为二抗标记HA蛋白,用DAPI染核,通过激光共聚焦显微镜进行观察和拍摄。 1.4.4 流式细胞术: rBV或wt-BV感染的悬浮Sf9细胞,用70%乙醇固定,以H7N9 HA单抗为一抗、Cy3标记的羊抗兔IgG为二抗标记HA蛋白后通过流式细胞仪进行分析。 1.5 SPF鸡血清的收集分别将重组H7N9流感病毒rH7N9-53WT、rH7N9-MCX、rH7N9-HZ13制备的全病毒灭活疫苗免疫SPF鸡,以PBS免疫的SPF鸡为阴性对照。分别在2周龄进行首次免疫,首次免疫后2周用相同的疫苗进行加强免疫,加强免疫后2周进行第三次免疫,首次免疫前和每次免疫后对鸡进行翅静脉采血并分离血清,并通过HI试验确定每份血清的HI滴度。共收集H7N9阳性鸡血清90份,H7N9阴性鸡血清44份。
1.6 血凝抑制(HI)试验将H7N9禽流感病毒HI抗原制备为4单位抗原,同时制备1%鸡红细胞。HI试验按照《兽药典》中的方法进行。
1.7 间接ELISA反应条件的确定通过棋盘法确定间接ELISA的血清样品稀释度、抗原包被浓度和酶标驴抗鸡IgY二抗的稀释度。用ELISA方法对44份H7N9阴性鸡血清进行检测,计算cutoff值,cutoff值计算方法为阴性血清平均OD450值(x)+3×标准差(s)。
1.8 特异性试验分别将4种HA蛋白为包被抗原的ELISA方法对H1N1、H5N1、H9N2流感病毒、IBV、NDV单因子阳性SPF鸡血清进行检测,同时以H7N9阳性鸡血清作为阳性对照,将得到的OD450值与cutoff值进行比较确定ELISA方法的特异性。
1.9 敏感性试验分别取rH7N9-53WT、rH7N9-HZ13和rH7N9-MCX灭活疫苗免疫的阳性鸡血清进行梯度稀释,以ELISA结果OD450值小于cutoff值时的血清稀释度为ELISA滴度,并与HI滴度进行比较。
1.10 重复性试验取H7N9阳性鸡血清和阴性鸡血清各3份,按建立的间接ELISA方法对3个批次蛋白进行3次检测,计算批内、批间变异系数。
1.11 ELISA检测方法的统计学分析通过间接ELISA方法对44份阴性血清和90份H7N9禽流感病毒阳性鸡血清进行检测。检测结果通过GraphPad Prism 6软件受试者工作特征曲线(Receiver operating characteristic curve,ROC曲线)分析方法对间接ELISA方法进行可靠性分析[14]。根据ROC曲线分析得到的特异性和敏感度值,取两者之和最大时的Cutoff值作为优化Cutoff值,进而优化ELISA方法的准确性[15]。通过Spearman’s等级相关方法对ELISA与HI试验的相关性进行分析。
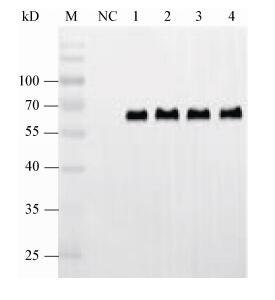
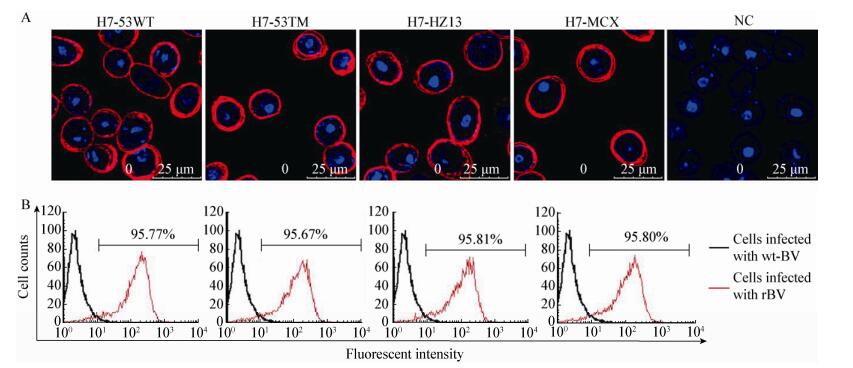
2 结果与分析 2.1 H7N9流感病毒HA蛋白的表达和纯化 2.1.1 重组杆状病毒的构建: HA基因H7-53WT、H7-HZ13和H7-MCX分别属于W2-B、W1和W2-A分支[10],为了在昆虫细胞-杆状病毒表达系统中表达HA基因,分别将其插入pFastBac1质粒中。我们之前的实验结果显示跨膜区置换为H3 HA TM的H7-53TM具有更好的稳定性,为了比较其与H7-53WT作为间接ELISA包被抗原是否具有差异,同时将H7-53TM基因插入pFastBac1质粒中。4个重组质粒双酶切和测序鉴定结果符合预期,表明重组质粒均构建成功。之后通过1.3.2中的方法构建重组杆状病毒(rBV),通过PCR检测,结果符合预期,因此插入4种HA基因的rBV分别构建成功。 2.1.2 HA蛋白的表达: 将分别插入H7-53WT、H7-53TM、H7-HZ13和H7-MCX基因的rBV感染Sf9细胞后检测HA蛋白在细胞中的表达。Western blot结果显示4种HA蛋白均能够表达,并且分子量大小相近,略小于70 kD (图 1)。IFA结果显示4种HA蛋白均定位于Sf9细胞膜上(图 2A)。流式细胞技术检测结果显示,rBV感染的Sf9细胞(红色曲线)中表达4种HA蛋白的比例均在95.67%-95.81%之间(图 2B)。
|
| 图 1 HA蛋白的Western blot检测 Figure 1 Western blot analysis of HA protein expression 注:M:蛋白marker;NC:感染wt-BV的Sf9细胞;1:H7-53WT;2:H7-53TM;3:H7-HZ13;4:H7-MCX. Note: M: protein marker; NC: Sf9 cells infected with wt-BV; 1: H7-53WT; 2: H7-53TM; 3: H7-HZ13; 4: H7-MCX. |
|
|
|
| 图 2 HA蛋白的IFA (A)和流式检测(B) Figure 2 Detection of HA protein expression by IFA (A) and flow cytometry (B) |
|
|

|
| 图 3 纯化HA蛋白的SDS-PAGE检测 Figure 3 Analysis of purified HA proteins by SDS-PAGE 注:M:蛋白marker;1:H7-53WT;2:H7-53TM;3:H7-HZ13;4:H7-MCX. Note: M: protein marker; 1: H7-53WT; 2: H7-53TM; 3: H7-HZ13; 4: H7-MCX. |
|
|
| 抗原Antigen | NDV (OD450) | IBV (OD450) | H1N1 (OD450) | H5N1 (OD450) | H9N2 (OD450) | H7N9 (OD450) |
| H7-53WT | 0.076 | 0.134 | 0.139 | 0.247 | 0.218 | 1.800 |
| H7-53TM | 0.062 | 0.145 | 0.122 | 0.193 | 0.153 | 1.995 |
| H7-HZ13 | 0.123 | 0.151 | 0.332* | 0.499* | 0.160 | 2.068 |
| H7-MCX | 1.150 | 0.154 | 0.111 | 0.180 | 0.148 | 1.963 |
| 注:*:假阳性. Note: *: false positive. | ||||||
| 抗原Antigen | H7N9流感病毒阳性血清Positive serum of H7N9 influenza virus | ||
| 1 | 2 | 3 | |
| H7-53WT | 729 000 | 2 187 000 | 2 187 000 |
| H7-53TM | 729 000 | 2 187 000 | 2 187 000 |
| H7-HZ13 | 729 000 | 2 187 000 | 2 187 000 |
| H7-MCX | 729 000 | 2 187 000 | 2 187 000 |
| 注:1、2和3分别代表免疫rH7N9-53WT、rH7N9-HZ13和rH7N9-MCX灭活疫苗的鸡血清. Note: 1, 2 and 3 represent sera collected from chickens vaccinated with rH7N9-53WT, rH7N9-HZ13 and rH7N9-MCX respectively. | |||
|
| 图 4 应用H7-53TM蛋白ELISA检测134份鸡血清 Figure 4 Detection of 134 chicken serum specimens by ELISA using recombinant H7-53TM protein 注:A:ELISA的ROC曲线分析;B:鸡血清的OD450值. Note: A: ROC curve analysis of the ELISA; B: OD450 values of chicken sera. |
|
|

|
| 图 5 ELISA与HI相关性分析 Figure 5 Analysis of correlation between ELISA and HI assay 注:A:134份鸡血清ELISA结果和HI试验结果的相关性分析;B-D:分别为rH7N9-53WT、rH7N9-HZ13和rH7N9-MCX免疫鸡血清ELISA结果和HI试验结果的相关性分析. Note: A: Correlation between ELISA and HI assay of chicken sera (n=134); B-D: Correlation between ELISA and HI assay of sera collected form chickens vaccinated with rH7N9-53WT, rH7N9-HZ13 and rH7N9-MCX, respectively. |
|
|
|
| 图 6 弱阳性样品ELISA检测结果 Figure 6 Detection of weakly positive serum specimens by ELISA 注:A:ELISA的ROC曲线分析;B:梯度稀释的血清样品的OD450值. Note: A: ROC curve analysis of the ELISA; B: OD450 values of gradient diluted serum sample. |
|
|
H7N9亚型禽流感病毒血清学检测对于鸡群H7N9亚型禽流感病毒的感染情况和免疫水平的监测具有重要意义。目前,H7亚型禽流感病毒血清学检测方法主要采用HI试验[16],而ELISA方法具有更加高效、简便、高通量等优点,并且待检血清不需要进行前处理,因此更加适合现地检测。已报道的H7亚型HA抗体ELISA检测方法主要为竞争ELISA。Sala等[17]、Yang等[18]和Jensen等[19]以灭活的H7N1亚型流感病毒为抗原,通过检测待检血清抑制H7 HA蛋白单抗与抗原的反应来评价血清中H7抗体的含量。为了避免灭活病毒为抗原的竞争ELISA受到待检血清中NA蛋白抗体的干扰,Shien等[20]和He等[21]分别以大肠杆菌表达和杆状病毒表面展示的H7 HA蛋白为抗原建立了竞争ELISA方法。这些竞争ELISA方法具有特异性高和能够检测多物种血清的优点,但是还存在一些缺点,例如:(1)由于单抗特异识别HA蛋白的表位,竞争ELISA方法不能检测所有H7亚型的抗体;(2)当抗原为灭活病毒时,血清中NA蛋白抗体会影响竞争ELISA的特异性;(3)竞争ELISA的敏感度较低,Shien等[20]建立的竞争ELISA在检测HI滴度为26和25的血清时,敏感性仅有33%和20%。间接ELISA方法具有特异性高、灵敏度好的优点,因此本研究建立了一种基于H7N9流感病毒HA蛋白的间接ELISA方法,对鸡血清中H7亚型HA抗体进行检测。
前期研究表明昆虫细胞表达的HA蛋白具有良好的抗原性,其作为抗原的间接ELISA检测具有良好的特异性、敏感性和重复性[22]。因此本研究通过昆虫细胞-杆状病毒表达系统表达了不同分支的4种H7N9流感病毒HA蛋白,其表达水平没有明显差异,所表达的蛋白进一步通过离子交换层析的方法进行纯化。由于4种HA蛋白具有相同的等电点,因此其纯化效果相似,终产物的纯度保持一致。然而以4种HA蛋白为抗原的ELISA检测方法表现出不同的特异性和重复性,跨膜区置换为H3 HA TM的H7-53TM作为抗原的ELISA方法不仅特异性良好,并且具有最好的重复性,批内和批间变异系数小于10%,而3种野生型HA蛋白作为抗原检测部分H7N9阳性或阴性血清批内和(或)批间变异系数大于10%,并且H7-HZ13作为抗原特异性较差。我们之前的研究证明H7-53TM蛋白相比于H7-53WT具有更高的二硫键连接的三聚体和更高的热稳定性[12],这可能是跨膜区置换影响HA蛋白抗原ELISA重复性的原因。
进一步通过ROC曲线对以H7-53TM为抗原的ELISA方法的鉴别能力进行分析,发现其能够精准地区分H7N9亚型禽流感病毒抗体阳性和阴性血清(图 5)。对于HI滴度 < 25的弱阳性鸡血清,ROC曲线分析结果显示该ELISA具有良好的可靠性,可以准确区分弱阳性血清和阴性血清。通过弱阳性血清ELISA结果的ROC曲线,我们进一步将Cutoff值确定在0.527 5,以提高该ELISA方法的准确性。与HI试验进行比较发现,以H7-53TM为抗原的ELISA方法与HI试验具有显著强相关性,并且所得到的线性回归方程拟合度较好,可以通过ELISA结果估算HI抗体滴度。Lam等研究表明H7N9流感病毒在流行过程中变异形成了不同的HA分支[10],并且H7N9流感病毒正在持续不断地变异。我们相信H7亚型禽流感疫苗在使用后会像其他亚型禽流感病毒疫苗一样,需要根据流行情况周期性地更换疫苗株。然而本研究建立的ELISA方法与W1、W2-A和W2-B分支疫苗株血清HI滴度都具有显著相关性,能够同时检测不同分支疫苗株免疫产生的HA抗体,这提示该ELISA方法能够满足不同H7N9亚型禽流感疫苗株免疫水平的检测要求,不需要频繁更换检测抗原。
综上所述,跨膜区置换的H7-53TM蛋白检测H7N9禽流感病毒抗体具有更好的重复性,以H7-53TM HA蛋白为抗原的间接ELISA检测方法能够精准区分H7N9亚型禽流感病毒阳性和阴性血清,检测结果与HI试验结果具有强相关性,为H7N9亚型禽流感病毒抗体的检测提供了一种适用于实验室和现地的灵敏、便捷的检测方法。
| [1] |
Gao RB, Cao B, Hu YW, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. The New England Journal of Medicine, 2013, 368(20): 1888-1897. DOI:10.1056/NEJMoa1304459 |
| [2] |
Zhou L, Ren RQ, Yang L, et al. Sudden increase in human infection with avian influenza A (H7N9) virus in China, September-December 2016[J]. Western Pacific Surveillance and Response Journal, 2017, 8(1): 6-14. DOI:10.5365/wpsar |
| [3] |
World Health Organization. Antigenic and genetic characteristics of zoonotic influenza viruses and development of candidate vaccine viruses for pandemic preparedness[EB/OL]. (2017-03-02). http://www.who.int/influenza/vaccines/virus/201703_zoonotic_vaccinevirusupdate.pdf?ua=1 (2017-04-28
|
| [4] |
Sakabe S, Sakoda Y, Haraguchi Y, et al. A vaccine prepared from a non-pathogenic H7N7 virus isolated from natural reservoir conferred protective immunity against the challenge with lethal dose of highly pathogenic avian influenza virus in chickens[J]. Vaccine, 2008, 26(17): 2127-2134. DOI:10.1016/j.vaccine.2008.02.001 |
| [5] |
Abbas MA, Spackman E, Fouchier R, et al. H7 avian influenza virus vaccines protect chickens against challenge with antigenically diverse isolates[J]. Vaccine, 2011, 29(43): 7424-7429. DOI:10.1016/j.vaccine.2011.07.064 |
| [6] |
Hu CMJ, Chien CY, Liu MT, et al. Multi-antigen avian influenza a (H7N9) virus-like particles: particulate characterizations and immunogenicity evaluation in murine and avian models[J]. BMC Biotechnology, 2017, 17: 2. DOI:10.1186/s12896-016-0321-6 |
| [7] |
Charlton B, Crossley B, Hietala S. Conventional and future diagnostics for avian influenza[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2009, 32(4): 341-350. DOI:10.1016/j.cimid.2008.01.009 |
| [8] |
Katz JM, Hancock K, Xu XY. Serologic assays for influenza surveillance, diagnosis and vaccine evaluation[J]. Expert Review of Anti-Infective Therapy, 2011, 9(6): 669-683. DOI:10.1586/eri.11.51 |
| [9] |
Shiraishi R, Nishiguchi A, Tsukamoto K, et al. Comparison of commercial enzyme-linked immunosorbent assay kits with agar gel precipitation and hemagglutination-inhibition tests for detecting antibodies to avian influenza viruses[J]. Journal of Veterinary Medical Science, 2012, 74(9): 1217-1220. DOI:10.1292/jvms.12-0086 |
| [10] |
Lam TTY, Zhou BP, Wang J, et al. Dissemination, divergence and establishment of H7N9 influenza viruses in China[J]. Nature, 2015, 522(7554): 102-105. DOI:10.1038/nature14348 |
| [11] |
Xie SM, Jia WX, Lin YC, et al. Third wave of influenza A(H7N9) virus from poultry, Guangdong Province, China, 2014-2015[J]. Emerging Infectious Diseases, 2015, 21(9): 1657-1660. DOI:10.3201/eid2109.150635 |
| [12] |
Wang Y, Wu JL, Xue CY, et al. A recombinant H7N9 influenza vaccine with the H7 hemagglutinin transmembrane domain replaced by the H3 domain induces increased cross-reactive antibodies and improved interclade protection in mice[J]. Antiviral Research, 2017, 143: 97-105. DOI:10.1016/j.antiviral.2017.03.029 |
| [13] |
Wang Y, Zhang Y, Wu JL, et al. Recombinant influenza H7 hemagglutinin containing CFLLC minidomain in the transmembrane domain showed enhanced cross-protection in mice[J]. Virus Research, 2017, 242: 16-23. DOI:10.1016/j.virusres.2017.09.008 |
| [14] |
Rodriguez A, Rodriguez PN. Understanding and predicting sovereign debt rescheduling: a comparison of the areas under receiver operating characteristic curves[J]. Journal of Forecasting, 2006, 25(7): 459-479. DOI:10.1002/(ISSN)1099-131X |
| [15] |
Schmitz A, Le Bras MO, Guillemoto C, et al. Evaluation of a commercial ELISA for H5 low pathogenic avian influenza virus antibody detection in duck sera using Bayesian methods[J]. Journal of Virological Methods, 2013, 193(1): 197-204. DOI:10.1016/j.jviromet.2013.05.002 |
| [16] |
Lebarbenchon C, Brown JD, Luttrell MP, et al. Comparison of two commercial enzyme-linked immunosorbent assays for detection of Influenza A virus antibodies[J]. Journal of Veterinary Diagnostic Investigation, 2012, 24(1): 161-165. DOI:10.1177/1040638711416626 |
| [17] |
Sala G, Cordioli P, Moreno-Martin A, et al. ELISA test for the detection of influenza H7 antibodies in avian sera[J]. Avian Diseases, 2003, 47(3 Suppl): 1057-1059. |
| [18] |
Yang M, Clavijo A, Graham J, et al. Evaluation of diagnostic applications of monoclonal antibodies against avian influenza H7 viruses[J]. Clinical and Vaccine Immunology, 2010, 17(9): 1398-1406. DOI:10.1128/CVI.00023-10 |
| [19] |
Jensen TH, Ajjouri G, Handberg KJ, et al. An enzyme-linked immunosorbent assay for detection of avian influenza virus subtypes H5 and H7 antibodies[J]. Acta Veterinaria Scandinavica, 2013, 55(1): 84. DOI:10.1186/1751-0147-55-84 |
| [20] |
Shien JH, Fu LF, Wu JR, et al. Development of blocking ELISA for detection of antibodies against avian influenza virus of the H7 subtype[J]. Journal of Microbiology, Immunology, and Infection, 2008, 41(5): 369-376. |
| [21] |
He F, Prabakaran M, Tan YR, et al. Development of dual-function ELISA for effective antigen and antibody detection against H7 avian influenza virus[J]. BMC Microbiology, 2013, 13: 219. DOI:10.1186/1471-2180-13-219 |
| [22] |
Yang Q, Xue CY, Zhu DZ, et al. Comparation of three methods for detection of antibodies to H1N1 swine influenza virus[J]. Guangdong Journal of Animal and Veterinary Science, 2014, 39(1): 16-20. 杨倩, 薛春宜, 朱道中, 等. 三种抗原检测H1N1猪流感病毒抗体的比较[J]. 广东畜牧兽医科技, 2014, 39(1): 16-20. |
 2017, Vol. 44
2017, Vol. 44