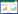扩展功能
文章信息
- 张小明, 崔文耀, 丁少青, 李伟明, 张庆华
- ZHANG Xiao-Ming, CUI Wen-Yao, DING Shao-Qing, LI Wei-Ming, ZHANG Qing-Hua
- 一株凡纳滨对虾源维氏气单胞菌的分离鉴定及药敏特性
- Isolation, identification and antibiotic sensitivity of Aeromonas veronii from Litopenaeus vannamei
- 微生物学通报, 2017, 44(12): 2795-2804
- Microbiology China, 2017, 44(12): 2795-2804
- DOI: 10.13344/j.microbiol.china.170550
-
文章历史
- 收稿日期: 2017-07-17
- 接受日期: 2017-10-16
- 优先数字出版日期(www.cnki.net): 2017-10-23
2. 国家水生动物病原库(上海海洋大学) 上海 201306;
3. 海洋生物科学国际联合研究中心(上海海洋大学)中国科学技术部 上海 201306
2. National Pathogen Collection Center for Aquatic Animals (Shanghai Ocean University), Shanghai 201306, China;
3. International Research Center for Marine Biosciences at Shanghai Ocean University, Ministry of Science and Technology, Shanghai 201306, China
凡纳滨对虾(Litopenaeus vannamei)又名南美白对虾(Penaeus vannamei),其生长迅速、抗病力强,是全球范围内最主要的对虾养殖品种之一,也是当前国内产量最高的虾类养殖品种[1]。2016年中国渔业统计年鉴显示凡纳滨对虾养殖产量约为162万t。
目前对虾高密度养殖容易引起水质恶化和疾病的暴发。对虾疾病通常分为病毒性、细菌性和真菌性疾病。已有研究报道称弧菌属(Vibrio spp.)为对虾主要细菌性病原,近年来关于维氏气单胞菌(Aeromonas veronii)引起水产动物发病的报道日益增多,给水产养殖业带来了较大的经济损失[2]。维氏气单胞菌在养殖水体中普遍存在[3],关于凡纳滨对虾中致病性维氏气单胞菌的分离纯化尚未见报道,本研究有利于明确病因,具有一定的实际应用价值。
2017年5-6月上海某凡纳滨对虾养殖场出现死亡病例,病虾游动缓慢、对外界刺激反应迟钝,主要症状为肝胰腺成浆糊状、尾部发红、解剖濒死对虾发现头胸甲易分离、发病较快、死亡率较高。通过光学显微镜检测排除真菌及寄生虫感染,通过PCR检测,排除了WSSV病毒的感染。本研究从濒死对虾体内分离得到一株优势菌,采用常规的细菌表型特征及理化特性,并结合分子生物学16S rRNA基因序列及系统发育学分析等方法对分离菌株进行鉴定,利用科赫法则通过回归感染后再分离鉴定对该病原菌进行确诊,通过半数致死剂量(LD50)的测定,分析了其致病性和毒力大小,最后对病原菌进行药敏试验,旨在筛选敏感药物,为凡纳滨对虾维氏气单胞菌病的防控提供参考依据。
1 材料与方法 1.1 材料 1.1.1 试验用虾和参考菌株: 濒死对虾样品取自上海某发病塘口,体重1.00±0.05 g,体长4.5±0.5 cm。健康对虾体重0.90±0.05 g,体长4.0±0.5 cm,购自上海海洋大学滨海基地,无损伤,活力好,暂养7 d无异常后用于实验。维氏气单胞菌参考菌株9L2 (基因序列登录号:KU525083)由集美大学李忠琴博士惠赠。 1.1.2 主要试剂和仪器: 营养肉汤、生化微量鉴定管和药敏试纸均购自杭州微生物试剂有限公司;营养琼脂和水解酪蛋白琼脂(MH)购自北京陆桥生物技术有限责任公司;细菌基因组DNA提取试剂盒、PCR扩增细菌16S rRNA基因试剂盒均购自上海迈浦生物科技有限公司。无菌操作台、摇床及高压灭菌锅购自上海博讯实业有限公司;离心机及恒温培养箱购自上海恒一科学仪器有限公司;PCR仪购自伯乐生命医学产品(上海)有限公司。 1.2 方法 1.2.1 病害临床诊断: 对养殖场凡纳滨对虾发病死亡情况进行评估,实地测量养殖水环境,了解发病对虾的规格。取具有典型症状的样品进行病原菌的分离和纯化。 1.2.2 病原分离与纯化: 取具有典型症状的对虾30尾,用75%酒精进行消毒后无菌环境下取其肝胰腺、鳃、肌肉和肠道用于细菌分离,接种于普通营养琼脂平板上,置于28 ℃培养24 h后,挑取颜色、大小和形态等基本一致的优势菌进一步在营养琼脂斜面纯化,纯化后的菌株用含30%甘油的营养肉汤保存于-80 ℃备用。为了排除病毒感染的可能性,随机扦取健康和患病对虾各30尾,在冰上取鳃、肝脏和肌肉混合后参考丁正峰等[4]的方法,应用PCR方法检测白斑综合征病毒(White spot syndrome virus,WSSV)。正向引物序列:5′-TCACAGGCGTAT TGTCTCTCCT-3′;反向引物序列:5′-CACGAGTCT ACCGTCACAACATC-3′。 1.2.3 人工感染及半数致死剂量(LD50)测试试验: 将分离纯化后的菌株接种于普通营养肉汤中,28 ℃、180 r/min培养18 h,制成菌悬液。参照麦氏比浊法调整菌悬液浓度为5×104、5×105、5×106、5×107、5×108、5×109 CFU/mL。选取健康活力强的对虾进行人工感染试验,感染方式为肌肉注射。将暂养7 d的健康对虾随机分组,每个稀释度菌液接种10尾虾,每尾20 μL;对照组注射20 μL无菌生理盐水。攻毒组和对照组均设2个重复组,10尾虾/组。试验期间,水体溶氧保持在6.0-7.5 mg/L,水温28-30 ℃,保持水质良好,不投喂饵料。每隔2 h观察对虾的发病情况,记录死亡尾数,并对濒死的对虾进行解剖,观察器官病理变化,同时进行细菌的再分离。参照Bliss法[5]计算分离菌株24 h的半数致死剂量(LD50)。 1.2.4 细菌形态特征观察和生理生化鉴定: 将分离菌株接种于营养琼脂平板上,28 ℃培养24 h后观察细菌菌落的颜色、大小和形态,同时进行革兰氏染色镜检细菌的个体形态。将菌株无菌操作接种于细菌微量生化鉴定管中进行理化特性鉴定,具体方法参照《常见细菌系统鉴定手册》[6]。 1.2.5 细菌16S rRNA基因序列分析: 按照细菌DNA提取试剂盒说明书提取分离菌株的DNA。细菌16S rRNA基因扩增通用引物由上海迈浦生物科技有限公司合成,正向引物27F:5′-AGAGTTTGA TC(C/A)TGGCTCAG-3′;反向引物1492R:5′-GG TTACCTTGTTACGACTT-3′。基因序列的扩增体系和条件参照梁利国等[7]的方法进行。PCR扩增产物经1%琼脂糖凝胶电泳检测目的条带,随后将PCR产物送上海迈浦生物科技有限公司进行纯化和序列测定。 1.2.6 系统发育树的构建: 将得到的16S rRNA基因序列通过NCBI进行BLAST (https://blast.ncbi.nlm. nih.gov/Blast.cgi),根据比对结果检索出同源性较高的序列采用ClustalX软件进行多序列比对,再用MEGA 5.0软件包中的Neighbour-Joining法构建系统进化树,采用Kimura 2-parameter作为校正模型,通过1 000次Bootstrap检验置信度。 1.2.7 药物敏感试验: 采用琼脂扩散法(K-B)对菌株进行30种常用抗生素的敏感性检测。将分离菌株接种于营养肉汤,28 ℃、200 r/min培养18 h后,稀释菌液浓度至1.0×107 CFU/mL,取200 μL均匀涂布于MH琼脂平板上,贴上不同的药敏纸片,置于28 ℃培养箱中培养24 h后测量抑菌圈直径(包括药敏纸片),以抑菌圈直径大小作为判定细菌对药物敏感性的标准[8]。 2 结果与分析 2.1 临床主要症状发病凡纳滨对虾养殖场水色略黑,氨氮含量偏高,部分池塘高达0.3 mg/L。发病率在50%左右,死亡率75%左右,幼虾和成虾均有发病。发病症状为病虾游动缓慢、对外界刺激反应迟钝、尾部发红;解剖后发现肝胰腺发黑,成浆糊浑浊状,肠道中几乎无食物(图 1)。
|
图 1 正常与患病凡纳滨对虾体表与解剖症状
Figure 1 Morphological and anatomical symptoms of normal and diseased Litopenaeus
vannamei
注:a、d:正常凡纳滨对虾;b、e、f:患病对虾,肝胰腺发褐黑色,成浆糊浑浊状( ),肠道中几乎无食物( ),肠道中几乎无食物( );c:患病对虾,头胸甲易分离( );c:患病对虾,头胸甲易分离( ),尾部发红( ),尾部发红( ).
Note: a, d: Normal L. vannamei. b, e, f: Diseased L. vannamei, the hepatopancreas was black brown and paste shape of turbidity ( ).
Note: a, d: Normal L. vannamei. b, e, f: Diseased L. vannamei, the hepatopancreas was black brown and paste shape of turbidity ( ); There is almost no food in the intestine ( ); There is almost no food in the intestine ( ). c: Easy to separate the carapace from the meat ( ). c: Easy to separate the carapace from the meat ( ) and red tails ( ) and red tails ( ). ).
|
|
|
对患病和健康对虾进行WSSV PCR检测后,发现患病和健康的对虾都不携带WSSV病毒,因此排除了该病毒感染的可能性。从自然发病的凡纳滨对虾肌肉中未分离到细菌,肝胰腺中分离到一株优势菌AVZ01,鳃和肠道中也出现和AVZ01相似的菌落,但平板上的细菌数量都低于肝胰腺,因此以肝胰腺中分离的优势菌AVZ01作为后续研究对象。经人工回感试验发现,AVZ01对凡纳滨对虾具有致病性,死亡率较高,感染后发病对虾也出现与自然发病对虾一致的症状,并从感染后濒死的虾体内又分离到与菌株AVZ01形态特征及理化特性一致的菌株。纯培养菌株在营养琼脂平板上的菌落形态为:表面光滑湿润、中央向上凸起、边缘整齐、灰白色较不透明,菌落直径1.5 mm-1.8 mm。根据人工感染试验,采用Bliss法对凡纳滨对虾进行LD50测定评估,得到回归方程YProbit=0.398 35+ 0.774 64 Log(X),其中YProbit为剂量回归单位,X为剂量;计算出24 h内菌株AVZ01对凡纳滨对虾的半致死浓度为LD50=8.7×105 CFU/mL (表 1)。
| 剂量 Dose (CFU/mL) |
剂量对数 Logarithmic dose (X) |
数量 Amount (n) |
死亡量 Amount of death (n) |
死亡率 Mortality (%) |
试验机率单 Probit (Y) |
回归几率 Regression probability (Y) |
| 5.0×109 | 9.699 | 10 | 10 | 100 | - | 7.912 |
| 5.0×108 | 8.699 | 10 | 10 | 100 | - | 7.137 |
| 5.0×107 | 7.699 | 10 | 9 | 90 | 6.282 | 6.362 |
| 5.0×106 | 6.699 | 10 | 7 | 70 | 5.524 | 5.588 |
| 5.0×105 | 5.699 | 10 | 4 | 40 | 4.747 | 4.813 |
| 5.0×104 | 4.699 | 10 | 2 | 20 | 4.159 | 4.038 |
| 20 μL生理盐水 Normal saline |
- | 10 | 0 | 0 | - | - |
| 注:-:说明没有对应的数值. Note: -: Indicates there was no data for it. | ||||||
菌株AVZ01为革兰氏阴性短杆菌,氧化酶阳性,具有运动性,能产生吲哚,利用葡萄糖、蔗糖、纤维二糖和枸缘酸盐;不能利用阿拉伯糖、尿素和丙二酸盐(表 2)。根据菌株AVZ01菌落与菌体特征以及与维氏气单胞菌参考菌株9L2的系统鉴定结果,参照文献[8-9],初步判定菌株AVZ01为维氏气单胞菌。分离菌株AVZ01扩增出的16S rRNA基因序列长度约为1 444 bp (图 2),序列提交NCBI获得序列号为MF521598。与已知基因序列比,发现与菌株AVZ01基因序列相似性最高的菌株均属于气单胞菌属,构建的系统发育树显示,菌株AVZ01与维氏气单胞菌(9L2 KU525083、NR_044845.1、NR_119045.1和NR_118947.1)聚为一支,相似性高达99% (图 3)。
| 鉴定项目 Test items |
分离株 AVZ01 |
参考株 9L2 |
| 革兰氏染色Gram stain | – | – |
| 运动性Mobility | + | + |
| 氧化酶Oxidase | + | + |
| 葡萄糖(产气) Glucose | + | + |
| 阿拉伯糖Arabinose | – | – |
| 蔗糖Saccharose | + | + |
| 水杨苷Salicin | – | – |
| 乳糖Lactose | + | + |
| 麦芽糖Maltose | + | + |
| 产生吲哚Indole | + | + |
| 尿素Urea | – | – |
| 硫化氢Hydrothion | – | – |
| 肌醇Inositol | – | – |
| 山梨醇Sorbitol | – | – |
| 水杨素Salicin | – | – |
| 丙二酸盐Malonate | – | – |
| 枸橼酸盐Citrate | + | + |
| 棉籽糖Raffinose | – | – |
| 戊糖Pentose | – | – |
| 海藻糖Trehalose | – | – |
| 纤维二糖Cellobiose | + | + |
| 蜜二糖Melibiose | + | + |
| 注:+:阳性;-:阴性. Note: +: Positive; -: Negative. | ||

|
| 图 2 分离菌株AVZ01 16S rRNA基因扩增产物电泳结果 Figure 2 Agarose electrophoresis results of AVZ01 16S rRNA gene fragments of pathogen strains 注:M:DNA marker;1:参考菌株9L2;2:分离菌株AVZ01;3:阴性对照. Note:M: DNA marker; 1: Reference strain 9L2; 2: Isolated strain AVZ01; 3: Negative control. |
|
|

|
| 图 3 基于菌株AVZ01的16S rRNA基因序列同源性构建的系统发育树 Figure 3 Phylogenetic tree based on 16S rRNA gene sequence homolog of strain AVZ01 注:括号内的数字为GenBank登录号;节点处的数字为Bootstrap值. Note: Numbers in parenthesis represented GenBank accession number; Numbers at the branch points indicated the Bootstrap values. |
|
|
综合分析AVZ01菌株的形态特征、理化特性及16S rRNA基因序列的系统发育结果,判定其为气单胞菌属(Aeromonas)的维氏气单胞菌(A. veronii)。
2.4 药敏试验AVZ01分离菌株对30种抗菌药物的敏感性结果显示,该菌株对米诺环素、诺氟沙星、庆大霉素、丁胺卡那和新霉素等16种药物高度敏感;对红霉素、麦迪霉素、哌拉西林、多西环素和万古霉素5种药物中度敏感;对青霉素、苯唑西林、氨苄西林、克林霉素和头孢氨苄等9种药物不敏感(表 3)。
| 药物 Drug |
抑菌圈直径判断标准 The judgment standard of inhibition zone diameter (mm) |
药物含量 Dose (μg/disc) |
抑菌圈直径 Inhibition zone diameter (mm) |
敏感性 Sensitivity |
||
| 耐药 Resistant |
中度敏感 Medium |
高度敏感 Highly sensitive |
||||
| 米诺环素Minocycline | ≤14 | 14-20 | ≥20 | 30.00 | 28.50 | S |
| 红霉素Erythromycin | ≤13 | 14-22 | ≥23 | 15.00 | 18.00 | I |
| 诺氟沙星Norfloxacin | ≤12 | 13-16 | ≥17 | 10.00 | 24.20 | S |
| 麦迪霉素Midecamycin | ≤13 | 14-17 | ≥18 | 30.00 | 8.70 | I |
| 庆大霉素Gentamicin | ≤12 | 13-14 | ≥15 | 10.00 | 23.50 | S |
| 丁胺卡那Amikacin | ≤14 | 15-16 | ≥17 | 30.00 | 25.00 | S |
| 头孢哌酮Cefoperazone | ≤15 | 16-20 | ≥21 | 75.00 | 30.00 | S |
| 新霉素Neomycin | ≤12 | 13-16 | ≥17 | 30.00 | 21.00 | S |
| 头孢他啶Ceftazidime | ≤14 | 15-17 | ≥18 | 30.00 | 28.00 | S |
| 头孢呋辛Cefuroxime | ≤14 | 15-17 | ≥18 | 30.00 | 30.50 | S |
| 青霉素Penicillin | ≤19 | 23-27 | ≥28 | 10.00 | 0.00 | R |
| 苯唑西林Oxacillin | ≤10 | 11-12 | ≥13 | 1.00 | 0.00 | R |
| 氨苄西林Ampicillin | ≤14 | 14-20 | ≥20 | 10.00 | 0.00 | R |
| 羧苄西林Carbenicillin | ≤14 | 14-20 | ≥20 | 100.00 | 0.00 | R |
| 哌拉西林Piperacillin | ≤14 | 14-20 | ≥20 | 100.00 | 24.50 | I |
| 头孢氨苄Cephalexin | ≤14 | 15-17 | ≥18 | 30.00 | 10.20 | R |
| 头孢唑啉Cefamezin | ≤14 | 15-17 | ≥18 | 30.00 | 21.30 | R |
| 头孢拉定Cefradine | ≤14 | 15-17 | ≥18 | 30.00 | 16.00 | R |
| 头孢曲松Ceftriaxone | ≤14 | 14-20 | ≥20 | 30.00 | 38.00 | S |
| 卡那霉素Kanamycin | ≤13 | 14-17 | ≥18 | 30.00 | 23.50 | S |
| 四环素Tetracycline | ≤14 | 15-18 | ≥19 | 30.00 | 17.00 | S |
| 多西环素Doxycycline | ≤12 | 13-15 | ≥16 | 30.00 | 13.20 | I |
| 氧氟沙星Ofloxacin | ≤12 | 13-15 | ≥16 | 5.00 | 28.50 | S |
| 环丙沙星Ciprofloxacin | ≤15 | 16-20 | ≥21 | 5.00 | 27.00 | S |
| 万古霉素Vancomycin | ≤14 | 14-20 | ≥20 | 30.00 | 11.00 | I |
| 多粘菌素B Polymyxin B | ≤7 | 8-11 | ≥12 | 300.00 | 14.20 | S |
| 复方新诺明Compound sulfamethoxazole | ≤14 | 14-20 | ≥20 | 23.75 | 24.00 | R |
| 呋喃唑酮Furazolidone | ≤14 | 15-16 | ≥17 | 360.00 | 15.50 | S |
| 氯霉素Chloroamphenicol | ≤12 | 13-17 | ≥18 | 30.00 | 31.00 | S |
| 克林霉素Clindamycin | ≤14 | 15-20 | ≥21 | 2.00 | 0.00 | R |
| 注:S:高度敏感;I:中度敏感;R:耐药. Note: S: Highly sensitive; I: Medium sensitivity; R: Resistant. | ||||||
维氏气单胞菌又名凡隆气单胞菌或维罗纳气单胞菌,隶属于气单胞菌科(Aeromonadaceae)气单胞菌属(Aeromonas),革兰氏阴性短杆菌,为纪念法国微生物学家Veron而得名。1983年由Hiekman-Brenner等从临床腹泻病人的粪便中分离获得,并于1987年通过DNA杂交的方法首次被确定为气单胞菌属的一个新种[10]。该菌在淡水、土壤、污水甚至海水中普遍存在,对环境的耐受性强,最高温度达到42 ℃时仍能生长繁殖[11]。维氏气单胞菌对人和多种水生动物具有很强的致病性,是一种新型的人兽共患性致病菌,该菌之所以具有较强的致病能力,是因为其能产生多种毒力因子,主要包括气溶素、肠毒素以及菌毛、S层、荚膜、内毒素(LPS)和外膜蛋白(OMP)等粘附因子[12-15]。本文首次从患病的凡纳滨对虾中分离到高致病性维氏气单胞菌,为进一步研究其流行病学及致病机制奠定了基础,具有重要的科学和实际意义。
近年来,除病毒性疾病外,多种细菌性疾病相继给凡纳滨对虾养殖业造成了巨大的经济损失。李梅等[16]报道豚鼠气单胞菌(Aeromonas caviae)感染凡纳滨对虾后虾体和足须发红,肝胰腺肿大,对虾大批量死亡。金春英[17]报道轮虫弧菌(Vibrio rotiferianus)可造成凡纳滨对虾浮游缓慢、体表发红、肌肉白浊、鳃部变黄溃烂等症状。张晓君等[18]报道副溶血弧菌(Vibrio parahaemolyticus)对凡纳滨对虾具有非常强的致病性,对虾感染后摄食能力下降,体表和腹肢上有大量污物,同时肌肉浑浊。本实验分离到的维氏气单胞菌也能影响到对虾摄食能力,造成虾体发红,肌肉浑浊等。
据报道,在20世纪80年代,维氏气单胞菌曾引起鱼类体表溃疡,当细菌侵染血细胞后可造成大量死亡[12, 19]。近年来关于该菌感染多种水生动物包括贝类[20]、甲壳类[21]、两栖类、爬行类、鱼类[14, 22]以及陆生动物[23]和人类[24]的报道越来越多,给我国水产养殖业造成巨大经济损失,并对人类健康构成威胁。本研究证实凡纳滨对虾是维氏气单胞菌的新宿主,并且测定了该菌株24 h对凡纳滨对虾的LD50为8.7×105 CFU/mL,按照Devesa[25]对鱼类致病菌毒力强弱的分类依据,该菌株属于强毒株,对凡纳滨对虾有很强的毒力。单晓枫等从青虾(Macrobrachium nipponense)中分离的维氏气单胞菌QXF0711B菌株的胞外产物具有淀粉酶、脂肪酶、蛋白酶活性和溶血活性,不具有明胶酶活性;其可溶解多种动物红细胞,尤以对鱼类红细胞溶血性更强,但对鸡、鸭红细胞无溶血活性[26]。钱爱东团队对不同宿主来源的维氏气单胞菌进行了毒力基因的比较分析,为细菌检测、疫苗制备及流行病学调查提供了很好的研究基础[27-30]。以上关于维氏气单胞菌的研究结果都为今后详细探究AVZ01的致病机制、流行规律和进化变异等方面提供了借鉴依据。综合以上信息,我们发现维氏气单胞菌危害的水产养殖品种逐渐增多,包含海淡水鱼类、虾蟹类及贝类等,该菌如何适应不同的海水、淡水环境,以及突破不同的宿主防御机制造成严重的致病性,是一个亟待解决的问题,因此需进一步研究其流行规律和致病机理,加强关键防控技术,减少经济损失。
关于维氏气单胞菌的防治方法,有很多学者开发了灭活疫苗[31]、菌影疫苗[32]、口服疫苗[33]和DNA疫苗[34]等,达到了一定的免疫效果,但目前均处于实验室研发阶段,不能针对不同宿主来源的病原进行有效的防治。因此,寻找敏感的抗生素仍是生产实践中迫切需求的药物防治方法。本研究中测试了AVZ01菌株对30种抗生素的药敏试验,结果表明,该菌株对米诺环素等16种药物高度敏感,对红霉素等5种药物中度敏感,对青霉素等9种药物不敏感。本实验结果与杨移斌等[2]、赵敏等[3]、贺扬等[14]的结果不尽相同,这可能与不同宿主来源、菌株数量及地域分布等因素有关。因此在实际生产中应结合药敏特性试验结果科学合理用药,避免抗生素的长期、大量使用导致菌株产生耐药性。本研究所选的万古霉素、环丙沙星、呋喃类和头孢类抗生素仅是用来研究菌株耐药性,并非可用于生产,这提示养殖户和生产人员在凡纳滨对虾养殖过程中,要在国家允许的药物使用范围内,选取敏感药物用于病害防治。
| [1] |
Wang MX, Guo R, Xia H, et al. Effects of seven kinds of carbohydrate structure on the metabolism of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2016, 40(4): 626-633. 王美雪, 郭冉, 夏辉, 等. 七种不同结构糖源对凡纳滨对虾三大营养物质代谢的影响[J]. 水产学报, 2016, 40(4): 626-633. |
| [2] |
Yang YB, Xu N, Dong J, et al. Isolation and identification of Aeromonas veronii strain Zy01 from Taiwan Loach and its antibiotic sensitivity[J]. Microbiology China, 2017, 44(4): 852-858. 杨移斌, 胥宁, 董靖, 等. 台湾泥鳅源维氏气单胞菌Zy01株的分离鉴定及药敏特性研究[J]. 微生物学通报, 2017, 44(4): 852-858. |
| [3] |
Zhao M, Wang KY, Wang J, et al. Tetracycline antibiotics resistance and its genetic determinants in Aeromonas veronii isolated from channel catfish (Ictalurus punctatus)[J]. Acta Hydrobiologica Sinica, 2014, 38(2): 386-392. 赵敏, 汪开毓, 王均, 等. 斑点叉尾鱼回源维氏气单胞菌对四环素类抗生素的耐药性及耐药基因的检测[J]. 水生生物学报, 2014, 38(2): 386-392. DOI:10.7541/2014.55 |
| [4] |
Ding ZF, Xue H, Xia AJ, et al. Study on the WSSV prevalence in the cultured crayfish (Procambarus clarkii)[J]. Journal of Nanjing Agricultural University, 2008, 31(4): 129-133. 丁正峰, 薛晖, 夏爱军, 等. 白斑综合征病毒在养殖克氏原螯虾中感染流行研究[J]. 南京农业大学学报, 2008, 31(4): 129-133. |
| [5] |
Dong XH, Tian M, Ji C, et al. The comparative study on the LD50 to evaluate the virulence of Vibrio parahaemolyticus using two calculation methods[J]. Journal of Shanghai Ocean University, 2016, 25(1): 86-96. 董雪红, 田敏, 季策, 等. 两种LD50计算方法对副溶血性弧菌毒力的比较研究[J]. 上海海洋大学学报, 2016, 25(1): 86-96. DOI:10.12024/jsou.20150501432 |
| [6] |
Dong XZ, Cai MY. Identification System Manual of Common Bacteria[M]. Beijing: Science Press, 2001. 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [7] |
Liang LG, Xie J, Ye SY. Identification and detection of the pathogenic Aeromonas hydrophila isolated from Hypophthalmichthys molitrix[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 35(5): 374-378. 梁利国, 谢骏, 叶诗尧. 鲢病原嗜水气单胞菌分离鉴定及检测方法的建立[J]. 中国预防兽医学报, 2015, 35(5): 374-378. |
| [8] |
CLSI. Performance standards for antimicrobial disk susceptibility tests; approved standard[S]. 11th Edition. CLSI document M02-A11. Wayne, PA: Clinical and Laboratory Standards Institute, 2012: 1-53
|
| [9] |
Garrity G, Staley JT, Brenner DJ, et al. Bergey's Manual of Systematic Bacteriology[M]. 2nd Edition. New York: Springer-Verlag, 2005, 557-578.
|
| [10] |
Hickman-Brenner FW, MacDonald KL, Steigerwalt AG, et al. Aeromonas veronii, a new ornithine decarboxylase-positive species that may cause diarrhea[J]. Journal of Clinical Microbiology, 1987, 25(5): 900-906. |
| [11] |
Monfort P, Baleux B. Dynamics of Aeromonas hydrophila, Aeromonas sobria, and Aeromonas caviae in a sewage treatment pond[J]. Applied and Environmental Microbiology, 1990, 56(7): 1999-2006. |
| [12] |
Janda JM, Abbott SL. Evolving concepts regarding the genus Aeromonas: an expanding panorama of species, disease presentations, and unanswered questions[J]. Clinical Infectious Diseases, 1998, 27(2): 332-344. DOI:10.1086/cid.1998.27.issue-2 |
| [13] |
Mencacci A, Cenci E, Mazzolla R, et al. Aeromonas veronii biovar veronii septicaemia and acute suppurative cholangitis in a patient with hepatitis B[J]. Journal of Medical Microbiology, 2003, 52(8): 727-730. DOI:10.1099/jmm.0.05214-0 |
| [14] |
He Y, Hua L, Wang KY, et al. Investigation on the pathogenicity of extracellular products of a high virulence Aeromonas veronii strain isolated from Ictalurus punctatus[J]. Journal of Fisheries of China, 2016, 40(3): 457-467. 贺扬, 华丽, 汪开毓, 等. 高致病性维氏气单胞菌胞外产物对斑点鱼回的致病性[J]. 水产学报, 2016, 40(3): 457-467. |
| [15] |
Wu TL, Shan XF, Meng QF, et al. Advances in Aeromonas veronii[J]. Chinese Journal of Veterinary Drug, 2011, 45(7): 41-44. 吴同垒, 单晓枫, 孟庆峰, 等. 维氏气单胞菌研究进展[J]. 中国兽药杂志, 2011, 45(7): 41-44. |
| [16] |
Li M, You ZL, Chen F, et al. Isolation and characterization of Aeromonas caviae from Penaeus vannamei Boone (Litopenaeus vannamei) in Guangdong Province[J]. Journal of Shanghai Ocean University, 2015, 24(4): 579-586. 李梅, 游卓霖, 陈锋, 等. 广东省南美白对虾豚鼠气单胞菌的分离鉴定[J]. 上海海洋大学学报, 2015, 24(4): 579-586. |
| [17] |
Jin CY. Identification and characterization of pathogenic bacteria causing vibriosis in cultured American white shrimp (Penaeus vannamei)[J]. Marine Environmental Science, 2013, 32(5): 647-651. 金春英. 南美白对虾弧菌病病原的分离和鉴定[J]. 海洋环境科学, 2013, 32(5): 647-651. |
| [18] |
Zhang XJ, Chen CZ, Yan BL, et al. Phenotypic and molecular characterization of pathogenic Vibrio parahaemolyticus isolated from Penaeus vannamei[J]. Oceanologia et Limnologia Sinica, 2009, 40(5): 654-662. 张晓君, 陈翠珍, 阎斌伦, 等. 凡纳滨对虾(Litopenaeus vannamei)病原副溶血弧菌(Vibrio parahaemolyticus)的表型及分子特征[J]. 海洋与湖沼, 2009, 40(5): 654-662. DOI:10.11693/hyhz200905021021 |
| [19] |
Rahman M, Colque-Navarro P, Kühn I, et al. Identification and characterization of pathogenic Aeromonas veronii Biovar Sobria associated with epizootic ulcerative syndrome in fish in Bangladesh[J]. Applied and Environmental Microbiology, 2002, 68(2): 650-655. DOI:10.1128/AEM.68.2.650-655.2002 |
| [20] |
Zhong L. Study on the etiology of Hyriopsis cumingii bacterial plague and the cloning and expression of LasB gene[D]. Changsha: Doctoral Dissertation of Hunan Agriculture University, 2011 (in Chinese) 钟蕾. 三角帆蚌细菌性瘟病病原学研究与LasB基因的克隆及表达[D]. 长沙: 湖南农业大学博士学位论文, 2011 |
| [21] |
Jiang GM, Qian CY, Gu XL, et al. The etiological agents of bacterial septicemia in Eriocheir sinensis and Procambarus clarkia[J]. Journal of Aquaculture, 2016, 37(4): 46-51. 姜光明, 钱彩源, 顾雪林, 等. 中华绒螯蟹和克氏原螯虾细菌性败血症病原学研究[J]. 水产养殖, 2016, 37(4): 46-51. |
| [22] |
Wang KY, Fan FL, Xiao D, et al. Biological characteristics and genotyping of Aeromonas veronii from fish[J]. Chinese Veterinary Science, 2011, 41(4): 367-374. 汪开毓, 范方玲, 肖丹, 等. 鱼源维氏气单胞菌的生物特性和基因分型[J]. 中国兽医科学, 2011, 41(4): 367-374. |
| [23] |
Li WJ, Zhao Y, Liu Y, et al. Isolation and identification of pathogenic Aeromonas veronii from fox[J]. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(4): 289-292. 李伟杰, 赵耘, 刘燕, 等. 狐狸源致病性维氏气单胞菌的分离鉴定及耐药性分析[J]. 中国预防兽医学报, 2012, 34(4): 289-292. |
| [24] |
Ge QQ, Bai YF, Chen X, et al. Distribution and drug resistance of Aeromonas in Patients with Diarrhea[J]. Chinese Journal of Gerontology, 2013, 33(21): 5228-5230. 葛樯樯, 白永凤, 陈晓, 等. 腹泻患者粪便来源的气单胞菌分布及耐药性[J]. 中国老年学杂志, 2013, 33(21): 5228-5230. DOI:10.3969/j.issn.1005-9202.2013.21.002 |
| [25] |
Devesa S. First Report of Vibriosis in Turbot (Scophthalmus maximus) Cultured in Northwestern Spain: Fish and Shellfish Pathology[M]. New York: Academic Press, 1985.
|
| [26] |
Shan XF, Zhang HY, Sun WW, et al. Bioactivity analysis of extracellular products of Aeromonas veronii strain isolated from freshwater shrimp[J]. Chinese Journal of Veterinary Medicine, 2017, 53(4): 105-107, 124. 单晓枫, 张海月, 孙武文, 等. 青虾源维氏气单胞菌胞外产物生物学特性及蛋白成分分析[J]. 中国兽医杂志, 2017, 53(4): 105-107, 124. |
| [27] |
Shan XF, Kang YH, Xia JJ, et al. Comparative studies on biological characteristics of Aeromonas veronii from different hosts[J]. Chinese Journal of Veterinary Medicine, 2015, 51(3): 82-85. 单晓枫, 康元环, 夏京津, 等. 不同动物源性维氏气单胞菌生物学特性比较研究[J]. 中国兽医杂志, 2015, 51(3): 82-85. |
| [28] |
Kang YH, Yang BT, Meng QF, et al. Cloning and comparison OMPAⅡ genes of Aeromonas veronii from different hosts[J]. Chinese Veterinary Science, 2014, 44(3): 271-276. 康元环, 杨滨僮, 孟庆峰, 等. 不同宿主来源的维氏气单胞菌外膜蛋白AⅡ基因的克隆及比较[J]. 中国兽医科学, 2014, 44(3): 271-276. |
| [29] |
Zeng FL, Zhao D, Kang YH, et al. Cloning and comparative analysis of aerA genes of Aeromonas veronii from different animal source[J]. Chinese Journal of Veterinary Drug, 2014, 48(8): 6-10. 曾范利, 赵丹, 康元环, 等. 不同动物源性维氏气单胞菌气溶素基因的克隆及比较分析[J]. 中国兽药杂志, 2014, 48(8): 6-10. |
| [30] |
Zhang HY, Kang YH, Chen L, et al. Cloning and comparison of OMPAⅠgenes of Aeromonas veronii from different hosts[J]. Chinese Veterinary Science, 2016, 46(5): 607-610. 张海月, 康元环, 陈龙, 等. 不同动物源性维氏气单胞菌OMPAⅠ基因的克隆及比较研究[J]. 中国兽医科学, 2016, 46(5): 607-610. |
| [31] |
Chen HL, Mo JL, Kang YH, et al. Preparation of Aeromonas veronii inactivated vaccine and evaluate of immune effect on koi[J]. Chinese Journal of Veterinary Medicine, 2016, 52(5): 110-113, 55. 陈亨利, 莫金龙, 康元环, 等. 维氏气单胞菌灭活疫苗的制备及对锦鲤免疫效果评价[J]. 中国兽医杂志, 2016, 52(5): 110-113, 55. |
| [32] |
Xu Z, Meng QF, Wang WL, et al. The construction of the Aeromonas veronii ghosts vaccine and the bacteriolytic dynamics[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(12): 982-984. 徐展, 孟庆峰, 王伟利, 等. 维氏气单胞菌菌影疫苗的构建及其溶菌动力学研究[J]. 中国预防兽医学报, 2014, 36(12): 982-984. DOI:10.3969/j.issn.1008-0589.2014.12.16 |
| [33] |
Merino-Contreras ML, Guzman-Murillo MA, Ruiz-Bustos E, et al. Mucosal immune response of spotted sand bass Paralabrax maculatofasciatus (Steindachner, 1868) orally immunised with an extracellular lectin of Aeromonas veronii[J]. Fish & Shellfish Immunology, 2001, 11(2): 115-126. |
| [34] |
Vazquez-Juarez RC, Gomez-Chiarri M, Barrera-Salda a H, et al. Evaluation of DNA vaccination of spotted sand bass (Paralabrax maculatofasciatus) with two major outer-membrane protein-encoding genes from Aeromonas veronii[J]. Fish & Shellfish Immunology, 2005, 19(2): 153-163. |
 2017, Vol. 44
2017, Vol. 44