扩展功能
文章信息
- 宋芳, 涂晨, 朱濛, 刘颖, 骆永明
- SONG Fang, TU Chen, ZHU Meng, LIU Ying, LUO Yong-Ming
- 紫金牛叶杆菌RC6b及其诱变菌株对二苯砷酸的降解特征
- Diphenylarsinic acid degradation by Phyllobacterium myrsinacearum RC6b and its mutants
- 微生物学通报, 2017, 44(11): 2557-2566
- Microbiology China, 2017, 44(11): 2557-2566
- DOI: 10.13344/j.microbiol.china.170041
-
文章历史
- 收稿日期: 2017-01-14
- 接受日期: 2017-05-08
- 优先数字出版日期(www.cnki.net): 2017-06-06
2. 中国科学院大学 北京 100049
2. University of Chinese Academic of Sciences, Beijing 100049, China
二苯砷酸(Diphenylarsinic acid,DPAA)是含砷化学武器的主要降解产物之一。在一战和二战期间,大量苯胂类化合物用于制造化学武器。其中,二苯氰胂和二苯氯胂是典型的刺激性毒气,也是日军在我国大陆使用最多的被标记为“红剂”的砒霜类毒物联苯化胂[1]。战后,这类化学武器主要通过就地掩埋或投入江河湖海等方式进行处置[2-4]。我国是日军遗留化学武器最大的受害者,目前在我国19个省市近百个地点发现了约200万枚日军遗留化学武器,其中大部分集中在东北地区[5-6]。埋藏在土壤或水体中的化学武器经长期腐蚀,弹体内的苯胂类化合物极易释放进入环境中,其中,二苯氰胂和二苯氯胂在环境中极不稳定,易发生水解氧化并生成稳定的DPAA[7]。DPAA具有较强的神经毒性和遗传毒性,并能够通过食物链等途径危害人体健康[3, 8-9]。因此,亟需开展有关污染土壤和地下水中DPAA的降解特征与修复技术研究。
基于降解的微生物修复因具有成本低、修复面积广和不易造成二次污染等优点[10],已被广泛应用于有机污染土壤和地下水的修复治理中。但目前国际上有关DPAA污染土壤和地下水微生物修复的研究仍非常有限,其中主要原因之一是由于DPAA的细胞毒性较高,难以筛选获得能直接利用DPAA为唯一碳源的DPAA高效降解微生物菌株[11]。共代谢降解是微生物应对此类高毒性、难降解类有机污染物的一种重要代谢方式,原本不能或不易被降解代谢的污染物在外加碳源或小分子共代谢基质的情况下能够被共代谢降解[12-13]。Nakamiya等[11]以甲苯为共代谢基质,从DPAA污染土壤中筛选出了一株栖息微球菌(Kytococcus sedentarius) NK0508,该菌株可在DPAA浓度为0.03 μmol/L的矿物盐培养基中存活3 d。此外,化学诱变和基因组重组技术也常被用于快速改变微生物的表型特征,进而影响微生物对有机污染物的降解代谢能力[14]。亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine,NTG)是烷化剂类诱变剂的一种,其诱变机理是使DNA分子上的碱基及磷酸部分烷化,导致DNA在复制时碱基配对错误而产生突变,进而影响微生物代谢途径[15-17]。而目前国际上有关利用共代谢手段提高微生物对DPAA降解能力的研究仍非常罕见,有关化学诱变强化DPAA微生物降解的效应与机理的研究尚无报道。因此,筛选我国本土的DPAA高效降解菌种资源,研究DPAA降解菌的共代谢降解与化学诱变强化效应,并阐明降解菌及其诱变菌株对DPAA的降解特征,对于发展我国化学武器残留区有机砷污染土壤的微生物修复原理与技术具有重要的科学与现实意义。
鉴于此,本研究以课题组前期从镉、锌、砷等重金属复合污染土壤中筛选获得的一株重金属高耐性菌株——紫金牛叶杆菌(Phyllobacterium myrsinacearum) RC6b为供试菌株[18],比较研究了添加不同共代谢碳源以及采用NTG进行化学诱变前后,RC6b菌株对DPAA的降解特征,鉴定了RC6b诱变菌株对DPAA的代谢产物,旨在为研发DPAA污染土壤和地下水的高效微生物修复技术提供菌株资源和科学依据。
1 材料与方法 1.1 供试菌株本实验所用菌株为实验室前期筛选保存的一株植物内生菌紫金牛叶杆菌(Phyllobacterium myrsinacearum RC6b,CGMCC 6621)。
1.2 主要试剂和仪器及培养基DPAA标准品购于日本Wako公司,纯度97%,其分子结构如图 1所示。

|
| 图 1 二苯砷酸的分子结构图 Figure 1 Molecular structure of diphenylarsinic acid |
|
|
LB液体培养基(富集培养基,g/L):酵母提取物5.0,蛋白胨10.0,NaCl 10.0,pH 6.8-7.0。R2A培养基(g/L):酵母提取物0.50,蛋白胨0.50,酪蛋白氨基酸0.50,葡萄糖0.50,可溶性淀粉0.50,K2HPO40.30,丙酮酸钠0.30,MgSO4·7H2O 0.05,固体培养基添加15%-20%琼脂。矿物盐培养基(g/L):NH4NO3 0.500,KH2PO4 1.000,MgSO4·7H2O 0.200,FeSO4·7H2O 0.005,维生素溶液10.0 mL,微量元素溶液10.0 mL,pH 7.0;其中维生素溶液(mg/L):维生素H 10.0,泛酸钙25.0,烟酸100.0,4-氨基苯甲酸500.0,氰钴胺20.0,硫铵50.0,吡哆胺250.0;微量元素溶液(mg/L):EDTA二钠500.0,MnSO4·H2O 5.0,CoSO4·7H2O 24.0,Na2MoO4·2H2O 5.0,ZnSO4·7H2O 10.0,H3BO4 30.0,CuSO4·5H2O 5.0,Ca(OH)2 50.0。DPAA降解培养基:向矿物盐培养基中添加2 mg/L DPAA粉末溶解。柠檬酸盐缓冲溶液(g/L):柠檬酸21.0,NaOH 8.8,用2 mol/L的NaOH调节pH至5.5。0.1 mol/L磷酸盐缓冲溶液(PBS,g/L):NaH2PO4 8.3,Na2HPO4 4.8,pH 7.2-7.4;0.01 mol/L PBS:NaH2PO4 7.8,Na2HPO4 17.9,pH 7.0。亚硝基胍(NTG)储备液:称取亚硝基胍10 mg于1.0 mL丙酮中溶解后,加水定容至10 mL,制成1.0 mg/mL的NTG储备液,新鲜制备。
DPAA浓度采用高效液相色谱-质谱联用法(HPLC-MS/MS)分析(TSQ Quantum Access MAX,美国Thermo公司),具体液相分离条件和质谱参数见文献[19]。降解菌生长情况采用Genesys 10S UV-VIS分光光度计(美国Thermo公司)测定OD600值进行评价。
1.3 实验方法 1.3.1 不同共代谢碳源对RC6b菌株降解二苯砷酸特征的影响试验: 挑取RC6b菌株于LB培养基中,28、180 r/min避光恒温振荡培养。将培养至对数生长期的RC6b菌株于5 000 r/min离心5 min,用0.01 mol/L PBS缓冲液洗涤3次后离心(同前)收集菌体,用矿物盐培养基重悬,调节OD600值至1.0左右,制成RC6b菌悬液备用。按10%接种量接种上述RC6b菌悬液于DPAA降解培养基(含DPAA 2 mg/L)中,分别添加蔗糖、葡萄糖和乙酸钠于DPAA降解培养基中,各碳源的浓度均为2 mg/L,同时设置灭活菌株作为对照组,每个处理设3个重复,于28、180 r/min进行避光振荡培养,并分别于0、3、7、14、21和28 d取样测定溶液中DPAA的浓度和降解菌生长情况。DPAA的降解率按公式(1)计算。

|
(1) |

|
(2) |
添加不同碳源后,RC6b菌株对DPAA的降解率及菌株OD600值随培养时间的变化曲线分别如图 2和图 3所示。由图 2和图 3可知,在以DPAA为唯一碳源的溶液培养体系中,RC6b菌株对DPAA的降解率低于2%,且细菌数量在整个培养期内几乎没有增长,这提示菌株RC6b难以直接利用DPAA为唯一碳源和能源而生长。分别添加蔗糖、葡萄糖和乙酸钠作为外加碳源后,DPAA的降解率均得到显著提高(P<0.05),培养28 d后对DPAA的降解率分别达到14.08%±1.20%、15.21%±1.21%和15.05%±1.36%,但不同碳源处理之间的DPAA降解率无显著性差异(P>0.05)。因此,后续实验选取降解效率相对较高的葡萄糖作为诱变菌株共代谢降解的外加碳源。

|
| 图 2 不同碳源条件下菌株RC6b对DPAA的降解率 Figure 2 Degradation rates of DPAA by strain RC6b utilizing different carbon sources |
|
|

|
| 图 3 不同碳源条件下液体培养系统菌株RC6b的生长情况 Figure 3 Growth of strain RC6b in a liquid culture system with different carbon sources |
|
|
从图 3可以看出,外加碳源处理组在培养前3天RC6b快速生长,OD600值从0.11左右快速升高至0.17左右,与此同时DPAA基本未发生降解;随后溶液OD600值缓慢下降,DPAA降解率有所提高,并在培养至14 d时达最大值,然后逐渐趋于稳定(图 2)。造成此现象的原因可能是,RC6b在培养前期主要利用外加碳源进行快速生长繁殖,由于易利用的外加碳源的存在,抑制了RC6b对DPAA的降解;随着外加碳源浓度的降低,细菌开始利用部分DPAA作为碳源,使培养后期DPAA降解率逐渐提高。但由于DPAA的毒性抑制了细菌的继续增殖,导致培养后期的OD600值逐渐下降[22],同时DPAA的降解率也趋于稳定。这一趋势与Nakamiya等[11]的研究结果相似,该研究先以DPAA为唯一碳源,拟从污染土壤中筛选富集DPAA降解菌但未能成功;考虑到DPAA的苯环结构及其生物毒性,改为向溶液体系中添加甲苯为唯一碳源后,成功地从DPAA污染土壤中筛选出了一株栖息微球菌(Kytococcus sedentarius) NK0508,该菌株可在DPAA浓度为0.03 μmol/L的矿物盐培养基中存活3 d;此后,DPAA的毒性仍抑制了菌株NK0508的进一步生长与增殖。
2.2 RC6b的NTG化学诱变株对DPAA的降解效应首先探讨了化学诱变剂亚硝基胍(NTG)的不同剂量对菌株RC6b生长的影响。随着诱变剂NTG浓度的提高,RC6b菌株的致死率显著提高。当NTG的浓度分别为50、100、250μg/mL时,RC6b菌株的致死率分别为33.9%、64.4%和78.0%。张春玲(2004)[23]和田雪娇等(2014)[24]分别采用NTG诱变选育高产海藻糖菌株和高产苯乳酸菌株时均发现,当NTG浓度控制在诱变致死率为75%-80%时的诱变效果较好,且更有利于增加正向突变频率。因此,本实验选择NTG的诱变浓度为250 μg/mL,此时的菌株诱变致死率为78%。
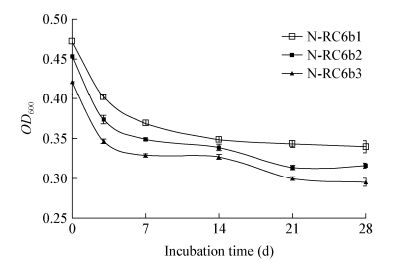
经NTG诱变后获得3株长势良好的诱变菌株,分别编号为N-RC6b1、N-RC6b2和N-RC6b3,3株诱变菌对DPAA的降解率及溶液OD600值随培养时间的变化曲线如图 4和图 5所示。

|
| 图 4 RC6b的诱变菌株对DPAA的降解率 Figure 4 Degradation rates of DPAA by mutant strain RC6b |
|
|
|
| 图 5 唯一碳源条件下溶液中诱变菌株的生长情况 Figure 5 Growth of mutant strains in a solution system with sole carbon sources |
|
|
由图 4可见,3株诱变菌对DPAA的降解能力均呈现随培养时间延长不断提高的趋势。在以DPAA为唯一碳源的条件下培养28 d后,N-RC6b1、N-RC6b2和N-RC6b3对DPAA的降解率分别达到26.29%±0.52%、36.71%±0.62%和24.21%±0.62%。与出发菌株相比,3株诱变菌对DPAA的降解能力均得到了显著提高。Ren等[25]的研究发现,诱变剂NTG对亚硝酸降解菌——乳酸杆菌同样具有较强的诱变效应。与出发菌株相比,诱变菌株对亚硝酸盐的降解率可显著提高5.8%-12.7%。然而在整个培养过程中,溶液OD600值呈先快速后缓慢下降,最后趋于稳定的趋势。其原因可能是NTG化学诱变改变了菌株RC6b对DPAA的代谢方式,激活了细菌中原本未表达的基因,使诱变菌株对DPAA的降解能力较出发菌株有显著提高。然而,DPAA的降解可能产生了毒性更强的中间代谢产物,导致降解菌的增殖速度减缓、死亡速率增加,从而使溶液OD600值表现出下降趋势。
图 6显示了以葡萄糖作为外加碳源的条件下,3株诱变菌株对DPAA的降解动态。由图 6可知,外加葡萄糖作为共代谢基质时,3株诱变菌对DPAA的降解率均随时间增加而逐渐提高,且外加碳源显著促进了诱变菌株在反应初期(7 d内)对DPAA的快速降解;但到反应后期(14-28 d),诱变菌对DPAA的降解速率显著减缓,到培养结束时(28 d),3株诱变菌株对DPAA的降解率最高仅为23.81%±2.07%,与以DPAA为唯一碳源的处理相比反而略有降低。可能的原因是,在外源添加葡萄糖后的0-7 d内,培养基中存在大量的速效碳源供菌株生长繁殖需要,同时也加快了诱变菌对DPAA的降解速率。但这在一定程度上也抑制了诱变菌降解DPAA相关基因的表达,导致在反应后期溶液中的速效碳源被逐渐耗竭时,诱变菌株因启动表达DPAA降解基因的迟滞效应而对DPAA降解速度减缓,降解效率降低。这一结果与李方卉等[26]的研究结果相似,其在优化菌株SL1对多氯联苯的降解率时发现,添加葡萄糖和蔗糖为共代谢底物时,菌株SL1对多氯联苯的降解率反而下降,可能与速效碳源的存在抑制了菌株降解多氯联苯基因的表达有关。

|
| 图 6 外加葡萄糖条件下诱变菌株对DPAA的降解率 Figure 6 Degradation rates of DPAA by mutagenic strains with glucose addition |
|
|
以DPAA作为唯一碳源,接种诱变菌株N-RC6b2培养28 d后溶液的HPLC-MS/MS分析结果如图 7所示。除保留时间为19.26 min处的DPAA外,在保留时间分别为18.42 min和18.84 min处出现2个新的未知色谱峰(U1和U2),这2个未知物具有相同的[M+H]+离子峰(m/z=279.10)。因为DPAA的分子量为262.0,而羟基的分子量为17.0,由此可初步鉴定该代谢产物可能为单羟基化的二苯砷酸。对照DPAA和苯砷酸PAA的标准品,进一步分析二级质谱中的碎片离子发现,m/z为261.00的碎片应为单羟基化DPAA脱羟基的产物;m/z为201.14的碎片应为单羟基化DPAA脱去一个苯环的产物。通过对代谢产物二级质谱碎片离子的结构分析,以及与文献[27]中单羟基化DPAA质谱图的比对分析,进一步证明了这2个未知代谢产物U1和U2分别为DPAA在苯环不同位点处的单羟基化产物。但由于单羟基化DPAA没有化学标准品,具体取代位点有待通过标准品的合成及比对后做进一步确定。单羟基化DPAA的分子结构如图 8所示。

|
| 图 7 DPAA降解液的总离子流图、选择离子流图及代谢产物MSn图 Figure 7 Total ion current (TIC) and extracted ion current (EIC) in HPLC-EIS(+)-MS/MS analysis of DPAA degradation solutions and mass spectra of ESI(+) MSn for metabolites 注:A:总离子流图;B:m/z=263.11,DPAA;C:m/z=279.10;D:代谢产物MSn图. Note: A: Total ion current; B: m/z=263.11, DPAA; C: m/z=279.10; D: Mass spectra of ESI(+) MSn for metabolite. |
|
|

|
| 图 8 单羟基化二苯砷酸的分子结构图 Figure 8 Molecular structures of mono-hydroxylated diphenylarsinic acids |
|
|
Harada等[27]的研究也发现,剑菌属Ensifer adhaerens菌株L2406与L2413在降解DPAA的产物中有单羟基化产物生成,且单羟基化DPAA进一步脱苯环生成了苯砷酸、砷酸盐等结构相对简单、毒性相对较低且更易去除的代谢产物。据此推断,虽然在本研究中目前就仅检测到DPAA的羟基化反应,但DPAA羟基化后很可能利于其进一步发生降解转化。
3 讨论大量研究表明,微生物对砷的代谢转化过程在砷的地球化学循环中起到了十分重要的作用,国内也已有多名研究者综述了微生物对无机砷的代谢转化作用机制[28-34],但目前有关利用微生物降解转化DPAA等有机砷污染物的机理研究仍非常有限,有关利用微生物降解修复化学武器残留地区有机砷污染土壤的应用研究仍为空白。因此,筛选DPAA高效降解菌种资源并阐明其对DPAA的降解特征,优化提升微生物对土壤中DPAA的降解转化潜力,对发展化学武器残留地区土壤中二苯砷酸等有机砷污染物的生物修复技术具有重要的科学意义与应用价值。
提高微生物降解修复DPAA污染土壤效率的途径主要包括:外加营养元素、筛选耐性/抗性较强的微生物菌株,以及利用分子生物学技术及基因工程等手段[33]。微生物在生长代谢过程中需要适合的碳源、氮源等营养元素。在适当的水分条件下,通过外源添加营养元素,一方面满足微生物生长发育过程中的物质需求,使之正常生长;另一方面可以作为共代谢基质,刺激土著降解性微生物对难降解性有机污染物进行共代谢降解。本研究利用课题组前期筛出的一株植物根际促生菌——紫金牛叶杆菌菌株RC6b,比较了蔗糖、葡萄糖和乙酸钠等不同外加碳源对DPAA降解的影响效果,发现RC6b菌株难以直接利用DPAA为唯一碳源生长,外加蔗糖、葡萄糖和乙酸钠等碳源均可显著加快菌株RC6b的生长与增殖活性,同时作为共代谢底物,显著提高菌株对DPAA的共代谢降解效率。然而,由于DPAA具有较高的水溶性和较强的细胞毒性,外加碳源仅将DPAA的降解率提高至15%左右,Harada等[27]报道筛选的菌株L2406和L2413对DPAA的降解率分别为55%和25%,与之相比,菌株RC6b对DPAA的降解效率仍有进一步的提升空间。
利用化学诱变与基因工程等手段对降解菌进行驯化和遗传改造则成为提高微生物对难降解有机污染物降解能力的另一重要途径。本研究首次探讨了化学诱变剂亚硝基胍(NTG)诱变菌株对DPAA的降解效果与代谢产物。研究发现,当NTG浓度为250μg/mL、DPAA为唯一碳源时,3株诱变菌对DPAA的降解率与出发菌株相比均显著提高,最高可达36.71%。与目前国际上仅有的关于DPAA好氧微生物降解的效果相比[27],NTG诱变菌对DPAA的降解能力已明显高于菌株L2413 (25%),但仍低于菌株L2406 (55%)。虽然NTG诱变可以显著提高微生物对特定底物的降解能力,但NTG诱变的精确机制尚不明确,可能的机制包括改变菌株的DNA分子结构,以及阻碍菌株DNA复制过程中双链的解开等[24, 26]。
有关DPAA的微生物降解代谢产物与代谢途径,Arao等[34]最早发现DPAA在厌氧环境下能被土壤微生物转化为无机砷,其可能的代谢途径为DPAA→PAA→砷酸盐。随后,Nakamiya等[11]发现栖息微球菌Kytococcus sedentarius菌株NK0508对DPAA的代谢产物包括砷酸盐和二苯基甲基砷氧化物(DPMAO),推测DPAA的降解可能主要是苯环的氧化和开环作用所致。Harada等[27]发现剑菌属Ensifer adhaerens菌株L2406与L2413对DPAA的降解代谢途径为DPAA→单羟基化DPAA→PAA→砷酸盐。其中,单羟基化DPAA的出现表明DPAA在生物体内的转化可能由单加氧酶所介导。本研究发现诱变菌株N-RC6b2对DPAA的代谢产物中有2种DPAA不同位置单羟基化代谢产物的生成,但DPAA的脱苯环产物苯砷酸PAA以及无机砷酸盐却未检出,这一方面可能是由于DPAA的初始浓度较低,导致其代谢产物的浓度低于检测限;另一方面也可能与不同降解菌株对DPAA的代谢途径与代谢机理的特异性有关。
土壤污染修复是一项复杂的系统工程,微生物修复是目前土壤污染生物修复研究的热点,也是治理有机砷污染土壤的主要手段之一。今后需进一步筛选具有高耐性的DPAA高效降解菌种资源,积极发展物理化学、植物-微生物联合修复技术,为我国化学武器遗留地区有机砷污染土壤的生物修复提供理论依据与技术原理。
| [1] |
He YZ, Ding RG. Casualties by the Japanese chemical weapons abandoned in China (1)——introduction of chemical weapon and the Japanese chemical weapons abandoned in China[J]. Chinese Critical Care Medicine, 2005, 17(8): 452-453. 何跃忠, 丁日高. 日本遗弃在华化学武器造成人员伤害的有关问题(1)——化学武器与日本遗弃在华化学武器情况介绍[J]. 中国危重病急救医学, 2005, 17(8): 452-453. |
| [2] |
Pitten FA, Müller G, K nig P, et al. Risk assessment of a former military base contaminated with organoarsenic-based warfare agents: uptake of arsenic by terrestrial plants[J]. Science of the Total Environment, 1999, 226(2/3): 237-245. |
| [3] |
崔玉玲, 金华, 张霞, 等. 对日本遗弃化学武器染毒土壤及水体中含砷物质的分析[J]. 三亚:中国化学会, 2007. |
| [4] |
Fu XJ. A study on chemical weapons abandoned by Japan in China[D]. Shanghai: Master's Thesis of Shanghai Normal University, 2010(in Chinese) 付小军. 日本遗弃在华化学武器问题研究[D]. 上海: 上海师范大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10270-2010084335.htm |
| [5] |
Shi JH, Zhou XZ. Technical Code for Recycling of Chemical Weapons Abandoned by Japan[M]. Beijing: China Economic Publishing House, 2007. 石建华, 周学志. 日本遗弃化学武器回收技术规程[M]. 北京: 中国经济出版社, 2007. |
| [6] |
Zhang FC, Wang YS, Shi FH, et al. Study on the abandoned chemical weapons by Japanese in China with an attempt to explore the burying location and pollution disposal[J]. Earth and Environment, 2011, 39(4): 567-570. 张福存, 王雨山, 石奉华, 等. 日本在华遗弃化学武器埋藏地调查及其污染处置方法研究[J]. 地球与环境, 2011, 39(4): 567-570. |
| [7] |
Ishii K, Tamaoka A, Otsuka F, et al. Diphenylarsinic acid poisoning from chemical weapons in Kamisu, Japan[J]. Annals of Neurology, 2004, 56(5): 741-745. DOI:10.1002/(ISSN)1531-8249 |
| [8] |
Ishizaki M, Yanaoka T, Nakamura M, et al. Detection of bis(diphenylarsine)oxide, diphenylarsinic acid and phenylarsonic acid, compounds probably derived from chemical warfare agents, in drinking well water[J]. Journal of Health Science, 2005, 51(2): 130-137. DOI:10.1248/jhs.51.130 |
| [9] |
Kroening KK, Solivio MJV, García-López M, et al. Cytotoxicity of arsenic-containing chemical warfare agent degradation products with metallomic approaches for metabolite analysis[J]. Metallomics, 2009, 1(1): 59-66. DOI:10.1039/B816980B |
| [10] |
Zheng JL, Li JW, Chao FH. Advance in study on biodegradation of aniline, nitrobenzene and trinitrotoluene[J]. Microbiology China, 2001, 28(5): 85-88. 郑金来, 李君文, 晁福寰. 苯胺、硝基苯和三硝基甲苯生物降解研究进展[J]. 微生物学通报, 2001, 28(5): 85-88. |
| [11] |
Nakamiya K, Nakayama T, Ito H, et al. Degradation of arylarsenic compounds by microorganisms[J]. FEMS Microbiology Letters, 2007, 274(2): 184-188. DOI:10.1111/fml.2007.274.issue-2 |
| [12] |
Janke D, Fritsche W. Nature and significance of microbial cometabolism of xenobiotics[J]. Journal of Basic Microbiology, 1985, 25(9): 603-619. DOI:10.1002/(ISSN)1521-4028 |
| [13] |
Xie S, Liu JX, Li L, et al. Biodegradation of malathion by Acinetobacter johnsonii MA19 and optimization of cometabolism substrates[J]. Journal of Environmental Science, 2009, 21(1): 76-82. DOI:10.1016/S1001-0742(09)60014-0 |
| [14] |
Zhang YX, Perry K, Vinci VA, et al. Genome shuffling leads to rapid phenotypic improvement in bacteria[J]. Nature, 2002, 415(6872): 644-646. DOI:10.1038/415644a |
| [15] |
Fiedurek J, Gromada A. Screening and mutagenesis of molds for improvement of the simultaneous production of catalase and glucose oxidase[J]. Enzyme and Microbial Technology, 1997, 20(5): 344-347. DOI:10.1016/S0141-0229(96)00148-2 |
| [16] |
Cheng M, Cui CB, Li CW, et al. Chemical mutation technique applied in microorganism breeding[J]. Journal of International Pharmaceutical Research, 2009, 36(6): 412-417. 程明, 崔承彬, 李长伟, 等. 化学诱变技术在微生物育种研究中的应用[J]. 国际药学研究杂志, 2009, 36(6): 412-417. |
| [17] |
Li HM, Miao XY, Wei M, et al. Screening of high-yield polysaccharide Athelia rolfsii by UV and NTG[J]. Science and Technology of Food Industry, 2014, 35(20): 244-247, 262. 李鸿梅, 苗琇岩, 魏明, 等. 紫外与亚硝基胍复合诱变选育高产多糖罗耳阿太菌[J]. 食品工业科技, 2014, 35(20): 244-247, 262. |
| [18] |
Ma Y, Rajkumar M, Luo YM, et al. Phytoextraction of heavy metal polluted soils using Sedum plumbizincicola inoculated with metal mobilizing Phyllobacterium myrsinacearum RC6b[J]. Chemosphere, 2013, 93(7): 1386-1392. DOI:10.1016/j.chemosphere.2013.06.077 |
| [19] |
Zhu M, Tu C, Hu XF, et al. Degradation of diphenylarsinic acid in soil by Fenton and Fenton-like reactions[J]. Environmental Chemistry, 2015, 34(6): 1078-1085. 朱濛, 涂晨, 胡学锋, 等. Fenton法和类Fenton法降解土壤中的二苯砷酸[J]. 环境化学, 2015, 34(6): 1078-1085. DOI:10.7524/j.issn.0254-6108.2015.06.2014091606 |
| [20] |
Miller JH. Experiments in Molecular Genetics[M]. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory, 1972.
|
| [21] |
Wu HH, Niu F. Selection for low temperature-resistant strain by composite mutagenesis of lactic acid bacteria[J]. Microbiology China, 2013, 40(4): 631-645. 吴慧昊, 牛锋. 乳酸菌低温菌株的复合诱变选育[J]. 微生物学通报, 2013, 40(4): 631-645. |
| [22] |
Feng SJ. Microbial-hyperaccumulator combined remediation of the diphenylarsinic acid contaminated soil[D]. Guiyang: Master's Thesis of Guizhou University, 2015(in Chinese) 冯仕江. 微生物-超富集植物联合修复二苯砷酸污染土壤研究[D]. 贵阳: 贵州大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10657-1016777670.htm |
| [23] |
Zhang CL. UV/NTG mutagenesis for breeding of a high trehalose-producing strain of Saccharomyces cerevisiae[J]. Food Science, 2009, 30(21): 188-191. 张春玲. 紫外线与亚硝基胍复合诱变选育高产海藻糖菌株的研究[J]. 食品科学, 2009, 30(21): 188-191. DOI:10.3321/j.issn:1002-6630.2009.21.044 |
| [24] |
Tian XJ, Zhang LP. Screening of high-yield phenyllactic acid strains by NTG mutation[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(4): 104-110. 田雪娇, 张丽萍. 亚硝基胍法诱变选育高产苯乳酸菌株[J]. 中国食品学报, 2014, 14(4): 104-110. |
| [25] |
Ren DY, Chen P, Li WT, et al. Screening, mutagenesis of nitrite-degrading lactobacilli in Chinese traditional fermented sauerkraut and its application in the production of sauerkraut[J]. Journal of Food Safety, 2016, 36(4): 474-481. DOI:10.1111/jfs.2016.36.issue-4 |
| [26] |
Li FH, Xu L, Zhang TH, et al. Degradation characteristics and fermentation conditions optimization of a PCBs-degrading strain[J]. Microbiology China, 2014, 41(7): 1299-1307. 李方卉, 徐莉, 张腾昊, 等. 一株PCBs降解菌的降解特性及发酵条件优化[J]. 微生物学通报, 2014, 41(7): 1299-1307. |
| [27] |
Harada N, Takagi K, Baba K, et al. Biodegradation of diphenylarsinic acid to arsenic acid by novel soil bacteria isolated from contaminated soil[J]. Biodegradation, 2010, 21(3): 491-499. DOI:10.1007/s10532-009-9318-3 |
| [28] |
Luo T, Jing CY. Research progress on mechanisms of arsenic mobilization in groundwater[J]. Environmental Chemistry, 2011, 30(1): 77-83. 罗婷, 景传勇. 地下水砷污染形成机制研究进展[J]. 环境化学, 2011, 30(1): 77-83. |
| [29] |
Yang J, Zhu YG. Progress in study of mechanisms of microbial arsenic transformation in environment[J]. Asian Journal of Ecotoxicology, 2009, 4(6): 761-769. 杨婧, 朱永官. 微生物砷代谢机制的研究进展[J]. 生态毒理学, 2009, 4(6): 761-769. |
| [30] |
Wu J, Xie MJ, Yang Q, et al. Current researches in microbial remediation of arsenic pollution[J]. Environmental Science, 2011, 32(3): 817-824. 吴佳, 谢明吉, 杨倩, 等. 砷污染微生物修复的进展研究[J]. 环境科学, 2011, 32(3): 817-824. |
| [31] |
Wang GJ, Wang Q, Chen F, et al. Research progress of microbial arsenite oxidation regulation[J]. Journal of Microbiology, 2014, 34(5): 1-7. 王革娇, 王倩, 陈芳, 等. 微生物砷氧化调控研究进展[J]. 微生物学杂志, 2014, 34(5): 1-7. |
| [32] |
K hler M, Hofmann K, V lsgen F, et al. Bacterial release of arsenic ions and organoarsenic compounds from soil contaminated by chemical warfare agents[J]. Chemosphere, 2001, 42(4): 425-429. DOI:10.1016/S0045-6535(00)00060-6 |
| [33] |
Yu TH, Li HS. Mechanism of bioremediation in arsenic contaminated soil and its research progress[J]. Environmental Pollution & Control, 2014, 36(12): 77-82. 余天红, 黎华寿. 砷污染土壤微生物修复机制及其研究进展[J]. 环境污染与防治, 2014, 36(12): 77-82. DOI:10.3969/j.issn.1001-3865.2014.12.017 |
| [34] |
Arao T, Maejima Y, Baba K. Uptake of aromatic arsenicals from soil contaminated with diphenylarsinic acid by rice[J]. Environmental Science & Technology, 2009, 43(4): 1097-1101. |
 2017, Vol. 44
2017, Vol. 44




