扩展功能
文章信息
- 颜鹏, 孙浩本, 毛忠贵, 唐蕾
- YAN Peng, SUN Hao-Ben, MAO Zhong-Gui, TANG Lei
- 链霉菌ε-聚赖氨酸发酵过程中的氧化胁迫效应
- Oxidative stress in ε-poly-L-lysine fermentation by Streptomyces
- 微生物学通报, 2017, 44(11): 2547-2556
- Microbiology China, 2017, 44(11): 2547-2556
- DOI: 10.13344/j.microbiol.china.170093
-
文章历史
- 收稿日期: 2017-02-03
- 接受日期: 2017-04-12
- 优先数字出版日期(www.cnki.net): 2017-04-18
2. 江南大学生物工程学院 江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China
ε-聚赖氨酸(ε-Poly-L-lysine,ε-PL)是微生物产生的由25-30个赖氨酸残基经α-COOH和ε-NH2缩合而成的聚合物[1]。ε-PL带有正电荷,水溶性及生物相容性好,无毒且抑菌谱广,可应用于食品、医药等领域[2]。ε-PL作为食品添加剂已在日本、美国、中国等国家获准使用,具有广阔的市场前景[3-4]。
目前微生物发酵是ε-PL工业化生产的主要方式,产物浓度低、成本高是症结所在,如常用的Streptomyces albulus摇瓶发酵,ε-PL的浓度在0.3-0.9 g/L[5],解决问题的方式包括ε-PL菌种的遗传改造以及发酵工艺控制等。依据L-赖氨酸的代谢途径,解除天冬氨酸激酶的反馈控制,提高单体L-赖氨酸的胞内含量曾经是ε-PL菌种改造的有效方法,如S. albulus摇瓶发酵中ε-PL的浓度提高到1.2 g/L[6-7]。但是这种通过对单一酶活力的调控以提升产物浓度的幅度有限。近年来,利用基因组重排(Genome shuffling,GS)和核糖体工程的方法在全基因组和细胞蛋白合成水平上尝试ε-PL生产菌种的改良已初见成效,摇瓶发酵ε-PL的浓度在3.0 g/L以上[8-9],但其相关机制尚不明确。本研究的前期工作是将Streptomyces sp. AS32和Streptomyces albulus F15进行GS育种,获得的GS菌种Streptomyces sp. AF3-44其ε-PL合成的代谢通量发生改变,合成能力有所提升[9]。本研究试图在此基础上进一步拓展,深入分析是否存在其他因素能够显著影响ε-PL合成,阐明GS方式改良ε-PL生产菌种的机理。
发酵工艺控制是ε-PL增产的另一种策略。在链霉菌ε-PL发酵过程中,pH的变化是ε-PL合成与否的关键。当培养基pH值降低到4.0时ε-PL开始合成,但酸性环境对菌体的生长显然不利。Kahar等[10]采用生长与产物合成分阶段控制的手段,5 L发酵罐、流加发酵条件下,ε-PL的浓度达到48.3 g/L。Ren等采用pH冲击策略,流加培养中ε-PL的浓度为54.7 g/L,较未冲击提高了52.5%[11]。另外,作为抑菌剂ε-PL的累积对产生菌自身也是不利的,Liu等[12]通过原位分离和固定化技术解除ε-PL的产物抑制和对菌体的毒害作用,并通过外源添加酵母提取物增强菌体活性,30 L发酵罐、流加发酵条件下,ε-PL的浓度为28.2 g/L[13]。Zhou等[14]利用GS手段选育出一株ε-PL耐受型高产菌株,能够在恒定pH 4.0时维持较好的菌体活力和ε-PL合成能力,但其耐受机制尚不明确。
活性氧(Reactive oxygen species,ROS)是正常有氧代谢过程中形成的一类活性物质的总称,过高的ROS会引起DNA、蛋白质、脂质等胞内生物大分子的氧化损伤,影响细胞活性[15]。Wang等[16]研究表明,酸胁迫能够诱发谷氨酸棒杆菌产生过量的ROS,导致酸胁迫下的细胞毒性。Ye等[17]报道ROS参与了ε-PL介导的抑菌作用。因此,在好氧、低pH和高ε-PL的发酵条件下,ROS有可能对生产菌株产生损伤,导致细胞活性的降低,从而影响ε-PL积累。
为了验证上述推测,本文从不同ε-PL产生菌株对ε-PL和pH耐受性及ROS和发酵性能之间的关系出发,探究在发酵过程中ε-PL和pH对ε-PL耐受型GS菌株ROS形成的影响,从而为控制ROS水平及提升菌体活力和ε-PL的发酵水平提供一个新的思路。
1 材料与方法 1.1 实验材料 1.1.1 菌种: 葡萄糖耐受型Streptomyces sp. AS32、ε-PL耐受型S. albulus F15和GS菌株Streptomyces sp. AF3-44为实验室保存ε-PL产生菌株[9]。 1.1.2 培养基: 平板培养基(BTN)的配制参照文献[9]。种子培养基和发酵培养基的配制参照文献[9]中的筛选培养基。 1.1.3 主要试剂和仪器: 纯度99%的ε-PL样品,浙江新银象生物工程公司;其它试剂均为分析纯,中国医药集团上海试剂公司。UV-2100分光光度计,尤尼柯上海仪器有限公司;多功能酶标仪BIOTEK,美国伯腾仪器有限公司;激光共聚焦显微镜Leica TCS SP8,德国莱卡公司;超声波细胞破碎仪SM-650D,南京舜玛仪器设备有限公司;紫外可见分光光度计U-3900,日本日立株式会社;高效液相色谱系统DIONEX U-3000,美国戴安公司。 1.2 实验方法 1.2.1 培养方法: 固体平板培养和种子培养参照文献[18]。摇瓶发酵培养:将3 mL种子液接入含有40 mL发酵培养基的250 mL摇瓶中,30、200 r/min培养3 d。 1.2.2 不同ε-PL浓度和不同pH固体培养基的配制: 向灭菌后的BTN培养基中加入无菌ε-PL母液,使BTN培养基中ε-PL的终浓度分别为所需浓度,倒平板。pH 4.0时BTN培养基中琼脂含量为40 g/L,pH 5.0时为30 g/L,其余为20 g/L。 1.2.3 不同pH缓冲体系的配制: 参考Ren等[19]的方法。 1.2.4 发酵过程参数的测定: ε-PL浓度的测定参考Itzhaki等[20]的方法。菌体干重(DCW)的测定参考Chen等[21]的方法。 1.2.5 丙二醛(Malonaldehyde,MDA)和ROS的测定: 参考Zeng等[22]的方法。 1.2.6 细胞活力的测定: 参考Zhou等[18]的方法。 1.2.7 细胞提取液的制备: 发酵液经4 500 r/min离心10 min,用0.2% KCl洗涤2次,8 000 r/min离心10 min,弃去上清,取1 g菌泥并用Tris-HCl (0.5 mol/L)定容至5 mL,进行超声波细胞破碎。破碎条件:功率40% (总功率为650 W),破碎2 s停2 s,工作20 min (实际破碎10 min),破碎过程在冰水混合物(0 ℃)中进行。经12 000 r/min离心20 min,上清液即为细胞提取液,用于海藻糖含量和抗氧化酶类活性测定。 1.2.8 海藻糖含量的测定: 取细胞提取液300 μL,加入无水乙醇700 μL,12 000 r/min离心10 min,取上清液采用高效液相色谱法测定海藻糖含量。色谱柱为Aminex HPX-87H (300 mm×7.8 mm,9 μm,Hercules,CA);检测器为RI (Shodex RI-101,Japan);流动相5 mmol/L硫酸;柱温60;流速0.6 mL/min;进样量10 μL。 1.2.9 抗氧化酶类活力测定: 超氧化物歧化酶(Superoxide dismutase,SOD)活力、过氧化氢酶(Catalase,CAT)和葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase,G6PDH)活力的测定参考Zeng等[22]的方法。其中,SOD酶活定义为:在1 mL反应液中,1 min内抑制联苯三酚自氧化速率达到50%时的酶量为1个酶活单位;CAT酶活定义为:在25每分钟μmol/L H2O2所需酶量为1个酶活单位;G6PDH酶活定义为:每分钟产生1 μmol NADPH所需的酶量为1个酶活单位。 2 结果与分析 2.1 3株ε-PL产生菌发酵过程参数比较选取前期研究中获得的葡萄糖耐受型Streptomyces sp. AS32、ε-PL耐受型S. albulus F15和上述两种菌株为亲本,经过三轮GS筛选得到的ε-PL耐受型Streptomyces sp. AF3-44[9]作为研究对象。F15来源于ε-PL生产的常用菌株S. albulus且具有产物耐受性,AS32为底物耐受型菌株,AF3-44为F15和AS32的融合菌株,3种菌株各具特征。本研究比较了它们在摇瓶发酵过程中pH、ε-PL和菌体生长的差异。pH是影响ε-PL合成和菌体生长的重要因素,如图 1所示。F15和AF3-44的pH值下降速度较AS32快,ε-PL开始合成的时间早于AS32,但F15的菌体生长受到抑制,发酵结束时菌体量为5.4 g/L,低于AS32的6.8 g/L。AF3-44的菌体量为6.4 g/L,虽略低于AS32,但ε-PL的浓度明显高于F15和AS32,说明AF3-44的单位菌体ε-PL合成能力强于其亲本菌株F15和AS32。

|
| 图 1 菌株F15 (A)、AS32 (B)和AF3-44 (C)摇瓶发酵过程参数 Figure 1 Profile of process parameters of strain F15 (A), AS32 (B) and AF3-44 (C) in shake flask fermentation |
|
|
由上述发酵参数分析可知,GS菌株AF3-44的ε-PL浓度高于亲本菌株,而自然发酵过程中培养基pH值低于亲本菌株。为探究AF3-44菌产物浓度高于亲本是否由于提高了菌株对酸性pH和ε-PL耐受能力所致,比较了GS菌株与亲本菌株对pH和ε-PL的耐受性。
用无菌牙签刮取孢子进行等面积涂布,比较3株菌在不同pH和ε-PL固体培养基上的生长和孢子生成情况,结果如图 2所示。在pH 7.0和5.0的条件下,AF3-44菌的孢子形成能力强于F15和AS32,而且随着ε-PL浓度的增高,F15和AS32的生长受到抑制。在pH 4.0时AF3-44菌的孢子形成能力优于AS32,但是与F15相差不大。为比较在pH 4.0条件下AF3-44和F15孢子生长能力,进一步提高了ε-PL的添加浓度,结果表明当ε-PL升至8.0 g/L和10.0 g/L时抑制了F15的生长(图 3)。综上所述,GS菌AF3-44不论是在酸性pH还是在高ε-PL浓度下,菌体生长和孢子形成能力均高于亲本菌株F15和AS32。也就是说,GS菌对酸性pH和高浓度ε-PL的耐受能力均强于亲本菌株。

|
| 图 2 3株菌对pH和ε-PL耐受性的比较 Figure 2 Comparison of pH and ε-PL tolerance of three strains 注:A、D、G分别代表菌株F15在pH 7.0、5.0、4.0的固体培养基上生长及孢子形成情况;B、E、H分别代表菌株AS32在pH 7.0、5.0、4.0的固体培养基上生长及孢子形成情况;C、F、I分别代表菌株AF3-44在pH 7.0、5.0、4.0的固体培养基上生长及孢子形成情况;添加的ε-PL终浓度依次为0、0.2、0.4、0.6、0.8、1.0 g/L. Note: A, D and G represent the growth and spore formation of strain F15 on solid media under pH 7.0, 5.0, 4.0, respectively; B, E and H represent the growth and spore formation of strain AS32 on solid media under pH 7.0, 5.0, 4.0, respectively; C, F and I represent the growth and spore formation of strain AF3-44 on solid media under pH 7.0, 5.0, 4.0, respectively; The final concentration of ε-PL in media is 0, 0.2, 0.4, 0.6, 0.8, 1.0 g/L respectively. |
|
|

|
| 图 3 pH 4.0时菌株F15和AF3-44对高浓度ε-PL的耐受性比较 Figure 3 Comparison of tolerance to high concentration of ε-PL between F15 and AF3-44 under pH 4.0 注:A、B分别代表菌株F15和菌株AF3-44在pH 4.0的固体培养基上生长及孢子形成情况;添加的ε-PL终浓度依次为3.0、5.0、8.0、10.0 g/L. Note: A, B represent the growth and spore formation of strain F15 and strain AF3-44 on solid media under pH 4.0 respectively; The final concentration of ε-PL in media is 3.0, 5.0, 8.0, 10.0 g/L respectively. |
|
|
以上结果表明低pH和高浓度的ε-PL会抑制菌体生长,与已有的文献报道相一致[12],但是其作用机制以及GS菌株耐受机制未见报道。一般认为ε-PL可以与敏感菌的细胞膜结合,导致细胞膜完整性的缺失,近年的研究表明ROS介导的核酸与蛋白质氧化也是造成敏感菌死亡的原因[17]。酸胁迫曾被报道造成谷氨酸棒杆菌ROS的上升和菌体活性的下降。对于ε-PL产生菌而言,发酵过程中ROS是如何变化,ROS的水平与细胞氧化损伤之间的关系尚不清楚。为此,首先检测了3株菌在发酵过程中ROS水平,以及以MDA为指标的氧化损伤程度。
结果表明随着发酵进行,3株菌中ROS的含量均呈上升趋势(图 4A),说明pH的下降和ε-PL累积确实可以导致ROS的提升。有文献报道ROS的增加会导致膜脂不饱和脂肪酸被氧化生成MDA,其含量能够间接反映膜脂受损情况[23]。虽然GS菌株AF3-44的ROS水平要显著高于其亲本AS32和F15,但是MDA的含量却介于AS32和F15之间,发酵后期还呈现下降趋势且60 h时明显低于两亲本(图 4B)。这表明GS菌在发酵后期膜的损伤程度低于亲本菌株,菌体活性强于亲本,以至于GS菌呼吸活力高,呼吸链的电子传递速率更快,但同时也增加了电子泄漏的可能性,导致ROS高于亲本[24]。

|
| 图 4 摇瓶发酵过程中3株菌ROS (A)和MDA (B)含量变化 Figure 4 Changes of ROS (A) and MDA (B) contents of three strains in shake flask fermentation |
|
|
进一步采用5-氰基-2, 3-二-(p-苄基-四唑氯化物)(5-Cyano-2, 3-ditolyl tetrazolium chloride,CTC)细胞染色的方法比较了发酵过程中3株菌的菌体活力。CTC自身并无荧光,但与微生物细胞膜接触后,可被位于膜表面电子传递链中的脱氢酶还原成非水溶性红色荧光物质[18],荧光强弱与细胞活性相对应。染色结果表明,随着发酵的进行,3株菌的荧光强度逐渐减弱,表明细胞活力下降,但在后期仍能维持较强的菌体活力(图 5)。利用系统软件将荧光信号转化为具体数值,结果表明发酵36 h后AF3-44活力显著高于AS32和F15 (图 6),与上述AF3-44细胞抗氧化能力较强、膜氧化损伤较少相一致。

|
| 图 5 摇瓶发酵中菌株AS32 (A)、F15 (B)与AF3-44 (C) CTC染色比较 Figure 5 Comparison of AS32 (A), F15 (B) and AF3-44 (C) with CTC staining in shake-flask fermentation |
|
|

|
| 图 6 摇瓶发酵过程中3株菌菌体活力比较 Figure 6 Comparison of the cell activity of three strains in shake-flask fermentation |
|
|
微生物为了能够在氧化胁迫下生存,将会激活相关胁迫抵制系统来对抗不利的生活环境。抗氧化胁迫系统一般包含抗氧化酶类和抗氧化物质[25]。抗氧化酶类包含SOD、CAT、G6PDH[26]等;抗氧化物质一般有海藻糖[27]、谷胱甘肽[28]等。为探究促进GS菌提升抗氧化胁迫应激的相关机制,对3株菌发酵过程中SOD、CAT、G6PDH酶活以及海藻糖含量分别进行测定,结果表明:发酵12-18 h时,3株菌的SOD酶活力上升,随后逐渐降低(图 7A),CAT和G6PDH酶活力随着发酵的进行逐渐升高(图 7B、C)。一般认为SOD通过歧化作用将O2-转化为H2O2和O2,H2O2量的增加会抑制SOD酶的活性;相反,CAT则会被H2O2诱导激活[29]。G6PDH是磷酸戊糖途径的关键酶,该代谢途径为细胞活动提供大量的还原力NADPH。有研究发现,G6PDH除了提供NADPH外还对H2O2产生的胁迫具有抵制作用[26]。本研究中随着发酵过程ROS含量的增加(图 4A),SOD酶活先上升后下降,CAT和G6PDH显著升高,与上述文献报道相一致。GS菌AF3-44的SOD和CAT酶活力前期高于两亲本F15和AS32 (图 7A、B),能够抵制氧化胁迫对菌体的损害;随着发酵的进行,GS菌的CAT和G6PDH酶活力也随之上升且活力均高于亲本(图 7B、C),可对发酵过程中产生的ROS进行清除,从而减轻氧化损伤。

|
| 图 7 摇瓶发酵过程中GS菌与亲本菌株抗氧化胁迫能力的比较 Figure 7 Comparison of antioxidative activity between GS strain and parent strains in shake-flask fermentation Note: A: SOD; B: CAT; C: G6PDH; D: Trehalose. |
|
|
海藻糖是一种非还原性双糖,作为一种抗氧化物质能够避免蛋白质和细胞膜在多种氧化胁迫条件下发生变性或失活,同时海藻糖还是组成放线菌细胞壁的基本成分[30]。对3株菌发酵过程中胞内海藻糖含量的分析显示:3株菌的海藻糖含量均呈现先上升后下降的趋势。GS菌AF3-44的胞内海藻糖含量始终高于亲本F15和AS32,并且在发酵60 h、F15和AS32中海藻糖含量开始下降时达到最大值,分别是F15和AS32的1.5和2.3倍(图 7D),对氧化胁迫下的GS菌具有保护作用。
2.5 ε-PL发酵过程中氧化胁迫的诱发因素有研究证实,温度、金属离子、酸碱、化学试剂等因素都可以诱导生物体产生氧化胁迫,导致生物体的活力降低甚至死亡。上述结果表明在ε-PL发酵过程中伴随着ROS的产生,并且浓度逐渐上升,诱发因素尚不清楚。pH是非常重要的ε-PL发酵参数,摇瓶自然发酵过程中pH值逐渐降低,低pH值可能诱发ROS的产生;发酵产物ε-PL能够结合在微生物细胞膜上,引起细胞膜通透性增加,而ROS主要来自细胞膜上呼吸链的电子传递,随着发酵产物ε-PL的积累,有可能引发电子泄漏和ROS的生成。
为了研究ε-PL对ROS生成的影响,将培养好的AF3-44种子液转接到发酵培养基预培养10 h后,加入终浓度分别为1.0、2.0、3.0 g/L的ε-PL,以未添加ε-PL的发酵为对照,每隔6 h对ROS进行测定。如图 8所示,当ε-PL加入后,发酵前期6-12 h ROS有明显增加趋势且与添加的ε-PL浓度呈正相关;而12-30 h中ROS的变化与ε-PL浓度变化没有明显的相关性。这可能与发酵前期pH值较高,ε-PL对菌体损伤作用大有关。
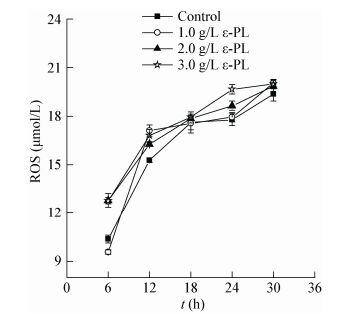
|
| 图 8 摇瓶发酵过程中ε-PL对ROS生成的影响 Figure 8 Effects of ε-PL on ROS generation in shake-flask fermentation |
|
|
由发酵过程参数分析可知,在发酵10-30 h pH值会出现一个快速下降过程,对细胞造成损害,为研究pH对氧化胁迫的影响,首先要将pH稳定在不同水平,为此选取pH为3.0、4.0、5.0的醋酸-醋酸钠和甘氨酸-盐酸缓冲体系,测定摇瓶发酵结束时pH、DCW和ε-PL水平,结果如表 1所示。发酵结束后G3、G4控制的培养基pH分别为4.8和5.1,与缓冲液所对应的pH 3.0和4.0不相符,并且DCW远高于pH不控制时的6.4 g/L (图 1C)。然而通过醋酸-醋酸钠缓冲体系(A)控制的培养基,发酵结束时的pH与缓冲液所对应的pH差别不大,DCW接近6.4 g/L,因此选用A作为调控摇瓶发酵pH的缓冲体系。当培养基pH值分别自然下降到5.0、4.0、3.0时加入对应的A5、A4、A3,每隔6 h对发酵过程中的ROS进行测定。
| 缓冲体系 Buffer system |
Parameters | ||
| pH | DCW (g/L) | ε-PL (g/L) | |
| A3 | 3.10±0.01 | 5.40±0.05 | 1.20±0.03 |
| A4 | 4.10±0.02 | 5.50±0.06 | 0.60±0.02 |
| A5 | 4.90±0.04 | 5.70±0.07 | 0 |
| G3 | 4.80±0.05 | 12.90±0.05 | 0 |
| G4 | 5.10±0.02 | 13.80±0.03 | 0 |
| G5 | 5.40±0.04 | 14.00±0.08 | 0 |
| 注:A3、A4、A5分别代表pH为3.0、4.0、5.0的醋酸-醋酸钠缓冲体系;G3、G4、G5分别代表pH为3.0、4.0、5.0的甘氨酸-盐酸缓冲体系. Note: A3, A4, A5 represent acetic acid-sodium acetate buffer system with pH 3.0, 4.0, 5.0 respectively; G3, G4, G5 represent the glycine-hydrochloric acid buffer system with pH 3.0, 4.0, 5.0 respectively. | |||
如图 9所示,ROS随pH值的降低而增加,并且当调控pH维持4.0和5.0时,发酵过程中会出现ROS迸发现象;然而调控pH维持3.0时,6-12 h时ROS有明显上升趋势,随着pH调控时间的延长并没有出现ROS迸发现象,可能是由于pH值过低导致菌体活力下降所致。综上所述,虽然ε-PL和酸性pH都会引发ε-PL产生菌的氧化胁迫效应,但ε-PL主要在发酵前期pH接近中性条件时起作用;到发酵中后期,pH值逐渐降低,培养基被酸化,菌体受到酸胁迫会诱发ROS的迸发。因此,根据上述特点对ε-PL发酵过程的ROS进行调控可能会提高ε-PL的浓度,目前该工作正在进行中。

|
| 图 9 摇瓶发酵过程中pH对ROS生成的影响 Figure 9 Effects of pH on ROS formation in shake-flask fermentation |
|
|
ε-PL作为天然防腐剂颇具应用价值,但是野生型菌ε-PL的合成能力较低,近年来新型的育种方法如GS、核糖体育种等,较传统的方法很大程度上提升了ε-PL的浓度。阐明突变株的高产机制,将为后续工业化应用打下基础[31-32]。本文比较了利用GS方法选育的耐受型高产菌株和其亲本菌株在pH和ε-PL耐受性上的差异,发现GS高产菌株在低pH和高浓度的ε-PL下能够保持高的菌体活力。为了解决ε-PL产生菌对低pH敏感及产物的反馈抑制造成的菌体量不足和产物浓度低的问题,使用固定化和营养物质流加的工艺控制,可以提高菌体活力,增加ε-PL的合成量[13]。本文研究发现通过GS育种手段获得的菌株可改善菌体自身耐受性,达到上述工艺控制所达到的目的,从而简化工艺控制过程,为ε-PL菌种的遗传改造提供新的思路。
作为好氧发酵过程,ROS被认为可以降低链霉菌细胞活力和ε-PL的比生成速率[25],本研究发现虽然GS高产菌株的ROS水平高于亲本菌株,但是由于其抗氧化胁迫能力,包括抗氧化酶类的活性和抗氧化物质的含量高于亲本菌株,所以减弱了ROS造成的损伤,因而在发酵后期保持了较强的菌体活力和较高的ε-PL水平,从抗氧化胁迫角度提出了GS选育的菌株耐受性强及产量高的生化机制。
酸性pH和高浓度的ε-PL均可以造成发酵过程中ROS的增高,但是由于pH值降低伴随ε-PL的累积,较难区分在自然发酵过程中二者对ROS水平的影响。本研究采用缓冲体系控制pH和外源添加ε-PL的方式,发现ε-PL引起的氧化胁迫主要发生在发酵前期,而发酵中后期氧化胁迫的产生主要由酸性pH导致,为今后控制ε-PL发酵过程中的ROS水平、提升ε-PL浓度提供了一种新的发酵过程控制策略。
| [1] |
Shima S, Sakai H. Poly-L-lysine produced by Streptomyces. Part Ⅱ. Taxonomy and fermentation studies[J]. Agricultural and Biological Chemistry, 1981, 45(11): 2497-2502. |
| [2] |
Hiraki J, Ichikawa T, Ninomiya SI, et al. Use of ADME studies to confirm the safety of ε-polylysine as a preservative in food[J]. Regulatory Toxicology and Pharmacology, 2003, 37(2): 328-340. DOI:10.1016/S0273-2300(03)00029-1 |
| [3] |
Li F. ε-Poly-l-lysine producing strain breeding by genome shuffling[D]. Wuxi: Master's Thesis of Jiangnan University, 2012(in Chinese) 李凤. Genome shuffling技术选育ε-聚赖氨酸高产菌[D]. 无锡: 江南大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10295-1013129652.htm |
| [4] |
National Health and Family Planning Commision of the People's Republic of China. Announcement on the approval of ε-polylysine and other four new food additives (No. 5, 2014)[J]. China Food Additives, 2014(3): 213-221. 中华人民共和国国家卫生和计划生育委员会. 关于批准ε-聚赖氨酸等4种食品添加剂新品种等的公告(2014年第5号)[J]. 中国食品添加剂, 2014(3): 213-221. |
| [5] |
Chheda AH, Vernekar MR. Improved production of natural food preservative ε-poly-L-lysine using a novel producer Bacillus cereus[J]. Food Science, 2014, 7: 56-63. |
| [6] |
Wang T, Jia SR, Tan ZL, et al. Mutagenesis and selective breeding of a high producing ε-poly-L-lysine strain[J]. Frontiers of Chemical Science and Engineering, 2012, 6(2): 179-183. DOI:10.1007/s11705-012-1273-6 |
| [7] |
Hiraki J, Hatakeyama M, Morita H, et al. Improved epsilon-poly-L-lysine production of an S-(2-aminoethyl)-L-cysteine resistant mutant of Streptomyces albulus[J]. Seibutsu-kogaku Kaishi, 1998, 76(12): 487-493. |
| [8] |
Wu GY, Chen XS, Wang L, et al. Screening of high-yield ε-poly-L-lysine producing strains through ribosome engineering[J]. Microbiology China, 2016, 43(12): 2744-2751. 吴光耀, 陈旭升, 王靓, 等. 核糖体工程技术选育ε-聚赖氨酸高产菌株[J]. 微生物学通报, 2016, 43(12): 2744-2751. |
| [9] |
Li S, Yan P, Zeng C, et al. Effect of genome shuffling on ε-poly-L-lysine synthesis and metabolic flux[J]. Microbiology China, 2016, 43(12): 2568-2577. 李双, 颜鹏, 曾晨, 等. Genome shuffling筛选ε-聚赖氨酸高产菌及其对代谢流量分配的影响[J]. 微生物学通报, 2016, 43(12): 2568-2577. |
| [10] |
Kahar P, Iwata T, Hiraki J, et al. Enhancement of ε-polylysine production by Streptomyces albulusstrain 410 using pH control[J]. Journal of Bioscience and Bioengineering, 2001, 91(2): 190-194. DOI:10.1016/S1389-1723(01)80064-5 |
| [11] |
Ren XD, Chen XS, Zeng X, et al. Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation by Streptomyces sp. M-Z18 from agro-industrial by-products[J]. Bioprocess and Biosystems Engineering, 2015, 38(6): 1113-1125. DOI:10.1007/s00449-015-1354-2 |
| [12] |
Liu SR. Study on ε-poly-L-lysine biosynthesis and metabolic regulation[D]. Guangzhou: Doctoral Dissertation of South China University of Technology, 2012(in Chinese) 刘盛荣. ε-聚赖氨酸生物合成及代谢调控研究[D]. 广州: 华南理工大学博士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10561-1013151583.htm |
| [13] |
Liu SR, Wu QP, Zhang JM, et al. Efficient production of ε-poly-L-lysine by Streptomyces ahygroscopicus using one-stage pH control fed-batch fermentation coupled with nutrient feeding[J]. Journal of Microbiology and Biotechnology, 2015, 25(3): 358-365. DOI:10.4014/jmb.1405.05069 |
| [14] |
Zhou YP, Ren XD, Wang L, et al. Enhancement of ε-poly-lysine production in ε-poly-lysine-tolerant Streptomyces sp. by genome shuffling[J]. Bioprocess and Biosystems Engineering, 2015, 38(9): 1705-1713. DOI:10.1007/s00449-015-1410-y |
| [15] |
Zhang QS, Zhang M, Liu XJ, et al. Progress in protein carbonylation[J]. Chinese Journal of Brain Diseases and Rehabilitation (Electronic Edition), 2014, 4(6): 54-57. 张秋生, 张猛, 刘晓佳, 等. 蛋白质羰基化的研究进展[J]. 中华脑科疾病与康复杂志:电子版, 2014, 4(6): 54-57. |
| [16] |
Wang TT, Gao F, Kang YW, et al. Mycothiol peroxidase MPx protects Corynebacterium glutamicum against acid stress by scavenging ROS[J]. Biotechnology Letters, 2016, 38(7): 1221-1228. DOI:10.1007/s10529-016-2099-y |
| [17] |
Ye RS, Xu HY, Wan CX, et al. Antibacterial activity and mechanism of action of ε-poly-l-lysine[J]. Biochemical and Biophysical Research Communications, 2013, 439(1): 148-153. DOI:10.1016/j.bbrc.2013.08.001 |
| [18] |
Zhou YP. Genome shuffling and metabolic regulation analysis of ε-poly-L-lysine producing strains[D]. Wuxi: Master's Thesis of Jiangnan University, 2015(in Chinese) 周永鹏. ε-聚赖氨酸产生菌的基因组重排与代谢调控分析[D]. 无锡: 江南大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10295-1015427308.htm |
| [19] |
Ren XD. Regulation of ε-poly-L-lysine biosynthetic process by Streptomyces sp. M-Z18[D]. Wuxi: Master's Thesis of Jiangnan University, 2012(in Chinese) 任喜东. Streptomyces sp. M-Z18生物合成ε-聚赖氨酸过程调控研究[D]. 无锡: 江南大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10295-1013129602.htm |
| [20] |
Itzhaki RF. Colorimetric method for estimating polylysine and polyarginine[J]. Analytical Biochemistry, 1972, 50(2): 569-574. DOI:10.1016/0003-2697(72)90067-X |
| [21] |
Chen XS, Li S, Liao LJ, et al. Production of ε-poly-L-lysine using a novel two-stage pH control strategy by Streptomyces sp. M-Z18 from glycerol[J]. Bioprocess and Biosystems Engineering, 2011, 34(5): 561-567. DOI:10.1007/s00449-010-0505-8 |
| [22] |
Zeng X. Physiological analysis of the ε-poly-L-lysine fermentation with simultaneous consumption of glucose and glycerol by Streptomyces albulus M-Z18[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2016(in Chinese) 曾欣. 小白链霉菌同步代谢葡萄糖和甘油合成ε-聚赖氨酸的生理机制研究[D]. 无锡: 江南大学博士学位论文, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10295-1016265381.htm |
| [23] |
Deng XP, Xia Y, Hu W, et al. Cadmium-induced oxidative damage and protective effects of N-acetyl-L-cysteine against cadmium toxicity in Solanum nigrum L.[J]. Journal of Hazardous Materials, 2010, 180(1/3): 722-729
|
| [24] |
Na YA, Lee JY, Bang WJ, et al. Growth retardation of Escherichia coli by artificial increase of intracellular ATP[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(6): 915-924. |
| [25] |
Zeng X, Chen XS, Gao Y, et al. Continuously high reactive oxygen species generation decreased the specific ε-poly-L-lysine formation rate in fed-batch fermentation using glucose and glycerol as a mixed carbon source[J]. Process Biochemistry, 2015, 50(12): 1993-2003. DOI:10.1016/j.procbio.2015.09.012 |
| [26] |
Izawa S, Maeda K, Miki T, et al. Importance of glucose-6-phosphate dehydrogenase in the adaptive response to hydrogen peroxide in Saccharomyces cerevisiae[J]. Biochemical Journal, 1998, 330(2): 811-817. DOI:10.1042/bj3300811 |
| [27] |
Moon MH, Ryu J, Choeng YH, et al. Enhancement of stress tolerance and ethanol production in Saccharomyces cerevisiae by heterologous expression of a trehalose biosynthetic gene from Streptomyces albus[J]. Biotechnology and Bioprocess Engineering, 2012, 17(5): 986-996. DOI:10.1007/s12257-012-0148-5 |
| [28] |
Li Y, Hugenholtz J, Abee T, et al. Glutathione protects Lactococcus lactis against oxidative stress[J]. Applied and Environmental Microbiology, 2003, 69(10): 5739-5745. DOI:10.1128/AEM.69.10.5739-5745.2003 |
| [29] |
Beites T, Pires SDS, Santos CL, et al. Crosstalk between ROS homeostasis and secondary metabolism in S. natalensis ATCC 27448: modulation of pimaricin production by intracellular ROS[J]. PLoS One, 2011, 6(11): e27472. DOI:10.1371/journal.pone.0027472 |
| [30] |
Song XL, Shi DS, Wen JW, et al. Biological synthesis pathways and biological characteristics of trehalose[J]. Food and Fermentation Industries, 2013, 39(8): 167-171. 宋晓丽, 石东升, 温佳文, 等. 海藻糖的生物合成途径及其生物学功能[J]. 食品与发酵工业, 2013, 39(8): 167-171. |
| [31] |
Wang L, Chen XS, Wu GY, et al. Enhanced ε-poly-L-lysine production by inducing double antibiotic-resistant mutations in Streptomyces albulus[J]. Bioprocess and Biosystems Engineering, 2017, 40(2): 271-283. DOI:10.1007/s00449-016-1695-5 |
| [32] |
Jin C. Screening of high-yield ε-poly-L-lysine producing strains[J]. Microbiology China, 2016, 43(12): 2743. 金城. ε-聚赖氨酸高产菌株的选育[J]. 微生物学通报, 2016, 43(12): 2743. |
 2017, Vol. 44
2017, Vol. 44




