扩展功能
文章信息
- 陶然, 毛雨丰, 付晶, 黄灿, 王智文, 陈涛
- TAO Ran, MAO Yu-Feng, FU Jing, HUANG Can, WANG Zhi-Wen, CHEN Tao
- 乙酸合成途径阻断及NADH氧化酶表达对于谷氨酸棒杆菌生产乙偶姻的影响
- Effects of inactivation of acetate synthetic pathway genes and overexpression of NADH oxidase on acetoin production in Corynebacterium glutamicum
- 微生物学通报, 2017, 44(11): 2530-2538
- Microbiology China, 2017, 44(11): 2530-2538
- DOI: 10.13344/j.microbiol.china.170080
-
文章历史
- 收稿日期: 2017-01-28
- 接受日期: 2017-03-31
- 优先数字出版日期(www.cnki.net): 2017-03-31
2. 天津化学化工协同创新中心 天津 300072
2. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin 300072, China
乙偶姻(CH3COCHOHCH3),作为美国能源部30种优先开发的平台化合物之一[1],广泛应用于食品、农业、医药和化工领域[2-3]。目前,乙偶姻的工业化生产主要依赖于化学合成法[4-5]。由于能源和环境的恶化以及化学合成的乙偶姻作为食品添加剂存在健康隐患,越来越多的研究者致力于通过微生物发酵法制备天然乙偶姻。
自然界中能够合成乙偶姻的微生物包括芽孢杆菌属、乳酸生产菌株和肠杆菌科[6]。早期关于乙偶姻生物合成的研究多集中于上述菌株[6-8],但是这些生产菌株工业化应用前景并不明朗。因为上述菌株目前产量还不理想,而且多为潜在致病菌,无法满足安全生产要求。近年来通过代谢工程改造GRAS微生物生产乙偶姻取得了突破性进展[9-13]。Bae等[14]对酿酒酵母进行代谢工程改造,合成乙偶姻100.1 g/L,其产量是目前此领域的最高水平,但该菌株生长较为缓慢,流加发酵初始接种量的OD600高达9.5,不利于后续的工业化生产。
谷氨酸棒杆菌(Corynebacterium glutamicum)广泛应用于L-谷氨酸和L-赖氨酸的商业化生产[15],具有悠久的食品工业发酵历史,底物利用范围广,十分适合乙偶姻的工业化生产。同时,谷氨酸棒杆菌耐受性强,有利于抵抗乙偶姻作为有机溶剂产生的毒性[16]。此外,该菌株也是重要的模式菌株,遗传改造工具丰富且方便快捷,有利于进一步进行代谢工程改造。但是目前鲜有相关研究,仅本课题组先前研究中在谷氨酸棒杆菌中引入枯草芽孢杆菌乙偶姻合成基因,其摇瓶产量为8.33 g/L,显示了谷氨酸棒杆菌在乙偶姻生产方面的应用潜力[17]。
本研究以谷氨酸棒杆菌CGF2为出发菌株,详细考察副产物乙酸相关基因的敲除对乙偶姻产量的影响,并通过调节溶氧和辅因子水平,进一步研究影响乙偶姻合成的因素。
1 材料与方法 1.1 菌株、质粒和引物| 菌株和质粒 Strains and plasmids |
相关特性 Relevant characteristics |
来源 Sources |
| Escherichia coli DH5α | Host for plasmid construction | Lab stock |
| CGF2 | C. glutamicum ATCC 13032△ldhA△pta△ack△butA | Unpublished work |
| CGT1 | CGF2; pEC-XK99E-SD | This study |
| CGT2 | CGF2△cat; pEC-XK99E-SD | This study |
| CGT3 | CGF2△cat△pqo; pEC-XK99E-SD | This study |
| CGT4 | CGF2△cat; pEC-XK99E-NSD | This study |
| pDsacB | KanR; vector for allelic exchange in C. glutamicum | Lab stock |
| pDsacB-△cat | pDsacB carrying a truncated cat gene | [18] |
| pDsacB-△pqo | pDsacB carrying a truncated pqo gene | This study |
| pEC-XK99E-alsSD | pEC-XK99E, Ptrc::alsSD | [17] |
| pEC-XK99E-NSD | pEC-XK99E, Ptrc::alsSD, nox | This study |
| Primer | Primer sequence (5′→3′) | Restriction site |
| pqo-FU | GGAGTCTAGATAACGAATGGTCGGTACAGTTACAA | Xba Ⅰ |
| pqo-FL | CAGGTCCAGGATATGCCGCACCGGCTGCAAACGCCGCCGCTTCCTCATTTCGA | |
| pqo-BU | GCGTTTGCAGCCGGTGCGGCATATCCTGGACCTGTACTGATCGATAT | |
| pqo-BL | CCGGAAGCTTCTCACCATTTCCCGGGCCATAAGAAT | Hind Ⅲ |
| cat-U | AAGGAATCGCAGAACCGCCA | |
| cat-L | GCTGCGGCTGATTTTGCTGA | |
| nox-U | AGACGAGCTCAAAGGAGGACAACCATGAAAGTCACAGTTGTTGGTTG | Sac Ⅰ |
| nox-L | AGACGAGCTCTATCCCGGGGCGCCCTGCAGGTTAAGCGTTAACTGATTGGGCAAC | Sac Ⅰ |
LB培养基和BHI培养基参照文献[17]配制。CGXIIY培养基(g/L):葡萄糖30.0,Yeast extract 5.0,(NH4)2SO4 5.0,Urea 5.0,KH2PO4 1.0,K2HPO4 1.0,MgSO4·7H2O 0.3,CaCl2 1.0×10-2,FeSO4·7H2O 1.0×10-2,MnSO4·H2O 1.0×10-4,ZnSO4·7H2O 1.0×10-3,CuSO4·5H2O 2.0×10-4,NiCl2·6H2O 2.0×10-5,Biotin 4.0×10-4,pH 7.0。分批补料发酵培养基(g/L):酵母粉50.0,玉米浆干粉10.0,Urea 1.0,K2HPO4 0.5,MgSO4·7H2O 0.5,pH 7.0。
质粒提取试剂盒、SanPrep柱式PCR产物纯化试剂盒及胶回收试剂盒、抗生素、PCR引物,生工生物工程(上海)股份有限公司;IPTG,Sigma公司;PCR相关酶、T4 DNA连接酶、限制性内切酶,Thermo公司;其他试剂为国产或进口的分析纯产品。
PCR仪,Bio-Rad公司;移液枪、电转仪,Eppendorf公司;5 L发酵罐,上海百仑生物工程有限公司;高效液相色谱,Agilent公司。
1.3 敲除载体pDsacB-Δpqo的构建以野生型谷氨酸棒杆菌基因组为模板,分别使用引物pqo-FU、pqo-FL和pqo-BU、pqo-BL,进行PCR扩增得到pqo上下游同源臂pqo-F和pqo-B片段。PCR反应体系(50μL):无菌水29μL,5×Buffer 10 μL,dNTPs (2 mmol/L) 5 μL,基因组模板1μL,上下游引物(10μmol/L)各2μL,Pfu聚合酶(5 U/μL) 1μL。PCR反应条件:96 ℃ 5 min;96 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,32个循环;72 ℃ 10 min。以纯化后的pqo-F和pqo-B片段为模板,使用引物pqo-FU和pqo-BL进行融合PCR得到拼接产物pqo-FB。PCR反应体系(50 μL):无菌水28 μL,5×Buffer 10 μL,dNTPs (2 mmol/L) 5 μL,上下游同源臂模板各1 μL,上下游引物(10 μmol/L)各2 μL,Pfu聚合酶(5 U/μL) 1 μL。PCR反应条件同上。
将pqo-FB片段纯化后使用限制性内切酶Xba Ⅰ和Hind Ⅲ酶切连接到载体pDsacB上,转化至大肠杆菌DH5α感受态中,在添加25 mg/L卡那霉素的LB培养基上培养,挑取阳性转化子,LB培养提取质粒,酶切验证正确后进行测序,得到pqo基因敲除质粒pDsacB-Δpqo。
1.4 目的基因的敲除参照Wieschalka等[19]的方法利用负筛选标记通过两次同源重组进行目的基因的无痕敲除。以敲除cat为例,将pDsacB-Δcat质粒通过电转导入谷氨酸棒杆菌感受态细胞中,电转化条件:100Ω,50μF,1.8 kV,5 ms。然后用含有卡那霉素的BHI固体培养基在30 ℃恒温培养,挑取第一次同源重组的转化子,使用引物cat-U和cat-L进行菌落PCR验证,筛选出在染色体上成功整合了pDsacB-Δcat的阳性克隆。菌落PCR反应体系(25 μL):无菌水10.5 μL,2×Taq PCR Master Mix 12.5 μL,引物(10μmol/L)各1μL,挑取少量单菌落作为反应模板。PCR反应条件:94 ℃ 10 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,32个循环;72 ℃ 10 min。再将其转接到BHI液体培养基中,于30 ℃、220 r/min振荡培养12 h,涂布于含有10%蔗糖的BHI固体培养基上,通过蔗糖致死基因sacB负筛选出第二次同源重组的转化子,将其在分别含有10%蔗糖和25 mg/L卡那霉素的BHI固体培养基上进行对照点板。最后挑取在蔗糖板上生长而卡那霉素板上不长的菌落,再次使用引物cat-U和cat-L进行菌落PCR验证,筛选出cat敲除菌株。pqo的敲除按照上述方法进行。
1.5 NADH氧化酶表达载体pEC-XK99E-NSD的构建以短乳杆菌基因组为模板,使用引物nox-U和nox-L进行PCR扩增得到nox片段(PCR反应体系和条件同1.3),纯化后使用限制性内切酶Sac Ⅰ单酶切连接到载体pEC-XK99E-SD上,转化至大肠杆菌DH5α感受态中,在添加25 mg/L卡那霉素的LB固体培养基上培养,挑取阳性转化子,LB培养提取质粒,酶切验证正确后进行测序,得到NADH氧化酶表达载体pEC-XK99E-NSD。
1.6 培养方法一级种子培养:从平板上挑取单菌落接种至装有5 mL BHI培养基的试管中,30℃、220 r/min培养12 h。
二级种子培养:将一级种子全部接入42 mL/250 mL锥形瓶CGXIIY培养基中,添加终浓度为25 mg/L的卡那霉素和20 g/L的葡萄糖,30 ℃、220 r/min振荡培养至OD600为10左右。
摇瓶发酵:转接二级种子液5 mL至42 mL/250 mL锥形瓶CGXIIY培养基中,添加终浓度为25 mg/L的卡那霉素和30 g/L的葡萄糖,同时于发酵初始添加1 mmol/L IPTG诱导alsSD操纵子表达,30 ℃、150 r/min振荡培养。进行溶氧水平优化后,振荡培养条件为30 ℃、220 r/min。
分批补料发酵:在5 L发酵罐进行,装液量2 L,接种量10%,温度30 ℃,通气量2.5 L/min,转速恒定500 r/min,待pH降至5.5后流加25%氨水控制为6.0。初始葡萄糖为50 g/L,当糖浓度低于10 g/L时补加800 g/L的葡萄糖恢复到初始水平。
1.7 发酵产物分析方法生物量测定:菌体浓度采用紫外可见分光光度计波长600 nm处的吸光值OD600表示。
葡萄糖测定:葡萄糖浓度采用生物传感仪SBA-40C测定。
乙偶姻及其副产物测定:采用高效液相色谱系统,色谱柱型号为Bio-Rad HPX 87H (9 μm,300 mm× 7.8 mm),流动相为5 mmol/L H2SO4,流速0.4 mL/min,柱温65 ℃,使用紫外VWD和示差RID检测。
2 结果与分析 2.1 pDsacB-Δpqo和pEC-XK99E-NSD的构建及鉴定根据1.3所述方法和条件构建质粒pDsacB-Δpqo,PCR扩增得到的pqo上下游同源臂pqo-F和pqo-B片段大小分别为621 bp和690 bp (图 1A),二者的融合片段pqo-FB大小为1 311 bp (图 1B)。重组质粒经Xba Ⅰ和Hind Ⅲ双酶切产生大小为1 311 bp和4 426 bp的两个目的片段(图 1C),表明pDsacB-Δpqo构建成功。

|
| 图 1 pqo片段(A、B)及pDsacB-Δpqo酶切验证(C)电泳图 Figure 1 The agarose gel electrophoresis of pqo (A, B) and enzymatic digestion (C) of pDsacB-Δpqo 注:M:1 kb DNA marker;1:PCR产物pqo-F;2:PCR产物pqo-B;3:PCR产物pqo-FB;4:pDsacB-Δpqo经Xba Ⅰ和Hind Ⅲ酶切的产物. Note: M: 1 kb DNA marker; 1: PCR product of pqo-F; 2: PCR product of pqo-B; 3: PCR product of pqo-FB; 4: Digestion products of pDsacB-Δpqo by XbaⅠ and Hind Ⅲ. |
|
|
根据1.5所述方法和条件构建质粒pEC-XK99E-NSD,PCR扩增得到的nox片段大小为1 380 bp (图 2A)。重组质粒经SacⅠ酶切产生大小为1 380 bp和9 505 bp的两个目的片段(图 2B),表明pEC-XK99E-NSD构建成功。

|
| 图 2 nox片段(A)及pEC-XK99E-NSD酶切验证(B)电泳图 Figure 2 The agarose gel electrophoresis of nox (A) and enzymatic digestion (B) of pEC-XK99E-NSD 注:M:1 kb DNA marker;1:PCR产物nox;2:pEC-XK99E-NSD经Sac Ⅰ酶切的产物. Note: M: 1 kb DNA marker; 1: PCR product of nox; 2: Digestion products of pEC-XK99E-NSD by Sac Ⅰ. |
|
|
根据1.4所述方法和条件敲除cat和pqo基因。分别以pqo突变株和野生型谷氨酸棒杆菌基因组为模板,使用引物pqo-FU和pqo-BL进行PCR验证。pqo突变株和野生型的PCR产物分别为1 311 bp和2 691 bp (图 3A),表明pqo基因被成功敲除。分别以cat突变株和野生型谷氨酸棒杆菌基因组为模板,使用引物cat-U和cat-L进行PCR验证。cat突变株和野生型的PCR产物分别为1 877 bp和3 251 bp (图 3B),表明cat基因被成功敲除。
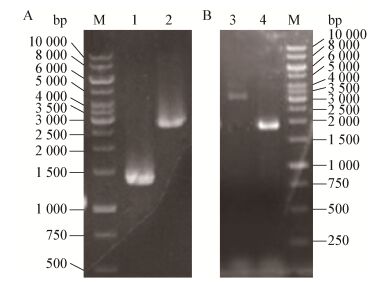
|
| 图 3 pqo (A)及cat (B)缺失的PCR验证琼脂糖凝胶电泳 Figure 3 The agarose gel electrophoresis of identification the mutation of pqo (A) and cat (B) by PCR 注:M:1 kb DNA marker;1:pqo突变株的PCR产物;2:pqo野生型的PCR产物;3:cat野生型的PCR产物;4:cat突变株的PCR产物. Note: M: 1 kb DNA marker; 1: PCR product of pqo mutation; 2: PCR product of pqo wild type; 3: PCR product of cat wild type; 4: PCR product of cat mutation. |
|
|
根据研究报道,微生物可以利用糖类物质经EMP途径生成丙酮酸,两分子丙酮酸在α-乙酰乳酸合成酶的作用下合成乙酰乳酸和二氧化碳,随后乙酰乳酸在α-乙酰乳酸脱羧酶的作用下转化为一分子乙偶姻。生成的乙偶姻会在2, 3-丁二醇脱氢酶的催化下变为2, 3-丁二醇[1]。以上途径广泛存在于各类乙偶姻生产菌株中。将枯草芽孢杆菌乙偶姻合成关键酶编码基因alsS和alsD引入谷氨酸棒杆菌,其中葡萄糖到乙偶姻的代谢途径如图 4所示。

|
| 图 4 谷氨酸棒杆菌合成乙偶姻的代谢途径 Figure 4 Metabolic pathway for acetoin synthesis in C. glutamicum 注:alsSBs:枯草芽孢杆菌α-乙酰乳酸合成酶基因;alsDBs:枯草芽孢杆菌α-乙酰乳酸脱羧酶基因;butA:2, 3-丁二醇脱氢酶基因;ldhA:乳酸脱氢酶基因;pqo:丙酮酸氧化还原酶基因;pta:磷酸转乙酰酶基因;ackA:乙酸激酶基因;cat:乙酰辅酶A转移酶基因;aceE:丙酮酸脱氢酶E1亚基基因. Note: alsSBs: α-acetolactate synthase gene from B. subtilis; alsDBs: α-acetolactate decarboxylase gene from B. subtilis; butA: 2, 3-butanediol dehydrogenase gene; ldhA: lactate dehydrogenase gene; pqo: pyruvate:quinone oxidoreductase gene; pta: phosphotransacetylase gene; ackA: acetate kinase gene; cat: acetyl-CoA transferase gene; aceE: pyruvate dehydrogenase E1 component gene. |
|
|
出发菌株CGF2为ldhA、pta-ackA和butA的敲除株,阻断了乳酸、乙酸、2, 3-丁二醇合成途径,有利于乙偶姻的积累。在此基础上将质粒pEC-XK99E-alsSD导入CGF2构建含有乙偶姻合成途径的重组菌株CGT1。摇瓶发酵显示,CGT1合成乙偶姻6.27 g/L,同时积累了3.96 g/L乙酸(图 5)。实验结果表明异源的alsSD在谷氨酸棒杆菌中成功进行了表达,在发酵过程中没有检测到乳酸以及2, 3-丁二醇,说明ldhA和butA的敲除可有效阻断乳酸的生成以及防止乙偶姻向2, 3-丁二醇转化。虽然菌株CGT1中的主要乙酸生成途径被阻断,但仍积累了大量乙酸,因此有必要进一步阻断其他乙酸合成途径,以提高乙偶姻产量。

|
| 图 5 CGT1发酵曲线 Figure 5 Fermentation curve of CGT1 |
|
|
目前谷氨酸棒杆菌中涉及乙酸合成的已知基因包括pta-ackA、cat、pqo和aceE (图 4)[20]。CGT1中的pta-ackA已经被敲除,而失活aceE会极大阻碍乙酰辅酶A的合成造成菌体生长困难,需要额外添加适量乙酸盐才能正常生长[21],从而增加发酵成本,因此选择cat和pqo进行敲除。首先敲除CGT1中的cat构建重组菌株CGT2,其在摇瓶发酵中可积累乙偶姻8.21 g/L,比CGT1提高了30.94%。同时,乙酸显著降低了86.86%,而最高生物量则提高9.91% (图 6)。实验结果表明,敲除cat高效阻断了胞内乙酰辅酶A向乙酸的转化,将更多碳通量导向生物量和乙偶姻的合成,相应地也提高了糖耗速率和乙偶姻的产率。

|
| 图 6 CGT2发酵曲线 Figure 6 Fermentation curve of CGT2 |
|
|
为了进一步减少乙酸生成,敲除CGT2中的pqo得到菌株CGT3。然而CGT3的发酵情况和CGT2差异不大(数据未显示),失活pqo对乙酸和乙偶姻的生成以及菌体生长都没有产生明显影响。这可能是由以下几点原因造成的:(1)虽然丙酮酸氧化还原酶PQO在体外反应中被证实能够以丙酮酸为底物生成乙酸,但相较于丙酮酸脱氢酶复合体PDHC,其对丙酮酸的亲和度远高于前者(PDHC、PQO的Km分别为0.8 mmol/L和30 mmol/L)[22]。(2) Schreiner等发现PDHC的降低或缺失可能激活pqo,但即使在敲除PDHC E1编码基因aceE的菌株中过表达pqo (酶活提高15倍)也只有少量碳通量经过该途径生成乙酸[23]。因此,在PDHC存在的情况下pqo可能处于抑制状态。(3)添加葡萄糖会使PQO的活性降低3倍[23],在非葡萄糖限制的培养过程中该酶的活性可能进一步被抑制。鉴于上述结果,后续选择菌株CGT2进行优化。
2.5 溶氧水平对乙偶姻积累的影响乙偶姻与2, 3-丁二醇的相互转化可平衡胞内NAD+/NADH (图 4),阻断该通路会造成NADH过剩从而影响菌体生长。NADH可通过呼吸链被消耗而实现平衡[24],因此溶氧水平对乙偶姻积累有着重要影响。将CGT2在不同转速下进行摇瓶发酵,结果表明当转速从150 r/min提高到180 r/min,乙偶姻得率、产率均明显增加,而继续增大至220 r/min,得率无明显变化,产率进一步提升(表 3)。因此,后续研究采用220 r/min进行发酵培养。
| 转速 Rotation speed (r/min) |
葡萄糖消耗 Glucose consumed (g/L) |
乙偶姻 Acetoin (g/L) |
得率 Yield on glucose (g/g) |
产率 Productivity (g/(L·h)) |
乙酸 Acetate (g/L) |
| 150 | 30.50±0.50 | 8.21±0.10 | 0.27±0.01 | 0.23±0.01 | 0.52±0.01 |
| 180 | 30.75±0.85 | 9.68±0.15 | 0.31±0.01 | 0.27±0.01 | 0.48±0.09 |
| 220 | 31.10±0.60 | 10.06±0.20 | 0.32±0.01 | 0.34±0.01 | 0.38±0.02 |
先前的研究中150 r/min为生产乙偶姻的最佳转速[17],与本文结果不一致,一方面是菌株基因型存在差异,马红武等[17]构建的菌株敲除aceE后丙酮酸不能生成乙酰辅酶A,阻断了该途径NADH的产生,NADH的过剩程度较低,因此不需要太多氧气平衡胞内还原力;另一方面可能是aceE敲除后需要添加乙酸盐造成。
2.6 有氧条件下表达NADH氧化酶对乙偶姻积累的影响应用辅因子工程策略,表达NADH氧化酶也可以消耗过剩的NADH。将短乳杆菌的NADH氧化酶编码基因nox引入CGT2中得到菌株CGT4。摇瓶发酵显示(图 7),表达NADH氧化酶能够显著提高菌株的生长速率及糖耗速率,但乙偶姻的产量反而有所降低。同时CGT4的生物量较CGT2增加了20.93%。实验结果表明,高溶氧条件下在谷氨酸棒杆菌中表达NADH氧化酶并不能提高乙偶姻的得率。

|
| 图 7 CGT2和CGT4在220 r/min下的发酵曲线 Figure 7 Fermentation curve of CGT2 and CGT4 at 220 r/min |
|
|
在同类研究中,均是通过该酶的适度表达消耗胞内过量的NADH。Zhang等[25]在枯草芽孢杆菌中表达NADH氧化酶,发现酶活提高20-30倍时的乙偶姻产量只有酶活提高5倍时的67%。在CGT4中,nox的表达使用了中等拷贝数质粒作为载体且携带强启动子trc,可能造成NADH氧化酶表达量过高。而且优化后的溶氧水平有效改善了NADH过剩的问题,胞内NAD+的再生可能不再是合成乙偶姻的限制因素,在该条件下表达NADH氧化酶反而与呼吸链竞争NADH,造成了能量的浪费,细胞可能需要更多的碳通量进入TCA循环以补充流失的NADH,从而致使乙偶姻产量降低,同时碳源的快速消耗也导致了细胞生长加快、生物量增加的现象。
2.7 菌株CGT2的分批补料发酵实验为探究谷氨酸棒杆菌在乙偶姻工业生产方面的潜力,菌株CGT2在5 L发酵罐中进行了分批补料发酵。结果表明乙偶姻的产量达到40.51 g/L,得率为0.24 g/g葡萄糖,产率为0.51 g/(L·h) (图 8)。补料发酵的乙偶姻得率相比摇瓶发酵有所下降,但其产量和产率却显著提高。得率下降的原因一方面在于分批补料发酵中氮源丰富、溶氧优于摇瓶,快速积累了过高的生物量,大量碳源用于菌体生长造成了浪费;另一方面,发酵周期较长,后期存在质粒丢失现象,而且随着乙偶姻浓度的增加其对细胞的抑制作用也加强。

|
| 图 8 CGT2分批补料发酵生产乙偶姻 Figure 8 Fed-batch fermentation of CGT2 for acetoin production |
|
|
在补料发酵中GGT2还积累了2.13 g/L琥珀酸和3.32 g/L乙酸,其对葡萄糖的得率分别为0.013 g/g和0.019 g/g,与摇瓶发酵的结果较为接近(分别为0.016 g/g和0.012 g/g)。但甘油的积累却显著提高到5.83 g/L (摇瓶中小于1 g/L)。在发酵前期(36 h)琥珀酸、乙酸几乎没有生成,然而随着生物量的不断积累,发酵罐中溶氧水平逐渐降低,二者的含量才出现明显的增加。当氧供给不足时,谷氨酸棒杆菌会分泌诸如乳酸、琥珀酸、乙酸等有机酸以及甘油[26]。此外,造成甘油增加的原因可能是发酵培养基的改变。在补料发酵培养基中使用了更为廉价、高效的有机氮源玉米浆,其成分十分复杂[27],可能激活了甘油生成途径的相关酶。
3 讨论本研究构建的工程菌株CGT2在5 L发酵罐中积累了较高浓度的乙偶姻,在生产菌株中具有一定竞争力,但是其得率和产率还有很大的提升空间。其中,表达NADH氧化酶提高菌株生产乙偶姻的能力在粘质沙雷氏菌[8]、枯草芽孢杆菌[25]、酿酒酵母[14]、大肠杆菌[9]、阴沟肠杆菌[28]中已有报道。但是,高溶氧条件下在谷氨酸棒杆菌中使用该策略并没有提高乙偶姻的得率,还需要对该酶的表达水平进一步优化。对于分批补料发酵中积累的琥珀酸、甘油,后期实验可以对相关途径进行代谢工程改造,同时引入外源的乙酰辅酶A合成酶将发酵过程中产生的乙酸转化为乙酰辅酶A,进一步减少各类副产物生成以提高乙偶姻的产量和得率。此外,培养基和发酵工艺的优化可以有效提高乙偶姻的产量和产率,在今后的研究中需要详细研究培养基成分及转速、通气量、pH值等发酵条件对乙偶姻生产的影响。
| [1] |
Xiao ZJ, Xu P. Acetoin metabolism in bacteria[J]. Critical Reviews in Microbiology, 2007, 33(2): 127-140. DOI:10.1080/10408410701364604 |
| [2] |
Chen RZ, Li Y. A novel plant volatile attractant scheme to protect corn in China from the white-spotted flower chafer (Coleoptera: Scarabaeidae: Cetoniinae)[J]. Journal of Pest Science, 2011, 84(3): 327-335. DOI:10.1007/s10340-011-0353-6 |
| [3] |
Yu CM, Lei M, Su WK, et al. Europium Triflate-catalyzed one-pot synthesis of 2, 4, 5-Trisubstituted-1H-imidazoles via a Three-component Condensation[J]. Synthetic Communications, 2007, 37(19): 3301-3309. DOI:10.1080/00397910701483589 |
| [4] |
Hilmi A, Belgsir EM, Léger JM, et al. Electrocatalytic oxidation of aliphatic diols Part Ⅴ. Electro-oxidation of butanediols on platinum based electrodes[J]. Journal of Electroanalytical Chemistry, 1997, 435(1/2): 69-75. |
| [5] |
Studer M, Blaser HU, Studer M, et al. Hydrogenation of butane-2, 3-dione with heterogeneous cinchona modified platinum catalysts: a combination of an enantioselective reaction and kinetic resolution[J]. Chemical Communications, 1998(9): 1053-1054. DOI:10.1039/a801390j |
| [6] |
Xiao ZJ, Lu JR. Strategies for enhancing fermentative production of acetoin: a review[J]. Biotechnology Advances, 2014, 32(2): 492-503. DOI:10.1016/j.biotechadv.2014.01.002 |
| [7] |
Dai JY, Cheng L, He QF, et al. High acetoin production by a newly isolated marine Bacillus subtilis strain with low requirement of oxygen supply[J]. Process Biochemistry, 2015, 50(11): 1730-1734. DOI:10.1016/j.procbio.2015.07.010 |
| [8] |
Sun JA, Zhang LY, Rao B, et al. Enhanced acetoin production by Serratia marcescens H32 with expression of a water-forming NADH oxidase[J]. Bioresource Technology, 2012, 119: 94-98. DOI:10.1016/j.biortech.2012.05.108 |
| [9] |
Xu QM, Xie LX, Li YY, et al. Metabolic engineering of Escherichia coli for efficient production of (3R)-acetoin[J]. Journal of Chemical Technology and Biotechnology, 2015, 90(1): 93-100. DOI:10.1002/jctb.2015.90.issue-1 |
| [10] |
Zhang B, Li XL, Fu J, et al. Production of acetoin through simultaneous utilization of glucose, xylose, and arabinose by engineered Bacillus subtilis[J]. PLoS One, 2016, 11(7): e0159298. DOI:10.1371/journal.pone.0159298 |
| [11] |
Luo QL, Wu J, Wu MC. Enhanced acetoin production by Bacillus amyloliquefaciens through improved acetoin tolerance[J]. Process Biochemistry, 2014, 49(8): 1223-1230. DOI:10.1016/j.procbio.2014.05.005 |
| [12] |
Zhang X, Bao T, Rao ZM, et al. Two-stage pH control strategy based on the pH preference of acetoin reductase regulates acetoin and 2, 3-butanediol distribution in Bacillus subtilis[J]. PLoS One, 2014, 9(3): e91187. DOI:10.1371/journal.pone.0091187 |
| [13] |
Zhang LY, Chen S, Xie HB, et al. Efficient acetoin production by optimization of medium components and oxygen supply control using a newly isolated Paenibacillus polymyxa CS107[J]. Journal of Chemical Technology and Biotechnology, 2012, 87(11): 1551-1557. DOI:10.1002/jctb.v87.11 |
| [14] |
Bae SJ, Kim S, Hahn JS. Efficient production of acetoin in Saccharomyces cerevisiae by disruption of 2, 3-butanediol dehydrogenase and expression of NADH oxidase[J]. Scientific Reports, 2016, 6: 27667. DOI:10.1038/srep27667 |
| [15] |
Yang J, Kim B, Kim H, et al. Industrial production of 2, 3-butanediol from the engineered Corynebacterium glutamicum[J]. Applied Biochemistry and Biotechnology, 2015, 176(8): 2303-2313. DOI:10.1007/s12010-015-1719-7 |
| [16] |
Luo QL, Wu J, Wu MC. Effects of acetoin on Bacillus amyloliquefaciens cell physiology[J]. Chinese Journal of Bioprocess Engineering, 2015, 13(6): 49-54. 罗秋玲, 吴静, 邬敏辰. 乙偶姻对解淀粉芽胞杆菌细胞生理的影响[J]. 生物加工过程, 2015, 13(6): 49-54. |
| [17] |
Ma HW, Liu HJ, Zhu NQ, et al. Metabolic engineering of Corynebacterium glutamicum for acetoin production[J]. Journal of Tianjin University (Science and Technology), 2014, 47(11): 967-972. 马红武, 刘会娟, 朱年青, 等. 代谢工程方法改造谷氨酸棒状杆菌生产乙偶姻[J]. 天津大学学报:自然科学与工程技术版, 2014, 47(11): 967-972. |
| [18] |
Zhu NQ. Metabolic engineering of Corynebacterium glutamicum for high-level production of succinate[D]. Tianjin: Doctoral Dissertation of Tianjin University, 2013(in Chinese) 朱年青. 谷氨酸棒杆菌高产琥珀酸的代谢工程改造[D]. 天津: 天津大学博士学位论文, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10056-1014036184.htm |
| [19] |
Wieschalka S, Blombach B, Eikmanns BJ. Engineering Corynebacterium glutamicum for the production of pyruvate[J]. Applied Microbiology and Biotechnology, 2012, 94(2): 449-459. DOI:10.1007/s00253-011-3843-9 |
| [20] |
Litsanov B, Kabus A, Brocker M, et al. Efficient aerobic succinate production from glucose in minimal medium with Corynebacterium glutamicum[J]. Microbial Biotechnology, 2012, 5(1): 116-128. DOI:10.1111/mbt.2012.5.issue-1 |
| [21] |
Schreiner ME, Fiur D, Holátko J, et al. E1 enzyme of the pyruvate dehydrogenase complex in Corynebacterium glutamicum: molecular analysis of the gene and phylogenetic aspects[J]. Journal of Bacteriology, 2005, 187(17): 6005-6018. DOI:10.1128/JB.187.17.6005-6018.2005 |
| [22] |
Schreiner ME, Eikmanns BJ. Pyruvate: quinone oxidoreductase from Corynebacterium glutamicum: purification and biochemical characterization[J]. Journal of Bacteriology, 2005, 187(3): 862-871. DOI:10.1128/JB.187.3.862-871.2005 |
| [23] |
Schreiner ME, Riedel C, Holatko J, et al. Pyruvate: quinone oxidoreductase in Corynebacterium glutamicum: molecular analysis of the pqo gene, significance of the enzyme, and phylogenetic aspects[J]. Journal of Bacteriology, 2006, 188(4): 1341-1350. DOI:10.1128/JB.188.4.1341-1350.2006 |
| [24] |
Radoš D, Carvalho AL, Wieschalka S, et al. Engineering Corynebacterium glutamicum for the production of 2, 3-butanediol[J]. Microbial Cell Factories, 2015, 14: 171. DOI:10.1186/s12934-015-0362-x |
| [25] |
Zhang X, Zhang RZ, Bao T, et al. The rebalanced pathway significantly enhances acetoin production by disruption of acetoin reductase gene and moderate-expression of a new water-forming NADH oxidase in Bacillus subtilis[J]. Metabolic Engineering, 2014, 23: 34-41. DOI:10.1016/j.ymben.2014.02.002 |
| [26] |
Jojima T, Igari T, Moteki Y, et al. Promiscuous activity of (S, S)-butanediol dehydrogenase is responsible for glycerol production from 1, 3-dihydroxyacetone in Corynebacterium glutamicum under oxygen-deprived conditions[J]. Applied Microbiology and Biotechnology, 2015, 99(3): 1427-1433. DOI:10.1007/s00253-014-6170-0 |
| [27] |
Yang TW, Rao ZM, Zhang X, et al. Effects of corn steep liquor on production of 2, 3-butanediol and acetoin by Bacillus subtilis[J]. Process Biochemistry, 2013, 48(11): 1610-1617. DOI:10.1016/j.procbio.2013.07.027 |
| [28] |
Zhang LJ, Liu QY, Ge YS, et al. Biotechnological production of acetoin, a bio-based platform chemical, from a lignocellulosic resource by metabolically engineered Enterobacter cloacae[J]. Green Chemistry, 2016, 18(6): 1560-1570. DOI:10.1039/C5GC01638J |
 2017, Vol. 44
2017, Vol. 44




