扩展功能
文章信息
- 林建春, 吴群, 徐岩
- LIN Jian-Chun, WU Qun, XU Yan
- 清香型白酒发酵过程中酵母群落结构及其与尿素代谢的关系
- Dynamic profile of yeast community associated with urea metabolism in Chinese light-aroma liquor fermentation
- 微生物学通报, 2017, 44(11): 2522-2529
- Microbiology China, 2017, 44(11): 2522-2529
- DOI: 10.13344/j.microbiol.china.170162
-
文章历史
- 收稿日期: 2017-02-28
- 接受日期: 2017-04-12
- 优先数字出版日期(www.cnki.net): 2017-04-18
氨基甲酸乙酯(Ethyl carbamate,EC),是一种潜在的2A类致癌物,广泛存在于酒精饮料及发酵食品中[1]。认识不同酒精饮料及发酵食品中EC形成的主要途径,对控制EC具有重要的作用。EC的前体物质包括尿素、瓜氨酸和氰化物。然而,在不同的酒精饮料及发酵食品中EC的形成途径往往不一样,如尿素是黄酒、葡萄酒中EC形成的主要前体物质[2-3],瓜氨酸是酱油中EC形成的主要前体物质[4],氰化物则是一些蒸馏酒在蒸馏过程中EC形成的主要前体物质[5]。
尿素和瓜氨酸分别主要由酿酒酵母(Saccharomyces cerevisiae)和乳酸菌代谢精氨酸产生,而氰化物主要来自于原料中的生氰糖苷[6]。在一些以酿酒酵母为主导的酒精饮料(葡萄酒、黄酒等)发酵过程中,使用基因工程获得的低产尿素酿酒酵母工程菌起到了降低酒中EC的显著效果[3],因此明确EC前体物质及主要代谢微生物是控制EC的关键。
白酒中也检测到了EC,尽管大部分未超出国际蒸馏酒标准(150 μg/L)[7-8],但随着白酒的普遍消费,降低白酒中EC的含量也显得尤为重要。然而,白酒发酵过程中EC的主要前体物质及其代谢微生物并不清楚。并且,发酵过程中富集了多种酵母、细菌和霉菌[9-10],这些多种多样的微生物对EC前体物质的贡献也未见报道。白酒发酵过程是EC产生的重要阶段之一,因此,明确发酵过程中EC的主要前体物质及关键代谢微生物,为降低EC含量提供理论依据。
环境因素在一定程度上会影响微生物的群落结构[11],如大曲制作过程中发现pH和水分能够显著影响细菌和真菌的群落结构,并且受影响的主要有Saccharomycetales、Enterobacteriales和Bacillales等目的微生物[12]。然而,环境因素对白酒发酵过程中微生物群落的影响及其对生产调控的研究并不清楚。解析环境因素对代谢EC主要前体物质微生物群落的影响,有助于通过调节生产工艺、改变理化参数降低发酵过程中EC和前体物质的含量。
本研究以清香型白酒为例,通过高通量测序的方法研究发酵过程中代谢EC主要前体物质的微生物群落结构及演变,并进一步结合环境因素,阐明发酵过程中环境因素对代谢EC主要前体物质关键微生物的影响,以期为调控环境因素降低白酒发酵过程中EC与主要前体物质的含量提供科学基础。
1 材料与方法 1.1 材料 1.1.1 酒醅样品: 酒醅取自于清香型白酒酒厂。采集正常大口发酵地缸中距离表层50 cm的酒醅(约200 g),取样时间点为发酵0、3、5、10、15、20和28 d (发酵结束)。每个发酵时间点的酒醅样品取自同一车间的2个地缸。所有酒醅样品于-20 ℃保存,用于酒醅中DNA的提取及理化指标检测。 1.1.2 主要试剂和仪器: 无水硫酸钠、酒石酸、氢氧化钠和乙酸锌等均为分析纯,购自国药集团化学试剂有限公司;乙腈、甲醇和正己烷等均为色谱纯,购自美国Sigma公司;EC、瓜氨酸、EC-D5等均为色谱纯,购自上海安谱科技仪器有限公司;荧光定量PCR酶(AceQ qPCR SYBR® Green Master Mix)购自南京诺唯赞生物科技有限公司。高效液相色谱仪(Agilent 1200)和气相色谱-质谱联用仪(GC6890N-MSD5975)购自美国Agilent公司;细胞破碎仪(Mini-Beadbeater)购自上海玉博生物科技有限公司;核酸浓度检测仪(NanoDrop 8000)购自赛默飞世尔科技有限公司;氮吹仪(DC-12)和氨基甲酸乙酯检测专用固相萃取小柱(碱性硅藻土柱)购自上海安谱科技仪器有限公司。 1.2 方法 1.2.1 酒醅理化指标检测: 酒醅取样的同时记录每个取样地缸中的发酵温度。准确称取5 g酒醅,于105烘箱内烘至恒重,计算样品中的含水量。酒醅中微生物的数量以及物质含量均以干重(DW)计。酒醅中乙醇、pH以及还原糖的测定方法参照文献[13]。 1.2.2 EC及前体物质检测: 取20 g酒醅,加入50 μL EC-D5内标溶液,混匀并于4固定过夜。次日加入50 mL去离子水,超声30 min之后,12 000 r/min离心15 min。取30 mL上清液过SPE小柱,使上清液中EC及内标吸附其上。用15 mL正己烷去除杂质,真空抽干SPE小柱,之后用30 ml 5%的乙酸乙酯/乙醚溶液进行洗脱。整个过程控制流速为2 mL/min。最后将收集的洗脱液氮吹至1 mL,加入无水硫酸钠过夜除水后用于EC测定,GC-MS条件参照文献[14]。分光光度计法测定酒醅中的氰化物[15],高效液相色谱-荧光检测器法测定酒醅中的尿素[16],高效液相色谱-紫外检测器法测定酒醅中氨基酸(瓜氨酸和精氨酸)[17]。 1.2.3 酒醅宏基因组提取: 称取5 g酒醅,用0.1 mol/L PBS缓冲溶液(0.057 7 mol/L Na2HPO4,0.042 3 mol/L NaH2PO4)洗涤并收集酒醅中的微生物细胞后,利用Mini-Beadbeater细胞破碎仪破碎细胞并用苯酚-氯仿抽提法提取酒醅中的宏基因组,具体步骤参考文献[9]。将提取的酒醅宏基因组DNA用核酸浓度检测仪进行检测。 1.2.4 细菌、酵母及霉菌定量: 将提取的酒醅宏基因组DNA用ddH2O稀释10倍后,利用荧光定量PCR的方法对发酵过程中细菌、酵母以及真菌的生物量进行定量。其中,细菌所使用的引物为P2 (5′-ATTACCGCGGCTGCTGG-3′)和P3 (5′-CCTACG GGAGGCAGCAG-3′)[18],酵母所使用的引物为YeastF (5′-TCTCTTTTCCAAAGTTCTTTTCATCTT T-3′)和YeastR (5′-GAGTCGAGTTGTTTGGGAATG C-3′)[19],真菌所使用的引物为817F (5′-TTAGCA TGGAATAATRRAATAGGA-3′)和1196R (5′-TCTG GACCTGGTGAGTTTCC-3′)[20]。荧光定量PCR扩增体系为20 μL,包含了模板DNA 20 ng,上下游引物(20 μmol/L)各0.4 μL,AceQ qPCR SYBR® Green Master Mix 10 μL,ddH2O补足20 μL。荧光定量PCR扩增条件均参照相对应的文献[18-20]。发酵过程中霉菌的生物量通过真菌的生物量与酵母生物量相差计算获得。 1.2.5 高通量测序及序列分析: 利用Illumina MiSeq技术对酒醅中的宏基因组进行测序,测序的区域为真菌的ITS2区域,所用的引物为ITS3 (5′-GCATCG ATGAAGAACGCAGC-3′)和ITS4 (5′-TCCTCCGCT TATTGATATGC-3′)[21]。将高通量测序的原始数据提交DNA Data Bank of Japan (DDBJ)数据库,其编号为DRA005471。高通量测序过程及数据处理参考文献[22]。采用UNITE将测序序列进行物种分类和注释,在97%的水平计算操作分类单元(Operational taxonomic units,OTUs)的数量,利用MOTHUR软件计算香农指数(Shannon index)、丰富度估计量(Chao1 estimator)、覆盖率指数(Good’s coverage)。 1.2.6 数据统计分析: 相关性分析使用Statistical Product and Service Solutions (SPSS,v19.0)软件。利用SIMCA-P (v11.5)软件对酵母和尿素进行偏最小二乘回归分析(Partial least squares regression,PLS)。使用Canoco (v5.0)对酵母群落结构进行冗余分析(Redundancy analysis,RDA)评价环境因素对酵母群落结构的影响,并进行蒙特卡罗置换检验[12]。 2 结果与分析 2.1 发酵过程中EC与前体物质演变规律分别检测了发酵过程中EC与3种前体物质的含量(图 1)。EC在0-15 d时不断形成并达到最大值(29.88μg/kg),之后EC含量开始下降。在整个发酵过程中,EC增加了5.70 μg/kg,增幅为43.97%。尿素与氰化物在整个发酵过程中都是呈先上升后下降的趋势,但与发酵起始相比,尿素增加了11.63 mg/kg,而氰化物减少了78.50 μg/kg。瓜氨酸在发酵过程中呈波动状,与发酵起始相比增加了48.43 mg/kg。

|
| 图 1 清香型白酒发酵过程中EC (A)与前体物质(B)的变化 Figure 1 The dynamic profiles of EC (A) and its precursors (B) during Chinese light-aroma liquor fermentation process |
|
|
对3种前体物质与EC分别进行相关性分析,结果显示,尿素与EC的相关性最强(r=0.92,P<0.01),氰化物次之(r=0.61,P=0.02),而瓜氨酸最弱(r=0.56,P=0.04)。尽管发酵过程中瓜氨酸的含量略高于尿素,但尿素与乙醇发生反应形成EC的速率远大于瓜氨酸[17]。氰化物与乙醇发生反应形成EC,不仅需要Cu2+、Fe2+等金属离子的催化,而且需要在较高的温度条件下才能进行反应[8]。因此,氰化物并不是白酒发酵过程中EC形成的主要前体物质,并且在白酒模拟发酵实验中也已证实氰化物几乎不参与EC的形成[15]。综上分析,尿素是白酒发酵过程中EC形成的主要前体物质。
2.2 尿素代谢相关的微生物类群白酒发酵过程中的微生物可以划分为细菌、酵母和霉菌三大类,利用荧光定量PCR的方法检测发酵过程中这三类微生物的生物量变化。由图 2可知,细菌在整个发酵过程中生物量一直在增加,在发酵结束时生物量达到最大值(5.75×107 copies/g)。酵母与霉菌在发酵过程中生物量变化趋势相似,但从整体上分析,酵母的生物量大于霉菌。

|
| 图 2 清香型白酒发酵过程中细菌、酵母、霉菌生物量的变化 Figure 2 The dynamic profiles of the biomass of bacterium, yeast and mold during Chinese light-aroma liquor fermentation process |
|
|
分别将这三大类微生物与尿素进行相关性分析,发现酵母的数量与尿素相关性最强(ryeast=0.54,P<0.05),而霉菌和细菌与尿素的相关性均小于酵母(rbacterium=0.17,rmold=0.43),且显著性水平P值大于0.05,说明白酒发酵过程中酵母是主要的尿素代谢微生物。这与目前所报道的一些酒精饮料发酵过程中酿酒酵母是主要的尿素代谢菌是一致的[23-24]。
2.3 酵母群落结构及演变采用高通量测序的方法揭示了清香型白酒发酵过程中酵母群落结构及演变。高通量测序结果如表 1所示,各样品中OTU在81–152之间,且所有测序样品的覆盖率指数均达到了99.8%以上,说明测序深度已足够,基本上能反映真菌群落结构组成。
| 发酵时间 Time (d) |
覆盖率指数 Good’s coverage (%) |
操作分类单元 OTUs |
丰富度估计量 Chao1 estimator |
香农指数 Shannon index |
| 0 | 99.87±0.01 | 127±8 | 122.34±3.75 | 1.78±0.38 |
| 3 | 99.85±0.01 | 128±1 | 131.26±9.67 | 2.75±0.14 |
| 5 | 99.84±0.01 | 130±4 | 123.68±5.33 | 3.07±0.07 |
| 10 | 99.87±0.05 | 107±37 | 122.77±35.09 | 2.94±0.08 |
| 15 | 99.86±0.01 | 143±13 | 138.75±5.80 | 3.24±0.05 |
| 20 | 99.84±0.01 | 140±5 | 146.53±8.11 | 3.41±0.06 |
| 28 | 99.85±0.02 | 139±1 | 145.96±20.82 | 3.32±0.10 |
进一步研究酵母群落组成及演变结果见图 3。高通量测序共鉴定出13个酵母属,包含22个酵母种。由图 3可知,库德毕赤酵母(Pichia kudriavzevii)在发酵各阶段占绝对优势,其所占比例呈先上升后下降的趋势。在发酵起始时,P. kudriavzevii酵母所占的比例最大(85.12%),之后比例一直下降,到发酵20 d时达到最小值(32.85%),发酵结束时又有所上升(43.29%);其次,Naumovozyma castellii酵母在发酵过程中所占的比例也较大(0.71%–34.07%),且在发酵过程中大致呈现逐渐上升的趋势;除此之外,S. cerevisiae (1.38%–24.52%)、扣囊复膜酵母(Saccharomycopsis fibuligera) (5.14%–13.87%)、发酵毕赤酵母(Pichia fermentans) (0.59%–20.20%)等酵母所占的比例较大,可看作是清香型白酒发酵过程中的优势酵母。
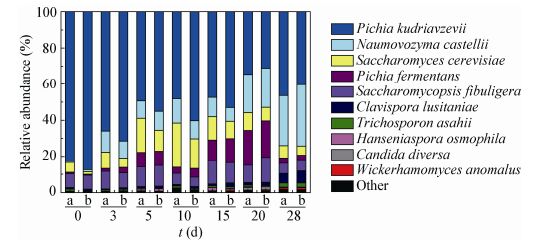
|
| 图 3 清香型白酒发酵过程中酵母群落结构及演变 Figure 3 The dynamic profiles of yeast community structure during Chinese light-aroma liquor fermentation process 注:将整个发酵过程中比例始终小于1%的酵母归为other. a、b:同一时间点的两个平行样品. Note: The yeast species whose proportions were less than 1% in yeast community in whole fermentation process were categorized into other. The letters a and b represent two parallel samples at the same time point. |
|
|
尽管白酒发酵过程中存在多种酵母,但不同酵母对尿素代谢的重要程度和相关程度会有所不同。使用SIMCA-P软件进行偏最小二乘回归分析评估微生物与代谢产物之间的重要程度,根据软件说明,VIP值(variable importance plot)大于1.0,说明微生物在产物代谢中起重要作用,而且VIP值越大,重要程度也越大[25]。根据酵母与尿素之间偏最小二乘回归分析结果,有6种酵母的VIP值大于1.0 (图 4),说明这6种酵母在尿素代谢中起着重要作用。

|
| 图 4 酵母与尿素偏最小二乘回归和相关性分析结果 Figure 4 The results of partial least squares regression and correlation analysis between the profiles of yeast species and urea 注:白色代表正相关,黑色代表负相关. *:显著性水平P值小于0.05;**:显著性水平P值小于0.01. Note: The white columns represent positive correlation, and the black columns represent negative correlation. *: P < 0.05; **: P < 0.01. |
|
|
进一步通过相关性分析,发现在6种酵母中,P. fermentans、嗜高压有孢汉生酵母(Hanseniaspora osmophila)和S. cerevisiae与尿素呈正相关(P<0.05),说明这3种酵母与尿素产生存在相关性;而P. kudriavzevii与尿素呈极显著负相关(r=-0.74,P<0.01),说明与尿素降解存在相关性。尽管Candida derodonti (r=0.48,P=0.08)和赛瓦酵母(Kazachstania servazzii) (r=0.44,P=0.12)与尿素也呈一定的正相关,但它们的显著性水平P值大于0.05。综上分析,H. osmophila、P. fermentans、P. kudriavzevii和S. cerevisiae是清香型白酒发酵过程中潜在的关键尿素代谢酵母。
2.5 环境因素对关键尿素代谢酵母的影响环境因素在一定程度上会影响微生物群落结构组成,通过改变或调整环境因素,起到调整微生物群落结构的作用。白酒发酵过程中,主要的理化指标有酒精度、pH、温度、含水量和还原糖[13]。由于精氨酸是尿素的直接前体物质,因此也将精氨酸作为其中一个环境因素研究其对酵母群落的影响。图 5显示了发酵过程中这6种环境因素的变化。

|
| 图 5 发酵过程中环境因素的动态变化(A)及环境因素与酵母群落之间的冗余分析和蒙特卡罗置换检验(B) Figure 5 The dynamic profiles of environmental factors during Chinese light-aroma liquor fermentation process (A), and redundancy analysis and Monte Carlo permutation test between yeast community structure and environmental factors (B) 注:B中圆点代表不同发酵时间点的样品. Note: B: Dots represent samples of different fermentation time points. |
|
|
冗余分析结果表明,所有的环境因素可解释酵母群落结构变化的52.55%,说明环境因素是影响群落结构演替的重要因素。蒙特卡罗置换检验结果显示,pH、乙醇和精氨酸与酵母群落存在极显著相关性(P<0.01),水分与酵母结构存在显著相关性(P<0.05)。
进一步对4种环境因素(水分、乙醇、精氨酸和pH)与潜在的关键尿素代谢酵母进行相关性分析(图 6)。结果显示,水分与这4种酵母均具有一定的相关性,乙醇和pH对部分酵母具有相关性,而精氨酸对这4种酵母均不具有相关性。
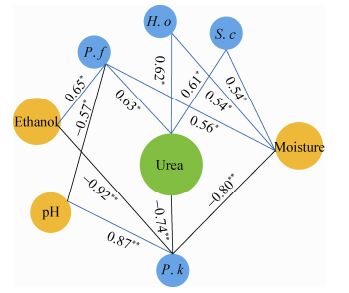
|
| 图 6 关键尿素代谢酵母与环境因素之间的相关性 Figure 6 The correlation analysis between environmental factors and key yeast species which associated with urea metabolism 注:蓝线代表关键尿素代谢菌与环境因素呈正相关,黑线代表关键尿素代谢菌与环境因素呈负相关.数字代表相关性系数. *:显著性水平P值小于0.05;**:显著性水平P值小于0.01. Note: Blue lines represent positive correlation, while black lines represent negative correlation between key yeast species and environmental factors. In addition, the numbers are the value of correlation coefficients. *: P < 0.05; **: P < 0.01. H. o: Hanseniaspora osmophila; P. k: Pichia kudriavzevii; S. c: Saccharomyces cerevisiae; P. f: Pichia fermentans. |
|
|
通过研究发现,尿素是清香型白酒发酵过程中EC的主要前体物质,酵母是主要的尿素代谢微生物。高通量测序结果显示,白酒发酵过程中存在多种多样的酵母,除了酿酒酵母之外,还存在21种非酿酒酵母,且在发酵过程中占了很大的比例(79.49%–96.61%)。相比于采用WL平板筛选法研究清香型白酒发酵过程中酵母群落结构及多样性[25-26],存在易低估群落物种组成、难以真实客观反映群落结构等缺点,而本研究所采用的高通量测序能够较为全面和准确地反映微生物群落结构。
通过偏最小二乘回归分析,发现非酿酒酵母也是白酒发酵过程中潜在的尿素代谢菌,在尿素代谢中发挥重要的作用。在酱油、食醋等食品发酵过程中,存在着多种多样的非酿酒酵母,如戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)、异常威克汉姆酵母(Wickerhamyces anomalus)等[27-28]。在这些食品发酵过程中,也会不可避免地产生EC[17, 29]。因此,控制食品中尿素与EC含量时,也应重视非酿酒酵母对尿素积累的作用。
尽管利用代谢工程构建低产尿素酿酒酵母、使用脲酶、原料预处理(降低前体物质含量)等方法在降低黄酒、日本清酒中尿素与EC的含量起到了显著的效果,但由于这些方法存在处理麻烦、成本较高等缺点,在实际应用中难以开展[30]。本研究发现环境因素能够影响酵母群落结构,因此,可采用调节环境因素控制关键尿素代谢酵母的创新思路,在一定程度上能够有效降低EC含量。后续的研究将进一步围绕环境因素探究其对白酒生产过程中关键尿素代谢酵母的影响,以验证环境因素能够起到降低EC的效果。
| [1] |
Cui X, Miao H, Zhao YF, et al. Research progress on toxicity and contamination of ethyl carbamate in fermented foods[J]. Journal of Food Safety & Quality, 2014, 5(9): 2617-2622. 崔霞, 苗虹, 赵云峰, 等. 发酵食品中氨基甲酸乙酯污染及其毒性研究进展[J]. 食品安全质量检测学报, 2014, 5(9): 2617-2622. |
| [2] |
Wu DH, Li XM, Lu J, et al. The overexpression of DUR1, 2 and deletion of CAR1 in an industrial Saccharomyces cerevisiae strain and effects on nitrogen catabolite repression in Chinese rice wine production[J]. Journal of the Institute of Brewing, 2016, 122(3): 480-485. |
| [3] |
Guo XW, Li YZ, Guo J, et al. Reduced production of ethyl carbamate for wine fermentation by deleting CAR1 in Saccharomyces cerevisiae[J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43(5): 671-679. |
| [4] |
Zhang JR, Du GC, Chen J, et al. Characterization of a Bacillus amyloliquefaciens strain for reduction of citrulline accumulation during soy sauce fermentation[J]. Biotechnology Letters, 2016, 38(10): 1723-1731. DOI:10.1007/s10529-016-2147-7 |
| [5] |
Bortoletto A, Alcarde A. Assessment of ethyl carbamate contamination in Cachaça (Brazilian sugar cane spirit)[J]. Beverages, 2016, 2(4): 28. DOI:10.3390/beverages2040028 |
| [6] |
Ryu D, Choi B, Kim E, et al. Determination of ethyl carbamate in alcoholic beverages and fermented foods sold in Korea[J]. Toxicological Research, 2015, 31(3): 289-297. DOI:10.5487/TR.2015.31.3.289 |
| [7] |
Xia Q, Yuan HW, Wu CD, et al. An improved and validated sample cleanup method for analysis of ethyl carbamate in Chinese liquor[J]. Journal of Food Science, 2014, 79(9): T1854-T1860. DOI:10.1111/jfds.2014.79.issue-9 |
| [8] |
Li GH, Zhong QD, Wang DB, et al. Determination and formation of ethyl carbamate in Chinese spirits[J]. Food Control, 2015, 56: 169-176. DOI:10.1016/j.foodcont.2015.03.029 |
| [9] |
Wang XS, Du H, Xu Y. Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J]. International Journal of Food Microbiology, 2017, 244: 27-35. DOI:10.1016/j.ijfoodmicro.2016.12.018 |
| [10] |
Chen B, Wu Q, Xu Y. Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai-flavor liquor[J]. International Journal of Food Microbiology, 2014, 179: 80-94. DOI:10.1016/j.ijfoodmicro.2014.03.011 |
| [11] |
Wang HY, Xu Y. Effect of temperature on microbial composition of starter culture for Chinese light aroma style liquor fermentation[J]. Letters in Applied Microbiology, 2015, 60(1): 85-91. DOI:10.1111/lam.2014.60.issue-1 |
| [12] |
Li P, Lin WF, Liu X, et al. Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J]. Frontiers in Microbiology, 2016, 7: 1237. |
| [13] |
Yan SB, Wang SC, Wei GG, et al. Investigation of the main parameters during the fermentation of Chinese Luzhou-flavour liquor[J]. Journal of the Institute of Brewing, 2015, 121(1): 145-154. DOI:10.1002/jib.v121.1 |
| [14] |
Zhang SR, Fan WL, Xu Y. Research and risk assessment of ethyl carbamate in different aroma types of Chinese liquors[J]. Food and Fermentation Industries, 2016, 42(5): 198-202. 张顺荣, 范文来, 徐岩. 不同香型白酒中氨基甲酸乙酯的研究与风险评估[J]. 食品与发酵工业, 2016, 42(5): 198-202. |
| [15] |
Cao S, Wu Q, Xu Y. Effects of different sorghum cultivars on the formation of ethyl carbamate in the solid-state fermentation process of Chinese liquor[J]. Journal of Food Science and Biotechnology, 2016, 35(7): 677-683. 曹帅, 吴群, 徐岩. 白酒固态发酵过程中不同品种高粱原料对氨基甲酸乙酯形成的影响[J]. 食品与生物技术学报, 2016, 35(7): 677-683. |
| [16] |
Zhang J, Liu GX, Zhang Y, et al. Simultaneous determination of ethyl carbamate and urea in alcoholic beverages by high-performance liquid chromatography coupled with fluorescence detection[J]. Journal of Agricultural and Food Chemistry, 2014, 62(13): 2797-2802. DOI:10.1021/jf405400y |
| [17] |
Zhang JR, Fang F, Chen J, et al. The arginine deiminase pathway of koji bacteria is involved in ethyl carbamate precursor production in soy sauce[J]. FEMS Microbiology Letters, 2014, 358(1): 91-97. DOI:10.1111/fml.2014.358.issue-1 |
| [18] |
Assohoun-Djeni NMC, Djeni NT, Messaoudi S, et al. Biodiversity, dynamics and antimicrobial activity of lactic acid bacteria involved in the fermentation of maize flour for doklu production in Côte d'Ivoire[J]. Food Control, 2016, 62: 397-404. DOI:10.1016/j.foodcont.2015.09.037 |
| [19] |
Shao MK, Wang HY, Xu Y, et al. Yeast community structure and its impact on flavor components during the fermentation process of Chinese Maotai-flavor liquor[J]. Microbiology China, 2014, 41(12): 2466-2473. 邵明凯, 王海燕, 徐岩, 等. 酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J]. 微生物学通报, 2014, 41(12): 2466-2473. |
| [20] |
Uroz S, Oger P, Tisserand E, et al. Specific impacts of beech and Norway spruce on the structure and diversity of the rhizosphere and soil microbial communities[J]. Scientific Reports, 2016, 6: 27756. DOI:10.1038/srep27756 |
| [21] |
Hong XT, Chen J, Liu L, et al. Metagenomic sequencing reveals the relationship between microbiota composition and quality of Chinese Rice Wine[J]. Scientific Reports, 2016, 6: 26621. DOI:10.1038/srep26621 |
| [22] |
Li Z, Dong L, Huang Q, et al. Bacterial communities and volatile compounds in Doubanjiang, a Chinese traditional red pepper paste[J]. Journal of Applied Microbiology, 2016, 120(6): 1585-1594. DOI:10.1111/jam.2016.120.issue-6 |
| [23] |
Wu DH, Li XM, Shen C, et al. Decreased ethyl carbamate generation during Chinese rice wine fermentation by disruption of CAR1 in an industrial yeast strain[J]. International Journal of Food Microbiology, 2014, 180: 19-23. DOI:10.1016/j.ijfoodmicro.2014.04.007 |
| [24] |
Li XM, Shen C, Wu DH, et al. Enhancement of urea uptake in Chinese rice wine yeast strain N85 by the constitutive expression of DUR3 for ethyl carbamate elimination[J]. Journal of the Institute of Brewing, 2015, 121(2): 257-261. DOI:10.1002/jib.v121.2 |
| [25] |
Kong Y, Wu Q, Zhang Y, et al. In situ analysis of metabolic characteristics reveals the key yeast in the spontaneous and solid-state fermentation process of Chinese light-style liquor[J]. Applied and Environmental Microbiology, 2014, 80(12): 3667-3676. DOI:10.1128/AEM.04219-13 |
| [26] |
Wu Q, Zhu WA, Wang W, et al. Effect of yeast species on the terpenoids profile of Chinese light-style liquor[J]. Food Chemistry, 2015, 168: 390-395. DOI:10.1016/j.foodchem.2014.07.069 |
| [27] |
Šuranská H, Raspor P, Uroić K, et al. Characterisation of the yeast and mould biota in traditional white pickled cheeses by culture-dependent and independent molecular techniques[J]. Folia Microbiologica, 2016, 61(6): 455-463. DOI:10.1007/s12223-016-0455-x |
| [28] |
Song YR, Jeong DY, Baik SH. Monitoring of yeast communities and volatile flavor changes during traditional Korean soy sauce fermentation[J]. Journal of Food Science, 2015, 80(9): M2005-M2014. DOI:10.1111/1750-3841.12995 |
| [29] |
Chen DW, Miao H, Zhao YF. Determination of ethyl carbamate in soy sauce and vinegar by dispersive solid phase extraction/gas chromatography-mass spectrometry[J]. Journal of Instrumental Analysis, 2014, 33(1): 108-111. 陈达炜, 苗虹, 赵云峰. 分散固相萃取/气相色谱-质谱法测定酱油及食醋中氨基甲酸乙酯[J]. 分析测试学报, 2014, 33(1): 108-111. |
| [30] |
Jiao ZH, Dong YC, Chen QH. Ethyl carbamate in fermented beverages: presence, analytical chemistry, formation mechanism, and mitigation proposals[J]. Comprehensive Reviews in Food Science and Food Safety, 2014, 13(4): 611-626. DOI:10.1111/1541-4337.12084 |
 2017, Vol. 44
2017, Vol. 44




