扩展功能
文章信息
- 李晓灵, 喻其林, 张冰, 刘哲, 李明春
- LI Xiao-Ling, YU Qi-Lin, ZHANG Bing, LIU Zhe, LI Ming-Chun
- 白念珠菌肌醇多磷酸激酶Kcs1的功能
- Function of the inositol polyphosphate kinase Kcs1 in Candida albicans
- 微生物学通报, 2017, 44(10): 2428-2436
- Microbiology China, 2017, 44(10): 2428-2436
- DOI: 10.13344/j.microbiol.china.170284
-
文章历史
- 收稿日期: 2017-04-07
- 接受日期: 2017-07-10
- 优先数字出版日期(www.cnki.net): 2017-08-08
白念珠菌(Candida albicans)是临床常见的条件致病真菌之一,有81个亚种,其中11个亚种对人体存在致病性[1]。该真菌在正常情况下以共生形式广泛存在于人体口腔、肠道、呼吸道及阴道之中,不会引起疾病。但近年来随着大剂量抗生素、激素、免疫抑制剂的使用,以及临床大型手术病例的逐渐增多,白念珠菌的感染已经成为人类面临的一大健康问题。根据医学临床统计,其致死率可达38%-49%[2-3]。在白念珠菌感染的治疗过程中,最严重的问题就是菌株对各类药物,尤其唑类药物产生的抗药性[4]。仅1997-2003年间,临床分离的抗氟康唑白念菌株数量已上升0.6%[5-6]。
肌醇多磷酸(inositol polyphosphate)是由肌醇三磷酸(IP3)衍生而来的一类小分子化合物,在真核细胞诸多生理代谢过程中发挥重要的调节作用。这些化合物主要包括:肌醇四磷酸(IP4)、肌醇五磷酸(IP5)、肌醇六磷酸(IP6)、肌醇七磷酸(IP7)及肌醇八磷酸(IP8)。在模式生物酿酒酵母(Saccharomyces cerevisiae)中,存在数种重要的参与肌醇多磷酸合成的激酶,称为肌醇多磷酸激酶,包括:催化IP3磷酸化生成IP4与IP5的Ipk2、催化IP5磷酸化生成IP6的Ipk1、催化IP6磷酸化生成IP7及IP8的Kcs1。
作为真核细胞用于自身防御的应激调控机制,自噬过程是真核细胞满足细胞代谢需要和某些细胞器更新过程的必要手段,对细胞正常生长和生理活动起着极为重要的作用[7-8]。酿酒酵母中的研究报道,Kcs1在自噬过程中扮演重要角色[9-10],KCS1基因缺失会导致菌株在氮饥饿条件下自噬体大小与数量明显下降,自噬流(Autophagic flux)显著减
弱。这种由KCS1缺失所引起的自噬缺陷与自噬体囊泡组装位点(Phagophore assembly site,PAS)的错误定位和Atg18蛋白从液泡膜中释放缺陷密切相关[11]。
然而,在条件致病真菌白念珠菌中,目前尚未明确是否存在Kcs1的同源蛋白,以及该蛋白是否在细胞自噬过程中发挥功能,并且该蛋白是否是白念珠菌毒力相关因子均需进一步深入探讨。本研究首次对白念珠菌肌醇多磷酸激酶Kcs1的功能展开研究,初步探索了该蛋白在细胞自噬、菌丝发育及致病过程中的作用,为发掘新的抗真菌药物靶点和新型抗真菌药物的开发提供了理论依据。
1 材料与方法 1.1 菌株和质粒白念珠菌野生型菌株WT (ura3Δ::λimm434/ ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/ arg4::hisG)由美国明尼苏达大学Dana Davis教授馈赠,KCS1基因敲除白念珠菌菌株kcs1Δ/Δ (ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG kcs1::ARG4/kcs1::dpl200)通过两步PCR介导的同源重组方法建立[12]。白念珠菌KCS1基因回补菌株KCS1c(ura3Δ::λimm434/ ura3Δ:: λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG kcs1::ARG4/kcs1::dpl200,pDDB78-KCS1)则将KCS1表达质粒pDDB78-KCS1转入kcs1Δ/Δ菌株而得。
1.2 主要试剂和仪器限制性核酸内切酶,宝生物工程(大连)有限公司;Taq DNA聚合酶、dNTPs、DNA Marker,北京鼎国生物技术有限公司;LiAc和PEG3350,Sigma-Aldrich公司;HRP发光试剂盒,Millipore公司。凝胶成像仪,UVP公司;蛋白电泳仪,Bio-Rad公司;PCR仪,Gene Company Limitied公司;荧光显微镜,Olympus公司。
1.3 培养基白念珠菌培养采用YPD和SC培养基,均添加0.1%的0.08 g/L无菌尿苷(SC-Ura除外)[12]。大肠杆菌培养采用LB培养基[12],按需添加0.1%的0.1 g/L氨苄青霉素溶液。菌丝诱导培养采用RPMI-1640液体培养基和YPD+FBS液体培养基。RPMI-1640液体培养基(g/L):RPMI-1640粉末10.40,丙磺酸4.18,碳酸钠0.20,用HCl调pH值至7.4,过滤除菌,使用前加入0.1%的0.08 g/L无菌尿苷。YPD+FBS液体培养基:在YPD培养基基础上添加10%胎牛血清(FBS)。氮源饥饿培养基(g/L):KCl 0.52,KH2PO4 1.52,MgSO4·7H2O 0.52,葡萄糖10.00,微量元素溶液0.1%,维生素溶液0.1%,调pH值为6.5,1×105 Pa灭菌30 min。含氮培养基(g/L):在氮源饥饿培养基中补加(NH4)2SO4 0.5。巨噬细胞RAW264.7培养采用RPMI-1640+10% FBS,即RPMI-1640中添加10%胎牛血清(FBS),使用前加入0.1%的0.08 g/L无菌尿苷。
1.4 白念珠菌的转化基因缺失菌株构建、回补菌株构建以及pAU34M-GFP-Atg8转入白念珠菌均涉及白念珠菌的转化试验,具体方法参见文献[12]。
1.5 白念珠菌KCS1回补质粒pDDB78-KCS1的构建pDDB78-KCS1的构建参见文献[12]。具体方法如下:采用KCS1-5con和KCS1-3con扩增包含开放阅读框及其上游的启动子和下游终止子在内的DNA片段,长度为1.8 kb,该片段两端分别含有Xho Ⅰ和Kpn Ⅰ酶切位点,将该片段进行双酶切(Xho Ⅰ、Kpn Ⅰ)后,与同时进行双酶切后的pDDB78进行连接,从而构建KCS1回补质粒pDDB78-KCS1。
1.6 氮饥饿耐受性的测定将野生型菌株WT、缺失菌株kcs1Δ/Δ及回补菌株KCS1c单菌落接种至液体YPD培养基中,于30℃摇床中180 r/min振荡培养过夜,离心收集菌体(室温,4 000 r/min,2 min),无菌水洗涤一遍,转入液体氮源饥饿培养基中,调整OD600为0.5。将各菌株置于30℃摇床中180 r/min培养3 d,取100 μL培养菌液摇匀后,用无菌水梯度稀释至10-4,涂布于YPD固体培养基。30 ℃培养24-48 h后,对平板上的菌落进行计数,计算菌落形成单位(Colony forming unit,CFU)。
1.7 菌丝诱导观察将野生型菌株WT、缺失菌株kcs1Δ/Δ及回补菌株KCS1c单菌落接种至液体YPD培养基中,于30℃、180 r/min振荡培养过夜,离心收集菌体(室温,4 000 r/min,2 min),用无菌水洗涤一遍,转入YPD+FBS或RPMI-1640液体培养基中,调整初始OD600至0.1,37℃、120 r/min振荡培养,2 h后离心收集菌体(室温,12 000 r/min,2 min),于显微镜下观察菌丝发育情况。
1.8 巨噬细胞敏感性测定巨噬细胞-白念珠菌混合体系的制备:巨噬细胞采用RAW264.7细胞株,首先将细胞培养于24孔板至良好生长状态;同时,将培养至对数初期的白念珠菌细胞收集后,用RPMI-1640培养基调整至1×106细胞/mL;将各菌株菌悬液100 μL与贴壁巨噬细胞共孵育形成巨噬细胞-白念珠菌相互作用混合体系。
巨噬细胞对白念珠菌损伤能力测定:将混合体系在37 ℃培养箱中共孵育1 h后,加入1 mL无菌水裂解巨噬细胞,吸取裂解液,梯度稀释至10-3后涂布YPD平板,30 ℃培养1 d后对白念珠菌菌落进行计数,计算被杀死的白念珠菌百分率。
白念珠菌对巨噬细胞损伤能力的测定:将混合体系在37℃培养箱中共孵育3 h后,采用碘化丙啶(Propidium Iodide,PI)对混合体系进行染色,在显微镜下观察染色情况,PI阳性细胞视为损伤的巨噬细胞,统计并计算被损伤的巨噬细胞的百分率。
1.9 Western blotting检测Atg8降解情况将转入pAU34M-GFP-Atg8质粒的野生型菌株WT、缺失菌株kcs1Δ/Δ及回补菌株KCS1c分别接种于含氮(Control)培养基及氮源饥饿(-N)培养基中,30 ℃、120 r/min振荡培养8 h,离心收集菌体(室温,4 000 r/min,2 min)后,提取总蛋白,测定蛋白含量,将各样品蛋白上样量进行统一。各蛋白样品经SDS-PAGE分离后,转至PVDF膜上,于含5%脱脂奶粉的TBST中封闭1 h;加入兔抗GFP一抗(1:3 000稀释),室温孵育2 h;TBST洗膜5次,每次10 min;加入HRP标记的羊抗兔二抗(1:5 000稀释),室温孵育1 h;TBST洗膜5次,每次10 min;利用HRP化学发光试剂盒进行显色分析。
1.10 小鼠系统性感染模型将野生型菌株WT、缺失菌株kcs1Δ/Δ及回补菌株KCS1c单菌落接种至液体YPD培养基中,30℃、180 r/min振荡培养过夜,离心收集菌体(室温,4 000 r/min,2 min)后重悬于0.9%的无菌生理盐水中,调整最终浓度为5×106细胞/mL。将30只4-6周龄ICR雌性小鼠随机分为3组,10只为一组作为平行试验,各组小鼠分别用作WT菌株、缺失菌株kcs1Δ/Δ及回补菌株KCS1c的侵染宿主。感染模型采用尾静脉注射方式,每只注射0.1 mL菌液。从感染后第1天开始观察并记录小鼠死亡情况,绘制生存曲线,从而测定KCS1基因缺失对白念珠菌毒力的影响。
2 结果与分析 2.1 白念珠菌Kcs1蛋白的结构特征在白念珠菌基因组数据库(www.candidagenome.org)进行检索发现,白念珠菌的Kcs1蛋白由orf19.1007开放阅读框编码,含有352个氨基酸残基,与酿酒酵母Kcs1 (ScKcs1)蛋白的氨基酸序列有50%相似性。由GenBank数据库可知:KCS1基因位于其R染色体上,参考序列号NC_032096.1;Kcs1蛋白参考序列号为XP_710272.1。通过NCBI在线结构域查询,发现白念珠菌Kcs1具有肌醇多磷酸激酶结构域(IPK domain),含有保守的DLNNNNNNPNNNDNKNGNR基序(图 1A、B)。该保守基序均存在于酿酒酵母肌醇多磷酸激酶Kcs1 (ScKcs1)、秀丽线虫肌醇三磷酸-3-激酶1 (CeITP3K1)、拟南芥肌醇多磷酸激酶2β (AtIPPK2β)、盘基网柄菌肌醇六磷酸激酶(DdIP6K)、人肌醇三磷酸-3-激酶A (HsITP3KA)等诸多IPK超家族成员中(图 1B)。

|
| 图 1 白念珠菌Kcs1的保守结构域 Figure 1 The conserved domain in C. albicans Kcs1 注:A:通过NCBI在线分析白念珠菌IPK结构域;B:多种生物细胞中IPK家族保守结构域分析. Note:A: IPK domain identified by NCBI-online conserved domain architecture retrieval tool (CDART); B: Conserved sequences among the IPK superfamily members. |
|
|
采用PCR介导的同源重组法进行缺失菌株kcs1Δ/Δ的构建,进而采用检测引物对缺失菌株进行PCR验证。杂合子(KCS1/kcs1)菌株预期得到2 541 bp的ARG4片段和1 541 bp的野生型片段;纯合子(kcs1Δ/Δ)预期得到2 541 bp的ARG4片段和2 141 bp的URA3片段。由图 2A可知,所得菌株符合预期,即为正确的杂合子及纯合子菌株。采用KCS1内部检测引物进行回补菌株的验证,预期得到1 059 bp的KCS1片段。由图 2B可知,所得菌株符合预期,即为正确的回补菌株KCS1c。

|
| 图 2 白念珠菌KCS1基因缺失菌株及回补菌株的验证 Figure 2 PCR confirmation of KCS1 deletion strain and reconstituted strain 注:A:KCS1基因缺失菌株的验证,WT代表野生型菌株,KCS1/kcs1代表杂合子菌株,kcs1Δ/Δ代表纯合子菌株. B:回补菌株KCS1c的验证,KCS1c代表回补菌株,kcs1Δ/Δ代表纯合子菌株. Note: A: Confirmation of KCS1 deletion strains. KCS1/kcs1 indicates the heterozygous strain and kcs1Δ/Δ indicates the homozygous strain. B: Confirmation of the reconstituted strain KCS1c. KCS1c indicates the reconstituted strain and kcs1Δ/Δ indicates the homozygous strain. |
|
|
氮源饥饿是触发白念珠菌自噬反应的重要因素之一,自噬功能缺陷会导致菌株氮饥饿耐受能力下降[13]。为探索Kcs1在白念珠菌自噬过程中的作用,采用氮源饥饿培养基测定野生型菌株WT、缺失菌株kcs1Δ/Δ及回补菌株KCS1c的氮饥饿耐受能力,以测定Kcs1是否参与白念珠菌自噬过程。在氮饥饿培养3 d后,对各菌株菌落形成单位(CFU)进行统计,CFU下降说明氮饥饿耐受能力的降低,提示自噬过程的削弱。对各菌株的CFU进行统计学分析发现(图 3),缺失菌株kcs1Δ/Δ表现为CFU数量显著下降,而野生型菌株WT及回补菌株KCS1c并无显著性差异,表明KCS1基因缺失导致氮饥饿耐受能力的明显降低,提示白念珠菌Kcs1在细胞自噬过程中扮演重要角色。

|
| 图 3 KCS1缺失对白念珠菌氮饥饿耐受能力的影响 Figure 3 Effect of KCS1 deletion on tolerance of C. albicans to nitrogen starvation 注:*:与对照组相比较差异显著(P < 0.05). Note: *: There was significant different with control group (P < 0.05). |
|
|
Atg8蛋白作为一种重要的自噬相关蛋白,在自噬体前体的形成及自噬体囊泡转运过程中发挥重要作用。当自噬激活后,该蛋白会从胞质转移至液泡,进而在液泡中实现降解[14-15]。利用GFP标记Atg8蛋白,自噬发生时在液泡中能够观察到GFP荧光的积累。将自噬报告质粒pAU34M-GFP-Atg8转入WT菌株、缺失菌株kcs1Δ/Δ及回补菌株KCS1c中,测定KCS1缺失对Atg8转运及降解的影响。
荧光观察结果表明:在氮饥饿诱导4 h后,野生型菌株WT及回补菌株KCS1c中的GFP荧光全部聚集于液泡内,说明二者均能正常进行Atg8从胞质向液泡的转运,细胞自噬过程激活。与此相比,缺失菌株kcs1Δ/Δ中的GFP荧光在液泡和胞质中均有分布,液泡聚集现象较少(图 4A左),说明kcs1Δ/Δ自噬过程缺陷。对液泡积累GFP的细胞数进行统计发现,kcs1Δ/Δ菌株的液泡积累GFP的细胞数显著低于野生型菌株WT及回补菌株KCS1c (图 4A右)。表明在氮饥饿条件下,KCS1缺失导致GFP-Atg8向液泡转运缺陷,细胞自噬过程受阻。

|
| 图 4 KCS1缺失对氮饥饿条件下白念珠菌Atg8转运及降解的影响 Figure 4 Effect of KCS1 deletion on cytoplasm-to-vacuole transport and degradation of Atg8 注:A:荧光观察Atg8从胞质向液泡的转运,箭头标注的为转运至液泡内的GFP,比例尺为5μm;B:统计液泡中存在GFP积累的细胞比例,*表示与对照组相比较差异显著(P < 0.05);C:Western blotting检测GFP-Atg8降解情况. Note: A: Cytoplasm-to-vacuole transport of Atg8. The white arrows (left images) indicate the cells with GFP-accumulating vacuoles; The statistic data of the cells with GFP-accumulating vacuoles are demonstrated in the right panel; *: There was significant different with control group (P < 0.05); Bar=5 μm. B: Western blotting of GFP-Atg8 degradation; The intact GFP-Atg8 and the degraded GFP-Atg8 (GFP) were detected by GFP mono-antibody. |
|
|
为了进一步证实KCS1缺失阻断GFP-Atg8向液泡转运的程度,采用Western blotting方法检测GFP-Atg8的降解情况。由图 4B可知,在自噬并未发生激活的条件下(含氮培养基/Control),各菌株中Atg8仅发生较低程度的降解。在氮饥饿(-N)诱导4 h后,野生型菌株WT及回补菌株KCS1c中出现了GFP特异性条带积累,表明在氮饥饿条件下能够正常进行Atg8向液泡的转运并发生降解。然而,缺失菌株kcs1Δ/Δ同时存在特异性降解的GFP条带和未发生降解的GFP-Atg8条带,与荧光观察结果相符,表明氮饥饿条件下KCS1缺失导致了自噬过程在一定程度上的抑制。综上所述,自噬诱导条件下KCS1缺失部分抑制了自噬过程的发生,但并未导致自噬过程的完全阻断,说明Kcs1在白念珠菌自噬过程中发挥重要作用。
2.5 KCS1缺失对白念珠菌菌丝发育能力的影响白念珠菌具有两型性特征,即可在酵母型与菌丝型之间发生转换,其中菌丝型细胞与侵染宿主、逃避宿主免疫系统攻击等紧密相关,因而对于菌株毒力至关重要[12]。为探究KCS1对白念珠菌菌丝形成能力的影响,采用RPMI-1640及YPD+FBS液体培养基测定野生型菌株WT、缺失菌株kcs1Δ/Δ及回补菌株KCS1c的菌丝发育能力。如图 5所示,在菌丝诱导培养1 h后,野生型菌株WT及回补菌株KCS1c均能形成正常的萌发管,而缺失菌株kcs1Δ/Δ则存在大量的酵母型细胞,仅有部分细胞形成萌发管并且明显较短。然而,随着菌丝诱导时间的延长,kcs1Δ/Δ同样能够形成发育良好的菌丝。由此表明,KCS1基因缺失导致菌丝发育迟缓,但并未引起菌丝发育能力的完全丧失。

|
| 图 5 KCS1缺失对白念珠菌菌丝发育能力的影响 Figure 5 Effect of KCS1 deletion on hyphal development in C. albicans Note: Bar=20 μm. |
|
|
巨噬细胞是宿主体内一种重要的免疫细胞,能够通过吞噬作用进一步产生活性氧,抑制或杀死入侵的病原菌,参与先天性免疫和特异性免疫过程。将巨噬细胞与WT、kcs1Δ/Δ及KCS1c共同培养后,测定白念珠菌死亡情况及巨噬细胞损伤情况。白念珠菌死亡情况见图 6A,野生型菌株WT及回补菌株KCS1c仅有10%-15%细胞发生死亡,缺失菌株kcs1Δ/Δ约有35%的细胞死亡,死亡率明显上升。巨噬细胞损伤情况见图 6B,野生型菌株WT及回补菌株KCS1c引起60%以上的巨噬细胞损伤,而缺失菌株kcs1Δ/Δ仅引起45%左右的巨噬细胞受损。因此,KCS1缺失导致白念珠菌对巨噬细胞的耐受能力及损伤巨噬细胞的能力下降。
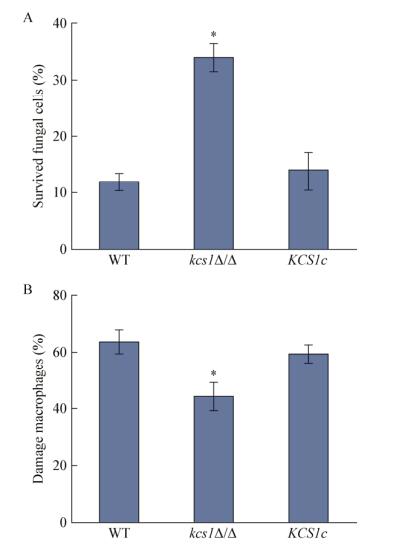
|
| 图 6 KCS1缺失对白念珠菌耐受巨噬细胞能力(A)及损伤巨噬细胞能力(B)的影响 Figure 6 Effect of KCS1 deletion on the ability of C. albicans to tolerate macrophage attack (A) and to damage macrophages (B) 注:*:与对照组相比较差异显著(P < 0.05). Note: *: There was significant different with control group (P < 0.05). |
|
|
鉴于Kcs1在白念珠菌自噬、菌丝发育、压力耐受过程中均发挥重要作用,推测该蛋白可能与白念珠菌的系统性感染能力有关。采用小鼠系统性感染模型,测定各菌株的系统性感染能力(图 7)。野生型菌株WT、回补菌株KCS1c与缺失菌株kcs1Δ/Δ感染小鼠能力并无差异,从感染第2天开始,陆续出现死亡现象,到第16天全部死亡。可见,KCS1缺失并未导致菌株系统性感染能力下降,表明Kcs1并不是白念珠菌感染宿主所必需的蛋白。
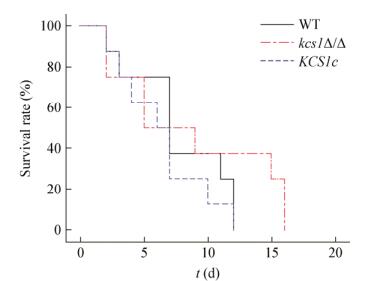
|
| 图 7 KCS1缺失对白念珠菌系统性感染能力的影响 Figure 7 Virulence assay of C. albicans strains in vivo experiments in mice |
|
|
当微生物细胞处于营养缺乏条件下时,为了给自己的生存提供必要的能量,会通过自噬过程消化分解自身体内无用或者有害的物质或者细胞器。氮饥饿被认为是自噬的触发条件之一。本研究结果显示,白念珠菌KCS1基因缺失后,白念珠菌对氮饥饿耐受能力显著降低,说明该基因缺失之后白念珠菌细胞不能正常发生自噬过程,导致其在氮饥饿情况下不能从自身获得足够的营养物质保证存活。在酿酒酵母中,作为编码肌醇多磷酸催化酶的基因,KCS1基因缺失会减少自噬体的形成和自噬通量,而这两点又与细胞内吞噬泡装配位点(PAS)的数量减少和PAS的定位错误有关[16]。本研究发现,氮饥饿情况下,kcs1Δ/Δ菌株中Atg8蛋白由胞质向液泡的转运和降解受到阻碍,推测原因是KCS1基因的缺失导致PAS的数量减少和定位错误,进而影响Atg蛋白向液泡的转运和在PAS位点附近的聚集。Atg8蛋白参与脂质膜的脂化过程,与磷脂酰乙醇胺(Phosphatidyl ethanolamine,PE)相结合时促进膜融合进而形成自噬体。在kcs1Δ/Δ菌株中,由于Atg8蛋白的异常定位,导致自噬前体无法提供足够的液泡曲率完成扩张,因而无法正常与自噬体囊泡融合,从而影响自噬的转运及降解过程。
酿酒酵母中的研究发现,KCS1基因缺失会影响液泡延伸和营养物质运输。在本研究中,菌丝诱导实验发现,在菌丝诱导的前期阶段,kcs1Δ/Δ菌株多为酵母型细胞,仅存在少量具萌发管的菌丝型细胞,但萌发管长度也明显短于野生型菌株,推测在KCS1基因缺失情况下白念珠菌液泡不能有序扩张,营养物质运输会部分阻断,导致了萌发管形成的迟滞,同时也说明肌醇多磷酸激酶与细胞的形态建成密切相关。
白念珠菌的毒力及侵袭性与菌株菌体形态、粘附力、磷脂酶活力、抗药性和表面抗体的抗吞噬作用均有密切关系[17-18]。尽管Kcs1在细胞自噬、菌丝发育、巨噬细胞敏感性等方面发挥作用,但在系统性感染小鼠实验中,我们发现WT、KCS1c与kcs1Δ/Δ菌株感染的小鼠具有相同的死亡速率,说明KCS1基因缺失并未影响白念珠菌系统性感染宿主的能力。造成这一现象的原因可能有以下几个方面:(1)尽管体外试验证明Kcs1与细胞自噬有关,但白念珠菌进入宿主体内后并不需要承受极端的营养匮乏条件,因而自噬作用并非系统性感染的决定因素;(2) Kcs1在菌丝发育的前期发挥作用,但并未阻断后续的菌丝发育过程,在系统性感染过程中,菌丝发育的滞后可能并不能对菌丝的侵染与定殖产生明显影响;(3)虽然在与巨噬细胞的相互作用体外实验中,KCS1基因缺失会减弱白念珠菌对巨噬细胞的侵染能力,但是当大量菌液直接注入宿主血液后,巨噬细胞所调控的免疫反应不足以抵抗系统性感染,即不足以改变宿主对外源真菌的感染速率,因而KCS1的敲除并未导致菌株系统性感染能力下降。
| [1] |
Odds FC, Bernaerts RIA. CHROMagar Candida, a new differential isolation medium for presumptive identification of clinically important Candida species[J]. Journal of Clinical Microbiology, 1994, 32(8): 1923-1929. |
| [2] |
Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: a persistent public health problem[J]. Clinical Microbiology Reviews, 2007, 20(1): 133-163. DOI:10.1128/CMR.00029-06 |
| [3] |
Perlroth J, Choi B, Spellberg B. Nosocomial fungal infections: epidemiology, diagnosis, and treatment[J]. Medical Mycology, 2007, 45(4): 321-346. DOI:10.1080/13693780701218689 |
| [4] |
Koh AY, K hler JR, Coggshall KT, et al. Mucosal damage and neutropenia are required for Candida albicans dissemination[J]. PLoS Pathogens, 2008, 4: e35. DOI:10.1371/journal.ppat.0040035 |
| [5] |
Diekema DJ, Pfaller MA. Nosocomial candidemia: an ounce of prevention is better than a pound of cure[J]. Infection Control and Hospital Epidemiology, 2004, 25(8): 624-626. DOI:10.1086/502451 |
| [6] |
Munoz P, Burillo A, Bouza E. Criteria used when initiating antifungal therapy against Candida spp. in the intensive care unit[J]. International Journal of Antimicrobial Agents, 2000, 15(2): 83-90. DOI:10.1016/S0924-8579(00)00147-3 |
| [7] |
Saiardi A, Erdjument-Bromage H, Snowman AM, et al. Synthesis of diphosphoinositol pentakisphosphate by a newly identified family of higher inositol polyphosphate kinases[J]. Current Biology, 1999, 9(22): 1323-1326. DOI:10.1016/S0960-9822(00)80055-X |
| [8] |
Alcázar-Román AR, Tran EJ, Guo SG, et al. Inositol hexakisphosphate and Gle1 activate the DEAD-box protein Dbp5 for nuclear mRNA export[J]. Nature Cell Biololgy, 2006, 8(7): 711-716. DOI:10.1038/ncb1427 |
| [9] |
Wajszczuk CP, Dummer JS, Ho M, et al. Fungal infections in liver transplant recipients[J]. Transplantation, 1985, 40(4): 347-353. DOI:10.1097/00007890-198510000-00002 |
| [10] |
Niimi M, Nagai Y, Niimi K, et al. Identification of two proteins induced by exposure of the pathogenic fungus Candida glabrata to fluconazole[J]. Journal of Chromatography B, 2002, 782(1/2): 245-252. |
| [11] |
Taylor Jr R, Chen PH, Chou CC, et al. KCS1 deletion in Saccharomyces cerevisiae leads to a defect in translocation of autophagic proteins and reduces autophagosome formation[J]. Autophagy, 2012, 8(9): 1300-1311. DOI:10.4161/auto.20681 |
| [12] |
Yu Q, Wang H, Xu N, et al. Spf1 strongly influences calcium homeostasis, hyphal development, biofilm formation and virulence in Candida albicans[J]. Microbiology, 2012, 158(9): 2272-2282. |
| [13] |
Rabinowitz JD, White E. Autophagy and metabolism[J]. Science, 2010, 330(6009): 1344-1348. DOI:10.1126/science.1193497 |
| [14] |
Xie ZP, Nair U, Klionsky DJ. Atg8 controls phagophore expansion during autophagosome formation[J]. Molecular Biology of the Cell, 2008, 19(8): 3290-3298. DOI:10.1091/mbc.E07-12-1292 |
| [15] |
Shintani T, Klionsky DJ. Cargo proteins facilitate the formation of transport vesicles in the cytoplasm to vacuole targeting pathway[J]. Journal of Biological Chemistry, 2004, 279(29): 29889-29894. DOI:10.1074/jbc.M404399200 |
| [16] |
He CC, Baba M, Cao Y, et al. Self-interaction is critical for Atg9 transport and function at the phagophore assembly site during autophagy[J]. Molecular Biology of the Cell, 2008, 19(12): 5506-5516. DOI:10.1091/mbc.E08-05-0544 |
| [17] |
Mayer FL, Wilson D, Hube B. Candida albicans pathogenicity mechanisms[J]. Virulence, 2013, 4(2): 119-128. DOI:10.4161/viru.22913 |
| [18] |
H fs S, Mogavero S, Hube B. Interaction of Candida albicans with host cells: virulence factors, host defense, escape strategies, and the microbiota[J]. Journal of Microbiology, 2016, 54(3): 149-169. DOI:10.1007/s12275-016-5514-0 |
 2017, Vol. 44
2017, Vol. 44




