扩展功能
文章信息
- 江耀祖, 彭华松, 张雪洪
- JIANG Yao-Zu, PENG Hua-Song, ZHANG Xue-Hong
- 基于ARTP诱变和高通量筛选的绿针假单胞菌GP72
- Breeding of Pseudomonas chlororaphis GP72 based on ARTP mutagenesis and high throughput screening
- 微生物学通报, 2017, 44(10): 2421-2427
- Microbiology China, 2017, 44(10): 2421-2427
- DOI: 10.13344/j.microbiol.china.160938
-
文章历史
- 收稿日期: 2016-12-20
- 接受日期: 2017-01-16
- 优先数字出版日期(www.cnki.net): 2017-01-16
绿针假单胞菌GP72是从上海郊区甜椒根围土壤中分离得到的一株具有广谱抗真菌活性的生防菌株[1],其抗菌活性主要依赖于它产生的3种吩嗪化合物,即吩嗪-1-羧酸(Phenazine-1-carboxylic acid,PCA)、2-羟基-吩嗪(2-Hydroxyphenazine,2-OH-PHZ)和2-羟基-吩嗪-1-羧酸(2-Hydroxy-phenazine-1-carboxylic acid,2-OH-PCA),其中2-OH-PCA是以PCA为底物在PhzO蛋白作用下生成[2],随后自发脱羧生成2-OH-PHZ。GP72具有吩嗪合成基因簇,共10个基因,大小约12 000 bp,分别是群体感应调控基因phzI和phzR,PCA合成基因phzABCDEFG,以及2-OH-PHZ合成基因phzO。但是由于PhzO蛋白活性低、表达量少等因素,只有少部分PCA可以转化为2-OH-PCA和2-OH-PHZ,尤其是具有更强抑菌活性的2-OH-PHZ产量较低,因而PhzO成为2-OH-PHZ生物合成的限制性因子之一[1-3]。
Liu等[2]通过基因敲除、替换和过表达等方式对绿针假单胞菌GP72进行基因工程改造,2-OH-PHZ产量最高达到450.4 mg/L;但是多重改造后的基因工程菌株不仅难以进一步提高产量,而且其过表达株使用抗性标记,存在一定安全性和稳定性问题,也增加了生产成本。然而诱变育种相对来说较为简单,目前大多数的工业生产菌株都是通过诱变育种技术获得[4]。因此,利用新型的技术手段进行诱变育种,同时将具有易表达、易定量检测等优势的GFP作为标记基因来提高筛选效率将是获得2-OH-PHZ高产菌种的有效途径之一。
常压室温等离子体(ARTP)诱变育种是一种新型的育种技术,安全性好、正突变率高[5];由清华大学和北京思清源生物公司合作研发的ARTP育种仪,其在放电时产生的各种电子流对微生物基因进行损伤从而诱导其进行诱变,具有活性粒子浓度高、操作容易、运行成本低廉以及对环境无污染和危害小等特点,使其在微生物突变育种及生物医学领域中引起人们广泛关注[5-6]。
绿色荧光蛋白是从水母中分离出来,其蛋白质具有荧光效应,已经被广泛用于基因表达的检测和细胞中蛋白质的定位等方面,被称为一种“有生命”的荧光[7],GFP与其他荧光标记物兼容,并且不需要其它辅助因子或种特异性的荧光修饰[8]。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒: 实验所用的菌株和质粒见表 1。| Strains/Plasmids | Genotype and relevant characteristics | Reference |
| P. chlororaphis GP72 | Wild type, Ampr, Spr | This lab |
| E. coli | ||
| DH5α | supE44ΔlacU169(Φ80lacZΔM15)hsdR17recA1 gyrA96 thi-1 relA1 | This lab |
| S17 | res-pro mod+integrated copy of RP4, mod+ | This lab |
| Plasmids | ||
| pK18mobSacB | Broad-host-range gene replacement vector, SacB, Kanr | [9] |
| pK18-G-O | pK18mobSacB carrying EcoR Ι-BamH Ι insert of 597 and 403 bp flanking phzO and replace with GFP, SacB, Kanr | This study |
| pBbB5k-GFP | contain a sequence 695 bp of GFP | [10] |
| 注:Ampr:氨苄青霉素抗性;Spr:壮观霉素抗性;Kanr:卡那霉素抗性. Note: Ampr: Ampicillin resistance; Spr: Spectinomycin resistance; Kanr: Kanamycin resistance. |
||
| 引物 Primers |
序列 Sequences (5′→3′) |
大小 Sizes (bp) |
| PhzO-F1 | ACATGATTACGAATTTCATCCTCAATGGCCAG | 32 |
| PhzO-R1 | TTCTCCTTTACTCATGGTAGCAGCCTCAGTAATGT | 35 |
| GFP-F2 | ATGAGTAAAGGAGAAGAACTTTTCACTGG | 29 |
| GFP-R2 | TTATTTGTAGAGCTCATCCATGCCA | 25 |
| PhzO-F3 | GAGCTCTACAAATAAACCTGATTGCCGTGTAG | 32 |
| PhzO-R3 | CGACTCTAGAGGATCTGCTGAGCCTTTCGTGGAT | 34 |
| 注:引物PhzO-F1、PhzO-R3序列下划线部分为与pK18mobSacB质粒酶切后反向互补的一段序列;引物PhzO-R1、PhzO-F3序列下划线部分分别为与GFP-F2、GFP-R2从5′开始的一段序列. Note: The underlined parts of the primers PhzO-F1 and PhzO-R3 are in reverse complement to the pK18 plasmid which had been digested. The underlined parts of the primers PhzO-R1 and PhzO-F3 are the sequences starting from 5′ of GFP-F2 and GFP-R2 respectively. |
||
以pBbB5k质粒为模板,引物为GFP-F2和GFP-R2,将GFP基因从pBbB5k质粒上扩增出来。以GP72全基因组为模板,并设计引物,扩增phzO基因上下游同源臂,上游同源臂引物对为PhzO-F1和PhzO-R1,下游同源臂引物对PhzO-F3和PhzO-R3。其中F1、R3包含与pK18质粒(EcoR Ι和BamH Ι酶切之后)反向互补的一段序列,R1、F3包含一段与GFP反向互补的一段序列,以便4个片段能够在Infusion酶作用下连在一起。基因组、质粒的提取,以及电泳片段回收、酶切、产物纯化和连接等均按试剂盒说明书进行。采用同源重组的方法[11],将phzO上游同源臂、GFP基因片段、phzO下游同源臂、pK18mobSacB连接后转大肠杆菌DH5α感受态,并进行蓝白斑筛选、PCR验证、测序,验证正确后将获得的重组质粒pK18-G-O转入大肠杆菌S17感受态,在Kan、Amp双抗培养基中与菌株GP72共培养,进行结合转移后利用含Kan平板进行单交换筛选,以及蔗糖平板进行双交换筛选,选择只能在LB板中生长的菌株。最后用引物PhzO-F1和PhzO-R3进行PCR验证,可扩增出phzO上下游同源臂和GFP基因片段条带者为绿色荧光蛋白(GFP)成功替换PhzO的突变株,命名为GP72-G。
1.3 ARTP诱变及筛选参考谭剑等ARTP诱变方法,取对数期的GP72-G菌悬液(OD600约为0.6),用0.01 mol/L PBS稀释10倍,取10 μL菌液均匀涂抹于金属载片,设置仪器功率100 W,气流量10 SLM,照射距离2 mm[12-13]。实验中以时间为变量,各组处理时间为0、10、15、20、35、50、70、90 s,制作致死率曲线。致死率=(未经诱变处理菌落数−经诱变处理菌落数)/未经诱变菌落数×100%[4-5]。
选择最优辐照时间,将诱变菌液稀释涂布KB平板,将生长出来的单菌落用牙签接种在另一块KB板上,标记好相应的序号;待菌落长大后,按序号依次用牙签接种于96孔板,每个孔预先加入600 μL的KB培养基,盖上盖子后于摇床上振荡48 h,分别吸取200 μL菌液至透明的96孔板和全黑96孔板[14],分别用于测OD600和荧光强度值。测绿色荧光强度值的激发波长为488 nm,发射波长为510 nm[13, 15]。以单位OD600的荧光强度值表示相对荧光强度,代表突变菌株的PhzO活性变化[10]。每次实验中初筛出较高荧光强度的5株,通过摇瓶培养重测一次,每组实验做3个平行对照,筛出荧光强度最高的一株菌后完成一轮诱变,并作为下一轮诱变出发菌。
1.4 突变株中phzO的回替将第5轮诱变后获得的最高荧光强度菌株命名为GP72-G5。以类似于1.2中GFP基因替换phzO的方式,引物为PhzO-F1和PhzO-R3,以GP72基因组为模板,扩增出一条包含phzO上游同源臂、phzO基因、phzO下游同源臂共2 476 bp的一段基因序列,并按1.2中的方法连上pK18mobSacB质粒后,利用同源重组方法筛选phzO回替菌株。经过测序验证正确后进行保藏,将该菌株命名为GP72Y5。
1.5 发酵及吩嗪产量测定以GP72野生型为对照,将突变株在KB培养基中(每瓶60 mL)进行摇瓶发酵,定时取样,分别测定发酵液中菌体浓度及吩嗪产量,HPLC检测方法参照本实验室方法[1-3]。每个菌株分别以3个摇瓶进行发酵作为平行实验。
2 结果与分析 2.1 标记基因的克隆首先克隆出GFP基因,然后克隆出phzO上下游同源臂,并将它们和质粒pK18连在一起后,用同源重组的方法将phzO替换为GFP基因,替换之后片段大小由约2 500 bp变为1 800 bp。利用PCR获得该片段,将该片段进行测序。序列比对结果显示,phzO上下游同源臂以及GFP基因片段与测序结果完全一致,证明GFP基因已经存在GP72菌株的基因组之中(图 1),GFP基因大小695 bp,phzO基因大小约1 476 bp,上下游同源臂共约1 100 bp。
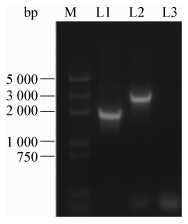
|
| 图 1 GFP基因替换phzO的PCR验证 Figure 1 Idetification of phzO replaced by GFP gene 注:引物为PhzO-F1和PhzO-R3. L1:以GP72-G基因组为模板;L2:以GP72基因组为模板;L3:以ddH2O为模板;M:Marker. Note: Amplification using primers PhzO-F1 and PhzO-R3. L1: Genome of GP72-G as a template; L2: Genome of GP72 as a template; L3: ddH2O as a template; M: Marker. |
|
|
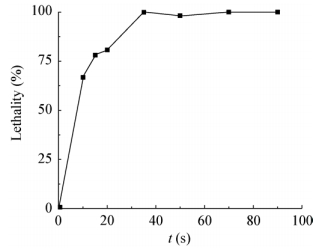
|
| 图 2 菌株GP72-G的ARTP致死率曲线 Figure 2 The ARTP lethality curve of the strain GP72-G |
|
|
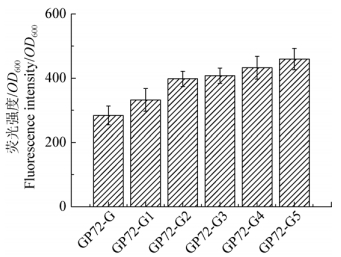
|
| 图 3 每轮诱变后突变株荧光强度变化 Figure 3 Fluorescence intensity changes of the different mutants |
|
|
每轮诱变过后获得的突变株单位OD600的荧光强度值均有一定程度的提高,经excel统计分析,F大于F crit,且P-value小于0.01,表示差异极显著。与诱变出发菌株GP72-G相比,第一轮到第五轮诱变后获得的最高荧光强度突变株,其单位荧光强度分别提高为1.17、1.40、1.44、1.52、1.62倍。
2.3 突变株中phzO的回替及发酵验证 2.3.1 phzO基因的回替: 以同样的分子操作步骤,在诱变株GP72-G5中用phzO基因替换GFP基因并整合到GP72基因组中。用引物对PhzO-F1和PhzO-R3克隆出phzO基因及上下游同源臂。由图 4A中可知,以GP72-G为模板时,GFP基因及上下游同源臂共约1 800 bp,在突变株GP72-G5中用phzO回替后,phzO及其上下游同源臂共约2 500 bp,且经测序比对结果显示一致,表明替换成功。

|
| 图 4 phzO替换GFP基因的PCR验证(A)及突变株颜色变化(B) Figure 4 Idetification of phzO replace GFP gene (A) and the color change of mutant strain (B) 注:引物为PhzO-F1和PhzO-R3. L1:以GP72-G基因组为模板;L2:以GP72Y5基因组为模板;L3:以ddH2O为模板;M:Marker. Note: Amplification using primers PhzO-F1 and PhzO-R3. L1: Genome of GP72-G as a template; L2: Genome of GP72 as a template; L3: ddH2O as a template; M: Marker. |
|
|
在KB平板上培养时GP72菌落呈橙色。将五轮诱变获得的突变株进行phzO回替后,获得的突变株GP72Y5,其菌落颜色较GP72野生株明显加深,由于PCA呈黄色,2-OH-PHZ呈砖红色,初步推断出吩嗪产量,尤其是2-OH-PHZ产量有所提高,如图 4B所示。
2.3.2 发酵验证: 将phzO回替后获得的突变株GP72Y5在KB培养基中进行摇瓶培养,定时取样,分别测定OD600和吩嗪产量(图 5)。
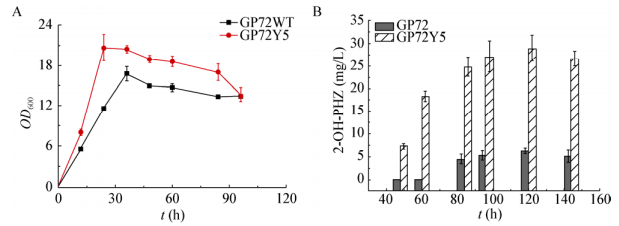
|
| 图 5 菌株GP72与GP72Y5生长曲线(A)和2-OH-PHZ产量变化(B) Figure 5 OD600value (A) and 2-OH-PHZ production of the strains GP72 and GP72Y5 (B) |
|
|
突变株GP72Y5生长情况比野生型好,平衡期GP72Y5最高生物量较野生型提高约20% (图 5A)。
突变株GP72Y5的2-OH-PHZ最高产量为28.94 mg/L,是野生型的4.62倍。由此可见,以ARTP技术对菌种GP72进行诱变后,可以大大提高2-OH-PHZ的产量(图 5B)。
3 结论与讨论ARTP诱变技术是一种新型诱变育种技术,具有安全性好、正突变率高等优点,已被广发用于微生物育种。Lu等[16]利用ARTP诱变技术,提高产气肠杆菌的氢气产量14.5%。本文使用ARTP技术对绿针假单胞菌GP72进行诱变,显著提高2-OH-PHZ产量,诱变时间仅15 s,而且在室温下进行,无需进行辐射防护。由此可见,该方法设备简单、操作易行、运行成本低、诱变育种过程安全高效。
GFP被广泛用于组织基因表达的检测和细胞中蛋白质的定位[17],但是使用GFP基因替换合成途径的限制性因子作为标记基因进行诱变育种研究未见报道,本方法使得在某些微生物育种过程中,较难进行筛选的问题得到解决,并且提高了筛选的效率,使高通量筛选得以进行。本研究中首次以GFP作为筛选标记,通过同源重组的方法将GFP替换2-OH-PHZ合成途径的限制性因子PhzO,以酶标仪测定荧光强度进行高通量筛选,成功获得一株荧光倍数提高为1.62倍的突变株;在突变株中进行PhzO的回替后,其2-OH-PHZ产量为野生株的4.62倍。由此可见,以GFP替换合成途径的限制性因子作为筛选标记,可以显著提高筛选效率和微生物诱变育种水平。
本研究中,首先选取了GFP来替代PhzO,使得原来表达吩嗪化合物2-OH-PHZ,变为表达GFP,从而使原本无法高通量地定量检测,变为仅使用高通量的孔板和酶标仪检测便可实现,该方法可大大提高筛选效率,获得更多正突变菌株。其次,在诱变方法上采用新型的诱变手段——ARTP,该方法具有较高的正突变率,而且诱变操作简单,快速易行,可较快完成一轮诱变,这也为高产菌株的育种打下基础。经过诱变可能造成GP72基因突变,从而影响吩嗪合成的调控通路,对转录或翻译造成影响,致使产量得到提高。当然本研究在诱变方式上如果采用组合诱变的方式或许产量提高更加显著。
本研究将ARTP诱变育种技术与GFP作为标记基因的方法相结合,并采用高通量筛选方法,取得较好的效果,为其他菌株育种提供了参考,具有一定的应用价值。
| [1] |
Liu HM, He YJ, Jiang HX, et al. Characterization of a phenazine-producing strain Pseudomonas chlororaphis GP72 with broad-spectrum antifungal activity from green pepper rhizosphere[J]. Current Microbiology, 2007, 54(4): 302-306. DOI:10.1007/s00284-006-0444-4 |
| [2] |
Liu KQ, Hu HB, Wang W, et al. Genetic engineering of Pseudomonas chlororaphis GP72 for the enhanced production of 2-Hydroxyphenazine[J]. Microbial Cell Factories, 2016, 15(1): 131. DOI:10.1186/s12934-016-0529-0 |
| [3] |
Huang L, Chen MM, Wang W, et al. Enhanced production of 2-hydroxyphenazine in Pseudomonas chlororaphis GP72[J]. Applied Microbiology and Biotechnology, 2011, 89(1): 169-177. DOI:10.1007/s00253-010-2863-1 |
| [4] |
Gepts P. A comparison between crop domestication, classical plant breeding, and genetic engineering[J]. Crop Science, 2002, 42(6): 1780-1790. DOI:10.2135/cropsci2002.1780 |
| [5] |
Wang Q, Feng LR, Wei L, et al. Mutation breeding of lycopene-producing strain blakeslea trispora by a novel atmospheric and room temperature plasma (ARTP)[J]. Applied Biochemistry and Biotechnology, 2014, 174(1): 452-460. DOI:10.1007/s12010-014-0998-8 |
| [6] |
Zong H, Zhan Y, Li X, et al. A new mutation breeding method for Streptomyces albulus by an atmospheric and room temperature plasma[J]. African Journal of Microbiology Research, 2012, 6(13): 3154-3158. |
| [7] |
Long H, Masato K. Application of GFP mark on inbred depuration of transgenic medaka (Oryzias latipes)[J]. Hereditas, 2003, 25(4): 409-413. 龙华, 木下政人. GFP标记在转基因青鳉同系繁殖纯化中的应用[J]. 遗传, 2003, 25(4): 409-413. |
| [8] |
Ha DS, Schwarz JK, Turco SJ, et al. Use of the green fluorescent protein as a marker in transfected Leishmania[J]. Molecular and Biochemical Parasitology, 1996, 77(1): 57-64. DOI:10.1016/0166-6851(96)02580-7 |
| [9] |
Yakoby, Bristow, Christopher A, et al. A combinatorial code for pattern formation in Drosophila oogenesis[J]. Developmental Cell, 2008, 15(5): 725. DOI:10.1016/j.devcel.2008.09.008 |
| [10] |
Tang YJ, Martin HG, Dehal PS, et al. Shewanella spp. reveals evolutionary robustness in central carbon metabolism[J]. Biotechnology & Bioengineering, 2009. DOI:10.1002/bit.22129 |
| [11] |
Schweizer HP, Hoang TT. An improved system for gene replacement and xylE fusion analysis in Pseudomonas aeruginosa[J]. Elsevier Science, 1995, 158(1): 15-22. |
| [12] |
Tan J, Xiong X, Liang WL, et al. Breeding of a phenazine-1-carboxamid-producing strain by ARTP mutation and its optimization of fermentation[J]. Biotechnology Bulletin, 2016, 32(1): 174-179. 谭剑, 熊欣, 梁万利, 等. ARTP技术选育吩嗪-1-甲酰胺高产菌株及发酵优化[J]. 生物技术通报, 2016, 32(1): 174-179. |
| [13] |
Yuan J, Zhao B, Sun MY, et al. Rapid mutation breeding schizochytrium strains producing high-yield docosahexenoic acid by atmospheric and room temperature plasmas (ARTP)[J]. Biotechnology Bulletin, 2015, 31(10): 199-204. 袁军, 赵犇, 孙梦玉, 等. 常压室温等离子体(ARTP)诱变快速选育高产DHA的裂殖壶菌突变株[J]. 生物技术通报, 2015, 31(10): 199-204. |
| [14] |
Shi WJ, Tan J, Chu J, et al. High-throughput screening for high-yield strains of Monascus pigment[J]. China Brewing, 2012, 31(7): 25-28. 石文娟, 谭俊, 储炬, 等. 红曲色素高产菌株的高通量选育[J]. 中国酿造, 2012, 31(7): 25-28. |
| [15] |
Li XM, Luo FN, Wang X, et al. Bioassay of recombinant green fluorescent protein gene yeast cell for a high throughput to screen estrogenic compounds[J]. 2008, 24(12): 2093-2097 (in Chinese) 李湘鸣, 罗方妮, 汪霄, 等. 高通量筛选雌激素类化合物重组绿色荧光蛋白酵母细胞测评体系[J]. 2008, 24(12): 2093-2097 http://www.cqvip.com/QK/71135X/201107/28993516.html |
| [16] |
Lu Y, Wang LY, Ma K, et al. Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma (ARTP)[J]. Biochemical Engineering Journal, 2011, 55(1): 17-22. DOI:10.1016/j.bej.2011.02.020 |
| [17] |
Cheng HY, Silberg J, Masiello C. Gas replacements for GFP to track microbial dynamics in soils and sediments[J]. Vienna Austria, 2016, 18: 11287. |
 2017, Vol. 44
2017, Vol. 44




