扩展功能
文章信息
- 邓佳, 吴海珍
- DENG Jia, WU Hai-Zhen
- 迟缓爱德华氏菌中甘油醛-3-磷酸脱氢酶的胞外分泌调控
- Regulation of GAPDH secretion in Edwardsiella tarda
- 微生物学通报, 2017, 44(10): 2398-2406
- Microbiology China, 2017, 44(10): 2398-2406
- DOI: 10.13344/j.microbiol.china.170271
-
文章历史
- 收稿日期: 2017-04-01
- 接受日期: 2017-05-27
- 优先数字出版日期(www.cnki.net): 2017-06-27
2. 华东理工大学生物工程学院 上海 200237
2. East China University of Science and Technology School of Biotechnology, Shanghai 200237, China
GAPDH (Glyceraldehyde 3-phosphate dehydrogenase)是糖酵解途径中关键酶之一,其在原核细胞中定位于胞内行使糖代谢功能,在真核细胞中大部分定位于胞质中,少量定位于细胞核和线粒体中。在真核细胞中各种压力条件下,GAPDH可以进行亚细胞的重新分布,从而具有了新的生物学功能特性。真核细胞中的GAPDH具有多种功能:在胞质中能促进微管集束和肌动蛋白的聚合[1],在线粒体中诱导细胞的凋亡[2],在细胞核中参与DNA的修复[3],等等。近年来病原菌中GAPDH的胞外定位及在致病机制中的作用和其他功能也正被研究者们逐渐认识。
1992年,Pancholi等完成了A群链球菌(Group A Streptococcus)表面的蛋白分离,首次发现细菌表面有GAPDH的定位[4]。2003年,Seifert等证实B群链球菌(Group B Streptococcus)的细胞表面存在GAPDH,同时发现其可与血纤维蛋白溶酶原、肌动蛋白、纤维蛋白原相互作用,有利于病原菌对宿主细胞的粘附和感染[5]。同年,Bergmann等证实了肺炎链球菌(Streptococcus pneumoniae)的表面存在GAPDH,而且能与血纤维蛋白溶酶原相互作用,促进致病菌的感染[6]。2006年,Terao等发现生脓链球菌(Pyogenic streptococcus)表面的GAPDH可以酶解宿主的C5a以逃避中性粒细胞捕获[7]。2007年,Egea等发现在EPEC (Enteropathogenic Escherichia coli)和EHEC (Enterohemorrhagic Escherichia coli)中,GAPDH不仅存在于细胞膜表面,还可分泌到胞外,但非致病性大肠杆菌中GAPDH不分泌到胞外[8]。
因GAPDH是一种保守的持家酶,并能够定位到细胞膜表面或分泌到胞外,其作为疫苗设计的靶点也日益被研究者们所关注。例如,研究发现白色念珠菌(Canidia albicans)[9]、曼氏血吸虫(Schistosoma mansoni)[10]和无乳链球菌(Streptococcus agalactiae)[11]等的GAPDH均具有良好的免疫原性。2005年,Liu等发现迟缓爱德华氏菌的GAPDH氨基酸序列与志贺氏菌(Shigella flexneri)、沙门氏菌(Salmonella enterica)和大肠杆菌(Escherichia coli)的相似性高达80%,而且在牙鲆(Japanese flounder)上具有良好的免疫保护作用[12]。2012年我们课题组[13-14]对水产养殖动物病害中常见的6种革兰氏阴性致病菌迟缓爱德华氏菌、鲶爱德华氏菌(Edwardsiella ictaluri)、嗜水气单胞菌(Aeromonas hydrophila)、鳗弧菌(Vibrio anguillarum)、溶藻弧菌(Vibrio alginolyticus)和哈维氏弧菌(Vibrio harveyi)的GAPDH进行了克隆和亚定位研究,发现其多能分泌到胞外,以斑马鱼为实验动物的免疫保护作用分析发现,重组的GAPDH具有较强的交叉免疫保护效率(60%以上),免疫大菱鲆(Turbot)后其表现出了良好的免疫原性,免疫鱼体的抗血清和多种病原呈阳性反应,表明抗原GAPDH具有较好的广谱性,可作为水产养殖动物多病原免疫防治中疫苗的开发靶点。2015年,Alves等基于小鼠动物实验,从免疫学、毒理学及疫苗稳定性等多方面分析认为B群链球菌的重组GAPDH亚疫苗是安全和可靠的[15]。
尽管病原菌中GAPDH多种功能的研究报道较多,但有关它是如何定位到细菌表面或分泌到胞外的研究报道甚少。目前仅2012年Oliveira等用电镜观察到GAPDH存在于B群链球菌表面的同时,发现该蛋白是通过菌体裂解的方式进入胞外后才重新定位到细胞表面[16];同年Aguilera等则发现在肠致病性大肠杆菌EPEC中,GAPDH是通过Ⅲ型分泌系统分泌到胞外,且分泌过程需要分子伴侣的帮助[17]。迟缓爱德华氏菌是一种重要的经济鱼类致病菌,对其致病性的机制研究以及针对该病原菌的疫苗开发非常重要。本文利用实验室前期构建的几个毒力相关的分泌系统的缺失株,以及一个全基因突变体文库,对迟缓爱德华氏菌GAPDH的胞外分泌进行了研究,以期找到迟缓爱德华氏菌GAPDH的胞外分泌途径及其调控方式。
1 材料与方法 1.1 实验材料 1.1.1 实验菌株: 迟缓爱德华氏菌EIB202,2006年山东渔场发病的大菱鲆中分离得到的强毒株。∆pEIB202为消除了含四型分泌系统(T4SS)的毒性大质粒(43.7 kb)的EIB202突变株;ΔT3SS为EIB202的T3SS缺失株,ΔT6SS为EIB202的T6SS缺失株,ΔT3SS+ΔT6SS为三型和六型分泌系统双缺失株;Defined transposon mutant library of E. tarda为菌株ΔpEIB202的转座子插入失活突变体文库,共包含2 757株突变株,突变基因覆盖率达57.6%。上述菌株均为课题组前期工作获得。 1.1.2 主要试剂和仪器及培养基: RNA抽提试剂盒购自天根生化科技(北京)有限公司;FastStart Universal SYBR Green Master (ROX)购自罗氏诊断产品(上海)有限公司;逆转录试剂盒购自宝生物工程(大连)有限公司;实验中所用一抗为识别EIB202中GAPDH的多克隆抗体,由吉尔生化(上海)有限公司定制;二抗羊抗兔IgG-HRP购自圣克鲁斯生物技术(上海)公司;RNA聚合酶抗体购自Santa Cruz公司;GAPDH蛋白抗体制备自吉尔生化公司;显色底物TMB购自天根生化科技(北京)有限公司;DMEM、化学发光显色底物ECL购自赛默飞世尔科技有限公司。TE缓冲液购自上海捷瑞生物工程有限公司;PBST缓冲液(g/L):NaCl 8.00,KCl 0.20,Na2HPO4 1.42,KH2PO4 0.27,Tween-20 0.50 mL;PBSTB缓冲液:PBST中加入10.00 g/L的白蛋白(BSA)。其他试剂均为分析纯,购自生工生物工程(上海)股份有限公司。ABI 7500荧光定量PCR仪购自Life Technology公司;核酸定量仪NanoDrop ND-1000 spectrophotometer购自赛默飞世尔科技有限公司。
LB液体培养基(g/L):蛋白胨10.0、酵母抽提物5.0、NaCl 10.0,在103.5 kPa下灭菌20 min,备用。LB固体培养基:在LB液体培养基中加入1.5%琼脂粉。DMEM培养基:称取13.5 g DMEM粉末,定容至1.0 L,边搅拌溶解边加入3.7 g NaHCO3粉末,至培养基澄清后用0.22 μm滤膜过滤除菌,备用。
1.2 实验方法 1.2.1 菌株培养: 活化:菌株划线于DHL平板,30 ℃倒置培养24 h;一级培养:单克隆挑入10 mL LB培养基,30 ℃、200 r/min振荡培养12−16 h;二级培养:按1%的接种量将上述一级培养物接入50 mL DMEM培养基中,30 ℃恒温培养箱中静置培养。 1.2.2 Western blot法检测胞外GAPDH: 二级培养物4 ℃、5 000×g离心15 min,上清用10 kD超滤管浓缩至200−300 μL。取15 μL进行SDS-PAGE电泳,并转印至PVDF膜上,BSA于37 ℃静置封闭2 h,一抗在37 ℃孵育3 h,二抗在37 ℃孵育1 h,全过程以PBST洗涤,最后以ECL显色。 1.2.3 ELISA法检测胞外GAPDH: 取1 mL二级培养物于4 ℃、5 000×g离心10 min,上清再次离心,取第二次离心的上清液100 μL,4 ℃过夜包板;200 μL BSA 37 ℃封闭2 h,100 μL一抗37 ℃孵育3 h,100 μL二抗37 ℃孵育1 h,全过程以PBST洗涤,最后以100 μL TMB底物于37 ℃下显色,并用酶标仪检测OD450。 1.2.4 突变体文库菌株胞外GAPDH分泌量的初筛: 一级培养:取出菌种库中的保种板,用无菌接种针沾取少量菌种保存液,接入96深孔板中,其中每孔含800 μL LB培养基,用透明封口膜封紧,30 ℃、200 r/min振荡培养12−14 h;二级培养:以1%的接种量将一级培养物接入96深孔板中,其中每孔含800 μL DMEM培养基,用无菌的八层纱布扎紧孔板口,置于30 ℃恒温静置培养24 h;二级培养物的96深孔板于4 ℃、5 000×g离心15 min,取100 μL上清液包板,进行胞外GAPDH分泌量的ELISA检测。 1.2.5 定量PCR (qRT-PCR)检测基因的转录水平: 1.2.1中不同时间点取二级培养物1−3 mL,4 ℃、5 000×g离心15 min,菌体沉淀按各试剂盒说明书进行RNA提取、逆转录cDNA以及qRT-PCR分析。分析引物为:gap-F:5′-CCGTGTTACCGCTG AAAGAG-3′;gap-R:5′-GGTTTACGCCCATAACG AAC-3′;esrA-F:5′-GAGAACGGTGAGAATACG-3′;esrA-R:5′-GAGAAGTCCAGCAGGTTA-3′;esrC-F:5′-TACTCGAAACCACCTCTA-3′;esrC-R:5′-CTC GGTGACTGACTAAAG-3′。内参基因为16s rRNA基因,以2−∆∆CT方法分析各基因相对表达量。 2 结果与分析 2.1 经典分泌途径对GAPDH分泌的影响课题组前期构建了3种经典分泌途径相关的EIB202缺失株,包括T4SS缺失株∆pEIB202、ΔT3SS、ΔT6SS和ΔT3SS/ΔT6SS,考察了它们在DMEM静置培养条件下胞外GAPDH的分泌情况。以GAPDH抗体为一抗进行的Western blot检测表明,各缺失株胞外仍能检测到GAPDH分泌;而以RNA聚合酶抗体为一抗进行的Western blot结果显示,各菌株胞外均没有RNA聚合酶的存在(图 1A),这表明胞外GAPDH的存在不是由各缺失株通透性改变或者细胞裂解后导致内含物释放所致,的确是各缺失株自身分泌的结果。进一步的ELISA分析发现,各缺失株胞外GAPDH的分泌量均明显减少(图 1B)。这些结果暗示着GAPDH并非由T3SS、T4SS或T6SS单一分泌途径分泌到胞外。

|
| 图 1 不同分泌途径缺失株胞外GAPDH的分泌 Figure 1 The levels of GAPDH in the supernatants of Edwardsiella tarda EIB202 and its mutants 注:A:Western blot结果;B:ELISA结果.所有结果均包含3次独立重复实验结果. Note: A: analysis with western blot; B: analysis with ELISA. Data are representative of 3 independent experiments. |
|
|
因在Western blot检测中T3SS缺失后胞外GAPDH的分泌量略显增加,进一步多次重复了Western blot和ELISA实验,检测各缺失株胞外GAPDH分泌量的情况,发现Western blot检测因超滤浓缩胞外蛋白,结果会存在一定的波动性,而ELISA检测各生物重复的结果基本一致,因此后续实验均以此方法进行分析。
2.2 基于突变体文库筛选GAPDH胞外分泌相关基因因3种经典分泌途径的缺失均未能阻断GAPDH的胞外分泌,推测GAPDH的胞外分泌过程相对复杂。因此基于课题组已经构建得到的转座子插入失活突变体文库,进行GAPDH胞外分泌调控相关基因的筛选。对突变体文库的各菌株进行培养后,用ELISA检测了其培养上清中GAPDH的分泌量。
经ELISA检测(图 2B)和Western blot实验排除菌体裂解导致的假阳性结果(图 2A),共得到14株分泌量出现明显差异的插入失活株(表 1)。其中7株为GAPDH胞外分泌量上调株,7株为下调株,相关基因包括:转录调控因子esrC,双组分系统调控元件esrA,T4相关元件pilW,T3SS相关元件esaU,T6SS相关元件evpF、evpO和evpG等。

|
| 图 2 突变体文库筛选结果 Figure 2 Screening the mutant library 注:不同突变株的Western blot (A)和ELISA (B)结果. Note: RNA polymerase and GAPDH in the supernatants of different mutants were analysed by Western blot (A) and ELISA (B) respectively. |
|
|
| 基因编号 Gene No. |
基因名 Gene name |
基因描述 Description of gene |
分泌量上调(↑)/下调(↓) Up (↑) or Down (↓)-regulation of secretion |
| ETAE_0861 | esrC | transcriptional regulator EsrC | ↑ |
| ETAE_2804 | pilW | type Ⅳ pilus biogenesis/stability protein | ↑ |
| ETAE_0986 | NULL | major facilitator superfamily transporter | ↑ |
| ETAE_2152 | fliP | flagellar biosynthesis pathway protein FliP | ↑ |
| ETAE_0505 | yrbE | transporter | ↑ |
| ETAE_0885 | esrA | two-component sensor/regulator EsrA | ↑ |
| ETAE_2435 | evpG | type Ⅵ secretion system protein EvpG | ↑ |
| ETAE_2434 | evpF | type Ⅵ secretion system protein EvpF | ↓ |
| ETAE_2443 | evpO | type Ⅵ secretion system protein EvpO | ↓ |
| ETAE_2559 | modA | molybdate transporter periplasmic protein | ↓ |
| ETAE_0883 | esaU | type Ⅲ secretion apparatus protein | ↓ |
| ETAE_3540 | pstA | phosphate ABC transporter permease | ↓ |
| ETAE_1411 | ychM | sulfate transporter | ↓ |
| ETAE_1805 | nlpC | lipoprotein | ↓ |
进一步考察了插入失活株ΔesrA/ΔpEIB202和ΔesrC/ΔpEIB202与ΔpEIB202胞外GAPDH分泌量随时间变化的情况,结果见图 3。插入失活株与ΔpEIB202的GAPDH胞外分泌量均在8−10 h达到最大,且随着培养时间的延长,胞外分泌量有所下降并逐渐降至某一相对稳定的分泌量。另一方面,相比ΔpEIB202,插入失活株的GAPDH胞外分泌量均有所上调,其中ΔesrA/ΔpEIB202上调更显著;而相比于强毒株EIB202,两插入失活株的胞外分泌量也略高。
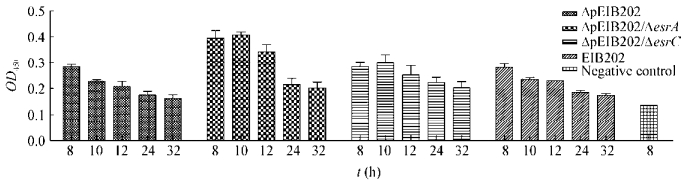
|
| 图 3 不同突变株胞外GAPDH分泌量随培养时间的变化情况 Figure 3 The levels of GAPDH in the supernatants of different mutants |
|
|
筛选所得的突变株均是在ΔpEIB202基础上进行转座子插入失活的,因此在对插入失活株ΔesrA/ΔpEIB202和ΔesrC/ΔpEIB202进行基因转录水平分析时,均以ΔpEIB202在培养8 h时基因的转录水平为对照组,结果见图 4。各菌株在培养早期gap的转录水平较高,随着细胞增殖进入稳定阶段,胞内代谢逐渐减缓,gap的转录量迅速下降。针对不同菌株间相同培养时间的对比分析可看出,由于esrA和esrC失活导致其蛋白无效表达,进而对gap的转录具有一定的影响,表现为胞内gap的转录量有所增加,特别是在培养至10 h时,其转录量显著高于ΔpEIB202,也略高于EIB202,即esrA和esrC的翻译产物负调控gap的转录(图 4A)。分析各菌株中esrA和esrC基因的转录情况发现,pEIB202缺失后esrA和esrC基因的转录水平均存在下调的现象,而esrA和esrC之间的转录水平的相互调控均呈正相关,当一个基因失活后另一基因转录水平也明显下降(图 4B及C)。gap、esrA和esrC转录的调控关系如图 5所示。

|
| 图 4 ΔesrA/ΔpEIB202和ΔesrC/ΔpEIB202胞内相关基因的转录水平分析 Figure 4 Expressions of mRNA of gap, esrA and esrC genes 注:以ΔpEIB202在8 h时的mRNA表达量为参照,其值设为1.0. Note: Expression of mRNA of ΔpEIB202 at 8 h was regarded as control, whose value is 1.0. |
|
|

|
| 图 5 基因gap、esrA和esrC间潜在调控模式 Figure 5 Regulation among genes gap, esrA and esrC |
|
|
GAPDH作为一个重要的看家基因,不仅在胞内参与重要的糖酵解过程,且还被分泌到胞外参与其他多种功能,在病原菌与宿主间的相互识别和侵染过程中起重要作用。病原微生物常常利用其多种分泌系统将效应分子和毒力蛋白分泌到胞外或直接注射到宿主细胞内,干扰宿主的信号通路及其免疫应答反应,从而实现其致病性[18-20]。T3SS、T4SS和T6SS是病原菌重要的分泌系统,全基因组测序显示EIB202携带有一套完整的Ⅲ型和Ⅵ型分泌系统,其大质粒上有一套不完整的Ⅳ型分泌系统。T3SS分泌系统是一个多蛋白复合物,其核心结构是一个针状复合物,与细菌鞭毛结构相似,由一个基座和一个针管组成,穿过细菌的内膜和外膜,其针管结构还可以刺穿宿主细胞的细胞膜,直接将效应分子注射到宿主细胞内[21-22];T4SS则能形成一种多组分及多功能的跨膜通道结构,允许DNA或蛋白质通过,众多耐药性基因的水平转移均通过该系统完成[23-24];T6SS形成膜通道的同时存在两个胞外组件Hcp和VgrG,通过VgrG形成的针头状结构完成宿主细胞的膜穿刺,继而通过Hcp形成的管状结构将毒力蛋白注入宿主细胞[25-26]。本文首先分析了迟缓爱德华氏菌中T3SS、T4SS和T6SS分泌系统对GAPDH胞外分泌的影响,发现这3个分泌系统的缺失均能导致GAPDH分泌量的下降。但是单一分泌系统的缺失都不能完全阻断其胞外分泌。说明GAPDH的胞外分泌是一个复杂的过程,不依赖于某一单独的分泌系统,而是受到多种因素调控。
另一方面,基于转座子突变体文库筛选得到多个GAPDH胞外分泌量增加或下降的突变体,包括ΔesrA/ΔpEIB202和ΔesrC/ΔpEIB202。其中esrA是迟缓爱德华氏菌中EsrA-EsrB双组分系统的调节基因,而EsrA-EsrB双组分系统与其致病性密切相关[27]。双组分系统是细菌内广泛存在的一种信号转导系统,响应体外生存环境,参与细菌的基因调控网络。病原菌利用双组分系统,在侵染宿主的不同阶段调控表达不同的毒力因子,以促进其感染[28]。目前已发现许多病原菌的双组分系统的突变株都具有良好的减毒效果。esrA存在于T3SS基因簇内,其编码产物可调控多种毒力因子的表达,包括T3SS和T6SS相关毒力因子的表达[29];esrC也存在于T3SS基因簇,受到EsrB的调控,EsrB可以直接结合在esrC的启动子上面,调控esrC的表达,而EsrC又能直接结合在esaM、eseJ、evpP和evpA的启动子上面,从而进一步调控T3SS和T6SS的表达[30]。EsrA是EsrA-EsrB双组分系统中的感应蛋白,定位在细胞膜上,响应特定的信号,并将信号传递给受响应的调节蛋白EsrB,从而调节胞外的GAPDH的分泌,通过检测胞外GAPDH随时间的变化,可以发现胞外GAPDH的水平在8 h达到一个稳定水平,并不再增加,可能是膜上的EsrA响应了胞外GAPDH的水平,将信号传递到胞内的EsrB,EsrB再通过EsrC调控T3SS和T6SS分泌系统,使胞外的GAPDH维持在一个稳定的水平。但是当esrA或者esrC缺失后,EsrA-EsrB双组分系统不能正常调节GAPDH的分泌,导致胞外GAPDH分泌量增加。
胞外蛋白分泌量的增加受到多方面因素的影响,既与其分泌途径相关,也和胞内的转录翻译水平密切相关。那么突变体ΔesrA/ΔpEIB202和ΔesrC/ΔpEIB202胞外GAPDH分泌量的增加是仅与EsrA-EsrB双组分系统介导的T3SS和T6SS分泌相关,还是与esrA和esrC影响gap的表达,进而影响GAPDH胞外分泌也相关呢?因此进一步分析了突变体ΔesrA/ΔpEIB202和ΔesrC/ΔpEIB202中gap的转录水平,发现esrA和esrC缺失后,胞内gap的表达有所提高,说明突变体ΔesrA/ΔpEIB202和ΔesrC/ΔpEIB202胞外GAPDH分泌量的增加不仅仅和EsrA-EsrB双组分系统及其调控的T3SS与T6SS分泌系统相关,而且还和esrA和esrC缺失后导致的gap表达量提高相关。
| [1] |
Durrieu C, Bernier-Valentin F, Rousset B. Microtubules bind glyceraldehyde 3-phosphate dehydrogenase and modulate its enzyme activity and quaternary structure[J]. Archives of Biochemistry and Biophysics, 1987, 252(1): 32-40. DOI:10.1016/0003-9861(87)90005-1 |
| [2] |
Tarze A, Deniaud A, Le Bras M, et al. GAPDH, a novel regulator of the pro-apoptotic mitochondrial membrane permeabilization[J]. Oncogene, 2007, 26(18): 2606-2620. DOI:10.1038/sj.onc.1210074 |
| [3] |
Hara MR, Agrawal N, Kim SF, et al. S-nitrosylated GAPDH initiates apoptotic cell death by nuclear translocation following Siah1 binding[J]. Nature Cell Biology, 2005, 7(7): 665-674. DOI:10.1038/ncb1268 |
| [4] |
Pancholi V, Fischetti VA. A major surface protein on group A streptococci is a glyceraldehyde-3-phosphate-dehydrogenase with multiple binding activity[J]. Journal of Experimental Medicine, 1992, 176(2): 415-426. DOI:10.1084/jem.176.2.415 |
| [5] |
Seifert KN, McArthur WP, Bleiweis AS, et al. Characterization of group B streptococcal glyceraldehyde-3-phosphate dehydrogenase: surface localization, enzymatic activity, and proteinprotein interactions[J]. Canadian Journal of Microbiology, 2003, 49(5): 350-356. DOI:10.1139/w03-042 |
| [6] |
Bergmann S, Rohde M, Hammerschmidt S. Glyceraldehyde-3-phosphate dehydrogenase of Streptococcus pneumoniae is a surface-displayed plasminogen-binding protein[J]. Infection and Immunity, 2004, 72(4): 2416-2419. DOI:10.1128/IAI.72.4.2416-2419.2004 |
| [7] |
Terao Y, Yamaguchi M, Hamada S, et al. Multifunctional glyceraldehyde-3-phosphate dehydrogenase of Streptococcus pyogenes is essential for evasion from neutrophils[J]. Journal of Biological Chemistry, 2006, 281(20): 14215-14223. DOI:10.1074/jbc.M513408200 |
| [8] |
Egea L, Aguilera L, Giménez R, et al. Role of secreted glyceraldehyde-3-phosphate dehydrogenase in the infection mechanism of enterohemorrhagic and enteropathogenic Escherichia coli: interaction of the extracellular enzyme with human plasminogen and fibrinogen[J]. The International Journal of Biochemistry & Cell Biology, 2007, 39(6): 1190-1203. |
| [9] |
Gil-Navarro I, Gil ML, Casanova M, et al. The glycolytic enzyme glyceraldehyde-3-phosphate dehydrogenase of Cadida albicans is a surface antigen[J]. Journal of Bacteriology, 1997, 179(16): 4992-4999. DOI:10.1128/jb.179.16.4992-4999.1997 |
| [10] |
Argiro LL, Kohlstädt SS, Henri SS, et al. Identification of a candidate vaccine peptide on the 37 kDa Schistosoma mansoni GAPDH[J]. Vaccine, 2000, 18(19): 2039-2048. DOI:10.1016/S0264-410X(99)00521-6 |
| [11] |
Madureira P, Baptista M, Vieira M, et al. Streptococcus agalactiae GAPDH is a virulence-associated immunomodulatory protein[J]. The Journal of Immunology, 2007, 178(3): 1379-1387. DOI:10.4049/jimmunol.178.3.1379 |
| [12] |
Liu Y, Oshima SI, Kurohara K, et al. Vaccine efficacy of recombinant GAPDH of Edwardsiella tarda against Edwardsiellosis[J]. Microbiology and Immunology, 2005, 49(7): 605-612. DOI:10.1111/mim.2005.49.issue-7 |
| [13] |
Li X, Wu H, Zhang M, et al. Secreted glyceraldehyde-3-phosphate dehydrogenase as a broad spectrum vaccine candidate against microbial infection in aquaculture[J]. Letters of Applied Microbiology, 2012, 54(1): 1-9. DOI:10.1111/lam.2011.54.issue-1 |
| [14] |
Liang SQ, Wu HZ, Liu B, et al. The immune response of turbot (Scophthalmus maximus L.) to a broad spectrum vaccine candidate, recombinant glyceraldehyde-3-phosphate dehydrogenase of Edwardsiella tarda[J]. Veterinary Immunology and Immunopathology, 2012, 15(3/4): 198-205. |
| [15] |
Alves J, Madureira P, Baltazar MT, et al. A safe and stable neonatal vaccine targeting GAPDH confers protection against group B streptococcus Infections in Adult Susceptible Mice[J]. PLoS One, 2015, 10(12): e0144196. DOI:10.1371/journal.pone.0144196 |
| [16] |
Oliveira L, Madureira P, Andrade EB, et al. Group B streptococcus GAPDH is released upon cell lysis, associates with bacterial surface, and induces apoptosis in murine macrophages[J]. PLoS One, 2012, 7(1): e29963. DOI:10.1371/journal.pone.0029963 |
| [17] |
Aguilera L, Ferreira E, Giménez R, et al. Secretion of the housekeeping protein glyceraldehyde-3-phosphate dehydrogenase by the LEE-encoded type Ⅲ secretion system in enteropathogenic Escherichia coli[J]. The International Journal of Biochemistry & Cell Biology, 2012, 44(6): 955-962. |
| [18] |
Gerlach RG, Hensel M. Protein secretion systems and adhesins: the molecular armory of gram-negative pathogens[J]. International Journal of Medical Microbiology, 2007, 297(6): 401-415. DOI:10.1016/j.ijmm.2007.03.017 |
| [19] |
Saier MH Jr. Protein secretion and membrane insertion systems in gram-negative bacteria[J]. The Journal of Membrane Biology, 2006, 214(1): 75-90. |
| [20] |
Costa TR, Felisberto-Rodrigues C, Meir A, et al. Secretion systems in Gram-negative bacteria: structural and mechanistic insights[J]. Nature Reviews Microbiology, 2015, 13(6): 343-359. DOI:10.1038/nrmicro3456 |
| [21] |
Wang QY, Yang MJ, Xiao JF, et al. Genome sequence of the versatile fish pathogen Edwardsiella tarda provides insights into its adaptation to broad host ranges and intracellular niches[J]. PLoS One, 2009, 17, 4(10): e7646. |
| [22] |
Garmendia J, Frankel G, Crepin VF. Enteropathogenic and enterohemorrhagic Escherichia coli infections: translocation, translocation, translocation[J]. Infection and Immunity, 2005, 73(5): 2573-2585. DOI:10.1128/IAI.73.5.2573-2585.2005 |
| [23] |
Bi DX, Liu ML, Tai C, et al. SecReT4: a web-based bacterial type Ⅳ secretion system resource[J]. Nucleic Acids Research, 2013, 41(D1): D660-D665. DOI:10.1093/nar/gks1248 |
| [24] |
Guglielmini J, Néron B, Abby SS, et al. Key components of the eight classes of type Ⅳ secretion systems involved in bacterial conjugation or protein secretion[J]. Nucleic Acids Research, 2014, 42(9): 5715-5727. DOI:10.1093/nar/gku194 |
| [25] |
Mougous JD, Cuff ME, Raunser S, et al. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus[J]. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [26] |
Cianfanelli FR, Alcoforado Diniz J, Guo M, et al. VgrG and PAAR proteins define distinct versions of a functional type Ⅵ secretion system[J]. PLoS Pathogens, 2016, 12(6): e1005735. DOI:10.1371/journal.ppat.1005735 |
| [27] |
Wang X, Wang Q, Xiao J, et al. Hemolysin EthA in Edwardsiella tarda is essential for fish invasion in vivo and in vitro and regulated by two-component system EsrA-EsrB and nucleoid protein HhaEt[J]. Fish and Shellfish Immunology, 2010, 29(6): 1082-1091. DOI:10.1016/j.fsi.2010.08.025 |
| [28] |
Gotoh Y, Eguchi Y, Watanabe T, et al. Two-component signal transduction as potential drug targets in pathogenic bacteria[J]. Current Opinion Microbiology, 2010, 13(2): 232-239. DOI:10.1016/j.mib.2010.01.008 |
| [29] |
Lv YZ, Xiao JF, Liu Q, et al. Systematic mutation analysis of two-component signal transduction systems reveals EsrA-EsrB and PhoP-PhoQ as the major virulence regulators in Edwardsiella tarda[J]. Veterinary Microbiology, 2012, 157(1/2): 190-199. |
| [30] |
Rogge ML, Thune RL. Regulation of the Edwardsiella ictaluri type Ⅲ secretion system by pH and phosphate concentration through EsrA, EsrB, and EsrC[J]. Applied and Environmental Microbiology, 2011, 77(13): 4293-4302. DOI:10.1128/AEM.00195-11 |
 2017, Vol. 44
2017, Vol. 44




