扩展功能
文章信息
- 陈香, 唐彤彤, 孙星, 刘勤
- CHEN Xiang, TANG Tong-Tong, SUN Xing, LIU Qin
- 对黄瓜枯萎病具防效的海洋源芽孢杆菌Y3F的鉴定
- Identification of marine bacillus isolate Y3F suppressing fusarium wilt of cucumber
- 微生物学通报, 2017, 44(10): 2370-2379
- Microbiology China, 2017, 44(10): 2370-2379
- DOI: 10.13344/j.microbiol.china.170019
-
文章历史
- 收稿日期: 2017-01-08
- 接受日期: 2017-05-31
- 优先数字出版日期(www.cnki.net): 2017-06-13
2. 中国科学院大学 北京 100049;
3. 滁州学院 生物与食品工程学院 安徽 滁州 239000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Biology and Food Engineering, Chuzhou University, Chuzhou, Anhui 239000, China
黄瓜枯萎病是黄瓜连作障碍中主要的因素之一,是黄瓜病害中危害最为严重、造成经济损失最大的病害之一[1-2]。黄瓜枯萎病的病原菌是尖孢镰刀菌(Fusarium oxysporum f. sp. cucumerinum),病原菌通过根部的伤口或根毛顶端侵入,在维管束内寄生,破坏黄瓜的根、茎和叶,使黄瓜植株吸收和运输水分的能力丧失,最终会导致黄瓜植株枯萎死亡[3]。国内外对黄瓜枯萎病进行了较为详细和深入的研究,化学农药是防治黄瓜枯萎病最常用的方法,但是长期使用化学农药不仅会造成药物残留,污染环境,危害人畜健康,而且病原菌会产生抗药性,逐渐降低防效。因此,研制开发高效、安全、绿色的防治黄瓜枯萎病的方法显得尤为重要。生物防治因其对人畜无害、环境友好、不易产生抗病性,成为行之有效的防治方法,生物防治黄瓜枯萎病害在国内外也有报道[4-5]。目前应用于防治黄瓜枯萎病的生防细菌主要包括芽孢杆菌(Bacillus spp.)和假单胞菌(Pesudomonas spp.)等[6],芽孢杆菌具有防病增产的作用,在防治黄瓜枯萎病方面具有良好的前景。例如Chung等研究发现枯草芽孢杆菌ME488对黄瓜枯萎病的发生有很好的抑菌效果[7];韦巧婕等从根际土壤中分离出对尖孢镰刀菌具有较强抑菌作用的菌株B,盆栽试验表明拮抗菌株B和有机肥发酵制成的微生物有机肥不仅能有效防治黄瓜枯萎病害,还有促生作用[3];张璐等从黄瓜根际土壤中筛选出对黄瓜枯萎病菌有稳定拮抗效果的短芽孢杆菌DS-1,与对照相比,对黄瓜苗期的防治效果达到84.92%[4]。
近年来,虽然芽孢杆菌防治黄瓜土传病害已有大量报道,但是大部分拮抗菌株都是从土壤或植物根际分离出来的,从海洋中分离出来的芽孢杆菌应用于黄瓜枯萎病害的防治还是比较少的,而且海洋生防菌作为新型的生物资源,具有独特的生存环境,能产生不同于陆地微生物的新颖的活性物质,从海洋中筛选具有强定殖能力的生防菌的可能高于陆地微生物中约4%的几率[8],具有研究开发的价值。海洋细菌具有耐高低温、耐贫营养、耐酸碱和耐盐等特性,能够产生不同于陆地微生物的新颖的生物活性物质[9-10],对于海洋微生物应用于植物病害防治方面的报道也很多[11],李伟等从南海中分离出对黄瓜枯萎病菌有强抑制效果的枯草芽孢杆菌3512A,对黄瓜枯萎病害的田间防治效果达到70%以上[12];刘小宇等分离出一株对稻瘟霉菌和大肠埃希氏菌有很强抑菌活性的海洋芽孢杆菌ZJ8112[13];汪晶晶等报道了海洋解淀粉芽孢杆菌GM-1菌株对水稻纹枯病有明显的防治效果,能够促进水稻幼苗的生长[14]。海洋藻类表面附着大量的微生物,其中细菌主要集中在假单胞菌属(Pesudomonas)、弧菌属(Vibrio)、微球菌属(Micrococcus)、芽孢杆菌属(Bucillus)等[15],海藻体表的微生物可以应用于海洋防污治理、生物防治、海洋药物的研发、食品防腐剂等。Egan等从石莼表面分离得到5株海洋细菌,其中3株细菌对多种海洋细菌和真菌的生长具有抑制作用[16];Trischman等从加利福尼亚海湾的石莼中分离出了13株细菌,其中2株革兰氏阳性菌能产生抗菌活性物质[17];Yoshikawa等发现从海藻表面分离筛选到弧菌C-979,其培养液对一些蓝细菌生长有抑制作用[18]。
本研究从连云港海域中筛选出一株对黄瓜枯萎病菌有强抑制作用的海洋细菌Y3F,对该菌株进行了鉴定,证明其为蜡样芽孢杆菌(Bacillus cereus)。盆栽试验显示Y3F对黄瓜枯萎病害具有防治效果,并对黄瓜有促生作用。初步研究显示该菌通过分泌某种抗菌物质抑制黄瓜枯萎病原菌的生长。
1 材料与方法 1.1 材料 1.1.1 供试菌株: 从采集的连云港海域的海藻样品中分离出菌株Y3F (本研究中分离);黄瓜尖孢镰刀菌cfcc 82185 (Fusarium oxysporum f. sp. cucumerinum)由南京农业大学海洋生物学重点实验室提供。 1.1.2 供试土壤: 从江苏省姜堰市采集的潮土用于黄瓜盆栽防效试验,供试土壤的基本理化性质如下:有机质含量23.42 g/kg,全氮含量为1.56 g/kg,碱解氮含量为103.6 mg/kg,速效磷和速效钾含量分别为13.1 mg/kg,126.6 mg/kg,pH 7.09。 1.1.3 供试作物: 用于盆栽试验的黄瓜品种为“富阳35F1”,是农业科学院育成的新一代杂交品种。 1.1.4 培养基: 2216E marine agar培养基参照Sun等的方法配制[19];真菌PDA培养基、牛肉膏蛋白胨培养基、高氏一号培养基、马丁氏培养基参照赵斌等的方法配制[20];尖孢镰刀菌选择性培养基参照Komada的方法配制[21]。 1.1.5 主要试剂和仪器: Bacterial DNA Kit (50)试剂盒购自OMEGA公司;引物由华大基因公司合成;PCR扩增反应试剂购自TaKaRa公司。XSP-6C双目生物显微镜,上海长方光学仪器厂;Bio-Rad PCR仪,美国伯乐公司;UVmini-1240紫外可见分光光度计,岛津分析检测仪器;Eppendorf 5424R高速冷冻离心机,德国艾本德公司。 1.2 方法 1.2.1 菌株Y3F的分离和筛选: 待连云港东西连岛海域退潮后,在岩礁、石块、贝壳、泥沙等海藻生长基质采集海藻样品,将不易腐烂、个体大的海藻直接收入采集袋,写好标签,4℃保存备用。将采集的海藻样品用无菌器具剪碎,再用无菌生理盐水稀释10倍后,吸取100 µL在2216E marine agar培养基上均匀涂布,28培养24−72 h。分别挑取颜色、形状、大小不同的单个菌落在2216E培养基上划线纯化,4℃保存分离纯化的菌株。采用琼脂挖块对峙法[22],将黄瓜枯萎病菌接入到PDA中央,在距离病原菌2.5 cm四周用无菌打孔器打直径为5 mm的孔,每个孔内加入25 µL的培养24 h的Y3F培养液,以接种2216E液体培养基的平板为对照,设3次重复,28℃倒置培养7 d后采用十字交叉法测量不同处理的病原菌的菌落直径,计算抑菌率,筛选出抑菌作用最强的拮抗菌。 1.2.2 菌株Y3F的鉴定: (1) 菌株形态特征观察是将菌株在2216E培养基上涂布,28℃培养24 h,对菌株的个体菌落的颜色、大小、形状等特征进行记录,同时对菌株进行革兰氏染色。(2) 菌株的生理生化学特征鉴定:参照《常见细菌系统鉴定手册》[23]调查生理生化学特征。
(3) 菌株16S rRNA基因序列测定分析:采用Bacterial DNA Kit(50)试剂盒提取菌株Y3F的基因组DNA,采用由华大基因公司合成的细菌16S rRNA基因通用引物(27F:5′-AGAGTTTGATCCTG GCTCAG-3′,1492R:5′-TACGGCTACCTTGTTAC GACTT-3′)进行PCR扩增。PCR反应体系(50 µL):10×PCR缓冲液0.5 µL,20 mmol/L dNTPs 2.5 µL,25 mmol/L MgCl2 4 µL,20 µmol/L正反向引物各1 µL,DNA模板0.5 µL,175 U/µL Taq DNA聚合酶0.5 µL,ddH2O 40 µL。PCR反应条件:94℃ 4 min;94℃,55℃,72℃,30个循环;72℃。将PCR扩增产物送交华大基因公司测序,然后向NCBI提交测得的菌株的序列,同时进行Blastn相似性比对,选择相似性较高的序列通过MEGA 5.0采用邻接法(Neighbor-Joining)构建菌株系统发育树。
1.2.3 菌株Y3F对病原菌的抑菌能力测定: 以菌株Y3F作为拮抗菌株,制备菌株Y3F的培养液和无菌滤液。菌株Y3F的培养液制备:挑取1–2环菌株Y3F接入到装有30 mL 2216E培养液的150 mL三角瓶中,28、180 r/min振荡培养24 h后吸取300 µL种子液接种到装有30 mL 2216E液体培养基的150 mL的三角瓶中,28℃、180 r/min振荡培养24 h,4℃保存备用。菌株Y3F无菌滤液的制备:将菌株Y3F的培养液4℃、8 000 r/min离心30 min,得到的上层清液用孔径为0.22 µm的滤膜过滤,4℃保存备用。分别吸取制备的菌株Y3F的培养液和无菌滤液200 µL到PDA培养基上,用无菌涂布棒均匀涂布后在培养基的中央接种黄瓜枯萎病原菌,以无菌的2216E液体培养基为对照,每个处理重复3次。28℃培养72 h后每隔一天用十字交叉法测量病原菌菌落直径,计算抑菌率[24]。 1.2.4 菌株Y3F对黄瓜枯萎病害的盆栽防效测试: 拮抗菌液的制备:将制备好的菌株Y3F的培养液用生理盐水稀释成108 cfu/mL的拮抗菌悬液;病原菌孢子悬浮液的制备:将黄瓜枯萎病原菌cfcc 82185接种到装有50 mL PDA液体培养基的250 mL三角瓶中,28℃、180 r/min振荡培养一周,得到的菌液用无菌纱布过滤后,用无菌水稀释成浓度为108 cfu/mL的病原菌孢子悬浮液。拮抗试验方法:试验设计5个处理,采用的拮抗菌液施用方法:J:浸种处理;G:灌根处理;JG:浸种和灌根处理;B:只接种病原菌孢子悬浮液;CK:清水对照。浸种处理是将饱满的黄瓜种子在拮抗菌液浸泡30 min,催芽后播种在温室内装有供试土的盆钵中,待黄瓜幼苗长至一心一叶时每株幼苗灌根接种浓度为108CFU/mL的病原菌孢子悬浮液20 mL;灌根处理是直接将黄瓜种子催芽后播种在温室内装供试土的盆钵中,待黄瓜幼苗生长至一心一叶时同时灌根接种病原菌孢子悬浮液20 mL和拮抗菌液20 mL;浸种和灌根同时处理是先将黄瓜种子浸泡在拮抗菌液中30 min,催芽后播种在温室内装有供试土的盆钵中,然后待黄瓜幼苗长至一心一叶时同时灌根接种病原菌孢子悬浮液20 mL和拮抗菌液20 mL。只接种病原菌孢子悬浮液是直接将黄瓜种子催芽后播种在温室内装有供试土的盆钵中,待黄瓜幼苗长至一心一叶时灌根接种病原菌孢子悬浮液20 mL。设清水作为对照。每个盆钵装入800 g土,播种前每盆土施入50 mL黄瓜营养液[营养液配方(g/L):(NH4)2SO40.190,MgSO4 0.537,Ca(H2PO4)2·H2O 0.589,KNO30.915,CaP2H4O8 0.337],每盆播种4粒,每个处理10盆,随机排列,播种后覆上一层地膜,地膜密封2−3 d。待出苗后白天温度保持在24−28℃,夜间温度保持在12−13℃,光照时数保持在8 h,每天喷施清水保湿。
1.2.5 发病调查: 分别在播种后第15、30天调查和记录各个处理黄瓜的病株数、发病症状,计算发病率、病情指数和防治效果。当病级为0级表示植株叶面无症状,正常生长;病级为1级表示植株上1/4以下的叶面表现出萎蔫症状;病级为2级表示植株上1/4−1/2的叶面表现出萎蔫症状;病级为3级表示植株上1/2以上叶面表现出萎蔫症状;病级为4级表示植株整株萎蔫死亡[2]。 1.2.6 黄瓜盆栽植株生物量测定: 黄瓜播种1个月后,每个不同的菌液处理的黄瓜盆栽随机采集10株黄瓜植株样测定株高、根长、地上部分及地下部分鲜重和干重。地下部分的干重的测定方法是将地下部分的样品先105℃杀青30 min,再70℃烘干至恒重。 1.2.7 黄瓜盆栽中根际土壤微生物种群和数量的变化: 黄瓜盆栽种植1个月后,每个不同菌液处理黄瓜盆栽随机采集5株植株的根际土,混匀后装入自封袋内,于4℃保存,尽快处理样品。采用稀释平板涂布分离法,分别对黄瓜植株根际土中的细菌(牛肉膏蛋白胨培养基)、放线菌(高氏一号培养基)、真菌(马丁氏培养基)、黄瓜尖孢镰刀菌(尖孢镰刀菌选择性培养基)进行分离和计数。所有的统计采用SPSS 16.0进行单因素方差分析。 2 结果与分析 2.1 菌株Y3F的分离和筛选通过稀释平板涂布划线法分离得到的不同颜色、大小、形状的菌株,采用琼脂挖块对峙法筛选到了2株对黄瓜尖孢镰刀菌有较强抑菌效果,抑菌率达到70%以上的菌株,把这两个菌株命名为yw2、Y3F。菌株Y3F的抑菌效果最好,抑菌率为71.45% (图 1),以菌株Y3F作为拮抗菌株进行下一步研究。

|
| 图 1 菌株Y3F的平板抑菌效果及其形态特征 Figure 1 The antimicrobial effect and morphological characteristics of strain Y3F 注:A、B:黄瓜尖孢镰刀菌在未接种Y3F和接种Y3F的平板上的生长情况;C、D:菌株Y3F在2216E培养基和油镜(1 000×)下的形态特征. Note: A−B: The growth of fusarium oxysporum cfcc 82185 without inoculation of strain Y3F and inoculation of strain Y3F; C−D:The morphology of strain Y3F in 2216E plate and under oil immersion lens (1 000×). |
|
|
菌株Y3F在2216E培养基上的菌落(图 1)呈现圆形,乳白色,直径5 mm−8 mm,边缘整齐,表面光滑,中央凸起,菌落不透明。如图 1所示,Y3F菌体在显微镜下呈杆状,芽孢呈椭圆形,革兰氏染色阳性。
2.3 菌株Y3F的生理生化特征菌株Y3F能分解利用葡萄糖,能水解淀粉,分解明胶,柠檬酸盐实验阴性,不产硫化氢,硝酸盐还原实验阳性,吲哚实验阳性,卵磷酯酶实验阳性,接触酶阳性,苯丙氨酸脱氨酶实验阴性。在pH 9.0、10% NaCl、55℃下不能生长。菌株Y3F理化特征和蜡样芽孢杆菌基本相同(表 1)。
| 测试项目 Test items |
Y3F菌株 Strain Y3F |
蜡样芽孢杆菌 Bacillus cereus |
| Glucose acid production | + | + |
| Arabinose acid production | − | − |
| Xylose acid production | − | − |
| Glucose gas production | − | − |
| Amylohydrolysis | + | + |
| Citrate utilization | − | + |
| Gelatin hydrolysis | + | + |
| Hydrogen sulfide | − | − |
| Nitrate reduction | + | + |
| Indole production | + | + |
| Phenylalanine ammonia lyase | − | − |
| Phospholipase | + | + |
| Catalase | + | + |
| pH for growth | ||
| 5.7 | + | + |
| 6.8 | + | + |
| 9.0 | − | − |
| NaCl concentration for growth | ||
| 3% | + | + |
| 5% | + | + |
| 7% | + | + |
| 10% | − | − |
| Temperature for growth | ||
| 10℃ | + | + |
| 30℃ | + | + |
| 50℃ | + | + |
| 55℃ | − | − |
| 注:+:阳性;−:阴性. Note: +: Positive; −: Negative. |
||
将菌株Y3F序列提交至GenBank获得的登录号是KX682281,通过BLASTn进行相似性比对分析显示,菌株Y3F的16S rRNA基因序列与NCBI数据库中比对的蜡样芽孢杆菌属同源相似度均大于99%,最高的相似度达到100%。同时通过构建的系统发育树(图 2)可知,菌株Y3F和Bacillus cereus KSCI、Bacillus cereus Fck-1-16、Bacillus cereus HG10、Bacillus cereus Fck-1-17的亲缘关系最近,同源性最高,而且Bootstrap的检验值是1 000。因此,根据菌株16S rRNA基因序列相似性分析,形态特征和生理生化特性的结果,可以确定菌株Y3F为蜡样芽孢杆菌(Bacillus cereus)。

|
| 图 2 菌株Y3F的16S rRNA基因序列系统发育树 Figure 2 Phylogenetic tree based on analysis of 16S rRNA gene sequences of strain Y3F and some related strains 注:括号中的序号为相关细菌的GenBank的登录号;分支点上的数字表示Bootstrap支持率;标尺表示每个核苷酸位点上的0.005替换值. Note: The numbers in parentheses represent the sequence accession numbers in GenBank. The numbers in each branch point indicate the rate of support by bootstrap. The scale bar shows the 0.005 substitution value on each nucleotide site. |
|
|
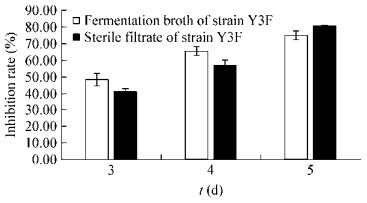
菌株Y3F对病原菌有很好的抑制效果,随着时间的增加,抑菌作用越来越强,培养5 d后,抑菌率达到了70%以上(图 3)。对于去除菌体的Y3F的无菌发酵滤液而言,无菌滤液对病原菌的抑菌活性也是随着时间增加不断变强,培养5 d后,菌株Y3F的无菌滤液的抑菌率大于70%。菌株Y3F对黄瓜尖孢镰刀菌有明显稳定的抑制作用,菌株Y3F能分泌抑菌活性物质有效地抑制病原菌的生长。
|
| 图 3 菌株Y3F的发酵液和无菌滤液的抑菌效果图 Figure 3 Fermentation broth and sterile filtrate of strain Y3F inhibite pathogenic fungi |
|
|
在温室黄瓜盆栽试验中,从不同施菌处理方式下的黄瓜植株的发病情况可以看出(表 2,图 4),施用拮抗菌的黄瓜植株病情指数明显低于病原菌和清水对照的黄瓜植株病情指数。在种植15 d后,不同施菌处理方式下的防治效果也有明显差异,其中浸种和灌根同时处理下的防治效果达到64.10%,随着种植天数的增加,黄瓜盆栽的病情指数也在增加,但是浸种和灌根同时处理下的黄瓜盆栽的病情指数上升幅度较小,显著低于对照的黄瓜病情指数。在种植30 d后,浸种和灌根同时处理下对黄瓜枯萎病的防治效果为50.46%,保持着较好的防治效果。
| 处理方式 Treatment |
15 days | 30 days | |||||
| 发病率 Incidence of fusarium wilt (%) |
病情指数 Disease index |
防治效果 Control efficiency (%) |
发病率 Incidence of fusarium wilt (%) |
病情指数 Disease index |
防治效果 Control efficiency (%) |
||
| J | 42.39±2.07d | 38.06±0.37d | 55.40±0.56b | 55.36±3.02c | 54.64±1.51d | 39.85±1.67b | |
| G | 51.06±2.04c | 43.33±1.67c | 49.21±2.00c | 58.62±2.81c | 60.51±0.42c | 33.38±0.46c | |
| JG | 31.28±1.05e | 30.63±0.15e | 64.10±0.22a | 36.61±1.66d | 45.00±1.44e | 50.46±1.58a | |
| B | 98.33±1.67a | 83.50±1.75a | − | 98.89±1.11a | 90.83±3.19a | − | |
| CK | 85.33±1.48b | 50.83±2.31b | − | 90.69±2.16b | 68.76±0.65b | − | |
| 注:J:浸种处理;G:灌根处理;JG:浸种和灌根处理;B:只接种病原菌;CK:清水对照.表中字母a、b、c等表示在P < 0.05水平上差异显著. Note: J: Soaking seeds treatment; G: Irrigating roots treatment; JG: Soaking seeds and irrigating roots treatment; B: Spore suspension of the pathogen treatment; CK: Water treatment. The letters a, b, c, etc in the table indicate significant difference at the P < 0.05 level. |
|||||||

|
| 图 4 不同处理方式下菌株Y3F对黄瓜枯萎病的防治效果 Figure 4 The control effect of strain Y3F on cucumber fusarium wilt under different treatments 注:A:灌根处理(G);B:浸种处理(J);C:浸种和灌根处理(JG);D:清水对照(CK);E:只接种病原菌(B). Note: A: Irrigating roots treatment (G); B: Soaking seeds treatment (J); C: Soaking seeds and irrigating roots treatment (JG); D: Water treatment (CK); E: Spore suspension of the pathogen treatment (B). |
|
|
通过分析采集的黄瓜植株样品,得到了黄瓜植株的生物量数据(表 3)。与清水对照相比,浸种和灌根同时处理、灌根处理下的黄瓜植株的株高、根长、地上地下部分鲜重和干重都有显著性差异,浸种处理下黄瓜植株的生长量与清水对照的差异不是很明显,但是浸种处理下的黄瓜植株的生物量数据还是高于清水对照下的数据。由此可见,浸种和灌根同时处理、灌根处理方式下的黄瓜植株生长较好,说明浸种和灌根同时处理、灌根处理的施菌方式对黄瓜生长有明显的促生作用。
| 处理方式 Treatment |
株高 Plant height (cm) |
根长 Root length (cm) |
地上部分鲜重 Fresh weight of aboveground (g) |
地下部分鲜重 Fresh weight of underground (g) |
地上部分干重 Dry weight of aboveground (g) |
地下部分干重 Dry weight of underground (g) |
| JG | 22.07±0.43a | 6.29±0.34ab | 52.36±0.09a | 7.35±0.28a | 15.25±0.38a | 4.47±0.19a |
| G | 20.48±0.46b | 6.00±0.35ab | 50.33±0.21b | 7.29±0.36a | 14.24±0.78ab | 4.42±0.03ab |
| J | 17.75±0.42c | 6.37±0.46a | 49.51±0.08b | 7.02±0.22ab | 13.17±0.21b | 4.39±0.11ab |
| CK | 17.75±0.50c | 5.28±0.22b | 35.18±0.86c | 6.35±0.13b | 10.34±0.14c | 4.04±0.13b |
| 注:JG:浸种和灌根处理;G:灌根处理;J:浸种处理;CK:清水对照.表中字母a、b、c等表示在P < 0.05水平上差异显著. Note: JG: Soaking seeds and irrigating roots treatment; G: Irrigating roots treatment; J: Soaking seeds treatment; CK: Water treatment. The letters a, b, c, etc in the table indicate significant difference at the P < 0.05 level. |
||||||
黄瓜种植一个月后,对黄瓜根际土的微生物进行分离计数,从表 4中的数据可以看出,采用浸种和灌根同时处理、灌根处理两种施菌方式下的黄瓜根际土的细菌和放线菌数量明显高于清水和病原菌对照。灌根和浸种同时处理的根际土细菌数和放线菌相比较清水对照增加了78.70%和65.76%;灌根处理的根际土细菌数和放线菌比清水对照增加了78.33%和63.85%。对于根际土的真菌和尖孢镰刀菌数量而言,施用拮抗菌液的根际土的真菌和尖孢镰刀菌的数量明显低于清水和病原菌对照,其中在浸种和灌根同时处理下的根际土的真菌和尖孢镰刀菌数比清水对照降低了63.23%和83.01%。
| 处理方式 Treatment |
细菌数 Number of bacteria (×107CFU/g) |
放线菌数 Number of actinomycetes (×106CFU/g) |
真菌数 Number of fungi (×104CFU/g) |
尖孢镰刀菌数 Number of F. oxysporum (×103CFU/g) |
| J | 7.08±0.96b | 3.36±0.71b | 3.06±1.56c | 15.55±2.13c |
| G | 12.83±1.12a | 12.92±1.70a | 2.72±0.89c | 4.08±0.58d |
| JG | 13.05±0.58a | 13.64±0.42a | 2.75±0.72c | 4.42±0.89d |
| B | 5.78±1.22bc | 3.90±1.48b | 12.5±1.20a | 64.28±4.71a |
| CK | 2.78±0.75c | 4.67±1.10b | 7.48±1.22b | 26.01±1.17b |
| 注:J:浸种处理;G:灌根处理;JG:浸种和灌根处理;B:只接种病原菌;CK:清水对照.表中字母a、b、c等表示在P < 0.05水平上差异显著. Note: J: Soaking seeds treatment; G: Irrigating roots treatment; JG: Soaking seeds and irrigating roots treatment; B: Spore suspension of the pathogen treatment; CK: Water treatment. The letters a, b, c, etc in the table indicate significant difference at the P < 0.05 level. |
||||
蜡样芽孢杆菌(Bacillus cereus)是革兰氏阳性需氧型杆菌,能够产生多种生物活性物质,被广泛用作生防制剂、饲料添加剂以及对人类胃肠道疾病的防治等。研究表明蜡样芽孢杆菌(Bacillus cereus)不仅对多种植物病害有明显抑制作用,而且能促进植物生长,如高芬等分离发现一株蜡样芽孢杆菌BC98-1对黄瓜枯萎病害有较好的抑制作用,而且抑制作用稳定[25];Xiao等研究发现蜡样芽孢杆菌X5和农业有机废弃物制备的生物有机肥能够有效控制温室盆栽和田间中的根结线虫(Meloidogyne sp.)[26];Niu等发现菌株Bacillus cereus AR156可以很好地定殖于番茄根系,能够防治植株病害和促进番茄植株生长[27];Milner等分离到一株蜡样芽孢杆菌Bacillus cereus UW85对黄瓜、花生、烟草苗等植物病害有很好的防治效果[28]。本实验室筛选得到一株菌株Y3F,根据其菌株形态特征、生理生化特征和《常规细菌系统鉴定手册》中蜡样芽孢杆菌的描述基本一致,对于柠檬酸盐的利用情况,菌株Y3F和蜡样芽孢杆菌是不同的,可能是因为蜡样芽孢杆菌的菌株之间的理化性质会存在一些差异[29],蜡样芽孢杆菌可以根据对柠檬酸盐利用、硝酸盐还原、淀粉水解、明胶液化性状的试验分成不同型别。对菌株Y3F的16S rRNA基因序列进行了比对分析,菌株Y3F和蜡样芽孢杆菌的同源性最高[30],认为该菌株Y3F属于蜡样芽孢杆菌。菌株Y3F的发酵液对黄瓜枯萎病原菌有明显稳定的抑制作用,其无菌滤液也对病原菌有显著的抑制效果,说明了蜡样芽孢杆菌能够分泌出抑菌作用强、稳定性好的生物活性物质[25]。这对进一步提取拮抗菌抑菌活性物质,研究活性物质的结构组成和拮抗作用机理提供了有效的依据。
熊丽平通过不同施菌方法防控温室烟草青枯病的试验中发现,浸种灌根的施用方式的防病效果达到80.23%,高于单个施用方法的防病效果,不同施用方法的组合的防效高于单个施用方法的防效[31]。在本研究的盆栽黄瓜实验中,通过浸种灌根同时施用Y3F菌液,接种30 d后,对黄瓜枯萎病的防治效果达到50.46%,防治效果高于浸种、灌根的单一施菌处理方式。表明不同施菌方式对防效结果有一定影响,当然影响防效的因素还包括施用菌液浓度、时间、土壤含水量、pH、温度等[32-33],这些因素会影响生防菌在土壤中的定殖能力和对病害的防治效果[34]。在黄瓜的生长期间,菌株Y3F不仅对黄瓜枯萎病有很好的防治作用,而且对黄瓜的地上、地下部分鲜重、干重、株高、根长有一定的促生作用,Turner等证明枯草芽孢杆菌能有效防治Rhizobium spp.引起的植物病害,同时能促进植株生长,这些特点使枯草芽孢杆菌作为生防菌剂得到了广泛应用[35]。经Y3F菌液处理的黄瓜根际土的真菌和尖孢镰刀菌的数量明显低于清水对照和病原菌对照,细菌和放线菌数量有所上升,这个结果显示Y3F可能产生和分泌了某种抗生素,这与王超等的研究结果相符合,即细菌、放线菌通过产生生物活性物质抑制土壤病原微生物的生长与土传病害发生[36]。综上所述,本研究从海藻中筛选得到的蜡样芽孢杆菌Y3F具有对黄瓜枯萎病生防作用和对黄瓜的促生作用,显示其具有潜在的在黄瓜生产中的应用价值。
| [1] |
Guo JY, Hu XF, Li Y, et al. Effect of Fusarium oxysporum f. sp. cucumerinum on photosynthesis and water physiological characteristics in cucumber[J]. Journal of Nanjing Agricultural University, 2011, 34(1): 79-83. 郭晋元, 胡晓峰, 李勇, 等. 黄瓜枯萎病对黄瓜光合和水分生理特性的影响[J]. 南京农业大学学报, 2011, 34(1): 79-83. |
| [2] |
Liang Y, Zhang GY, Wang C, et al. Identification and biocontrol effect of a strain of actinomycete antagonistic to wilt disease of cucumber[J]. Acta Pedologica Sinica, 2013, 50(4): 810-817. 梁银, 张谷月, 王辰, 等. 一株拮抗放线菌的鉴定及其对黄瓜枯萎病的生防效应研究[J]. 土壤学报, 2013, 50(4): 810-817. |
| [3] |
Wei QJ, Zheng XY, Deng KY, et al. Screening and identification of antagonistic Bacillus vallismortis B against cucumber Fusarium wilt and its biological effect[J]. Journal of Nanjing Agricultural University, 2013, 36(1): 40-46. 韦巧婕, 郑新艳, 邓开英, 等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效[J]. 南京农业大学学报, 2013, 36(1): 40-46. DOI:10.7685/j.issn.1000-2030.2013.01.008 |
| [4] |
Zhang L, Ding YQ, Du BH, et al. Identification and biocontrol effects of antagonistic bacterium DS-1 strain against Fusarium oxysporum f. sp. cucumerinum[J]. Acta Horticulturae Sinica, 2010, 37(4): 575-580. 张璐, 丁延芹, 杜秉海, 等. 黄瓜枯萎病病原拮抗细菌DS-1菌株鉴定及其生防效果研究[J]. 园艺学报, 2010, 37(4): 575-580. |
| [5] |
Yuan YJ, Hu J, Ling N, et al. Effects and mechanisms of application with different bio-organic fertilizers in controlling Fusarium wilt of cucumber[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(2): 372-379. 袁玉娟, 胡江, 凌宁, 等. 施用不同生物有机肥对连作黄瓜枯萎病防治效果及其机理初探[J]. 植物营养与肥料学报, 2014, 20(2): 372-379. DOI:10.11674/zwyf.2014.0213 |
| [6] |
Yang XR, Liu SF, Sun SQ, et al. Research development on preventing soil-borne disease with anti-bacteria[J]. Tianjin Agricultural Sciences, 2008, 14(4): 38-42. 杨秀荣, 刘水芳, 孙淑琴, 等. 生防细菌防治土传病害的研究进展[J]. 天津农业科学, 2008, 14(4): 38-42. |
| [7] |
Chung S, Kong H, Buyer JS, et al. Isolation and partial characterization of Bacillus subtilis ME488 for suppression of soilborne pathogens of cucumber and pepper[J]. Applied Microbiology and Biotechnology, 2008, 80(1): 115-123. DOI:10.1007/s00253-008-1520-4 |
| [8] |
Hu JC, Xue DL, Ma CX, et al. Research advances in plant growth-promoting rhizobacteria and its application prospects[J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1963-1966. 胡江春, 薛德林, 马成新, 等. 植物根际促生菌(PGPR)的研究与应用前景[J]. 应用生态学报, 2004, 15(10): 1963-1966. DOI:10.3321/j.issn:1001-9332.2004.10.052 |
| [9] |
Habbu P, Warad V, Shastri R, et al. Antimicrobial metabolites from marine microorganisms[J]. Chinese Journal of Natural Medicines, 2016, 14(2): 101-116. DOI:10.1016/S1875-5364(16)60003-1 |
| [10] |
Liu QY, Hu JC, Xue DL, et al. Bio-active substances derived from marine microorganisms[J]. Journal of Applied Ecology, 2002, 13(7): 901-905. 刘全永, 胡江春, 薛德林, 等. 海洋微生物活性物质研究[J]. 应用生态学报, 2002, 13(7): 901-905. |
| [11] |
Huang XQ, Zhang N, Yong XY, et al. Biocontrol of Rhizoctonia solani damping-off disease in cucumber with Bacillus pumilus SQR-N43[J]. Microbiological Research, 2012, 167(3): 135-143. DOI:10.1016/j.micres.2011.06.002 |
| [12] |
Li W, Hu JC, Wang SJ. Growth-promotion and biocontrol of Cucumber fusarium wilt by marine Bacillus subtilis 3512A[J]. Journal of Shenyang Agricultural University, 2008, 39(2): 182-185. 李伟, 胡江春, 王书锦. 海洋细菌3512A对黄瓜枯萎病的防治及促进植株生长的效应[J]. 沈阳农业大学学报, 2008, 39(2): 182-185. |
| [13] |
Liu XY, Xu QZ, Han WJ, et al. Identification and antibacterial/antifungal activity of a strain of Bacillus from East China Sea[J]. Academic Journal of Second Military Medical University, 2008, 29(3): 321-323. 刘小宇, 许强芝, 韩文菊, 等. 一株海洋芽孢杆菌的鉴定及抗菌活性研究[J]. 第二军医大学学报, 2008, 29(3): 321-323. |
| [14] |
Wang JJ, Bao ZH, Ma GZ, et al. Preliminary report on control effect and resistance mechanism of marine bacteria strain GM-1 against rice sheath blight[J]. Journal of Southern Agriculture, 2015, 46(7): 1223-1227. 汪晶晶, 暴增海, 马桂珍, 等. 海洋细菌GM-1菌株对水稻纹枯病的防治作用及抗病机制初探[J]. 南方农业学报, 2015, 46(7): 1223-1227. |
| [15] |
Yi N, Wu M, Li G. Isolation and analysis of bacterial diversity of the seaweed from the Weihai Beach in shandong province[J]. Journal of Zhejiang University (Science Edition), 2012, 39(2): 215-218. 衣娜, 吴敏, 李冠. 山东威海海藻中细菌分离和多样性分析[J]. 浙江大学学报:理学版, 2012, 39(2): 215-218. |
| [16] |
Egan S, Thomas T, Holmstr m C, et al. Phylogenetic relationship and antifouling activity of bacterial epiphytes from the marine alga Ulva lactuca[J]. Environmental Microbiology, 2002, 2(3): 343-347. |
| [17] |
Trischman JA, Oeffner RE, de Luna MG, et al. Competitive induction and enhancement of indole and a diketopiperazine in marine bacteria[J]. Marine Biotechnology, 2004, 6(3): 215-220. DOI:10.1007/s10126-003-0010-z |
| [18] |
Yoshikawa K, Adachi K, Nishijima M, et al. β-Cyanoalanine production by marine bacteria on cyanide-free medium and its specific inhibitory activity toward cyanobacteria[J]. Applied and Environmental Microbiology, 2000, 66(2): 718-722. DOI:10.1128/AEM.66.2.718-722.2000 |
| [19] |
Sun X, Zhao GM, Gu CH, et al. Screening for and identification of an anti-clam Vibrio marine bacterium from an Aquaculture Pond in the Yellow Sea[J]. Clean-Soil, Air, Water, 2016, 44(3): 304-308. DOI:10.1002/clen.v44.3 |
| [20] |
Zhao B, Lin H, He SJ. Microbiology Experiment[M]. 2nd Edition. Beijing: Science Press, 2014, 73-83, 200-202. 赵斌, 林会, 何绍江. 微生物学实验[M]. 第2版. 北京: 科学出版社, 2014, 73-83, 200-202. |
| [21] |
Komada H. Development of a selective medium for quantitative isolation of Fusarium oxysporum from natural soil[J]. Review of Plant Protection Research, 1975, 114-124. |
| [22] |
Guo G. Screening of marine microorganisms against Pyricularia grisea[D]. Zhanjiang: Master's Thesis of Hainan University, 2003 (in Chinese) 郭刚. 海洋微生物抗稻瘟菌(Pyricularia grisea)活性菌株的筛选[D]. 湛江: 华南热带农业大学硕士学位论文, 2003 http://d.wanfangdata.com.cn/Thesis/Y513903 |
| [23] |
Dong XZ, Cai MY. Handbook of Common Bacterial System Identification[M]. Beijing: Science Press, 2001, 62-63, 364-386. 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001, 62-63, 364-386. |
| [24] |
Wang L, Su HY, Yang RY, et al. Study on fermentation conditions of Alteromonas sp. YTW-10 producing anti-plant pathogens substance[J]. Ludong University Journal (Natural Science Edition), 2010, 26(2): 157-160. 王磊, 宿红艳, 杨润亚, 等. 海洋交替单胞菌YTW-10抗植物病原真菌活性物质的发酵条件研究[J]. 鲁东大学学报:自然科学版, 2010, 26(2): 157-160. |
| [25] |
Gao F, Ma LP, Qiao XW, et al. The antimicrobial characters of the fermenting liquor of BC98-Ⅰ(B. cereus) and its antifungal crude extraction on Fusarium oxysporum (Schl.) f. sp. cucumerinum Owen[J]. Chinese Journal of Eco-Agriculture, 2006, 14(1): 189-192. 高芬, 马利平, 乔雄梧, 等. 蜡质芽孢杆菌BC98-Ⅰ发酵液与抑菌粗提物对黄瓜枯萎病菌的抑菌特性研究[J]. 中国生态农业学报, 2006, 14(1): 189-192. |
| [26] |
Xiao TJ, Chen F, Gao C, et al. Bacillus cereus X5 enhanced bio-organic fertilizers effectively control root-knot nematodes (Meloidogyne sp.)[J]. Pedosphere, 2013, 23(2): 160-168. DOI:10.1016/S1002-0160(13)60003-X |
| [27] |
Niu DD, Wang CJ, Guo YH, et al. The plant growth-promoting rhizobacterium Bacillus cereus AR156 induces resistance in tomato with induction and priming of defence response[J]. Biocontrol Science and Technology, 2012, 22(9): 991-1004. DOI:10.1080/09583157.2012.706595 |
| [28] |
Milner JL, Silo-Suh LA, Lee JC, et al. Production of kanosamine by Bacillus cereus UW85[J]. Applied and Environmental Microbiology, 1996, 62(8): 3061-3065. |
| [29] |
Zhang LN. Identiifcation of a Bacillus cereus and isolation and study on its antimicrobial substance[D]. Guangzhou: Master's Thesis of South China University of Technology, 2012 (in Chinese) 张立娜. 一株蜡样芽孢杆菌的鉴定及其抑菌物质的分离纯化与性质的研究[D]. 广州: 华南理工大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10561-1012451059.htm |
| [30] |
Drancourt M, Bollet C, Carlioz A, et al. 16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates[J]. Journal of Clinical Microbiology, 2000, 38(10): 3623-3630. |
| [31] |
Xiong LP. The application technique of antagonistic strains against tobacco wilt and black shank[D]. Chongqing: Master's Thesis of Southwest University, 2009 (in Chinese) 熊丽平. 拮抗细菌控制烟草青枯、黑胫病害的应用技术研究[D]. 重庆: 西南大学硕士学位论文, 2009 http://d.wanfangdata.com.cn/Thesis/Y1459985 |
| [32] |
van Elsas JD, van Overbeek LS, Feldmann AM, et al. Survival of genetically engineered Pseudomonas fluorescens in soil in competition with the parent strain[J]. FEMS Microbiology Letters, 1991, 85(1): 53-64. |
| [33] |
Dughri MH, Bottomley PJ. Soil acidity and the composition of an indigenous population of Rhizobium tripolii in nodules of different cultivars of Trifolium subterraneum L.[J]. Soil Biology Biochemistry, 1984, 16(4): 405-411. DOI:10.1016/0038-0717(84)90041-5 |
| [34] |
Carté BK. Biomedical potential of marine natural products: Marine organisms are yielding novel molecules for use in basic research and medical applications[J]. Bioscience, 1996, 46(4): 271-286. DOI:10.2307/1312834 |
| [35] |
Turner JT, Backman PA. Factors relating to peanut yield increases after seed treatment with Bacillus subtilis[J]. Plant Disease, 1991, 75(4): 347-353. DOI:10.1094/PD-75-0347 |
| [36] |
Wang C, Wu F, Liu XL, et al. Tobacco rhizosphere microorganism in different fertility of soil[J]. Chinese Tobacco Science, 2005, 26(2): 12-14. 王超, 吴凡, 刘训理, 等. 不同肥力条件下烟草根际微生物的初步研究[J]. 中国烟草科学, 2005, 26(2): 12-14. |
 2017, Vol. 44
2017, Vol. 44




