扩展功能
文章信息
- 禹飞, 梁俊峰, 史静龙, 王胜坤, 陆俊锟
- YU Fei, LIANG Jun-Feng, SHI Jing-Long, WANG Sheng-Kun, LU Jun-Kun
- 林冠受损对小坑林场土壤固碳微生物群落结构的影响
- Effects of canopy damage on soil CO2 fixation bacterial community structure in Xiaokeng forest farm
- 微生物学通报, 2017, 44(10): 2297-2306
- Microbiology China, 2017, 44(10): 2297-2306
- DOI: 10.13344/j.microbiol.china.170004
-
文章历史
- 收稿日期: 2017-01-03
- 接受日期: 2017-02-27
- 优先数字出版日期(www.cnki.net): 2017-04-06
近年来,全球气候改变,极端天气频繁发生[1],特别是2008年我国南方发生的特大雨雪冰冻灾害,对林业方面造成严重危害,严重影响森林生态系统[2]。大庾岭南缘的小坑林场是我国重要的亚热带常绿阔叶林的主要分布区[3]。2008年的灾害对南陵南部森林造成了巨大破坏,超过90%的树木受到破坏[2],导致地面上的凋落物骤增,对森林冰雪灾害的响应格局仍不清楚。土壤微生物群落结构和活性对极端气候十分敏感,极端气候通过影响凋落物的产量和质量,从而影响微生物在分解过程中营养物的分解和转化作用;而固碳微生物通过对碳源的选择性利用,影响有机质的更新与循环,进而对土壤碳循环进行调控[4]。
到目前为止,国内外已经对森林极端气候的灾害有一定的研究,如树种的影响[2]、凋落物的动态变化[5],但对森林土壤微生物的研究还很少,特别是森林土壤固碳微生物。固碳微生物是指具有固碳功能的土壤微生物,大多数为自养微生物,它们不是分类学上的特定类群,只是具有固碳的生态功能而将其统称为固碳微生物[6]。当前发现自养微生物有5条固定CO2路径,即卡尔文循环、厌氧乙酰辅酶A途径、还原性三羧酸循环途径、3-羟基丙酸途径和琥珀酰辅酶A途径[6]。其中卡尔文循环是光能自养微生物和化能自养微生物固定CO2的主要途径,在调节大气CO2浓度方面起重要作用。卡尔文循环中的关键酶是核酮糖-l, 5-二磷酸核酮糖羧化酶/加氧酶(RubisCO),该酶催化卡尔文循环中的第一步CO2固定反应[7]。随着分子生物技术的发展,学者们已经使用分子生物技术研究RubisCO的基因编码在不同的群体核苷酸序列差距,通过比较RubisCO功能基因和16S rRNA基因的系统发育树,表明RubisCO在不同原核生物间的进化关系[6]。RubisCO根据其结构多样性、催化性能及对O2的敏感程度分为Ⅰ−Ⅳ 4种类型[8]。RubisCO Ⅰ存在于大部分好氧光能和化能自养型微生物中,RubisCO Ⅱ存在于好氧及兼性厌氧的化能自养微生物中,RubisCO Ⅲ仅存在古菌中,RubisCO Ⅳ对核酮糖-l, 5-二磷酸核酮糖羧化酶/加氧酶无催化作用[6]。研究表明,RubisCO Ⅰ的大亚基(cbbL)承担了该酶所有的催化功能[7]。cbbL是RubisCO Ⅰ大亚基的编码基因,其氨基酸序列长度为1 400 bp,具有高度的保守性[9],因此它已被很多学者用于各种生态环境中固碳微生物群落多样性的研究。研究的热点从水生生态系统(如地下水和深海[10-11])到农业生态系统(如花生地和稻田[12-13]),目前还鲜少有森林生态系统中固碳微生物方面的相关报道。研究方法从一代测序[14]到454焦磷酸测序[15],还未发现有报道使用MiSeq高通量测序对cbbL基因进行分析研究。
为研究极端气候对森林造成的损伤及响应机制,研究单位于2010年在小坑林场建立了模拟2008年冰雪对森林林冠造成损害的实验样地。本研究利用该样地研究林冠损伤对森林土壤微生物的影响及其响应机制,通过对土壤固碳微生物的功能基因cbbL进行MiSeq高通量测序,研究林冠损伤对森林土壤固碳微生物群落结构的影响,从而在土壤水平上反映不同受损程度的森林在冰冻灾害的影响力,为研究森林土壤微生物的固碳潜力及影响机理提供理论依据。
1 材料与方法 1.1 研究地概况研究区位于广东省韶关市曲江区小坑林场,地理位置为24°39′42′′−24°42′33′′N,113°49′08′′− 113°52′l2′′E,海拔550−580 m,坡度小于35°,该区域为亚热带季风气候区,年均气温20.4 ℃,年均降雨量1 594 mm,年均相对湿度78%,年均日照时数1 576 h,全年无霜期约306 d。小坑林场的森林类型为典型南亚热带常绿阔叶林,优势树种为藜蒴和小红栲[3],该林地未受2008年冰雪灾害天气的影响。
1.2 主要试剂和仪器DNA抽提试剂盒、琼脂糖凝胶DNA回收试剂盒、PCR反应中的BSA (Bovine serum albumin)、2×Taq PCR MasterMix、引物,生工生物工程(上海)股份有限公司。NanoDrop 2000微量紫外分光光度计,美国Thermo公司;PCR仪,美国ABI公司;电泳仪,北京市六一仪器厂;电泳凝胶成像系统,上海嘉鹏科技有限公司。
1.3 样地设置与调查在同一座山头设置4块30 m×30 m代表性的试验样地,样方间距大于10 m,共有3块样地作为重复,重复样地间距大于100 m,样地是典型南亚热带常绿阔叶林,林龄为30年,林分相似,林冠郁闭度相近,样地之间差异不显著。林冠损伤处理于2010年12月进行。每个样地内的4个样方被分成4个处理:对照(CN),损伤处理+移除处理枝叶(TR),损伤处理+保留处理枝叶(TD),未处理+添加处理枝叶(UD)。处理标准参照王旭等[16]对2008年冰雪灾害发生后对森林损害的调查数据处理,具体标准为:对样方内(TD和TR)所有胸径在5−10 cm间的树木,在第一级分叉下部进行断顶处理;对胸径 > 10 cm的树木拉断全部直径小于10 cm的树枝。将样方TD内的处理枝叶仍保留在原样方内,样方TR内的处理枝叶均匀撒在样方UD内。目前该样地正在进行林冠损伤对森林碳循环、养分循环、水文动态等方面的研究,样地维护良好,受损树木死亡率较低。分别于林冠受损1年后(2011年8月末),采用五点采样法,采集其0−10 cm的土壤样品后混合均匀,每一样地重复取样3次,带回实验室,过2 mm筛,−70 ℃保存。
1.4 不同样地环境因子的测定采用全画幅数码相机(Nikon D700S)和180度鱼眼镜头(Nikon F=8 mm)在距地面1 m处摄取林分垂直方向的影像,利用Gap Light Analyzer软件对2010年12月至2011年8月所拍摄照片进行分析计算得到林冠开度(Canopy openness)数据;在每个样地每个样方中心处分别安放4个规格(长、宽、高)为l.0 m×l.0 m×0.2 m网格孔径为1.0 cm的凋落物收集网框,于2010年12月至2011年8月每个月收集一次,每个月将4个收集框里的凋落物合为1个样品,在65 ℃恒温烘干至恒重后称重。
1.5 土壤总DNA的提取、PCR扩增及MiSeq高通量测序称取0.30 g土壤样品,按照Ezup柱式土壤基因组DNA抽提试剂盒中的操作步骤提取总DNA。将提取出的DNA样品溶解于去离子水中,使其稀释10倍,利用NanoDrop 2000微量紫外分光光度计检测其DNA浓度,使其核酸纯度的指示值A260/A280介于1.8−2.0之间,DNA浓度 > 50 mg/L。
采用常用的固碳微生物扩增引物对K2f (5′-ACCAYCAAGCCSAAGCTSGG-3′)和V2r (5′-GCCTTCSAGCTTGCCSACCRC-3′)进行cbbL基因片段(489−495 bp)的扩增[17]。20 μL PCR扩增体系:2×Taq PCR MasterMix 10 μL,K2f (10 μmol/L) 1 μL,V2r (10 μmol/L) 1 μL,DNA模板(50 mg/L) 2 μL,BSA (2.0 g/L) 2 μL,超纯水4 μL。PCR反应条件:95 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 7 min;4 ℃保存。扩增的PCR产物经1% (质量体积比)的琼脂糖凝胶电泳检测,琼脂糖凝胶DNA回收试剂盒对目的条带胶回收纯化,将纯化后的PCR产物送往北京华诺时代科技有限公司进行MiSeq高通量测序。
1.6 数据处理采用Illumina MiSeq测序平台对所有样品进行平行双末端测序,测序得到原始下机数据(Raw data)。根据Barcode序列将下机数据拆分为不同样品数据,使用COPE软件(Connecting overlapped pair-end,V 1.2.3.3)将双末端测序得到的成对Reads组装成一条序列,利用华诺公司内部编写程序删除Barcode序列、引物,将拼接的Tags按照长度过滤,去嵌合体等的处理,最终得到有效数据。在97%相似度下利用Usearch (V 8.0.1623)软件对其有效数据进行OTUs (Operational taxonomic units)聚类,Uparse构建OTUs时会选取代表性序列,这些代表性序列利用Perl编程将其翻译成氨基酸序列,使用Qiime (V 1.9.0)中的BLAST方法与NCBI (National Center for Biotechnology Information)数据库的氨基酸序列进行比对,进行物种注释[14],并在各个分类水平上统计所有样品的菌落组成。
1.7 多样性分析固碳微生物群落物种的Alpha多样性指数包含Chao1指数、ACE指数、Shannon指数,使用Qiime (V 1.9.0)对样品Alpha多样性指数进行计算。
通过对菌群分布情况进行无偏对应分析(Detrended correspondence analysis,DCA),因其DCA排序前4轴中最大值小于3,线性模型PCA (Principal component analysis)为最优分析模型。PCA排序分析使用R (V 3.3.3)语言中vegan包进行[18]。
根据所有样品在属水平的物种注释及丰度信息,对其样本进行聚类并绘制Heatmap图,利用R (V 3.3.3)语言中Pheatmap包绘制图形[19]。
1.8 统计学分析利用Excel作基本的数据前处理和分析;用SPSS 21.0软件作统计学分析,对数据进行正态分布和方差齐性检验,符合正态分布则采用平均值±标准误差,采用邓肯多重比较(P < 0.05),同列不同字母表示差异显著;通过SPSS 21.0作Pearson相关性分析[20]。
2 结果与分析 2.1 不同样地环境因子变化特征研究的4个样地相隔不超过0.5 km,环境极度相似,其对林冠开度和凋落物的处理见表 1。4个样地的林冠开度和凋落物输入量有显著性的差异(P < 0.05)。TD和TR均为损伤处理,其林冠开度明显高于CN、UD样地,TD样地的林冠开度为UD样地林冠开度的3.76倍;在凋落物输入量中TD和UD样地的凋落物输入量明显高于其他两个样地,其中UD样地凋落物输入量是TR样地凋落物输入量的36.22倍。
| 样地 Sample |
林冠开度 Canopy openness (%) |
凋落物输入量 Litter input (g) |
| CN | 10.72±0.09c | 70.33±2.83b |
| TR | 29.95±1.84b | 25.19±19.26c |
| TD | 39.61±3.53a | 886.06±0.73a |
| UD | 10.54±0.37c | 912.50±8.25a |
| 注:数据为平均值±标准误差(n=3);字母代表处理间的显著差异(P < 0.05). Note: The mean and standard error (n=3) were shown. The letters represent significant differences among treatments (P < 0.05). |
||
通过对不同样品中获得的序列进行随机抽取,以得到的序列数与基于该测序条数代表的OTU数量构建稀释性曲线(图 1),从图 1中看出4个样地3个重复共12个样本的稀释性曲线均趋于平坦,说明测序的数据量渐近合理,更多的测序只会产生较少的新的OTU,测序深度已经基本覆盖到样品中所有的物种。
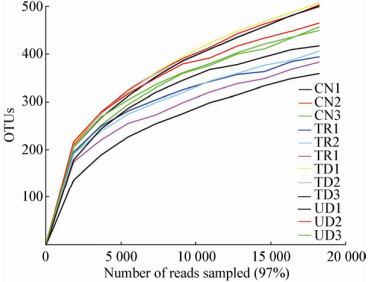
|
| 图 1 不同样地土壤固碳微生物OTU稀释曲线 Figure 1 OTUs rarefaction curves of soil CO2 fixation bacteria |
|
|
从表 2中可以看出,样本间的Chao1指数、ACE指数、Shannon指数在样地中有显著性的差异(P < 0.05),CN样地的Chao1指数、ACE指数比其他3个样地的高,Shannon指数比其他3个样地的低。Chao1指数用来估计群落中物种的总数,Shannon指数用来描述群落多样性,这说明没有经过任何处理的CN样地中的群落物种种群数量最高、多样性最低。TR和UD分别为林冠损伤和凋落物大量骤然输入的单一处理,它们的Chao1指数、ACE指数、Shannon指数没有显著差异,说明两种处理对土壤固碳微生物的种群数量及多样性无显著影响,但它们的Chao1指数和ACE指数均比对照明显降低,Shannon指数增加,表明林冠损伤和凋落物大量骤然输入降低了群落物种种群数量,增加了其多样性水平。TD样地的Shannon指数最高,表明损伤处理和保留处理枝叶对土壤固碳微生物多样性的影响最大。TD样地的Chao1指数比TR和UD的高,但比对照低,表明林冠损伤和凋落物输入双重处理对土壤固碳微生物的种群数量影响要比单一处理小。
| 样地 Sample |
Chao1指数 Chao1 index |
ACE指数 ACE index |
香农指数 Shannon index |
| CN | 867.94±36.53a | 838.73±22.43a | 4.58±0.42b |
| TR | 732.00±38.67b | 758.24±9.61b | 5.94±0.38ab |
| TD | 813.58±16.91ab | 792.35±14.44ab | 6.34±0.03a |
| UD | 735.65±28.54b | 735.60±28.43b | 5.61±0.59ab |
| 注:数据为平均值±标准误差(n=3);字母代表处理间的显著差异(P < 0.05). Note: The mean and standard error (n=3) were shown. The letters represent significant differences among treatments (P < 0.05). |
|||
通过对土壤固碳微生物的多样性指数和环境影响因子进行Pearson相关性分析(表 3)可以看出,Shannon指数与林冠开度呈显著正相关,与凋落物输入量呈正相关;Chao1指数、ACE指数与林冠开度、凋落物输入量呈负相关。总体说来,林冠开度对土壤固碳微生物的影响比凋落物输入量对土壤固碳微生物的影响大。
| 环境因子 Environment factors |
Chao1指数 Chao1 index |
ACE指数 ACE index |
Shannon指数 Shannon index |
| 林冠开度Canopy openness | −0.095 | −0.030 | 0.647* |
| 凋落物输入量Litter input | −0.166 | −0.347 | 0.386 |
| 注:*:双侧上显著相关(P < 0.05). Note: *: Bilateral significant correlation (P < 0.05). |
|||
根据DCA排序,其排序结果表明4个排序轴的长度均小于3,因此选择线性模型PCA分析。主成分分析是采取降维的方式将多个变量转化为几个综合变量的分析方法[18]。通过对土壤样品中在97%水平上相似的OTU进行分析,可以直观地反映样品之间的差异性和相似性,样地距离越近样地间的群落组成越相似,样地距离越远样地间的群落组成有差异。通过对4个样地土壤样品的OTU进行主成分分析,从图 2可以看出,第一主成分和第二主成分的贡献值分别为21.73%和14.37%。各个重复样地之间的差异不大,这说明重复测序的结果还是合理的。TR、TD、UD样地均在第一排序轴的正方向,CN样地在排序轴的负方向,这表明凋落物输入和林冠损伤对土壤固碳微生物的群落结构组成有影响。
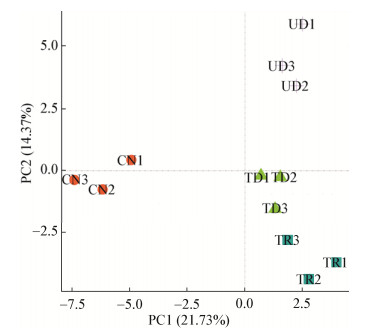
|
| 图 2 4个不同样地基于OTUs丰度的PCA分析 Figure 2 Principal component analysis based on OTUs among 4 samples |
|
|
如图 3所示,小坑林场中土壤固碳微生物主要的菌落包括放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)以及分类地位不明确的土壤固碳微生物菌群。其中变形菌门和放线菌门是土壤中的优势菌群。CN、TD、TR、UD样地的放线菌门所占的比例分别为42.33%、54.14%、40.02%、38.06%,TD样地放线菌门比其他3个样地明显高。CN、TD、TR、UD样地的变形菌门所占的比例分别为34.11%、44.79%、42.35%、40.47%,在分类不明确的菌落中占22.00%、3.56%、17.37%、20.71%。上述结果表明,林冠受损对森林土壤固碳微生物群落结构的影响非常大,特别是林冠损伤并保留枝叶的双重处理,变形菌门和放线菌门比例明显上升,未知类群的比例明显降低;而林冠受损和凋落物输入的单一处理,变形菌门含量增加,未知类群降低。
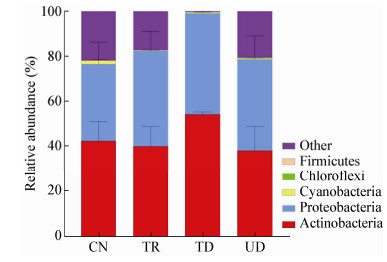
|
| 图 3 土壤固碳微生物在门水平上的群落结构组成分布 Figure 3 Soil CO2 fixation bacterial community groups at phylum level |
|
|
在属水平上,对样本及样本中不同OTU所含序列丰度进行绘制Heatmap图聚类分析(图 4),图 4能通过颜色变化直观地反映在属水平上各样本间的土壤菌落结构的差异和相似性。

|
| 图 4 基于属水平上的固碳微生物热图 Figure 4 Heatmap based on soil CO2 fixation bacteria at genus level |
|
|
根据图 4菌落丰度颜色变化可见,森林土壤固碳微生物的菌群在属水平上的丰度受到不同样地处理的影响,不同样地菌落含量不同。在对照样地,慢生根瘤菌属(Bradyrhizobium)为其优势菌群,亚硝化螺菌属(Nitrosospira)为次要菌群,Stappia、黄色杆菌属(Xanthobacter)、Methyloferula、副伯克氏菌属(Paraburkholderia)、硝化菌属(Nitrobacter)、中慢生根瘤菌属(Mesorhizobium)、Hydrocarboniphaga、寡养菌属(Oligotropha)、伯克氏菌属(Burkholderia)、草螺菌属(Herbaspirillum)、盐红螺旋菌属(Halorhodospira)、青枯菌属(Ralstonia)、食酸菌属(Acidovorax)、硫碱弧菌属(Thioalkalivibrio)、固碳螺菌属(Azospirillum)也存在。与对照相比,林冠损伤和凋落物输入处理后,亚硝化螺菌的OTU序列丰度比例明显增加,在TD、TR和UD样地的比例分别从CN的8.67%上升到21.92%、25.45%和22.04%,由原来的次要菌群成为优势类群;而慢生根瘤菌属的OTU序列丰度比例明显降低,在TD、TR和UD样地的比例分别由CN的12.93%下降至1.43%、1.87%和1.99%。一些其他的菌群OTU序列丰度比例也有变化,比如Stappia、黄色杆菌属和副伯克氏菌属在3个处理中均有增加,特别是在林冠损伤和凋落物输入的单一处理,增加更为明显;而Methyloferula和伯克氏菌属均较对照略有降低。
从总体来看,在属水平上,4个样地之间土壤固碳微生物群落结构存在差异,根据4个样本的OTU所含序列丰度特征,按照土壤固碳微生物菌落相似度进行聚类,TD样地和UD样地先聚在一起为第一类,再与TR样地聚为第二类。CN样地和其他3个样地之间的差异明显,说明凋落物输入和林冠开度对土壤固碳微生物的丰富度和多样性有影响,且差异明显;在TD、TR、UD样地中,TD和UD样地的凋落物输入量明显高于其他两个样地,且这两个样地的凋落物输入量比较相似(表 1),所以,TD和UD样地的土壤固碳微生物菌落结构和丰度都比较相似。由此可见,受凋落物输入量和林冠开度的不同,土壤固碳微生物的OTU所含序列丰度和分布有很大的差异。
2.8 属水平上固碳微生物与环境因子的相关性分析通过对土壤固碳微生物在属水平所有菌落分布和环境影响因子进行Pearson相关性分析(表 4)可以发现,土壤固碳微生物群落与林冠开度和凋落物输入量存在相关性。林冠开度与硝化菌属(Nitrobacter)和辫硫菌属(Thioploca)存在极显著正相关,与黄色杆菌属(Xanthobacter)和Hydrocarboniphaga存在显著正相关,与Methyloferula存在显著负相关;凋落物输入量与Stappia存在极显著正相关,与黄色杆菌属(Xanthobacter)和副伯克氏菌属(Paraburkholderia)存在显著正相关,与硫杆菌属(Acidithiobacillus)存在显著负相关。其他菌群虽然与林冠开度和凋落物输入量未达到显著相关水平,但大多与它们存在正相关或负相关关系。
| 属 Genus |
林冠开度 Canopy openness (%) |
凋落物输入量 Litter input (g) |
| Nitrosospira | 0.426 | 0.249 |
| Bradyrhizobium | −0.509 | −0.499 |
| Stappia | 0.335 | 0.777** |
| Methyloferula | −0.682* | −0.129 |
| Xanthobacter | 0.580* | 0.683* |
| Burkholderia | −0.120 | −0.351 |
| Paraburkholderia | 0.205 | 0.601* |
| Caballeronia | 0.078 | −0.473 |
| Hydrocarboniphaga | 0.695* | 0.546 |
| Methyloversatilis | −0.486 | −0.277 |
| Mesorhizobium | 0.015 | 0.467 |
| Nitrobacter | 0.760** | 0.047 |
| Oligotropha | 0.560 | 0.390 |
| Rhodopseudomonas | 0.227 | −0.422 |
| Acidovorax | 0.393 | 0.276 |
| Variovorax | 0.314 | −0.280 |
| Meganema | −0.367 | 0.418 |
| Herbaspirillum | −0.265 | −0.275 |
| Cupriavidus | −0.284 | 0.362 |
| Oscillochloridaceae | 0.526 | 0.316 |
| Derxia | 0.395 | 0.341 |
| Limnochorda | −0.381 | 0.230 |
| Aminobacter | 0.388 | 0.399 |
| Ralstonia | 0.091 | −0.361 |
| Thermithiobacillus | −0.276 | 0.301 |
| Skermanella | 0.267 | −0.228 |
| Dokdonella | −0.117 | −0.125 |
| Halorhodospira | 0.166 | 0.508 |
| Thioalkalivibrio | −0.244 | 0.366 |
| Rhodoblastus | 0.103 | 0.129 |
| Thioploca | 0.750** | 0.271 |
| Acidithiobacillus | −0.041 | −0.593* |
| Sinorhizobium | 0.244 | 0.440 |
| Solirubrobacter | −0.102 | −0.448 |
| Azospirillum | −0.029 | −0.427 |
| Azohydromonas | −0.277 | −0.287 |
| 注:*:双侧上显著相关(P < 0.05);**:双侧上极显著相关(P < 0.01);黑体字代表其存在显著相关性. Note: *: Bilateral significant correlation (P < 0.05); **: Bilateral significant correlation (P < 0.01). The boldface represents a significant correlation between CO2 fixation bacteria and environmental factor. |
||
在属水平上,固碳微生物群落所占比例大于1%的群落有亚硝化螺菌属(Nitrosospira)、慢生根瘤菌属(Bradyrhizobium)、Stappia、Methyloferula、黄色杆菌属(Xanthobacter)、伯克氏菌属(Burkholderia)、副伯克氏菌属(Paraburkholderia)。其中,黄色杆菌属与林冠开度和凋落物输入量均存在显著正相关关系,Stappia和副伯克氏菌属(Paraburkholderia)与凋落物输入量存在极显著或显著正相关;而Methyloferula与林冠开度存在显著负相关。亚硝化螺菌、慢生根瘤菌属和伯克氏菌属虽与林冠开度和凋落物输入量未达到显著相关水平,但可以观察到,亚硝化螺菌与它们存在正相关关系,而慢生根瘤菌属和伯克氏菌属存在负相关关系。总体说来,在属水平上,这些菌落受凋落物的影响比较大。
3 讨论森林林冠受损不仅对树木生长造成严重影响,林冠损伤增加了林冠开度,降低了森林郁闭度,同时大量受损的枝叶落入森林,森林地表的凋落物输入量迅速增加,对森林生态系统的平衡造成影响。土壤微生物作为森林生态系统中重要的一个组成部分,在凋落物分解、物质转化中起重要作用,必然受其影响。本项目通过模拟灾害对林冠造成的损伤研究林冠受损后林下土壤固碳微生物的群落组成及结构,了解森林生态系统遭受破坏后对土壤固碳微生物的影响,有助于了解土壤固碳微生物的固碳潜力。
3.1 林冠开度对土壤固碳微生物的影响林冠受损增加了林冠开度,能够通过改变乔木的冠层结构进而改变林下的湿度、养分和光照水平[21],显著提高林下生物多样性[22],降低微生物的种群数量[23-24]。刘杰[25]对不同间伐和修枝强度下不同林龄的华北落叶松土壤微生物的研究发现,与对照处理相比,间伐后的华北落叶松细菌、放线菌均下降;丁思一[26]对会同县杉木人工林进行间伐和修枝,观察一年后,与对照样地相比,间伐和修枝均使土壤细菌、放线菌以及微生物的数量降低。
本研究中,模拟灾害对森林造成的损伤程度对样地TD和TR进行了损伤处理,处理后上述两样地林冠开度明显增加,结果导致土壤固碳微生物的多样性增加,种群数量降低,这与前人的研究结果是一致的。TR样方与对照相比,只是林冠开度受到影响,所以只显示林冠开度对土壤固碳微生物的影响,结果表明其多样性明显增加,而种群数量降低。同时,还对土壤固碳微生物群落结构产生明显影响,亚硝化螺菌和黄色杆菌属等类群明显增加,而慢生根瘤菌属和Methyloferula等类群则明显减少。
3.2 凋落物输入对土壤固碳微生物的影响凋落物输入能够影响土壤呼吸,也是影响土壤CO2通量的主要因子之一[27],然而大量凋落物的骤然涌入可能会影响到土壤的通透性,进而影响土壤微生物的多样性。凋落物是微生物的营养来源[28],以往研究表明凋落物增加可以增加微生物的生物量和刺激微生物的活性[29]。本研究中,UD样方仅有凋落物输入量的大量增加,与对照相比,其土壤固碳微生物多样性明显增加,种群数量降低。凋落物的大量输入也对土壤固碳微生物群落结构产生了影响,亚硝化螺菌、Stappia、黄色杆菌属和副伯克氏菌属含量明显增加,而慢生根瘤菌属和伯克氏菌属含量明显减少。
林冠受损通过对森林林冠开度和凋落物输入量的影响,间接影响了土壤微生物的多样性和种群数量,并对其群落结构产生极大影响。TD样地是林冠损伤后将枝叶置于林下,与2008年冰灾发生后的情形相似,结果如表 1所示,林冠开度和凋落物输入的双重影响比单一处理对土壤固碳微生物多样性的影响更明显,而对其种群数量的影响要比单一处理小一些。可能的原因是林冠开度增加降低了森林郁闭度,而凋落物的输入增多则降低了土壤的通透性,从而影响到微生物的多样性和种群数量。
森林林冠受损会导致林冠开度和凋落物输入的变化,进而对森林生态系统产生一系列影响,林冠开度增加会影响林下凋落物的分解和物质转化等过程,从而对固碳微生物群落结构产生影响。表 4显示,大多数固碳微生物受上述两种因素的影响均显示相同的正相关或负相关,特别是一些主要的类群,如亚硝化螺菌和Stappia等类群呈正相关,慢生根瘤菌属和Methyloferula等类群呈负相关;但也有一些类群对两种因素产生相反的结果,比如Caballeronia和红假单胞菌属(Rhodopseudomonas)与林冠开度呈正相关,而与凋落物输入呈负相关;Meganema和贪铜菌属(Cupriavidus)呈正好相反,这可能是这些类群对不同的生态因子的敏感度不同而造成的。
总之,森林林冠受损不仅影响土壤固碳微生物的多样性和种群数量,也对其群落结构产生明显的影响。在未受损森林中,土壤固碳微生物中,慢生根瘤菌属为其优势种群,亚硝化螺菌次之;而林冠受损后,亚硝化螺菌迅速成为优势类群,Stappia、黄色杆菌属(Xanthobacter)和副伯克氏菌属(Paraburkholderia)等类群增加,而慢生根瘤菌属、Methyloferula和伯克氏菌属则明显减少。林冠受损后,凋落物骤然大量涌入,对微生物有重要影响。同时,随着凋落物的分解,大量的有机碳进入土壤,也会对土壤固碳微生物产生影响,上述研究为了解微生物在灾害后森林生态系统恢复过程中的作用提供了理论依据,为今后研究这些固碳微生物的固碳潜力提供了重要依据。
| [1] |
Dale VH, Joyce LA, McNulty S, et al. Climate change and forest disturbances: climate change can affect forests by altering the frequency, intensity, duration, and timing of fire, drought, introduced species, insect and pathogen outbreaks, hurricanes, windstorms, ice storms, or landslides[J]. BioScience, 2001, 51(9): 723-734. DOI:10.1641/0006-3568(2001)051[0723:CCAFD]2.0.CO;2 |
| [2] |
Wang X, Hu WQ, Zhou GY, et al. Selection of native evergreen tree species to restore damaged forests after ice storm in Nanling Mountains[J]. Chinese Journal of Ecology, 2015, 34(11): 3271-3277. 王旭, 胡文强, 周光益, 等. 南岭山地抗冰雪灾害常绿树种选择[J]. 生态学杂志, 2015, 34(11): 3271-3277. |
| [3] |
Xie TT, Li G, Zhou GY, et al. Aboveground biomass of natural Castanopsis carlesii-Schima superba community in Xiaokeng of Nanling Mountains, South China[J]. Chinese Journal of Applied Ecology, 2013, 24(9): 2399-2407. 谢亭亭, 李根, 周光益, 等. 南岭小坑红栲——荷木群落的地上生物量[J]. 应用生态学报, 2013, 24(9): 2399-2407. |
| [4] |
Liu HS, Li LH, Han XG, et al. Respiratory substrate availability plays a crucial role in the response of soil respiration to environmental factors[J]. Applied Soil Ecology, 2006, 32(3): 284-292. DOI:10.1016/j.apsoil.2005.08.001 |
| [5] |
Xu YW, Zhu LR, Wu KK, et al. Litter dynamics in different forest types suffered an extreme ice storm in the subtropical region, southern China[J]. Ecology and Environmental Sciences, 2011, 20(10): 1443-1448. 徐雅雯, 朱丽蓉, 吴可可, 等. 雨雪冰冻灾害后粤北森林各林型凋落物动态[J]. 生态环境学报, 2011, 20(10): 1443-1448. DOI:10.3969/j.issn.1674-5906.2011.10.010 |
| [6] |
Yuan HZ, Qin HL, Liu SL, et al. Advances in research of molecular ecology of carbon fixation microorganism[J]. Scientia Agricultura Sinica, 2011, 44(14): 2951-2958. 袁红朝, 秦红灵, 刘守龙, 等. 固碳微生物分子生态学研究[J]. 中国农业科学, 2011, 44(14): 2951-2958. DOI:10.3864/j.issn.0578-1752.2011.14.012 |
| [7] |
Tabita FR. Microbial ribulose 1, 5-bisphosphate carboxylase/oxygenase: a different perspective[J]. Photosynthesis Research, 1999, 60(1): 1-28. DOI:10.1023/A:1006211417981 |
| [8] |
Tabita FR. Molecular and cellular regulation of autotrophic carbon dioxide fixation in microorganisms[J]. Microbiological Reviews, 1988, 52(2): 155-189. |
| [9] |
Kusian B, Bowien B. Organization and regulation of cbb CO2 assimilation genes in autotrophic bacteria[J]. FEMS Microbiology Reviews, 1997, 21(2): 135-155. DOI:10.1111/j.1574-6976.1997.tb00348.x |
| [10] |
Alfreider A, Vogt C, Hoffmann D, et al. Diversity of ribulose-1, 5-bisphosphate carboxylase/oxygenase large-subunit genes from groundwater and aquifer microorganisms[J]. Microbial Ecology, 2003, 45(4): 317-328. DOI:10.1007/s00248-003-2004-9 |
| [11] |
van der Wielen PWJ. Diversity of ribulose-1, 5-bisphosphate carboxylase/oxygenase large-subunit genes in the MgCl2-dominated deep hypersaline anoxic basin discovery[J]. FEMS Microbiology Letters, 2006, 259(2): 326-331. DOI:10.1111/fml.2006.259.issue-2 |
| [12] |
Yousuf B, Keshri J, Mishra A, et al. Application of targeted metagenomics to explore abundance and diversity of CO2-fixing bacterial community using cbbL gene from the rhizosphere of Arachis hypogaea[J]. Gene, 2012, 506(1): 18-24. DOI:10.1016/j.gene.2012.06.083 |
| [13] |
Yuan HZ, Ge TD, Zou SY, et al. Effect of land use on the abundance and diversity of autotrophic bacteria as measured by ribulose-1, 5-biphosphate carboxylase/oxygenase (RubisCO) large subunit gene abundance in soils[J]. Biology and Fertility of Soils, 2013, 49(5): 609-616. DOI:10.1007/s00374-012-0750-x |
| [14] |
Tolli J, King GM. Diversity and structure of bacterial chemolithotrophic communities in pine forest and agroecosystem soils[J]. Applied and Environmental Microbiology, 2005, 71(12): 8411-8418. DOI:10.1128/AEM.71.12.8411-8418.2005 |
| [15] |
Herrmann M, Rusznyák A, Akob DM, et al. Large fractions of CO2-fixing microorganisms in pristine limestone aquifers appear to be involved in the oxidation of reduced sulfur and nitrogen compounds[J]. Applied and Environmental Microbiology, 2015, 81(7): 2384-2394. DOI:10.1128/AEM.03269-14 |
| [16] |
Wang X, Huang SN, Zhou GY, et al. Effects of the frozen rain and snow disaster on the dominant species of castanopsis forests in Yangdongshan Shierdushui provincial nature reserve of Guangdong[J]. Scientia Silvae Sinicae, 2009, 45(9): 41-47. 王旭, 黄世能, 周光益, 等. 冰雪灾害对杨东山十二度水自然保护区栲类林建群种的影响[J]. 林业科学, 2009, 45(9): 41-47. DOI:10.11707/j.1001-7488.20090908 |
| [17] |
Xu HH, Tabita FR. Ribulose-1, 5-bisphosphate carboxylase/oxygenase gene expression and diversity of Lake Erie planktonic microorganisms[J]. Applied and Environmental Microbiology, 1996, 62(6): 1913-1921. |
| [18] |
Borcard D, Gillet F, Legendre P. Numerical Ecology with R[M]. Lan JS, Trans. Beijing: Higher Education Press, 2014: 106-118 (in Chinese) 博卡德, 吉莱, 勒让德. 数量生态学-R语言的应用[M]. 赖江山, 译. 北京: 高等教育出版社, 2014: 106-118 |
| [19] |
Kolde R. Pheatmap: pretty heatmaps[R]. R Package Version 061, 2012
|
| [20] |
Landau S, Everitt BS. A Handbook of Statistical Analyses Using SPSS[M]. Florida: Chapman & Hall, 2003
|
| [21] |
He YL, Fu MY. Review of studies on understorey of plantations[J]. Forest Research, 2002, 15(6): 727-733. 何艺玲, 傅懋毅. 人工林林下植被的研究现状[J]. 林业科学研究, 2002, 15(6): 727-733. |
| [22] |
Zhang DH, Ye ZF, Fan BY, et al. Influence of thinning on soil fertility in artificial forests[J]. Chinese Journal of Applied Ecology, 2001, 12(5): 672-676. 张鼎华, 叶章发, 范必有, 等. 抚育间伐对人工林土壤肥力的影响[J]. 应用生态学报, 2001, 12(5): 672-676. |
| [23] |
Kayang H. Fungal and bacterial enzyme activities in Alnus nepalensis D. Don[J]. European Journal of Soil Biology, 2001, 37(3): 175-180. DOI:10.1016/S1164-5563(01)01082-2 |
| [24] |
Horák J, Kout J, Vodka, et al. Dead wood dependent organisms in one of the oldest protected forests of Europe: investigating the contrasting effects of within-stand variation in a highly diversified environment[J]. Forest Ecology and Management, 2016, 363: 229-236. DOI:10.1016/j.foreco.2015.12.041 |
| [25] |
Liu J. Thinning and pruning effect on soil quality in Larix Princicpis-rupprechtii Mayr. Plantations[D]. Beijing: Master's Thesis of Beijing Forestry University, 2013 (in Chinese) 刘杰. 抚育间伐和修枝对华北落叶松人工林土壤质量影响的研究[D]. 北京: 北京林业大学硕士学位论文, 2013 |
| [26] |
Ding SY. Effects of forest thinning and pruning on soil respiration and microbial community structure[D]. Changsha: Master's Thesis of Central South University of Forestry and Technology, 2015 (in Chinese) 丁思一. 间伐和修枝对土壤呼吸及微生物群落结构的影响[D]. 长沙: 中南林业科技大学硕士学位论文, 2015 |
| [27] |
Wang GJ, Tian DL, Yan WD, et al. Effects of aboveground litter exclusion and addition on soil respiration in a cunninghamia lanceolata plantation in China[J]. Chinese Journal of Plant Ecology, 2009, 33(4): 739-747. 王光军, 田大伦, 闫文德, 等. 改变凋落物输入对杉木人工林土壤呼吸的短期影响[J]. 植物生态学报, 2009, 33(4): 739-747. |
| [28] |
Harrop-Archibald H, Didham RK, Standish RJ, et al. Mechanisms linking fungal conditioning of leaf litter to detritivore feeding activity[J]. Soil Biology and Biochemistry, 2016, 93: 119-130. DOI:10.1016/j.soilbio.2015.10.021 |
| [29] |
Xiao CW, Guenet B, Zhou Y, et al. Priming of soil organic matter decomposition scales linearly with microbial biomass response to litter input in steppe vegetation[J]. Oikos, 2015, 124(5): 649-657. DOI:10.1111/oik.2015.v124.i5 |
 2017, Vol. 44
2017, Vol. 44




