扩展功能
文章信息
- 黄贞杰, 陈由强, 陈丽霞, 陈淑增
- HUANG Zhen-Jie, CHEN You-Qiang, CHEN Li-Xia, CHEN Shu-Zeng
- 代谢工程改造酿酒酵母合成肌醇
- Metabolic engineering of Saccharomyces cerevisiae for inositol production
- 微生物学通报, 2017, 44(10): 2289-2296
- Microbiology China, 2017, 44(10): 2289-2296
- DOI: 10.13344/j.microbiol.china.170461
-
文章历史
- 收稿日期: 2017-06-28
- 接受日期: 2017-07-28
- 优先数字出版日期(www.cnki.net): 2017-08-08
2. 福建师范大学生命科学学院 福建 福州 350108
2. College of Life Sciences, Fujian Normal University, Fuzhou, Fujian 350108, China
肌醇(Inositol)是一种具有生物活性的环状糖醇,分布在动植物,特别是全谷物和柑橘类水果内,是动物及微生物的生长因子,广泛应用于医药、食品和饲料领域。肌醇具有抗焦虑、抗炎等功效,可应用于辅助治疗神经性疾病[1],肌醇失衡被证实与阿尔茨海默病(Alzheimer’s disease)、双相性精神障碍(Bipolar disorder)、癫痫等神经退行性疾病相关[2]。肌醇可改善多囊卵巢综合症女性的排卵功能和胰岛素敏感性[3-5]。此外,肌醇是氟代肌醇、脉通等药物的中间体,在治疗肿瘤、动脉粥样硬化等方面有较好的疗效[6]。肌醇也是葡萄糖二酸微生物法生产的前体物[7]。
目前肌醇的生产方法,主要是提取米糠、麸皮等底物中的植酸钙,进行加压水解制备。其产率低,且存在污染环境、成本投入高等缺点。所以有必要通过其他有效途径来解决肌醇供求之间的矛盾。生物法制备肌醇因其长足的发展空间,越来越受到研究者的重视,主要包括微生物酶催化法产肌醇和微生物发酵法产肌醇[8]。目前微生物发酵法产肌醇所用的菌株有酵母菌、大肠杆菌以及枯草芽孢杆菌[9]等。
酵母中肌醇的生物合成途径基本明晰[10]。其中肌醇-3-磷酸合成酶是关键酶,其编码基因是ino1。张厚程等[11]将含有ino1的质粒转化于肌醇营养缺陷型粟酒裂殖酵母菌内,使其成为肌醇原养型,其中Sch.P944菌株的肌醇分泌量达到816 mg/L。Hisashi等[12]对酿酒酵母进行改造,过表达ino1,并且降低糖酵解酶的活性,重组菌通过培养,利用15.1 g/L葡萄糖可产3.1 g/L的肌醇,通气补料培养其肌醇生产强度达到4.0 g/(L·d)。Konishi等[13]对不具有内源肌醇合成途径的Escherichia coli进行代谢改造,得到工程菌株AKC-016-G22,其肌醇产量为2.31 g/L。
opi1为转录调控因子基因,它编码的蛋白质是肌醇生物合成的一个负调节子[14]。Henry等通过敲除酿酒酵母中opi1,构建了能够分泌肌醇的工程菌株YS2 (ATCC-74033)等[15]。
以上表明,利用基因工程改造酿酒酵母促进肌醇的合成是可行的。因此,本研究在已有研究基础上,通过构建高效表达ino1的肌醇基因工程菌,在此基础上敲除重组菌中opi1,以期构建高产肌醇的工程菌株。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒: S. cerevisiae Y01 (二倍体)由福建师范大学生命科学学院保存;S. cerevisiae S288c由上海交通大学微生物代谢国家重点实验室赵心清教授惠赠。pUG6、pSH65载体为本实验室保存,pUG6携带有G418抗性基因,kanMX的两端带有loxP位点。pURIH为本实验室构建。 1.1.2 主要试剂和仪器: G418购自北京索莱宝科技有限公司;鲑鱼精DNA购自sigma公司;Fastpfu Fly DNA Polymerase、DNA Marker、Plasmid MiniPrep Kit购自北京全式金生物技术有限公司;TIANamp Yeast DNA Kit (离心柱型)购自天根生化科技(北京)有限公司。2720 Thermal Cycler PCR仪、7500 Reol-Time PCR System,Applied Biosystems公司;GC-2010 Plus气相色谱仪,岛津公司;Gene Pulser XcellTM电穿孔系统,Bio-Rad公司。 1.1.3 培养基: (1) LB培养基(g/L):酵母粉5.0,蛋白胨10.0,氯化钠10.0。(2) YPD培养基(g/L):酵母粉10.0,蛋白胨20.0,葡萄糖20.0。(3) G418抗性培养基:将G418按需要加入到冷却至50左右的YPD培养基中,配制成不同终浓度的抗性培养基。(4) Zeocin抗性培养基:将Zeocin母液加入到冷却至46 ℃左右的YPD固体培养基中,终浓度为50 mg/L。(5) YPG诱导培养基(g/L):酵母粉10.0,半乳糖20.0,蛋白胨20.0。(6)摇瓶发酵培养基(g/L):Yeast Nitrigon Base 6.7,葡萄糖12.0,硫酸铵4.0。 1.2 引物设计根据S. cerevisiae S288c的opi1和ino1序列以及pUG6质粒序列,分别设计opi1敲除组件引物、ino1特异性引物及相关验证引物。引物序列见表 1。敲除组件引物设计原理和结构见图 1。opi1-disrupt-F、opi1-disrupt-R的5′端45个碱基,用来与opi1进行同源重组。opi1-disrupt-F、opi1-disrupt-R的3′端分别是19、22个碱基与质粒pUG6中LoxP-kanMX-LoxP两侧的上、下游的片段序列相同,用来扩增LoxP-kanMX-LoxP。
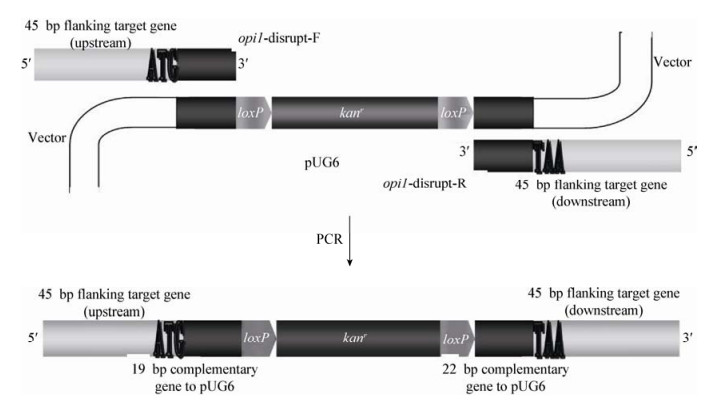
|
| 图 1 敲除组件引物设计原理和结构 Figure 1 Design the primers for gene disruption cassette |
|
|
| Primers | Sequences (5′→3′) | Sizes (bp) |
| ACT1-F | AGAGTTGCCCCAGAAGAACA | 20 |
| ACT1-R | GGCTTGGATGGAAACGTAGA | 20 |
| ino1-F | CGGTATTGGCGAATAAGCAC | 20 |
| ino1-R | TTGAGTCATGGAGCCGAAGT | 20 |
| opi1-disrupt-F | TGTGTATCAGGACAGTGTTTTTA ACGAAGATACTAGTCATTGATGC AGCTGAAGCTTCGTACGC |
64 |
| opi1-disrupt-R | TATTACTGGTGGTAATGCATGAA AGACCTCAATCTGTCTCGGTTAG CATAGGCCACTAGTGGATCTG |
67 |
| opi1-F | AGTCTTTCCCCTGGGTCAGATACAA | 21 |
| opi1-R | GAGCCATTCAAAGGTAAAGAGGGTC | 22 |
| opi1-mid | CAGCGAGCAGTCTATTGTGGTGAAA | 21 |
pURIH整合表达载体的构建过程及转化酿酒酵母Y01详见参考文献[16-17]。
1.4 opi1敲除组件的构建以pUG6质粒DNA为模板,利用引物opi1-disrupt-F和opi1-disrupt-R,用高保真酶Fastpfu Fly DNA Polymerase进行PCR扩增。PCR反应体系(50 μL):5×Buffer 10 μL,dNTPs (2.5 mmol/L) 5.0 μL,上下游引物(10 μmol/L)各2.0 μL,pUG6 (1 μg/μL) 1.0 μL,Fastpfu Fly DNA Polymerase 1.0 μL,ddH2O 29 μL。PCR反应条件:95 ℃ 2 min;94℃ 10 s,55℃ 25 s,72℃ 30 s,25个循环;72 ℃ 5 min。琼脂糖凝胶电泳分析后,使用Wizard SV Gel and PCR Clean-Up System柱式DNA胶回收试剂盒进行胶回收,保存于-20℃备用。
1.5 opi1及kanMX筛选标记的敲除根据Cre/loxP系统敲除原理[18],以pUG6质粒为模板,使用引物opi1-disrup-F和opi1-disrupt-R进行PCR得到删除组件,测序验证后,采用高效的酿酒酵母电击转化法[19],将其转化酿酒酵母工程菌YI2-1ΔKP。电转化条件为:电压:1.5 kV,电容:25 μF,电阻:200 Ω,2 mm转化杯。通过G418抗性平板筛选,基因组PCR验证后,获得发生同源重组的阳性转化子。再将pSH65质粒转化阳性转化子,利用YPG液体培养基诱导培养4 h,经半乳糖诱导表达产生Cre酶切除kanMX。提取基因组进行PCR验证,验证正确后在YPD液体培养基中连续传代10−15代丢失质粒pSH65,影印Zeocin抗性平板筛选,得到opi1单倍体缺陷型菌株。重复以上步骤敲除opi1等位基因,最终得到opi1二倍体缺陷型菌株,将其命名为YI2-1Δopi1。
1.6 酵母菌株发酵培养活化酿酒酵母菌株后,挑取平板上的酵母单菌落,接种到5 mL YPD液体培养基中,在30 ℃、220 r/min条件下培养18 h。然后按1%的接种量接种至含有50 mL无肌醇发酵培养基的摇瓶中进行二级扩大培养。将二级种子液按接种后菌体OD600为0.2的量接种至含有100 mL无肌醇发酵培养基的250 mL三角瓶中培养。
1.7 气相色谱法检测肌醇含量工程菌株接种于发酵培养基中,30 ℃、220 r/min培养50 h后,将上述发酵液的一部分进行离心(6 000 r/min,5 min),上清液过0.45 μm过滤器于样品瓶内,再按照GB5413.25-2010食品安全国家标准婴幼儿食品和乳品中肌醇的测定中的第二法——气相色谱法进行样品处理。使用岛津气相色谱仪GC-2010 Plus进行分析测定。色谱柱为RTX-1701 (30 m×0.25 mm×0.25 μm),程序设定:进样口温度:280 ℃;检测器温度:300 ℃;载气氮气:1.06 mL/min;氢气流速:40 mL/min;空气:400 mL/min;不分流;进样量:1 μL;程序升温:120 ℃ 0 min、190 ℃ 20 min、220 ℃ 10 min。
2 结果与分析 2.1 ino1过表达菌株的筛选以pUG6质粒为骨架,连入rDNA片段和ino1表达框,启动子为PGK,终止子为CYC1。最终获得多拷贝整合表达载体pURIH。再将pURIH转化酿酒酵母Y01菌株,经G418 (0.5−2.0 g/L)浓度梯度平板筛选,提取高拷贝转化子的基因组进行PCR验证后,获得重组菌YI1。为获得ino1表达量更高的菌株,将表达载体pURIH电转化YI1菌株。经筛选,最终构建工程菌株YI2-1和YI2-2。荧光定量PCR方法分析菌株ino1表达量,结果显示YI2-1菌株ino1的mRNA水平是出发菌Y01的16.235倍(图 2)。表明成功构建了ino1过表达菌。敲除kanMX,将不含kanMX的菌株命名为YI2-1ΔKP。重组菌株进行摇瓶发酵实验,检测得YI2-1肌醇产量为325 mg/L、YI2-1ΔKP为627 mg/L。两株重组菌肌醇产量存在差别的原因可能是,MX抗性标记对酵母有一定的毒性作用[20]。

|
| 图 2 ino1的表达分析 Figure 2 Gene expression levels of ino1 |
|
|
以质粒pUG6作为模板,使用引物opi1-disrupt-F和opi1-disrupt-R进行PCR得到基因删除组件,PCR扩增产物纯化回收后,1%琼脂糖电泳分析表明,组件基因片段大小与理论预计大小1 703 bp相符(图 3),测序正确,说明成功获得opi1敲除组件。

|
| 图 3 PCR扩增敲除组件 Figure 3 Verification of gene disruption cassette 注:1:敲除组件的PCR扩增片段;M:DL5000 DNA marker. Note: 1: PCR product of disruption cassette; M: DL5000 DNA marker. |
|
|
采用高效的酿酒酵母电击转化法将敲除组件转化酿酒酵母工程菌YI2-1ΔKP,多次转化实验后,筛选平板上长有3个菌落。以验证引物opi1-F/opi1-R (位于opi1的上下游)为引物,以转化子基因组为模板经PCR验证,如果敲除组件与转化子基因组发生了同源重组,那么PCR产物大小为2 140 bp,对照组为1 740 bp。结果显示1号和3号为阳性转化子,2号为阴性菌落(图 4)。

|
| 图 4 PCR验证阳性转化子 Figure 4 PCR identification of positive clones 注:M:DL5000 DNA marker;1、3:阳性转化子的PCR扩增片段;2:阴性转化子的PCR扩增片段. Note: M: DL5000 DNA marker; 1, 3: PCR products of positive clones; 2: PCR product of negative clone. |
|
|
转化pSH65质粒至阳性酿酒酵母菌株内,半乳糖诱导培养后,提取菌体基因组DNA作为模板进行PCR验证,得到opi1单倍体缺陷型菌株。
使用同样的方法删除另一条等位基因,获得opi1双倍体缺陷菌株。提取opi1缺陷菌株的基因组为模板,如果是单倍体缺陷菌株,以中间引物opi1-mid/opi1-R为引物的PCR产物大小是775 bp,以opi1上下游引物opi1-F/opi1-R为引物的PCR产物大小为1 740 bp和632 bp。如果是双倍体缺陷菌株,以中间引物opi1-mid/opi1-R为引物则无PCR产物,以opi1-F/opi1-R为引物的PCR产物大小是632 bp。经PCR验证,结果符合预期(图 5),说明成功敲除了opi1,获得opi1双倍体缺陷菌株,命名为YI2-1Δopi1。
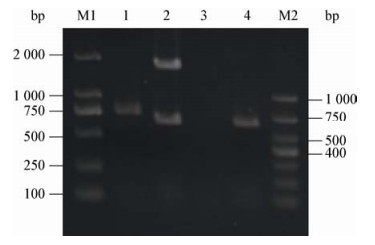
|
| 图 5 opi1基因敲除菌株的鉴定 Figure 5 Detection for opi1 gene deficient mutant 注:M1:DL2000 bp DNA marker;M2: DL1000 bp DNA marker; 1: opi1-mid/opi1-R引物、opi1单倍体缺陷菌基因组PCR产物;2: opi1-F/opi1-R引物、opi1单倍体缺陷菌基因组PCR产物;3: opi1-mid/opi1-R引物、opi1双倍体缺陷菌基因组PCR产物;4: opi1-F/opi1-R引物、opi1双倍体缺陷菌基因组PCR产物. Note: M1: DL2000 bp DNA marker; M2: DL1000 bp DNA marker; 1: PCR product from opi1 haploid deficient mutant by primers opi1-mid/opi1-R; 2: PCR products from opi1 haploid deficient mutant by primers opi1-F/opi1-R; 3: PCR product from opi1 diploid deficient mutant by primers opi1-mid/opi1-R; 4: PCR product from opi1 diploid deficient mutant by primers opi1-F/opi1-R. |
|
|
摇瓶发酵培养48 h,出发菌株Y01、过表达ino1的菌株YI2-1ΔKP,以及opi1敲除后的菌株YI2-1Δopi1的生长情况如图 6所示。YI2-1ΔKP生长最好,敲除了opi1的菌株YI2-1Δopi1与之相比较,OD值要小,说明opi1缺失可能对细胞有一定影响。但重组菌的生长速率均比出发菌株高,较早进入对数期。说明肌醇的合成能够增强菌株细胞的活力。

|
| 图 6 Y01、YI2-1△KP和YI2-1Δopi1生长曲线 Figure 6 Growth curves of Y01, YI2-1ΔKP and YI2-1Δopi1 |
|
|
YI2-1Δopi1重组菌摇瓶发酵培养50 h后,对发酵上清液进行样品处理。使用岛津气相色谱仪GC-2010 Plus进行分析测定,GC检测结果如图 7所示。以出发菌为对照,经重复实验,根据肌醇浓度的标准曲线(图 7A),测得YI2-1Δopi1菌株发酵液肌醇量为1.021 g/L,而出发菌株不产肌醇。该结果表明,通过过表达ino1以及敲除opi1能有效促进肌醇的合成。
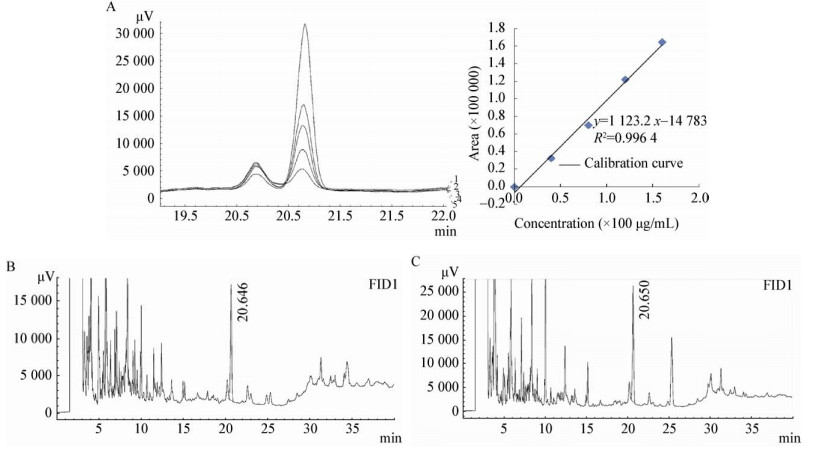
|
| 图 7 肌醇标准品和重组菌发酵液的GC图 Figure 7 GC chromatogram of the standard sample and the product from recombinant S. cerevisiae 注:A、B:肌醇标准品;C:YI2-1Δopi1菌株发酵液. Note: A, B: Inositol; C: The product from YI2-1Δopi1. |
|
|
本研究表明,对酿酒酵母进行过表达ino1和敲除opi1改造,能够有效提高重组菌的肌醇产量。在酵母肌醇的生物合成途径中,肌醇-3-磷酸合成酶是关键酶,其编码基因是ino1,但ino1的表达受UASINO元件及肌醇焦磷酸合成的调控[21-23],如果培养基中含有肌醇,UASINO会被激活而影响ino1的表达。然而胞内肌醇主要用于合成众多磷脂化合物和胆碱等[24],因此野生型酵母菌不外分泌肌醇。本研究通过过表达ino1获得能够分泌肌醇的菌株YI2-1,进一步证实了ino1在酵母肌醇生物合成中起到正调控的重要作用。
对YI2-1菌株kanMX敲除研究发现,kanMX去除后,重组菌的肌醇产量提高。根据Babazadeh等[20]的研究可知MX抗性标记对酿酒酵母具有一定的毒性作用,可能是这个原因造成的影响,具体原因有待于进一步的研究。因此,考虑到生产菌株的性能及生物安全性,有必要将用于筛选用的抗性基因敲除掉。
Opi1是肌醇生物合成的转录抑制子,能够招募辅抑制因子Sin3和Cyc8与Ino2转录子结合[25],从而抑制ino1的表达程度。因此,为消除Opi1对肌醇合成的抑制作用,本研究将opi1敲除。发酵实验结果表明,opi1缺失的工程菌株发酵产物肌醇,与只过表达ino1菌株相比,产量提高了62.8%。这进一步证明了opi1对肌醇生物合成的负反馈作用,敲除opi1能够更有效地促进酿酒酵母肌醇的合成。另外,摇瓶培养生长情况表明,opi1缺失菌株的生长速率要比YI2-1ΔKP菌株低。这可能因为Opi1不仅调控肌醇生物合成,Opi1作为转录调控因子还调控多个基因[14],opi1缺失对菌株细胞有一定的影响[26]。但与出发菌株相比,重组菌YI2-1Δopi1活力还是比较强的。这可能是由于肌醇作为PI (磷脂酰肌醇)的前体物及酵母生长因子,能够增强细胞活力[27],弥补了其缺失。
Hisashi等[12]研究构建的产肌醇酿酒酵母工程菌株时,利用合成培养基进行通气培养(1.2 L/min,680 r/min),其肌醇生产强度为4.0 g/(L·d)。Konishi等[28]研究发现通过增强肌醇单磷酸酶活性,这样的转化体的肌肉肌醇生产能力大幅提高,导入了肌醇单磷酸酶基因的菌株AKC-018,其肌肉肌醇产量为1.84 g/L,该菌株中的肌醇单磷酸酶活性的亢进使得肌肉肌醇生产率与对照相比提高了1.5−5.0倍。本研究构建的生物安全的肌醇产生菌YI2-1Δopi1与上述研究者相比,在肌醇产量上还不够理想,还存在一些差距。这可能是由于培养基对发酵结果有较大影响[10],而本研究为初步发酵培养,所用发酵培养基简单,培养方式为摇瓶分批培养。因此,在后期的研究中还需要加强对培养基配方和发酵工艺的优化,以及进一步改造重组菌,如过表达肌醇单磷酸酶基因等,以期进一步提高重组菌株的肌醇产量。
| [1] |
Taylor M, Wilder H, Bhagwagar Z, et al. Inositol for depressive disorders[J]. Cochrane Database of Systematic Reviews, 2004(1): CD004049. DOI:10.1002/14651858.CD004049.pub2 |
| [2] |
Frej AD, Otto GP, Williams RS. Tipping the scales: Lessons from simple model systems on inositol imbalance in neurological disorders[J]. European Journal of Cell Biology, 2017, 96(2): 154-163. DOI:10.1016/j.ejcb.2017.01.007 |
| [3] |
Genazzani AD, Santagni S, Rattighieri E, et al. Modulatory role of D-chiro-inositol (DCI) on LH and insulin secretion in obese PCOS patients[J]. Gynecological Endocrinology, 2014, 30(6): 438-443. DOI:10.3109/09513590.2014.897321 |
| [4] |
Genazzani AD, Santagni S, Ricchieri F, et al. Myo-inositol modulates insulin and luteinizing hormone secretion in normal weight patients with polycystic ovary syndrome[J]. Journal of Obstetrics and Gynaecology Research, 2014, 40(5): 1353-1360. DOI:10.1111/jog.12319 |
| [5] |
Genazzani AD, Prati A, Despini G, et al. PCOS from Lifestyle to the Use of Inositol and Insulin Sensitizers[A]//Genazzani AR, Brincat M. Frontiers in Gynecological Endocrinology[M]. New York: Springer International Publishing, 2014: 59-67 http://link.springer.com/10.1007/978-3-319-03494-2_7
|
| [6] |
Vucenik I, Shamsuddin AM. Cancer inhibition by inositol hexaphosphate (IP6) and inositol: from laboratory to clinic[J]. The Journal of Nutrition, 2003, 133(11): 3778S-3784S. |
| [7] |
Gong X, Liu Y, Wang C, et al. Metabolic engineering of Saccharomyces cerevisiae for production of glucaric acid[J]. Chinese Journal of Biotechnology, 2017, 33(2): 228-236. 巩旭, 刘叶, 王毳, 等. 代谢工程改造酿酒酵母合成葡萄糖二酸[J]. 生物工程学报, 2017, 33(2): 228-236. |
| [8] |
Huang ZJ, Chen YQ. Advances in microbial production of inositol[J]. Science and Technology of Food Industry, 2015, 36(16): 384-389. 黄贞杰, 陈由强. 微生物法生产肌醇研究进展[J]. 食品工业科技, 2015, 36(16): 384-389. |
| [9] |
Yamaoka M, Osawa S, Morinaga T, et al. A cell factory of Bacillus subtilis engineered for the simple bioconversion of myo-inositol to scyllo-inositol, a potential therapeutic agent for Alzheimer's disease[J]. Microbial Cell Factories, 2011, 10: 69. DOI:10.1186/1475-2859-10-69 |
| [10] |
Liu WB, Jin YK, You S. Current situation and development of the study on preparation methods of myo-inositol[J]. Journal of Shenyang Pharmaceutical University, 2012, 29(3): 234-240. 刘文宝, 金玉坤, 游松. 肌醇制备方法的现状与进展[J]. 沈阳药科大学学报, 2012, 29(3): 234-240. |
| [11] |
Zhang HC, Chi ZM, Yu DK, et al. Efects of ino1 gene expression in Schizosaccharomyces pombe on invertase secretion and phosphoinositol (PI) synthes[J]. Journal of Shandong University (Natural Science), 2002, 37(6): 544-547, 551. 张厚程, 池振明, 于典科, 等. ino1基因在粟酒裂殖酵母中的表达及对蔗糖酶分泌和磷脂合成的影响[J]. 山东大学学报:理学版, 2002, 37(6): 544-547, 551. |
| [12] |
Hisashi S, Yusuke M, Rie T. Microorganism producing inositol with high yield, and method for manufacturing inositol by using same: WO, 2013125666 A1[P]. 2013-08-29 http://www.freepatentsonline.com/WO2013125666.html
|
| [13] |
Konishi K, Imazu S, Sato M. Method for producing myo-inositol and myo-inositol derivative: CN, 104271756 A[P]. 2015-01-07
|
| [14] |
Santiago TC, Mamoun CB. Genome expression analysis in yeast reveals novel transcriptional regulation by inositol and choline and new regulatory functions for Opi1p, Ino2p, and Ino4p[J]. Journal of Biological Chemistry, 2003, 278(40): 38723-38730. DOI:10.1074/jbc.M303008200 |
| [15] |
Henry SA, White MJ. Inositol-excreting yeast: US, 5599701 A[P]. 1997-02-04
|
| [16] |
Huang ZJ, Chen L, Zhang JS, et al. Cloning of Scino1 gene and construction of yeast multi-copy integration expression vector[J]. Journal of Fujian Normal University (Natural Science Edition), 2012, 28(6): 100-105. 黄贞杰, 陈玲, 张积森, 等. Scino1基因克隆及酵母多基因多拷贝整合表达载体的构建[J]. 福建师范大学学报:自然科学版, 2012, 28(6): 100-105. |
| [17] |
Huang ZJ, Chen YQ, Chen LX, et al. Construction of genetically engineered Saccharomyces cerevisiae for inositol production[J]. Microbiology China, 2016, 43(7): 1540-1546. 黄贞杰, 陈由强, 陈丽霞, 等. 产肌醇酿酒酵母基因工程菌的构建[J]. 微生物学通报, 2016, 43(7): 1540-1546. |
| [18] |
Gueldener U, Heinisch J, Koehler GJ, et al. A second set of loxP marker cassettes for Cre-mediated multiple gene knockouts in budding yeast[J]. Nucleic Acids Research, 2002, 30(6): e23. DOI:10.1093/nar/30.6.e23 |
| [19] |
Xu ZW, Zhang Y, Wang ZX, et al. A highly efficient protocol for transformation of Saccharomyces cerevisiae and Pichia pastoris by electroporation[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2010, 49(3): 98-101. |
| [20] |
Babazadeh R, Jafari SM, Zackrisson M, et al. The Ashbya gossypii EF-1α promoter of the ubiquitously used MX cassettes is toxic to Saccharomyces cerevisiae[J]. FEBS Letters, 2011, 585(24): 3907-3913. DOI:10.1016/j.febslet.2011.10.029 |
| [21] |
Kagiwada S, Zen R. Role of the yeast VAP homolog, Scs2p, in ino1 expression and phospholipid metabolism[J]. Journal of Biochemistry, 2003, 133(4): 515-522. DOI:10.1093/jb/mvg068 |
| [22] |
Wang Y, Liu TB, Delmas G, et al. Two major inositol transporters and their role in cryptococcal virulence[J]. Eukaryotic Cell, 2011, 10(5): 618-628. DOI:10.1128/EC.00327-10 |
| [23] |
Ye CQ, Bandara WMS, Greenberg ML. Regulation of inositol metabolism is fine-tuned by inositol pyrophosphates in Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 2013, 288(34): 24898-24908. DOI:10.1074/jbc.M113.493353 |
| [24] |
Henry SA, Gaspar ML, Jesch SA. The response to inositol: regulation of glycerolipid metabolism and stress response signaling in yeast[J]. Chemistry and Physics of Lipids, 2014, 180: 23-43. DOI:10.1016/j.chemphyslip.2013.12.013 |
| [25] |
Kliewe F, Engelhardt M, Aref R, et al. Promoter recruitment of corepressors Sin3 and Cyc8 by activator proteins of the yeast Saccharomyces cerevisiae[J]. Current Genetics, 2017, 63(4): 739-750. DOI:10.1007/s00294-017-0677-8 |
| [26] |
Luévano-Martínez LA, Appolinario P, Miyamoto S, et al. Deletion of the transcriptional regulator opi1p decreases cardiolipin content and disrupts mitochondrial metabolism in Saccharomyces cerevisiae[J]. Fungal Genetics and Biology, 2013, 60: 150-158. DOI:10.1016/j.fgb.2013.03.005 |
| [27] |
Hong ME, Lee KS, Yu BJ, et al. Identification of gene targets eliciting improved alcohol tolerance in Saccharomyces cerevisiae through inverse metabolic engineering[J]. Journal of Biotechnology, 2010, 149(1/2): 52-59. |
| [28] |
Konishi K, Imazu S, Sato M. Method for producing myo-inositol and myo-inositol derivative: US, 20160194667[P]. 2016-07-07
|
 2017, Vol. 44
2017, Vol. 44




