扩展功能
文章信息
- 王洋, 李文龙, 刘恩, 王瑜, 霍苏馨, 白文成, 高玉敏, 韩润林
- WANG Yang, LI Wen-Long, LIU En, WANG Yu, HUO Su-Xin, BAI Wen-Cheng, GAO Yu-Min, HAN Run-Lin
- 铜绿假单胞菌二氢硫辛酸酰胺脱氢酶的重组表达及其与脂蛋白(a)的相互作用
- The interaction between lipoprotein (a) and recombinant dihydrolipoamide dehydrogenase derived from Pseudomonas aeruginosa
- 微生物学通报, 2017, 44(1): 172-177
- Microbiology China, 2017, 44(1): 172-177
- DOI: 10.13344/j.microbiol.china.160093
-
文章历史
- 收稿日期: 2016-01-26
- 接受日期: 2016-04-06
- 优先数字出版日期(www.cnki.net): 2016-04-20
2. 内蒙古农业大学兽医学院 内蒙古 呼和浩特 010018;
3. 内蒙古农业大学 血浆脂蛋白免疫学研究中心 内蒙古 呼和浩特 010018;
4. 内蒙古医科大学公共卫生学院 内蒙古 呼和浩特 010059
2. College of Veterinary Medicine, Inner Mongolia Agriculture University, Hohhot, Inner Mongolia 010018, China;
3. Research Center of Plasma Lipoprotein Immunology, Inner Mongolia Agriculture University, Hohhot, Inner Mongolia 010018, China;
4. School of Public Health, Inner Mongolia Medical University, Hohhot, Inner Mongolia 010059, China
HAN Run-Lin, E-mail: han-runlin@163.com.
铜绿假单胞菌(Pseudomonas aeruginosa)原名绿脓杆菌,在自然界中分布极其广泛。铜绿假单胞菌是医院中最为常见的条件致病菌之一,若宿主正常的防御机制发生改变或受到破坏,如皮肤粘膜损坏、烧伤等,就容易引发病原菌的感染[1],甚至可能导致患者死亡。
近年来,很多研究表明P. aeruginosa可以通过与宿主纤溶酶原(Plasminogen,Plg)结合,提高其穿越宿主组织屏障的能力[2]。Plg是一种相对分子质量为90 kD的纤维蛋白溶酶原,主要在肝脏中合成,最后分泌到血液中发挥作用。Plg分子中有5个连续的Kringle结构域,在这5个Kringle中均含有可以识别并结合Plg受体中赖氨酸残基,特别是羧基末端赖氨酸残基的赖氨酸结合位点(Lysine binding site,LBS)[3],且赖氨酸类似物6-氨基己酸(EACA)可以抑制Plg与受体的结合[4]。目前发现铜绿假单胞菌中存在很多Plg受体,如烯醇化酶样蛋白、表面翻译延长因子(Tuf)、二氢硫辛酸酰胺脱氢酶(Lpd)等。
1963年研究者在人类血浆中发现了脂蛋白(a)[5],但到目前为止其生理作用仍然不清楚。有研究表明Lp (a)可能是心血管疾病的一种危险因子[6]。Lp (a)是由一分子载脂蛋白(a) [Apolipoprotein (a),Apo (a)]和一分子低密度脂蛋白通过二硫键连接形成的脂蛋白[7],Apo (a)的cDNA序列与Plg有极高的相似性[8],两者都有Kringle结构域。不同的是,Apo (a)中没有与Plg的K1、K2、K3相应的序列,但是有多个与Plg的K4结构域相似的重复单位(KIV1−10),其中KIV10中同样含有一个强的LBS[9]。根据Lp (a)的这一特性,本实验室认为Lp (a)可能会抑制病原微生物利用宿主Plg入侵宿主机体,即Lp (a)的抗感染假说[10]。到目前为止,本实验室已经证明了Lp (a)可以与多种病原微生物表面的Plg受体特异性结合,包括金黄色葡萄球菌次黄嘌呤单核苷酸脱氢酶[11],A群链球菌三磷酸甘油醛脱氢酶[12]、烯醇化酶[13]及流感嗜血杆菌天冬氨酸酶[14]、F蛋白[15]等。
本研究中,我们对rLpd与Lp (a)的相互作用及其分子机制进行了初步研究,证明了Lpd可能是Lp (a)的另一个受体,Lp (a)能够对Lpd与Plg的结合起到显著的抑制作用,这可能为Lp (a)抗感染机制提供了新的依据。
1 材料与方法 1.1 菌株及培养基铜绿假单胞菌P. aeruginosa CMCC 10104购自中国菌种保藏中心;表达载体pGEX-6p-1购买于上海林渊生物科技有限公司;大肠杆菌感受态E. coli BL21购自上海生工生物科技有限公司。LB培养基(g/L):Trypton 10.0,Yeast extract 5.0,NaCl 5.0,Agar (固体) 10.0。
1.2 主要试剂和仪器菌株基因组DNA提取试剂盒购买于北京天根生物科技有限公司;Plg、鼠抗人纤溶酶原单抗、驴抗人IgG-HRP购自R & D Systems;Lp (a)、羊抗人Apo (a)多抗购自Biomedical Technologies Inc公司;低密度脂蛋白(Low-density lipoprotein,LDL)购自Chemicon公司;6-氨基己酸(6-Aminocaproic acid,EACA)、羊抗人LDL多抗购自Sigma公司;山羊抗鼠IgG-HRP购自北京博奥森生物科技有限公司;Pierce®Glutathione Agarose、GST-probe-HRP、Pierce®BCA蛋白测定试剂盒购自Thermo公司;Prescission protease (切GST标签)、引物合成、基因测序均购自上海生工生物工程股份有限公司。
TC-25/H基因扩增仪,博日科技有限公司;ZHJH-1112B垂直流超净台,Bio Tek;5810R台式冷冻离心机,EPPENDORF;可调微量移液器,EPPENDORF;DYCP-31DN蛋白电泳槽、DYCP-24D核酸电泳槽、DYY-12电脑三恒多用电泳仪,北京六一仪器厂;PB-10 pH计,赛多利斯科学仪器有限公司;TE70X半干转膜仪,Hoefer;湿转仪,Bio-Rad;Fine-dox3全自动凝胶图像分析仪,上海天能科技有限公司。
1.3 重组质粒的构建挑取少量P.aeruginosa CMCC 10104冻存菌株于LB固体平板上划线,放入37 ℃培养箱中过夜活化,第二天挑取单菌落于液体LB培养基中37 ℃、200 r/min培养至OD600在0.6-0.8之间,提取菌株基因组。以其基因组为模板,使用表 1中引物分别对目的基因进行PCR扩增。扩增条件:94;94;62;72;30个循环;72。PCR体系(50μL):2×Ultra-pfu PCR MIX 25 μL,基因组DNA 2 μL,Lpd F (5 μmol/L)1 μL,Lpd (Lpd-K476A、Lpd-K477A、LpdΔKKR) R (5 μmol/L)1 μL,ddH2O 21 μL。
| Primers | Sequence (5′→3′) | PCR product (bp) |
| F: CGCGGATCCATGAGCCAGAAATTCGACGTGGT | ||
| Lpd | R: ATTTGCGGCCGCTCAGCGCTTCTTGCGGTTGGCGAT | 1 437 |
| Lpd-K476A | R: ATTTGCGGCCGCTCAGCGCTTTGCGCGGTTGGCGAT | 1 437 |
| Lpd-K477A | R: ATTTGCGGCCGCTCAGCGTGCCTTGCGGTTGGCGAT | 1 437 |
| LpdΔKKR | R: ATTTGCGGCCGCTCAGCGGTTGGCGATGTGGATGGC | 1 431 |
用1%琼脂糖凝胶电泳对产物进行鉴定,然后使用BamH I、Not I对PCR产物及质粒进行酶切,条件为37酶切后的产物经切胶回收纯化后,使用T4连接酶进行连接,构建pGEX-6p-1-rLpd、pGEX-6p-1-rLpdK476A、pGEX-6p-1-rLpdK477A及pGEX-6P-1-rLpdΔKKR重组表达载体。将构建好的重组质粒转入E. coli BL21感受态细胞,经菌落PCR及测序鉴定为阳性的菌株保存。
1.4 重组蛋白的表达纯化及GST标签切除进行重组蛋白的诱导表达,并通过亲和层析进行蛋白纯化,使用Prescission Protease切除GST标签,BCA测定蛋白浓度[15]。
1.5 酶联免疫吸附试验(ELISA)检测重组蛋白rLpd、rLpd-K476A、rLpd-K477A、rLpdΔKKR与Lp (a)、LDL及Plg的结合将4种重组蛋白分别用PBS (pH 7.4)稀释至20 g/L,加入酶标板中,包被90 min,以PBS作为阴性对照;包被结束后,TBST (200 μL/孔)洗板3次,加入1% BSA-TBST封闭;洗涤酶标板3次,各孔加入相应蛋白[Lp (a) 100 ng、LDL 100 ng、Plg 100 ng]孵育90 min;洗板3次后,加相应的一抗,室温孵育90 min;孵育结束洗涤酶标板3次,加入相应的二抗,室温下孵育90 min;加入四甲基联苯胺(TMB)显色5 min;加入终止液,测OD450处的吸光值。
1.6 rLpd及rLpdΔKKR与人血浆Lp (a)的亲和色谱层析实验(Pull down)分别向3根装入GST标签填料的亲和柱中加入100 μg的rLpd、rLpdΔKKR及PBS (作为阴性对照),每个层析柱过1 mL血浆。然后用8个体积的Cleaver buffer冲洗未结合的杂蛋白。加入Prescission protease,4作用24 h。用3倍体积的Elution buffer冲洗目的蛋白收集于离心管中,分别做样进行Western blot,以人血浆为阳性对照。
1.7 ELISA检测EACA抑制rLpd与Lp (a)的结合在加入Lp (a) (1 000 μg/L)的同时加入浓度为0.3、0.5及1.0 mmol/L的EACA,实验所用一抗为羊抗人Apo (a) 1:4 000稀释,二抗为驴抗羊IgG-HRP 1:1 000稀释,其余试验方法与1.5相同。
1.8 ELISA检测Lp (a)抑制rLpd与Plg的结合实验加入Plg (1 000 μg/L)的同时,分别加入浓度为100、500及1 000 μg/L的Lp (a)。一抗为鼠抗人Plg 1:1 500,二抗为羊抗鼠IgG-HRP 1:3 000。其余试验方法与1.5相同。
2 结果与分析 2.1 基因克隆及重组蛋白的表达纯化以P. aeruginosa CMCC 10104菌株基因组为模板扩增的Lpd、Lpd-K476A、Lpd-K477A、LpdΔKKR基因经过1%琼脂糖凝胶电泳检测后,进行酶切、连接及转化,经菌落PCR及测序鉴定,重组表达载体中目的片段序列均与NCBI中的参考序列完全一致,表明成功构建了重组表达载体pGEX-6p-1-rLpd、pGEX-6p-1-rLpdK476A、pGEX-6p-1-rLpdK477A及pGEX-6P-1-rLpdΔKKR。然后进行诱导表达及纯化得到了纯度极高的rLpd、rLpd-K476A、rLpd-K477A和rLpdΔKKR。
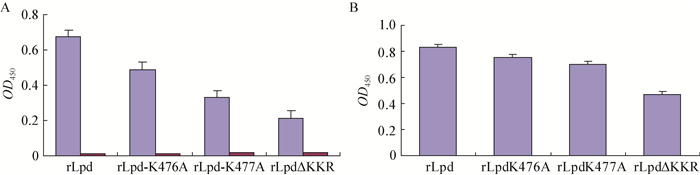
2.2 rLpd、rLpd-K476A、rLpd-K477A及rLpdΔKKR与Lp (a)、LDL及Plg的结合将4种重组蛋白纯化并切除GST标签后,ELISA检测其与Lp (a)、LDL及Plg的结合作用,结果表明(图 1),rLpd与Lp (a)结合,不与LDL结合(图 1A)。将第476、477位赖氨酸残基分别突变为A后与Plg及Lp (a)的结合值有一定程度的下降,与Lp (a)的结合值分别降低了27.6%和51.2%,将末端KKR全部敲除后结合值降低的效果更加明显,下降了68.2% (图 1A)。
|
| 图 1 ELISA检测rLpd、rLpd-K476A、rLpd-K477A、rLpdΔKKR与Lp (a)、LDL、Plg的结合 Figure 1 Interaction of rLpd, rLpd-K476A, rLpd-K477A and rLpdΔKKR with Lp (a), Plg and LDL detected by ELISA Note: A: ELISA detected the binding of rLpd, rLpd-K476A, rLpd-K477A, rLpdΔKKR to Lp (a) and LDL; B: ELISA detected the binding of rLpd, rLpd-K476A, rLpd-K477A, rLpdΔKKR to Plg. |
|
|
Western blot的结果显示(图 2),rLpd与Lp (a)结合,但是rLpdΔKKR与Lp (a)的结合能力大幅度下降,此结果与2.2 ELISA的结果相同。

|
| 图 2 Western blot检测rLpd及rLpdΔKKR与Lp (a)的结合 Figure 2 The binding of rLpd and rLpdΔKKR to Lp (a) detected by Western blot |
|
|
EACA抑制rLpd与Lp (a)结合的ELISA结果显示(图 3),一定浓度的EACA可以对rLpd与Lp (a)的结合起到抑制作用,当EACA的浓度为0.3、0.5和1.0 mmol/L时,rLpd与Lp (a)的结合值分别下降了26.8%、38.9%和66.4%。

|
| 图 3 EACA抑制rLpd与Lp (a)的结合 Figure 3 EACA inhibits the binding of rLpd to Lp (a) |
|
|
Lp (a)抑制rLpd与Plg结合的实验结果表明(图 4),一定浓度的Lp (a)可以对rLpd与Plg的结合起到显著的抑制作用。当加入的Lp (a)浓度为100、500、1 000 μg/L时,Lpd与Plg的结合值分别下降了10.1%、20.8%、29.6%。

|
| 图 4 Lp (a)抑制rLpd与Plg的结合 Figure 4 Lp (a) inhibits the binding of rLpd to Plg |
|
|
迄今为止,Lp (a)的生理功能仍不清楚。对Lp (a)的研究也主要集中在其与心脑血管疾病之间的联系。有报道表明Lp (a)可能具有修复伤口损伤、促进伤口愈合[11]等功能。以Lp (a)与Plg具有极高的相似性为基础,本实验室提出了Lp (a)抗感染假说,即Lp (a)可以竞争性地抑制病原菌与Plg的结合,进而阻止病原菌侵染宿主。
本研究结果表明,rLpd可以与Lp (a)结合但不与LDL结合(图 1),说明rLpd主要与Lp (a)中的Apo (a)结合。EACA可以显著地抑制rLpd与Lp (a)的结合(图 3),表明Lp (a)是通过LBS与rLpd进行特异性结合。Plg、Lp (a)中的赖氨酸结合位点(LBS)均可以与受体中的赖氨酸,特别是羧基末端的赖氨酸残基结合[9],因此Lpd第476、477两个赖氨酸很可能是其与Lp (a)的主要结合位点。将rLpd第476、477位赖氨酸分别突变为A后,rLpd与Lp (a)的结合有明显的降低,而敲除了476−478位氨基酸(KKR)的突变体与Lp (a)的结合值下降更加显著(图 1),说明Lpd第476、477两个赖氨酸残基是Lpd与Lp (a)的主要结合位点之一。亲和色谱层析实验也证实了上述结论。
P. aeruginosa可以通过与人Plg的结合提高其穿越宿主组织屏障的能力[2],而本研究发现Lp (a)可以竞争性抑制P. aeruginosa表面的Plg受体Lpd与Plg的结合(图 4)。本实验室已经证实,Lp (a)可以抑制A群链球菌[16]、金黄色葡萄球菌[17]与Plg的结合。因此Lp (a)很可能竞争性抑制P. aeruginosa与Plg的结合,发挥抵抗细菌感染的作用。因此,本文的结果可能为Lp (a)抗感染功能提供了新的佐证。
然而,Lp (a)仅能部分抑制Plg与其细菌表面受体之间的相互作用,一般不超过50%。主要是因为Plg不仅可以与其受体C末端的赖氨酸残基结合,也可以与受体肽链内部的某个(些)赖氨酸残基相结合。例如,Plg不仅可以与A群链球菌表面烯醇化酶C末端434和435位的赖氨酸残基特异性结合,也可以与肽链内部252和255位的两个赖氨酸残基结合[18],但Lp (a)只能与434和435位的赖氨酸残基结合[13]。本研究也发现了类似现象,但Lpd内部的哪个(些)氨基酸残基可以与Plg结合仍需要进一步的研究。另外,Lp (a)仅能有限抑制Plg与其细菌表面受体的结合,因此Lp (a)与细菌表面Plg受体的相互作用可能有另外的生理意义,这需要做进一步的研究。
| [1] | Tanideh N, Rokhsari P, Mehrabani D, et al. The healing effect of licorice on Pseudomonas aeruginosa infected burn wounds in experimental rat model[J]. World Journal of Plastic Surgery 2014, 3(2) : 99–106. |
| [2] | Ceremuga I, Seweryn E, Bednarz-Misa I, et al. Enolase-like protein present on the outer membrane of Pseudomonas aeruginosa binds plasminogen[J]. Folia Microbiologica 2014, 59(5) : 391–397. DOI:10.1007/s12223-014-0311-9 |
| [3] | Ji ZX, Han RL. Plasminogen might be a virulence factor in Staphylococcus aureus infection[J]. Chinese Bulletin of Life Sciences 2010, 22(5) : 449–453. (in Chinese) 纪智星, 韩润林. 纤溶酶原在金黄色葡萄球菌菌感染中的作用[J]. 生命科学 2010, 22(5) : 449–453. |
| [4] | Hallstr m T, M rgelin M, Barthel D, et al. Dihydrolipoamide dehydrogenase of Pseudomonas aeruginosa is a surface-exposed immune evasion protein that binds three members of the factor H family and plasminogen[J]. The Journal of Immunology 2012, 189(10) : 4939–4950. DOI:10.4049/jimmunol.1200386 |
| [5] | Berg K. A new serum type system in man-the Lp system[J]. Acta Pathologicaet Microbiologica Scandinavica 1963, 59 : 369–382. |
| [6] | Dahlén G, Frick MH, Berg K, et al. Further studies of Lp (a) lipoprotein/pre-beta1-lipoprotein in patients with coronary heart disease[J]. Clinical Genetics 1975, 8(3) : 183–189. |
| [7] | Xu SH. Apolipoprotein (a) binds to low-density lipoprotein at two distant sites in lipoprotein (a)[J]. Biochemistry 1998, 37(26) : 9284–9294. DOI:10.1021/bi9729662 |
| [8] | McLean JW, Tomlinson JE, Kuang WJ, et al. cDNA sequence of human apolipoprotein (a) is homologous to plasminogen[J]. Nature 1987, 330(6144) : 132–137. DOI:10.1038/330132a0 |
| [9] | Feric NT, Boffa MB, Johnston SM, et al. Apolipoprotein (a) inhibits the conversion of Glu-plasminogen to Lys-plasminogen: a novel mechanism for lipoprotein (a)-mediated inhibition of plasminogen activation[J]. Journal of Thormbosis and Haemostasis 2008, 6(12) : 2113–2120. DOI:10.1111/jth.2008.6.issue-12 |
| [10] | Han RL. Plasma lipoproteins are important components of the immune system[J]. Microbiology and Immunology 2010, 54(4) : 246–253. DOI:10.1111/mim.2010.54.issue-4 |
| [11] | Xu Y, Ji ZX, Han RL. The interaction between lipoprotein (a) and recombinant inosine 5′-monophosphate derived from Staphylococcus aureus[J]. Microbiology China 2011, 38(9) : 1405–1411. (in Chinese) 许颖, 纪智星, 韩润林. 重组金黄色葡萄球菌次黄嘌呤单核苷酸脱氢酶与脂蛋白(a)的相互作用[J]. 微生物学通报 2011, 38(9) : 1405–1411. |
| [12] | Dai XY, Xu LP, Bai WC, et al. The interaction between lipoprotein (a) and recombinant glyceraldehyde-3-phosphate dehudrogenase derived from group A Streptococcus[J]. Journal of Inner Mongolia Agricultural University 2011, 32(3) : 27–31. (in Chinese) 代霄燕, 许丽萍, 白文成, 等. 重组A群链球菌三磷酸甘油醛脱氢酶与脂蛋白(a)的相互作用[J]. 内蒙古农业大学学报 2011, 32(3) : 27–31. |
| [13] | Xu LP, Bai WC, Ji ZX, et al. Lipoprotein (a) binds to C-terminal lysine residues of recombinant enolase derived from group A Streptococcus[J]. American Journal of Clicinal and Experimental Medicine 2015, 3(5) : 327–331. DOI:10.11648/j.ajcem.20150305.33 |
| [14] | Li WL, Xu LP, Zhang YK, et al. Lipoprotein (a) binds to recombinant notypeable Haemophilus influenzae aspartase[J]. American Journal of Clicinal and Experimental Medicine 2015, 3(5) : 314–321. DOI:10.11648/j.ajcem.20150305.31 |
| [15] | Liu E, Li WL, Han RL. The interaction between recombinant protein F derived from nontypeable Haemophilus influenzae and lipoprotein (a)[J]. American Journal of Clinical and Experimental Medicine 2015, 3(6) : 338–343. DOI:10.11648/j.ajcem.20150306.11 |
| [16] | Xu LP, Gao YM, Liang CW, et al. The interaction between plasma lipoprotein (a) and group A Streptococcus[A]//The Abstract Corpus of Chinese Society For Microbiology Academic Annual Meeting[C]. Zhangjiajie: Chinese Society of Microbiology, 2009: 46-47 (in Chinese) 许丽萍, 高玉敏, 梁纯伟, 等. A群链球菌与血浆脂蛋白的相互作用[A]//中国微生物学会学术年会论文摘要集[C].张家界:中国微生物学会, 2009: 46-47 |
| [17] | Gao YM, Zhao RD, Li LM, et al. Lipoprotein (a) might inhabit the interaction between plasminogen and Staphylococcus aureus[A]//The 9th China Lipoproteins Academic Conference Dissertation Collection[C]. Shanghai: Chinese Society of Biochemistry and Molecular Biology, 2008 (in Chinses) 高玉敏, 赵瑞东, 李立民, 等.脂蛋白(a)抑制金黄色葡萄球菌激活纤溶酶原的初步研究[A]//第四届全国血脂分析与临床学术研讨会暨第九届全国脂蛋白学术会议论文汇编[C].上海:中国生物化学与分子生物学会, 2008 |
| [18] | Cork AJ, Jerqic S, Hammerschmidt S, et al. Defining the structural basis of human plasminogen binding by streptococcal surface enolase[J]. The Journal of Biological Chemistry 2009, 284(25) : 17129–17137. DOI:10.1074/jbc.M109.004317 |
 2017, Vol. 44
2017, Vol. 44