扩展功能
文章信息
- 刘博, 杜海, 王雪山, 徐岩
- LIU Bo, DU Hai, WANG Xue-Shan, XU Yan
- 基于高通量测序技术解析浓香型白酒中窖泥臭味物质4-甲基苯酚的来源
- Detecting source of p-cresol in strong flavor Chinese liquor by high throughput sequencing
- 微生物学通报, 2017, 44(1): 108-117
- Microbiology China, 2017, 44(1): 108-117
- DOI: 10.13344/j.microbiol.china.160087
-
文章历史
- 收稿日期: 2016-01-25
- 接受日期: 2016-04-05
- 优先数字出版日期(www.cnki.net): 2016-04-18
浓香型白酒最具特色的生产工艺之一是采用泥窖发酵[1]。窖池作为酒醅发酵容器,提供厌氧环境,其中的窖泥提供了大量酿造用菌,产生许多对酒体有贡献的风味物质[2-3]。然而,一些不好的风味如窖泥臭味物质也随之产生进入酒体[4]。由窖泥引起的不良风味以及异味影响到了酒体品质,特别是对高档白酒风味感官影响尤为明显。目前,泥窖对浓香型类白酒的影响,特别是对白酒风味的负面影响并未被详细、系统的论述。
根据国内学者的研究,白酒、窖泥中多数的酸、酯、醇、酚等挥发性风味组分都有较成熟的定性定量方法[5-6]。徐岩团队检测窖泥中的可挥发性组分后,应用现代分离与风味研究技术,确认产生窖泥臭的化合物是4-甲基苯酚(p-cresol),并测定该物质在46% vol酒精水溶液中的嗅觉阈值为166.97 μg/L[7-8]。4-甲基苯酚感官描述为窖泥臭、皮革臭、焦皮臭、动物臭[8]。朱燕等检测酒中酚类物质时,在浓香、清香、酱香型白酒中均检测到4-甲基苯酚,其中浓香型白酒中该物质的含量可达1 196 μg/L,明显高于其它香型[9]。浓香型白酒酿造采用固态发酵,所用的大曲、窖泥均为混菌体系,菌系复杂。窖泥中细菌菌群主要涵盖6个门,其中厚壁菌门又可分为梭菌纲、芽孢杆菌纲、柔膜菌纲,若细分为种属则种类更多[10-11]。另外,窖泥中含有丰富的酸类、酯类、醇类等风味物质,也是一个极复杂的混合体系[7]。如何从复杂的群落结构确定目标代谢物的来源一直是一大难题。以往只能通过可培养方式确定微生物与风味的代谢关系,但某些微生物难以培养且难以确定单一微生物在复杂的体系中对某一风味的贡献度。窖泥微生物体系复杂,通过可培养技术可初步了解其中的微生物群落结构。传统的可培养技术具有成本低、易于研究微生物生理生化特征等优势。但由于培养基与自然环境之间的营养差异,大量微生物无法培养。因此,可培养技术得到的结果常与未培养技术得到的结果往往存在较大差异。解析复杂的微生物体系依赖于研究技术的进步,基于分子生物学的未培养技术的出现提供了一条解决途径。针对白酒固态发酵中复杂的微生物群落结构解析,研究已经从传统的可培养技术逐渐演变到变性梯度凝胶电泳(PCR-DGGE)技术[12]、rRNA基因克隆文库技术[13]。新近发展的高通量测序适合整个基因组分析,与白酒酿造复杂的微生物体系研究需求相契合。高通量测序的优势在于:(1) 通量高,可以得到0.035−1 800 Gb的数据信息[14];(2) 准确率高(≥98.5%),同时也有效地解决了多聚重复序列的读取问题[15];(3) 全面客观地揭示目标环境中微生物群落信息,同时获得定性及相对定量信息[16]。
4-甲基苯酚是产生窖泥臭的主要化合物,明确原料来源及微生物来源是有效控制其含量提升酒质的基础。但白酒酿造中微生物群落结构及风味组分复杂,微生物与风味之间并非简单的一一对应关系,这给问题的解决造成极大困扰;而且窖泥微生物需要严苛的厌氧操作及菌株分离条件更增加了解决问题的难度。
针对以上研究现状及科学问题,本研究通过酿造原料的可挥发性物质分析,明确浓香型白酒酿造过程中4-甲基苯酚的原料来源。运用高通量测序技术解析窖泥中微生物群落结构,初步判定可能产4-甲基苯酚微生物的属,同时结合可培养技术对代谢产生4-甲基苯酚的微生物进行分离和判定。最后通过高通量测序与可培养技术结果比对确定分离的菌在窖泥中的含量,以此来明确窖泥中单菌种对4-甲基苯酚产生的贡献度。
1 材料与方法 1.1 材料样品来源:样品取自湖南某白酒厂。窖壁上部窖泥取样点距地面约0.2 m,窖壁中部窖泥取样点距地面约1 m,窖底窖泥取样点距地面约2 m。上述窖泥取样点分别从四壁中点取样,每个点取约100 g,并混匀作为一个样品,取3个窖池作为平行样。窖底窖泥样品采用五点取样法取自窖池窖底窖泥,每个点取约100 g,然后混匀作为一个样品,取3个窖池作为平行样。糖化料取自高粱加入小曲发酵后的结束点,随机取3个批次,每次取约200 g。大曲粉取自粉碎后待用的大曲,随机取3份样品,每份约200 g。样品分4 ℃和−20 ℃保存,分别用于菌株分离和风味物质检测。
1.2 试剂和培养基用于GC-MS分析的无水乙醇(纯度99%),3, 4-二甲基苯酚(纯度≥98%,内标)均为色谱级,购自美国Sigma公司;酵母浸膏、蛋白胨购自英国Oxoid公司;无水葡萄糖、乙酸钠、硫酸铵、硫酸钠、氯化钠和酪氨酸购自上海国药集团化学试剂公司。
产4-甲基苯酚微生物分离培养基(g/L):酵母膏5.0,蛋白胨5.0,乙酸钠6.0,磷酸氢二钾0.40,硫酸镁0.20,硫酸铵0.50,乙醇20 mL/L[17]。
1.3 主要仪器设备厌氧培养箱(BUG BOX)购自英国Ruskinn公司;pH计购自Mettler Toledo公司;超声波清洗仪购自天津Autoscience公司;气相色谱质谱联用仪GC 6890N-MSD 5975购自美国Agilent公司;厌氧试管、厌氧瓶购自贝思特实验耗材部;Beadbeater细胞破碎仪购自Biospec公司;透射电镜购自HITACHI公司H-7650型号;50/30 μm DVB/CAR/PBDS萃取头购自美国Supelco公司。
1.4 实验方法 1.4.1 窖泥、曲粉、糖化料样品的处理: 窖泥、曲粉、糖化料:取2 g样品,加入20 mL超纯水,振荡混匀后,超声浸提30 min,8 000 r/min离心10 min。取上清,顶空瓶加入3 g NaCl,取8 mL装入20 mL顶空瓶待测。 1.4.2 发酵液样品处理: 培养7 d后,8 000 r/min离心10 min,取上清,顶空瓶加入3 g NaCl,取8 mL装入20 mL顶空瓶待测。 1.4.3 GC-MS条件: 参照朱燕等[9]测定4-甲基苯酚的方法,优化部分参数而成。 萃取条件:DVB/CAR/PBDS萃取头萃取45 min,萃取温度为45 ℃。 GC条件:进样口温度250 ℃,载气He,流速2 mL/min,不分流进样,色谱柱为CP-Wax (60 m×0.25 m mi.d.×0.25 μm,J & W Scientific)。检测时的升温程序:50 ℃恒温2 min,以6 ℃/min的速度升温至230 ℃,保持15 min。MS条件:EI电离源,电子能量70 eV,离子源温度230 ℃,扫描范围30.00−50.00 amu。质谱分析用数据库来源于NIST05a.L (Agilent公司)。 1.4.4 标准溶液的配制: 分别准确称取一定量的标准品各溶于一定体积色谱纯乙醇中配成单标溶液,分别吸取一定体积的单标溶液于50 mL容量瓶中,用超纯水定容至刻度线。分别用超纯水及培养基稀释配制成一系列质量浓度梯度的混合标准溶液。每一质量浓度梯度的混合标准溶液中均加入10 μL终质量浓度为0.20 mg/L的内标(3, 4-二甲基苯酚)并加3 g氯化钠饱和,依次对每一质量浓度梯度的混合标准溶液进行顶空固相微萃取。 1.4.5 窖泥基因组的提取: 采用玻璃珠细胞破碎仪破碎细胞,苯酚氯仿抽提方法提取窖泥细菌基因组,具体方法参照文献[18]。 1.4.6 窖泥菌群结构分析: 窖泥提取基因组后,经IlluminaMiSeq测序,得到种属信息。测序所用的引物序列为515F (5′-GTGCCAGCMGCCGCG GTAA-3′)和806R (5′-NNNNNNNNNNNNGGACT ACHVGGGTWTCTAAT-3′,其中N为Barcode序列碱基)[19]。该引物针对细菌和古细菌16S rRNA基因序列中的V3、V4可变区进行扩增。 1.4.7 厌氧菌筛选: 所用主要工具包括厌氧管、厌氧瓶、注射器、厌氧培养箱。培养基灭菌后放入厌氧培养箱中除氧1 d,用注射器接种。5 g窖泥悬于100 mL 0.9% NaCl溶液,在固体培养基涂布后,放于厌氧培养箱37 ℃培养3 d;划线得到单菌落后挑选单菌落于12 mL液体培养基中,每块平板挑选3个平行,在37 ℃的厌氧培养箱中培养3 d;发酵液经8 000 r/min离心10 min后取上清液8 mL,经顶空微萃取-气相色谱-质谱联用(HS-SPME-GC-MS)技术测定其中的可挥发性风味。然后提取基因组,测定保守区域16S rRNA基因序列,与GenBank中的序列比对后确定种属,PCR用的引物序列为27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTA CGACTT-3′)[20]。 2 结果与分析 2.1 原酒中4-甲基苯酚的原料来源酿造过程中,高粱等粮食清蒸后加入小曲糖化制成糖化料,糖化料拌入大曲粉,移至窖池后在大曲和窖泥微生物的作用下发酵,窖池中的发酵物称为酒醅,酒醅发酵结束后蒸馏得到原酒。根据工艺流程判断,4-甲基苯酚主要可能来源于糖化料、大曲、窖泥。为了确定原酒中4-甲基苯酚的来源,检测上述样品中的4-甲基苯酚含量。
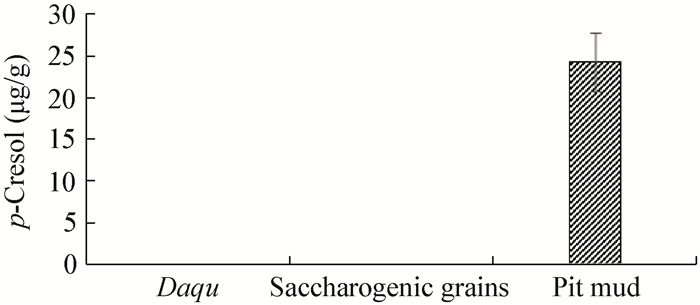
如图 1所示,大曲与糖化料中中的4-甲基苯酚浓度均低于检测限0.89 μg/kg。窖泥中检测到4-甲基苯酚,并且窖池由上部到下部,4-甲基苯酚含量逐渐升高。窖池底部窖泥含量最高,达到24.24 μg/g。由此推测窖泥是4-甲基苯酚的主要来源。
|
| 图 1 大曲、糖化料和窖泥中4-甲基苯酚的检测 Figure 1 p-Cresol concentration in Daqu, saccharogenic grains and pit mud |
|
|
白酒风味与酿造微生物的种类以及结构密切相关。已有研究显示,窖泥中细菌OTUs个数为1 183,而真菌OTUs个数仅为64[21]。此外,已有研究表明酒醅中细菌的种类及数量也明显多于真菌[22]。目前,研究学者已发现的产4-甲基苯酚的菌株较少,并且都属于细菌,如Clostridium difficile[23]。因此,本研究主要针对浓香型白酒酿造中的细菌菌群进行研究。
糖化料中添加的小曲为纯种根霉。大曲中细菌主要是嗜热芽孢杆菌,包括枯草芽孢杆菌和地衣芽孢杆菌[24]。根据图 1推断,糖化料和大曲中的微生物不会产生4-甲基苯酚。窖泥中的细菌主要包括6个门,其中厚壁菌门为绝对优势细菌类群,占到总量的86.1%[25]。厚壁菌门中梭菌纲为绝对优势种群,主要包括产氢产酸细菌种属,如互营共养单胞菌属(Syntrophomonas)、喜热菌属(Caloramator)、梭菌属(Clostridium),常与产甲烷菌共生[26-28]。酒醅发酵是一个菌群及其代谢物质相互影响、转化的动态过程。在高粱等酿造原料提供了丰富营养物质的前提下,窖泥中微生物代谢产生4-甲基苯酚并随之流入酒体。
2.2 窖泥的菌群结构运用高通量测序技术测定窖池窖壁上部(U)、窖壁中部(M)、窖池底部(D)窖泥中细菌菌群结构,纲结构组成如图 2所示。检测的窖泥中主要包括8个已知纲,Bacteroidia、Clostridia、Methanomicrobia、Bacilli、Methanobacteria、Synergistia、Cloacamonae和Coriobacteriia。其中Bacteroidia、Clostridia和Methanobacteria含量较高。8个已知纲在窖池上中底部的含量并不尽相同。其中Clostridia和Methanomicrobia随窖池深度增加含量逐渐升高,而Methanobacteria含量有降低趋势,Bacteroidia在窖池中部含量最低。用Excel软件CORREL函数进行相关性分析,Clostridia和Methanomicrobia与4-甲基苯酚的相关系数分别为0.90及0.99。Clostridia和Methanomicrobia与4-甲基苯酚的相关性较高,因此推断Clostridia和Methanomicrobia产生4-甲基苯酚的可能性较大。

|
| 图 2 窖泥细菌菌群纲组成图 Figure 2 The class structure of bacteria in pit mud 注:U:窖壁上部窖泥样品;M:窖壁中部窖泥样品;D:窖池底部窖泥样品;Other:含量低于1%纲的和;Unclassified:含量大于1%,但是不确定纲的类别的和. Note: U: the upper pit mud in pits; M: the middle pit mud in pits; D: the bottom pit mud in pits; Other: sum of less than 1%; Unclassified: more than 1%, but unclassified. |
|
|
如表 1所示,窖泥中含量在0.01%以上的属有30个,在1%以上的属有11个,包括Clostridium、Methanobacterium、Methanosarcina等。其中Methanosarcina和Methanobacterium含量较高,各占总原核微生物含量4%以上,表明窖池厌氧条件较高,适宜厌氧菌生存。Clostridium是白酒酿造中的重要菌属,可产生己酸、乙酸等有益风味物质[26],其在窖池中含量由上部到底部从1.55%升高至4.89%,与4-甲基苯酚的含量变化趋势一致,其它与4-甲基苯酚变化趋势一致的属还有Methanosarcina和Methanoculleus。用Excel软件CORREL函数进行相关性分析,Clostridium、Methanosarcina和Methanoculleus与4-甲基苯酚的相关性系数分别为0.97、0.99和0.98。Clostridium、Methanosarcina和Methanoculleus与4-甲基苯酚的相关性较高。因此,Clostridium、Methanosarcina和Methanoculleus产4-甲基苯酚的可能性较大。Methanosarcina和Methanoculleus属于Methanomicrobia,根据目前已有研究,该类菌并无代谢4-甲基苯酚的现象。但是Methanosarcina和Methanoculleus与Clostridium互利共生,可促进产酸、产氢反应[29]。因此,Clostridium最可能与4-甲基苯酚产生密切相关。
| Genus | U | M | D |
| Methanosarcina | 3.51±0.90 | 7.00±3.49 | 13.23±1.52 |
| Methanobacterium | 23.68±11.02 | 25.31±5.84 | 4.90±2.60 |
| Clostridium | 1.55±0.91 | 1.57±0.40 | 4.89±2.83 |
| Syntrophomonas | 0.57±0.35 | 0.14±0.03 | 4.50±0.94 |
| Lactobacillus | 3.63±2.37 | 5.02±0.83 | 2.05±0.19 |
| Methanobrevibacter | 1.16±0.36 | 14.47±1.91 | 1.41±1.39 |
| Sedimentibacter | 0.81±0.38 | 0.28±0.04 | 1.18±0.52 |
| Methanoculleus | 0.07±0.02 | 0.14±0.09 | 1.13±0.76 |
| Ruminococcus | 3.57±2.59 | 12.16±5.64 | 1.09±0.49 |
| Caloramator | 0.21±0.09 | 1.23±0.20 | 0.26±0.11 |
| Prevotella | 9.61±16.54 | 0.11±0.06 | 0.05±0.02 |
| Other | 6.07±1.20 | 6.95±1.30 | 8.65±1.50 |
| Unclassified | 45.55±11.85 | 22.61±7.75 | 56.66±4.97 |
| 注:U:窖壁上部窖泥样品;M:窖壁中部窖泥样品;D:窖池底部窖泥样品;Uncalssified:高于1%,但是无法确定属类别的和;Other:含量低于1%属的和. Note: U: the upper pit mud in pits; M: the middle pit mud in pits; D: the bottom pit mud in pits; Unclassified: sum of more than 1%, but unclassified; Other: sum of less than 1%. |
|||
运用Hungate滚管法对窖泥中产4-甲基苯酚菌进行分离,通过初步菌落形态鉴别共分离到20株细菌,测定16S rRNA基因序列后与GenBank数据库比对确定种属,结果如表 2所示。
| 菌株 Strain |
相似菌株登录号 Similarity strain accession No. |
相似度 Similarity (%) |
窖泥中比例 Proportion in pit mud (%) |
4-甲基苯酚 p-Cresol (mg/L) |
| JG-1 | Lactobacillus buchneri CP002652.1 | 99 | * | - |
| JG-2 | Oscillibactervalericigenes NR_074793.1 | 99 | * | - |
| JG-3 | Bacillus thermoamylovorans NR_117028.1 | 99 | * | - |
| JG-4 | Rummeliibacilluspycnus NR_041521.1 | 99 | * | - |
| JG-5 | Clostridium sartagoforme NR_026490.1 | 99 | * | - |
| JG-C1 | Clostridium ultunense NR_026531.1 | 95 | 0.29±0.10 | 0.06±0.02 |
| JG-C2 | Clostridium purinilyticum NR_117121.1 | 91 | 0.23±0.08 | 0.45±0.11 |
| JG-C3 | Clostridium aminovalericum NR_113199.1 | 99 | 0.44±0.28 | 0.01±0.01 |
| 注: *:未比对;−:无. Note: *: No comparison; −: Not detected. |
||||
如表 2所示,从窖泥分离得到的微生物共属于8个种。JG-1、JG-2、JG-3、JG-4和JG-5发酵液经GC-MS检测,未检测到4-甲基苯酚。JG-1、JG-2和JG-3可产生4-甲基苯酚,且都属于梭菌属。其中,JG-C3和JG-C1可产生少量4-甲基苯酚,产量分别为0.01 mg/L和0.06 mg/L;JG-C2产量最高,达到0.45 mg/L。窖泥样品高通量测序结果显示,JG-1、JG-2和JG-3在窖泥中的相对含量都高于0.2%。上述3株菌在窖泥中含量较高,并且可产生4-甲基苯酚,极可能是4-甲基苯酚的重要微生物来源。JG-5也属于梭菌属,但代谢物中并未检测到4-甲基苯酚。因此,并非所有梭菌都产4-甲基苯酚。JG-C2与模式菌株的特异性只有91%,其为新种的可能性较大。
JG-C1、JG-C2和JG-C3进一步做透射电镜照片观察菌的形态,如图 3所示。三株菌都呈典型杆状,直径1 μm左右,长度在5 μm−10 μm之间。其中,JG-C3有典型梭菌属单端孢子特征。

|
| 图 3 JG-C1 (A)、JG-C2 (B)和JG-C3 (C)透射电镜照片 Figure 3 Transmission electron photomicrograph of JG-C1 (A)、JG-C2 (B) and JG-C3 (C) |
|
|
运用顶空固相微萃取技术(HS-SPME)结合GC-MS,定性定量可产4-甲基苯酚菌株的可挥发性风味组分,随后挑选峰面积大于4 000的进行共8种风味物质进行分析,如表 3所示。
| Compound | JG-C1 | JG-C2 | JG-C3 |
| p-Cresol | 0.06±0.02 | 0.45±0.11 | 0.01±0.01 |
| Ethyl butyrate | 0.13±0.03 | 0.14±0.03 | 0.10±0.02 |
| Ethyl valerate | 0.01±0.01 | - | - |
| Ethyl hexanoate | 0.17±0.02 | 0.22±0.05 | 0.47±0.14 |
| Acetic acid | 0.15±0.04 | 0.14±0.11 | 0.15±0.07 |
| 2-Ethyl hexanol | 0.57±0.12 | 0.56±0.14 | 0.44±0.07 |
| Benzaldehyde | 0.43±0.21 | 0.37±0.12 | 0.53±0.20 |
| Phenylethyl alcohol | 0.10±0.02 | 0.08±0.02 | 0.03±0.01 |
| 注:−:未检测到. Note: −: Not detected. |
|||
检测到的8种风味物质包括3种酯、2种醇、1种酸、1种醛、1种酚。除去4-甲基苯酚,其余7种风味都对白酒香味有正向贡献。其中,Ethyl butyrate和Ethyl hexanoate为浓香型白酒中的主体香味物质[30]。据徐岩团队检测,浓香型白酒成品酒中Ethyl butyrate含量约为65.85−621.60 mg/L,Ethyl hexanoate含量约为1 522.34−3 509.74 mg/L[30-31]。本研究筛选到的3株产4-甲基苯酚菌的主体呈香物质己酸乙酯和丁酸乙酯仅为0.17−0.47 mg/L和0.10−0.14 mg/L,远低于成品酒中的含量。因此,3株产4-甲基苯酚菌对浓香型白酒主体风味的影响有限。
然而白酒酿造过程中,微生物种类繁多,微生物之间存在复杂的相互作用,如目前研究较多的乳酸菌[32]、地衣芽孢杆菌和酿酒酵母[33]。窖池中微生物在动态平衡中相互协作、相互抑制,才形成具有典型浓香型白酒特征的风味物质。目前,产4-甲基苯酚的3株菌的总含量已占到窖泥细菌微生物的1%。因此,去除产4-甲基苯酚的菌种可能打破原微生物系统的平衡状态,对其它微生物的生长及风味产量产生影响。
3 讨论泥窖发酵是浓香型类白酒的特色生产工艺之一。窖泥与大曲、糖化料之间最大的环境差异在于氧气含量,窖池是封闭的环境,在长达40−60 d的发酵周期内氧气的含量极低,所以窖泥中多为厌氧微生物。4-甲基苯酚只在窖泥中检测到,而且窖池底部窖泥中4-甲基苯酚的含量约为上部的3倍。由此推断4-甲基苯酚的浓度与厌氧程度密切相关,4-甲基苯酚主要是由窖泥中的厌氧菌产生的。因窖池底部厌氧环境好于上部,导致窖池底部窖泥4-甲基苯酚的含量明显高于上部。
窖泥菌群结构复杂,高通量测序结果显示窖泥中细菌菌群相对含量在1%以上的有8个纲,11个属。其中,Bacteroidia、Clostridia和Methanobacteria是细菌中主要优势纲。这与张文学团队及Zhou团队用16S rRNA基因克隆文库及PCR-DGGE测得的窖泥细菌菌群结构相似[11, 34]。但高通量测序测得的结果更准确精细。16S rRNA基因克隆文库文库技术和PCR-DGGE只测得窖泥细菌菌群中含量较高的5个门,高通量测序可测得19个门,包括Planctomycetes、Tenericutes等含量较低的门。窖池中不同深度厌氧程度的不同直接导致了菌群结构的差异,菌群结构的差异导致风味的差异,因此窖池中产生4-甲基苯酚的菌群应与其有相同的变化趋势。窖泥中菌群结构虽然复杂,但与4-甲基苯酚变化规律相似的只有Clostridia和Methanomicrobia。Yue等[26]和Zhang等[34]研究表明Clostridia可产生大量的酸、酚、醛等风味物质,而Methanomicrobia则与Clostridia为互利共生关系,可促进产酸、产氢等各种反应[26, 34]。据此推测,Clostridia最可能是4-甲基苯酚的主要微生物来源。Clostridia中Clostridium与4-甲基苯酚有相同的变化趋势,且Clostridium在Clostridia中含量最高。国内外研究已发现的产4-甲基苯酚的菌株也属于梭菌属,如Clostridium difficile。因此Clostridium可能是4-甲基苯酚的主要微生物来源。
通过高通量测序测得窖池上中底部的菌群结构,结合4-甲基苯酚在窖池中的分布规律,分析得到最可能产4-甲基苯酚的属。下一步通过传统的可培养技术验证上述分析结果。通过厌氧可培养技术筛选得到3株产4-甲基苯酚菌,3株菌都属于Clostridium。研究学者发现Clostridium ultunense、Clostridium purinilyticum、Clostridium aminovalericum可利用乙酸、氨基酸产生氢气、甲烷等[35-37],但尚未发现可产生4-甲基苯酚。窖泥中部分梭菌并不产4-甲基苯酚,如Clostridium sartagoforme。可培养技术得到的产4-甲基苯酚的单菌种与高通量测序结果进行比对,发现3个菌种含量都在0.20%以上。Clostridium在窖池底部中的含量达到了4.89%,3个产4-甲基苯酚的菌种在窖泥中总含量也达到1%,有足够的数量基础产生4-甲基苯酚。综上可明确Clostridium是窖泥中4-甲基苯酚的主要微生物来源。
产4-甲基苯酚的菌株也可产生少量酸、醇、醛等对香味有贡献的物质,但对白酒主体呈香风味影响很小。在明确4-甲基苯酚主要微生物来源及代谢途径的基础上,可以试用以下方法控制其在酒中的含量:选用低前体含量的酿造原料;优化发酵工艺,缩短发酵周期,控制酒醅与产4-甲基苯酚微生物的接触时间;代谢工程改造产4-甲基苯酚菌株,切断4-甲基苯酚的合成途径;优化酒醅蒸馏工艺,抑制已生成的4-甲基苯酚进入原酒。但3株产4-甲基苯酚菌在窖泥中含量较高,且存在于窖泥微生物生态中。因此,在白酒酿造实践中去除4-甲基苯酚时也要考虑对其它微生物生长和风味化合物产量的影响。
综上所述,本文通过对酿造原料糖化料、曲粉、窖泥中4-甲基苯酚定性定量检测,明确了原酒中4-甲基苯酚来源于窖泥。通过高通量测序解析窖泥中的菌群结构,明确窖池不同位置窖泥中微生物分布差异,分析得到Clostridium与4-甲基苯酚的产生有较强的相关性。随后,运用传统的可培养技术从中筛选得到了3株产4-甲基苯酚的菌株,验证了之前的分析结果。3株菌可通过与窖泥高通量测序结果比对确定含量,含量高低可在一定程度上表征对4-甲基苯酚的贡献度。但针对4-甲基苯酚更全面的微生物来源及代谢途径研究尚有待进行。这不仅对于解析白酒中4-甲基苯酚的微生物来源、代谢途径有重要意义,而且可以为控制浓香型白酒中其它异味,提升酒体品质提供借鉴。
| [1] | Shen YF. Liquor Production Technology Encyclopedia[M]. Beijing: Chinese Light Industry Press, 1998: 357 -359. (in Chinese) 沈怡方. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 1998: 357 -359. |
| [2] | Fan WL, Qian MC. Characterization of aroma compounds of Chinese "Wuliangye" and "Jiannanchun" liquors by aroma extract dilution analysis[J]. Journal of Agricultural and Food Chemistry 2006, 54(7) : 2695–2704. DOI:10.1021/jf052635t |
| [3] | Zhao JS, Zheng J, Zhou RQ, et al. Microbial community structure of pit mud in a Chinese strong aromatic liquor fermentation pit[J]. Journal of the Institute of Brewing 2012, 118(4) : 356–360. DOI:10.1002/jib.52 |
| [4] | Wang XX, Fan WL, Xu Y. Comparison on aroma compounds in Chinese soy sauce and strong aroma type liquors by gas chromatography-olfactometry, chemical quantitative and odor activity values analysis[J]. European Food Research and Technology 2014, 239(5) : 813–825. DOI:10.1007/s00217-014-2275-z |
| [5] | Peng QL, Dong R, Xun SY, et al. Determination of volatile phenols in Chinese liquors by high-performance liquid chromatography associated with β-cyclodextrin and a protective barrier layer[J]. Flavour and Fragrance Journal 2013, 28(3) : 137–143. DOI:10.1002/ffj.v28.3 |
| [6] | Li JJ, Song CX, Hou CJ, et al. Development of a colorimetric sensor array for the discrimination of Chinese liquors based on selected volatile markers determined by GC-MS[J]. Journal of Agriculture and Food Chemistry 2014, 62(43) : 10422–10430. DOI:10.1021/jf503345z |
| [7] | Fan WL, Xu Y. Volatile compounds of fermented-mud in Baijiu (Chinese Liquor)[J]. Liquor Making 2010, 37(3) : 24–31. (in Chinese) 范文来, 徐岩. 白酒窖泥挥发性成分研究[J]. 酿酒 2010, 37(3) : 24–31. |
| [8] | Fan WL, Xu Y. Determination of odor thresholds of volatile aroma compounds in baijiu by a forced-choice ascending concentration series method of limits[J]. Liquor Making 2011, 38(4) : 80–84. (in Chinese) 范文来, 徐岩. 白酒79个风味化合物嗅觉阈值测定[J]. 酿酒 2011, 38(4) : 80–84. |
| [9] | Zhu Y, Fan WL, Xu Y. Determination of free volatile phenolic compounds in Chinese liquors (Baijiu) using direct immersion-solid phase microextraction coupled with gas chromatography-mass spectrometry[J]. Food and Fermentation Industries 2010, 36(10) : 138–143. (in Chinese) 朱燕, 范文来, 徐岩. 应用DI-SPME和GC-MS分析白酒中游离挥发性酚类化合物[J]. 食品与发酵工业 2010, 36(10) : 138–143. |
| [10] | Liang HP, Li WF, Luo QC, et al. Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhou-flavour liquor by combined PCR-DGGE and quantitative PCR assay[J]. Journal of the Science of Food and Agriculture 2015, 95(13) : 2729–2735. DOI:10.1002/jsfa.2015.95.issue-13 |
| [11] | Wang MY, Zhang WX. Analysis of microbial community structure in pit mud from two Chinese Luzhou-flavor liquor producing areas[J]. Microbiology China 2014, 41(8) : 1498–1506. (in Chinese) 王明跃, 张文学. 浓香型白酒两个产区窖泥微生物群落结构分析[J]. 微生物学通报 2014, 41(8) : 1498–1506. |
| [12] | Wang HY, Gao YB, Fan QW, et al. Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J]. Letters in Applied Microbiology 2011, 53(2) : 134–140. DOI:10.1111/lam.2011.53.issue-2 |
| [13] | Wang MY, Zhang WX, Wang HY, et al. Analysis of bacterial phylogenetic diversity of pit muds with different cellar ages[J]. Food Science 2013, 34(11) : 177–181. (in Chinese) 王明跃, 张文学, 王海英, 等. 不同窖龄窖泥细菌的系统发育多样性分析[J]. 食品科学 2013, 34(11) : 177–181. |
| [14] | Shokralla S, Spall JL, Gibson JF, et al. Next-generation sequencing technologies for environmental DNA research[J]. Molecular Ecology 2012, 21(8) : 1794–1805. DOI:10.1111/j.1365-294X.2012.05538.x |
| [15] | Qin N, Li DF, Yang RF. Next-generation sequencing technologies and the application in microbiology-a review[J]. Acta Microbiologica Sinica 2011, 51(4) : 445–457. (in Chinese) 秦楠, 栗东芳, 杨瑞馥. 高通量测序技术及其在微生物学研究中的应用[J]. 微生物学报 2011, 51(4) : 445–457. |
| [16] | Wang XC, Yang ZR, Wang M, et al. High-throughput sequencing technology and its application[J]. China Biotechnology 2012, 32(1) : 109–114. (in Chinese) 王兴春, 杨致荣, 王敏, 等. 高通量测序技术及其应用[J]. 中国生物工程杂志 2012, 32(1) : 109–114. |
| [17] | Hu XL, Du H, Xu Y. Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J]. International Journal of Food Microbiology 2015, 214 : 116–122. DOI:10.1016/j.ijfoodmicro.2015.07.032 |
| [18] | Xu W, Zhang XJ, Xu HY, et al. Analysis of bacterial communities in aerobic solid-fermentation culture of Zhenjiang Hengshun vinegar[J]. Microbiology China 2007, 34(4) : 646–649. (in Chinese) 许伟, 张晓君, 许泓瑜, 等. 镇江香醋醋酸发酵过程中细菌群落组成分析[J]. 微生物学通报 2007, 34(4) : 646–649. |
| [19] | Caporaso JG, Lauber CL, Walters WA, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America 2011, 108(S1) : 4516–4522. |
| [20] | Zhang JR, Fang F, Chen J, et al. The arginine deiminase pathway of koji bacteria is involved in ethyl carbamate precursor production in soy sauce[J]. FEMS Microbiology Letters 2014, 358(1) : 91–97. DOI:10.1111/fml.2014.358.issue-1 |
| [21] | Wang FZ. Analysis of microbial diversity's distribution pattern in fermentation of liquor[D]. Hohhot: Master's Thesis of Inner Mongolia University, 2014 (in Chinese) 王福桢.北方浓香型白酒发酵微生物多样性分布模式解析[D].呼和浩特:内蒙古大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10126-1014270003.htm |
| [22] | Hou XG, Wang JY, Li XS, et al. The research progress on functional aroma-producing microorganisms in Zaopei and pit mud of Chinese strong-flavor liquor[J]. Microbiology China 2013, 40(7) : 1257–1265. (in Chinese) 侯小歌, 王俊英, 李学思, 等. 浓香型白酒糟醅及窖泥产香功能菌的研究进展[J]. 微生物学通报 2013, 40(7) : 1257–1265. |
| [23] | Tait E, Hill KA, Perry JD, et al. Development of a novel method for detection of Clostridium difficile using HS-SPME-GC-MS[J]. Journal of Applied Microbiology 2014, 116(4) : 1010–1019. DOI:10.1111/jam.2014.116.issue-4 |
| [24] | Wu CD, Qin Z, Huang J, et al. Characterization of microbial community in Daqu by PLFA method[J]. Food Science and Technology Research 2014, 20(1) : 147–154. DOI:10.3136/fstr.20.147 |
| [25] | Hu XL, Wang HY, Wu Q, et al. Development, validation and application of specific primers for analyzing the clostridial diversity in dark fermentation pit mud by PCR-DGGE[J]. Bioresource Technology 2014, 163 : 40–47. DOI:10.1016/j.biortech.2014.04.008 |
| [26] | Yue YY, Zhang WX, Liu X, et al. Isolation and identification of facultative anaerobes in the pit mud of Chinese Luzhou-flavor liquor[J]. Microbiology China 2007, 34(2) : 251–255. (in Chinese) 岳元媛, 张文学, 刘霞, 等. 浓香型白酒窖泥中兼性厌氧细菌的分离鉴定[J]. 微生物学通报 2007, 34(2) : 251–255. |
| [27] | Wang W, Zhao H, Chen FG. Isolation & preliminary identification of lactic acid bacteria in Luzhou-flavor pit mud[J]. Liquor-Making Science & Technology 2006(4) : 29–31. (in Chinese) 王葳, 赵辉, 陈凤阁. 浓香型白酒窖泥中乳酸菌的分离与初步鉴定[J]. 酿酒科技 2006(4) : 29–31. |
| [28] | Shi S, Wang HY, Zhang WX, et al. Analysis of microbial communities characteristics in different pit mud of Luzhou-flavor liquor[J]. Liquor-Making Science & Technology 2011(5) : 38–41. (in Chinese) 施思, 王海英, 张文学, 等. 浓香型白酒不同-窖泥的微生物群落特征分析[J]. 酿酒科技 2011(5) : 38–41. |
| [29] | Ding XF, Wu CD, Zhang LQ, et al. Characterization of eubacterial and archaeal community diversity in the pit mud of Chinese Luzhou-flavorliquor by nested PCR-DGGE[J]. World Journal of Microbiology and Biotechnology 2014, 30(2) : 605–612. DOI:10.1007/s11274-013-1472-4 |
| [30] | Wang XX. Comparison on aroma compounds of soy sauce and strong aroma type liquors[D]. Wuxi: Master's Thesis of Jiangnan University, 2014 (in Chinese) 王晓欣.酱香型和浓香型白酒中香气物质及其差异研究[D].无锡:江南大学硕士学位论文, 2014 http://cn.bing.com/academic/profile?id=a127afbaa84d382895198113337d6d2f&encoded=0&v=paper_preview&mkt=zh-cn |
| [31] | Fan WL, Nie QQ, Xu Y. Key aroma compounds of Yanghe supple and mellow aroma style liquors[J]. Food Science 2013, 34(4) : 135–139. (in Chinese) 范文来, 聂庆庆, 徐岩. 洋河绵柔型白酒关键风味成分[J]. 食品科学 2013, 34(4) : 135–139. |
| [32] | Zhang Y, Du H, Wu Q, et al. Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J]. Microbiology China 2015, 42(11) : 2087–2097. (in Chinese) 张艳, 杜海, 吴群, 等. 酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J]. 微生物学通报 2015, 42(11) : 2087–2097. |
| [33] | Meng X, Wu Q, Wang L, et al. Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai‑flavor liquor making[J]. Journal of Industrial Microbiology & Biotechnology 2015, 42(12) : 1601–1608. |
| [34] | Zhang L, Zhou R, Niu M, et al. Difference of microbial community stressed in artificial pit muds for Luzhou-flavour liquor brewing revealed by multiphase culture-independent technology[J]. Journal of Applied Microbiology 2015, 119(5) : 1345–1356. DOI:10.1111/jam.2015.119.issue-5 |
| [35] | Westerholm M, Dolfing J, Sherry A, et al. Quantification of syntrophic acetate-oxidizing microbial communities in biogas processes[J]. Environmental Microbiology Reports 2011, 3(4) : 500–505. DOI:10.1111/emi4.2011.3.issue-4 |
| [36] | Niu LL, Song L, Dong XZ. Proteiniborusethanoligenes gen. nov., sp. nov., an anaerobic protein-utilizing bacterium[J]. International Journal of Systematic and Evolutionary Microbiology 2008, 58(1) : 12–16. DOI:10.1099/ijs.0.65108-0 |
| [37] | Jeong H, Yi HN, Sekiguchi Y, et al. Clostridium jejuense sp. nov., isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology 2004, 54(5) : 1465–1468. DOI:10.1099/ijs.0.63128-0 |
 2017, Vol. 44
2017, Vol. 44