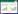扩展功能
文章信息
- 赵玉玲, 董奉鑫, 李素俭, 黄丽丽, 颜霞
- ZHAO Yu-Ling, DONG Feng-Xin, LI Su-Jian, HUANG Li-Li, YAN Xia
- 生防菌Act12铁载体合成酶Ser基因的功能
- Functional analysis of Ser gene from biological bacterium Act12
- 微生物学通报, 2017, 44(1): 79-85
- Microbiology China, 2017, 44(1): 79-85
- DOI: 10.13344/j.microbiol.china.160313
-
文章历史
- 收稿日期: 2016-04-15
- 接受日期: 2016-05-30
- 优先数字出版日期(www.cnki.net): 2016-06-07
2. 西北农林科技大学生命科学学院 陕西 杨凌 712100;
3. 西北农林科技大学植物保护学院 陕西 杨凌 712100
2. College of Life Sceinces, Northwest A&F University, Yangling, Shaanxi 712100, China;
3. College of Plant Protection, Northwest A&F University, Yangling, Shaanxi 712100, China
YAN Xia: Tel:86-29-87092262;E-mail:luckyx@126.com.
铁元素在生命有机体的代谢过程中起着重要的作用,铁元素缺乏时会产生不良的影响。但自然界中的铁元素主要以难溶性铁化合物的形式存在,大部分不能被生物直接吸收利用,生物有效性很低。随着生物的进化,微生物获得了活化、吸收和运输难溶性铁的特殊机制,即通过分泌铁载体(Siderophore)利用环境中的铁。铁载体是指微生物在限铁条件下产生的小分子量铁螯合剂,被分泌到细胞表面或细胞外捕获Fe3+或将难溶性铁变成可溶形式以便为微生物吸收和利用[1]。
植物根围促生菌(Plant growth-promoting rhizobacteria,PGPR)是指自由生活在土壤或附生于植物根系的、可以直接或间接地促进植物生长的一类有益菌[2]。PGPR的促生机理很多,其中之一是通过自身合成的各种对铁具有高亲和力的铁载体对寄主植物起到防病促生作用。一方面,PGPR分泌的铁载体可结合Fe3+并将其还原成能被植物高效利用的Fe2+,因此在植物铁营养方面发挥着重要作用[3-5];另一方面,PGPR通过铁载体与病原微生物争夺环境中有限的铁营养,抑制病原微生物的生长繁殖。随着对PGPR铁载体的深入研究,将可产铁载体的PGPR研发为细菌菌剂具有重要的意义。
生防菌Act12是分离自青藏高原的一株拮抗性放线菌,具有广谱性拮抗作用,经16S rRNA基因序列分析,鉴定其为密旋链霉菌(Streptomyces pactum)[6]。Act12及其发酵液对草莓疫霉(Phytophthora fragariae)、木贼镰刀菌(Fusarium equiseti)等多种土壤病原真菌均有明显的抑制作用[6-7],对草莓、甜瓜、人参等作物表现良好的促生效果[6, 8-9],但其防病促生机制还不清楚。前期试验结果表明,Act12有较强的铁载体分泌能力。目前已完成其全基因组测序和注释,通过基因组注释分析,Act12中有两个铁载体基因簇,一种是已知的desferrioxamine类铁载体;另一种基因簇暗示其可能是一种新型铁载体,Ser基因是这个基因簇的一个合成酶基因,预测其在这种铁载体的合成过程中起关键作用。鉴于此,本研究对Act12的铁载体合成酶Ser基因进行功能研究,为揭示Act12防病促生机制奠定基础,并为构建更有效的生防菌株奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 供试菌株和质粒: 供试生防菌Act12由西北农林科技大学资源与环境学院薛泉宏教授惠赠;苹果轮纹病菌(Macrophoma kawatsukai)、苹果树腐烂病菌(Valsa mali)、基因克隆受体菌E. coliDH5α、接合转移供体菌E. coliET12567 (pUZ8002)、自杀型质粒pKC1132 [aac (3) IV,oriT]、整合型质粒pSET152 [aac (3) IV,oriT]均为本实验室保存;pMD19-T-KmR由西北农林科技大学生命科学学院贾良辉老师馈赠;克隆载体pMD19-T购自Takara公司。 1.1.2 培养基: 放线菌培养采用高氏Ⅰ号培养基(g/L):可溶性淀粉20.00、KNO3 1.00、NaCl 0.50、MgSO4∙7H2O 0.50、K2HPO4 0.50、FeSO4∙7H2O 0.01、琼脂15.00;铁载体诱导发酵液采用无铁高氏Ⅰ号培养基:可溶性淀粉20.00、KNO3 1.00、NaCl 0.50、MgSO4∙7H2O 0.50、K2HPO4 0.50;大肠杆菌培养采用LB培养基(g/L):酵母提取物5.00、胰蛋白胨10.00、NaCl 10.00、琼脂15.00;放线菌提取DNA发酵液采用TSB培养基(g/L):大豆蛋白胨5.00、胰蛋白胨15.00、NaCl 5.00;接合转移培养基采用MS培养基(g/L):黄豆粉30.00、甘露醇20.00,琼脂15.00;病原真菌的培养采用PDA培养基:马铃薯200.00、葡萄糖20.00、琼脂15.00。 LB培养基中抗生素终浓度:氨苄青霉素(Amp) 100 mg/L、安普霉素(Apr) 50 mg/L、卡那霉素(Km) 50 mg/L;接合转移培养基中抗生素终浓度:萘啶酮酸(Nal) 25 mg/L、卡那霉素(Km) 10 mg/L。 1.1.3 供试甜瓜: 供试甜瓜种子品种“白雪公主”购自中国山西运城河东种业科技开发中心。 1.1.4 主要试剂和仪器: T4 DNA连接酶为TaKaRa公司产品;ExTaq Master Mix、质粒提取试剂盒、胶回收试剂盒为康为世纪生物科技公司产品;限制性内切酶为赛默飞世尔科技公司产品;其他生化试剂为国产分析纯。NanoDrop 2000型紫外分光光度计为Thermo公司产品;Bio-Rad S1000TM型PCR仪为Thermalcycler公司产品;电泳仪为JUNYI公司产品等。 1.1.5 引物: 引物由上海生工生物工程有限公司合成,引物序列见表 1。| 引物 Primers |
序列 primers sequence (5′→3′) |
酶切位点 Restriction sites |
| L-F | CCGGAATTCGAGTTGACGCGGATGAC | EcoRⅠ |
| L-R | GGAATTCCATATGGCACGATGGTGCAGAAG | NdeⅠ |
| R-F | CGCGGATCCACGGACGGAGCACCC | BamHⅠ |
| R-R | GCTCTAGACCGCCCCTGTCATCC | XbaⅠ |
| KY-F | ATGATTGAACAAGATGG | − |
| KY-R | TCAGAAGAACTCGTCAA | − |
| QY-F | GCACCTTAGCCGAGTCA | − |
| QY-R | TCCCAGTGGAAGAGCGT | − |
| BH-F | CCGGAATTCGCACCTTAGCCGAGTCA | EcoRⅠ |
| BH-R | GCTCTAGATCCCAGTGGAAGAGCGT | XbaⅠ |
CTAB法[10]提取Act12基因组DNA作为模板,以L-F、L-R和R-F、R-R为引物分别进行PCR,扩增得到两个同源交换臂BL和BR,长度分别为1 590 bp和1 547 bp。按照Fermentas Fastpfu说明书设置PCR体系和程序,PCR体系:5×Buffer 10μL,正、反向引物(10μmol/L)各1μL,2.5 mmol/L dNTPs 5 μL,DNA 1 μL ( < 0.5 μg),DNA polymerase (2.5 U/μL) 1 μL,ddH2O补足至50 μL。PCR条件:98 ℃ 2 min;98 ℃ 30 s,(Tm−5) ℃ 30 s,72 ℃ 1.5 min;72 ℃ 5 min。
参照康为世纪质粒提取试剂盒提取大肠杆菌质粒,用相应的限制性内切酶分别酶切BL、BR、pKC1132和pMD19-T-KmR,T4连接酶连接后转化入DH5α,筛选阳性转化子,PCR、酶切验证并测序,正确的重组质粒命名为pCT12。
1.3 Act12 Ser基因敲除突变株的获得和鉴定将pCT12转入ET12567 (pUZ8002)中,通过接合转移法[11]将重组质粒转入Act12,筛选AprS、KmR的菌落,采用PCR进行验证并测序,命名为Dser。
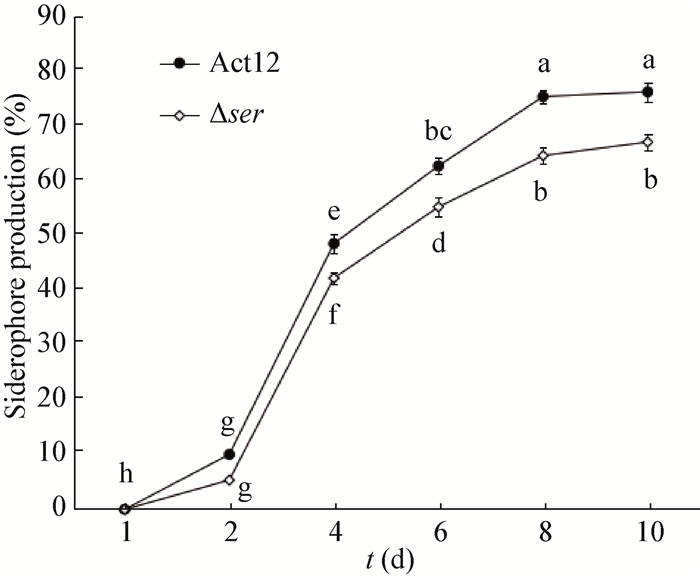
1.4 生物学特性分析 1.4.1 菌落形态观察: 采用三区划线法,分别将突变株Dser与野生株Act12单菌落接种于高氏Ⅰ号平板,28 ℃培养8 d,观察二者菌落形态、大小和产孢情况。 1.4.2 生长速率的测定: 分别制备突变株Dser与野生株Act12的孢子悬液,调整浓度使一致,按1%接种量接种于无铁高氏Ⅰ号培养基,28 ℃、180 r/min培养,每隔1 d称菌体干重,直至菌体生长至稳定期,绘制生长曲线。 1.4.3 无菌发酵滤液的制备: 制备Dser与Act12同等浓度的孢子悬液,按1%接种量接种于无铁高氏Ⅰ号培养基,28 ℃、180 r/min培养8 d,发酵液于8 000 r/min离心10 min、真空抽滤后用0.45 mm灭菌微孔滤膜过滤除菌,得无菌发酵滤液。 1.4.4 无菌发酵滤液铁载体产量的测定: Dser与Act12的发酵滤液采用CAS检测法检测,并用紫外-可见分光光度计测样品在630 nm波长下的光吸收值,利用Se=(Ar−A)/Ar×100%计算铁载体的含量[12],其中A和Ar分别为待测样品和对照样品(无铁高氏Ⅰ号培养基)在630 nm处的光吸光值,Se表示铁载体的含量。 1.4.5 无菌发酵滤液对甜瓜种子萌发的影响: 挑选饱满的甜瓜种子50粒,用1%的NaClO溶液消毒后,用无菌水反复冲洗,用灭菌的纱布包住,各取50粒浸泡于装有Dser与Act12的无菌发酵滤液的小烧杯中,28 ℃遮光浸种24 h。弃去浸液,无菌水冲洗种子,放入装有无菌水浸润滤纸的培养皿中,28 ℃恒温培养24 h观察种子萌发情况,统计种子萌发率,96 h时测量幼苗根长和胚轴长度。 1.4.6 对病原真菌皿内拮抗作用的测定: 苹果轮纹病菌和苹果树腐烂病菌在PDA平板上,25 ℃培养2 d,Dser与Act12在无铁高氏Ⅰ号平板上28 ℃培养8 d,分别用7 mm打孔器切取下来制成菌饼,将一个放线菌菌饼置于PDA平板中央,距培养皿中央2 cm处以对角线方式点接4个病原真菌菌饼,菌丝面朝下,25 ℃培养3 d,观察生长情况,十字交叉法测量抑菌圈直径。 2 结果与分析 2.1 Ser基因敲除载体的构建及验证两个同源臂、pMD19-T-KmR和pKC1132分别进行酶切、连接和转化后,在含卡那霉素(10 mg/L)和安普霉素(25 mg/L)的LB平板上筛选转化子,此转化子同时包含KmR基因片段和pKC1132片段,再将该转化子进行两个同源臂的PCR验证和酶切验证,结果见图 1。PCR验证和酶切验证片段大小均与预期相符,并经测序、比对,没有发生碱基突变,证明基因敲除载体pCT12构建成功。
|
| 图 1 Ser基因敲除载体的鉴定 Figure 1 Identification of the Serknock-out plasmid 注:M:Super DNA marker;1:L-F/R PCR扩增上游同源臂;2:R-F/R PCR扩增下游同源臂;3:转化子的酶切验证(EcoRⅠ/ NdeⅠ/BamHⅠ/XbaⅠ). Note: M: Super DNA marker; 1: L-F/R PCR amplification using plasmid of the transformant; 2: R-F/R PCR amplification using plasmid of the transformant; 3: Digestion of plasmid of the transformant (EcoRⅠ/NdeⅠ/BamHⅠ/XbaⅠ). |
|
|
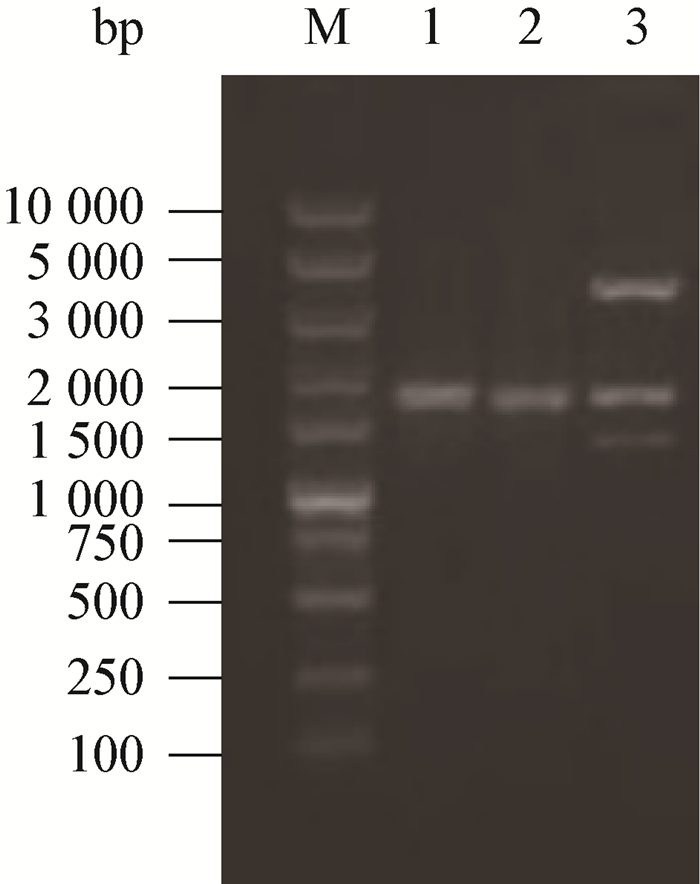
利用含有重组质粒pCT12的ET12567 (pUZ8002),通过接合转移法将重组质粒转入Act12,筛选AprS、KmR的菌落。如图 2所示,利用KmR基因设计的引物KY-F/R对Dser进行PCR,得到的扩增片段为795 bp,而Act12没有得到相应片段;利用Ser全长基因设计引物QY-F/R,Act12扩到约2 000 bp的片段,Dser扩到的片段比Act12的片段大144 bp,并将该片段测序、比对。PCR验证结果和测序结果均表明KmR基因插入到Ser基因中。
|
| 图 2 Dser的PCR验证 Figure 2 PCR analysis of Dser 注:M:Super DNA marker;1:KY-F/R PCR扩增Dser基因组DNA;2:KY-F/R PCR扩增Act12基因组DNA;3:QY-F/R PCR扩增Dser基因组DNA;4:QY-F/R PCR扩增Act12基因组DNA. Note: M: Super DNA marker; 1: KY-F/R PCR amplification using DNA of Dser; 2: KY-F/R PCR amplification using DNA of Act12; 3: QY-F/R PCR amplification using DNA of Dser; 4: PCR amplification using DNA of Act12. |
|
|

|
| 图 3 Dser(A)与Act12 (B)的菌落形态 Figure 3 Colony of Dser(A) and Act12 (B) |
|
|
|
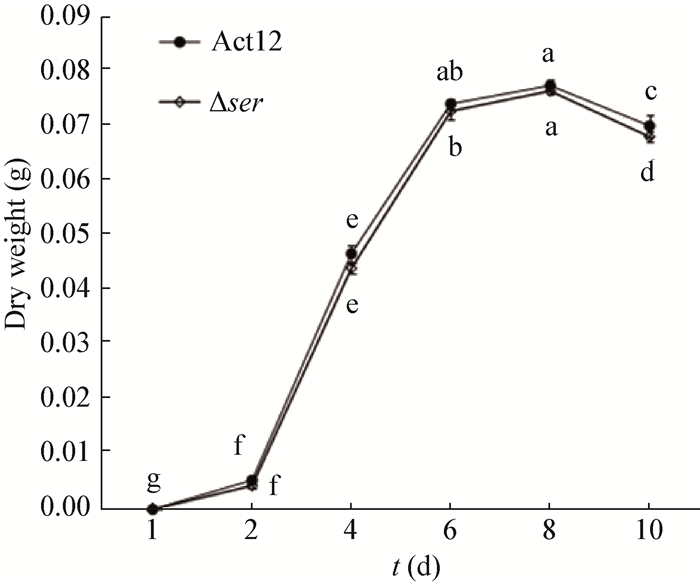
| 图 4 Dser与Act12的生长速率 Figure 4 Growth curves of Dser and Act12 注:图中误差线为标准偏差,不同小写字母表示差异显著性(P < 0.05).同图 5. Note: The error bars represent SD, and different letters indicate significant difference (P < 0.05). The same as figure 5. |
|
|
|
| 图 5 Dser与Act12发酵滤液铁载体产量曲线 Figure 5 Siderophore production curves of Dser and Act12 |
|
|
| 放线菌Actinomycete | 萌发率Rate of germination (%) | 胚根长度Length of radicle (cm) | 胚轴长度Length of hypocotyl (cm) |
| CK | 40.70±2.10a | 4.20±0.72a | 2.02±0.53b |
| Dser | 9.00±4.00b | 0.12±0.13b | 0c |
| Act12 | 41.00±1.00a | 4.54±0.26a | 2.86±0.15a |
| 注:表中数据为平均值±标准偏差,同列不同小写字母表示差异显著性(P < 0.05). Note: The datas represent means±s, and different letters in the same column indicate significant difference (P < 0.05). | |||
|
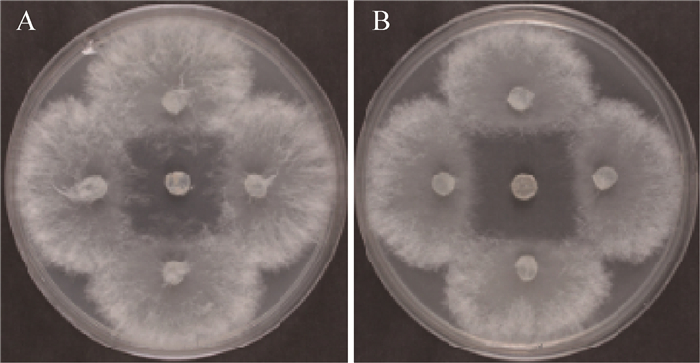
| 图 6 Dser(A)与Act12 (B)对苹果轮纹病菌的拮抗作用 Figure 6 Inhibition activity of Dser(A) and Act12 (B) against M. kawatsukai |
|
|
| 放线菌Actinomycete | 对M. kawatsukai抑菌圈直径Inhibitory zone diameter (cm) | 对V. mali抑菌圈直径Inhibitory zone diameter (cm) | |||
| 36 h | 48 h | 36 h | 48 h | ||
| CK | 0c | 0c | 0b | 0b | |
| Dser | 2.44±0.10b | 1.50±0.10b | 2.47±0.06a | 1.97±0.06a | |
| Act12 | 2.70±0.10a | 2.53±0.06a | 2.50±0.10a | 2.03±0.12a | |
| 注:表中数据为平均值±标准偏差,同列不同小写字母表示差异显著性(P < 0.05). Note: The datas represent means±s, and different letters in the same column indicate significant difference (P < 0.05). | |||||
以Act12基因组DNA为模板,利用引物BH-F和BH-R,通过PCR扩增得到包含完整Ser基因的片段,用限制性内切酶EcoRⅠ/XbaⅠ分别酶切Ser片段和pSET152,通过T4连接酶连接,构建重组质粒pSET-Ser,筛选阳性转化子,测序正确后转入ET12567(pUZ8002)中,通过接合转移法将重组质粒转入Dser,随机挑选3个转化子进行铁载体含量检测,其铁载体含量得以回复,表明基因缺失突变体铁载体产量的变化是由基因ser被敲除引起的,进而初步验证基因ser的功能。
3 讨论铁在生命有机体的代谢过程中起着重要的作用,当高等生物和微生物缺铁时,它们的代谢过程均会受到不利影响。研究证明铁载体在抑制病原微生物及植物促生方面发挥着重要作用。许多产铁载体微生物可利用铁载体和病原菌竞争环境中的铁营养而达到抑菌作用。恶臭假单胞(Pseudomonas putida)菌株wcs358r只依靠铁载体与镰刀霉枯萎病菌(Fusarium fungus)竞争铁从而抑制其生长[13]。朱慧明[14]等报道铜绿假单胞菌(Pseudomonas aeruginosa)菌株Z158产生的铁载体对4种常见致病菌都有抑制作用。产铁载体的植物内生菌能通过铁载体螯合环境中铁离子或其他重金属离子形成复合物被植物吸收而促进植物的生长,并且可以通过铁载体抑制病原微生物的生长繁殖间接促进植物的生长[15]。另有报道称,细菌分泌的铁载体在某些情况下可以诱导植物系统抗性[13],增强植物的抗病能力而促进植物生长。
种子萌发过程受到多个基因在时间和空间上的调控,在某一阶段,有些基因被激活表达,而有些基因被抑制表达,这些基因表达的抑制对维持正常的萌发十分关键[16]。Dser发酵滤液处理的甜瓜种子萌发率很低,并且萌发时间比对照组明显推迟很多,可能是铁载体合成酶ser基因敲除后,影响了ser基因参与合成的铁载体的合成,导致其他微生物的生长而产生毒素,从而抑制了甜瓜种子的萌发,或许另有他因。Act12在无铁高氏Ⅰ号培养基培养8 d的铁载体产量高达75%,属于高产铁载体放线菌。但菌株的铁载体产量和对病原菌的抑制作用不具有线性相关性,即使铁载体产量很高,也有可能无抑菌作用[17]。本实验以苹果轮纹病菌和苹果树腐烂病菌作为靶标菌,Dser和Act12对苹果轮纹病菌对峙培养前期拮抗作用没差异,后期有差异,可能是由于在对峙培养初期,主要是Dser和Act12产生的一些抗菌物质发挥拮抗作用;对峙培养后期,这些抗菌物质被消耗掉,Dser和Act12利用铁载体与病原真菌竞争铁营养而抑制其生长,Dser比Act12合成的铁载体少,因而拮抗作用比Act12弱。Dser和Act12对苹果树腐烂病菌对峙培养36 h时抑菌圈最大,之后抑菌圈均减小。Dser和Act12对苹果轮纹病菌的抑菌作用有差异,而对苹果树腐烂病菌的拮抗作用没差异,可能是Act12对不同病原真菌的抑菌机制不同所致。后期可以对突变体通过实时荧光定量PCR (RT-PCR)对Ser基因表达量做研究,并对Act12铁载体进行分离纯化,进一步研究其防病促生机制,开发出能有效防治农业病害的生防制剂,应用于农业生产。
| [1] | An Z, Zhao Q, McEvoy J, et al. The second finger of Urbs1 is required for iron-mediated repression of sid1 in Ustilago maydis[J]. Proceedings of the National Academy of Sciences of the United States of America 1997, 94(11) : 5882–5887. DOI:10.1073/pnas.94.11.5882 |
| [2] | Malik KA, Bilal R, Mehnaz S, et al. Association of nitrogen-fixing, plant-growth-promoting rhizobacteria (PGPR) with kallar grass and rice[J]. Plant and Soil 1997, 194(1/2) : 37–44. DOI:10.1023/A:1004295714181 |
| [3] | Haselwandter K, Winkelmann G. Siderophores of symbiotic fungi[A]//Varma A, Chincholkar S B. Microbial Siderophores[M]. Berlin Heidelberg: Springer, 2007, 12: 91-103 |
| [4] | Liang JG, Shi YF, Zhu LH. Plant growth promoting mechanism of rhizosphere bacteria[J]. Modern Agricultural Science and Technology 2008(17) : 133–135. (in Chinese) 梁建根, 施跃峰, 竺利红. 植物根围促生细菌作用机制的研究[J]. 现代农业科技 2008(17) : 133–135. |
| [5] | Liu DD, Li M, Liu RJ. Recent advances in the study of plant growth-promoting rhizobacteria in China[J]. Chinese Journal of Ecology 2016, 35(3) : 815–824. (in Chinese) 刘丹丹, 李敏, 刘润进. 我国植物根围促生细菌研究进展[J]. 生态学杂志 2016, 35(3) : 815–824. |
| [6] | Xu YJ, Xue QH, Xing SL, et al. Growth promoting effect and induced endurance of three actinomyces strains to strawberry[J]. Acta Agriculturae Boreali-occidentalis Sinica 2007, 16(6) : 146–153. (in Chinese) 许英俊, 薛泉宏, 邢胜利, 等. 3株放线菌对草莓的促生作用及对PPO活性的影响[J]. 西北农业学报 2007, 16(6) : 146–153. |
| [7] | Zhao J, Xue QH, Wang LN, et al. Antagonistic effect of multifunctional actinomycete strain Act12 on soil-borne pathogenic fungi and its identification[J]. Chinese Journal of Eco-Agriculture 2011, 19(2) : 394–398. (in Chinese) 赵娟, 薛泉宏, 王玲娜, 等. 多功能放线菌Act12对土传病原真菌的拮抗性及其鉴定[J]. 中国生态农业学报 2011, 19(2) : 394–398. DOI:10.3724/SP.J.1011.2011.00394 |
| [8] | Zhao J, Du JZ, Xue QH, et al. The growth-promoting effect and resistance induction of 3 antagonistic actinomyces on Cucumis melo L.[J]. Journal of Northwest A & F University (Natural Science Edition) 2010, 38(2) : 109–116. (in Chinese) 赵娟, 杜军志, 薛泉宏, 等. 3株放线菌对甜瓜幼苗的促生与抗性诱导作用[J]. 西北农林科技大学学报:自然科学版 2010, 38(2) : 109–116. |
| [9] | Zhang HY, Xue QH, Shen GH, et al. Effects of actinomycetes agent on ginseng growth and rhizosphere soil microflora[J]. Chinese Journal of Applied Ecology 2013, 24(8) : 2287–2293. (in Chinese) 张鸿雁, 薛泉宏, 申光辉, 等. 放线菌制剂对人参生长及根域土壤微生物区系的影响[J]. 应用生态学报 2013, 24(8) : 2287–2293. |
| [10] | Liu BH, Cao YY, Yan JF, et al. Comparison among six methods of genome DNA extraction from Streptomyces[J]. Journal of Henan Agricultural Sciences 2008(10) : 86–89. (in Chinese) 刘炳辉, 曹远银, 闫建芳, 等. 6种链霉菌基因组DNA提取方法比较[J]. 河南农业科学 2008(10) : 86–89. |
| [11] | Yan LB, Hong WR, Fang ZK, et al. Construction of the conjugal transfer system for Micromonospora purpurea G1008[J]. Chinese Journal of Antibiotics 2011, 36(12) : 899–904. (in Chinese) 严凌斌, 洪文荣, 方志锴, 等. 绛红色小单孢菌G1008接合转移体系的构建[J]. 中国抗生素杂志 2011, 36(12) : 899–904. |
| [12] | Wang P, Dong B, Li FD, et al. Detection and determination of the siderophores produced by wheat rhizo bacteria[J]. Microbiology China 1994, 21(6) : 323–326. (in Chinese) 王平, 董飚, 李阜棣, 等. 小麦根圈细菌铁载体的检测[J]. 微生物学通报 1994, 21(6) : 323–326. |
| [13] | Compant S, Duffy B, Nowak J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects[J]. Applied and Environmental Microbiology 2005, 71(9) : 4951–4959. DOI:10.1128/AEM.71.9.4951-4959.2005 |
| [14] | Zhu HM, Zhang Y, Yang HJ. Screening of Pseudomonas strains producing high-yield siderophore and its utilization of iron hydroxides[J]. Biotechnology Bulletin 2015, 31(9) : 177–182. (in Chinese) 朱慧明, 张彦, 杨洪江. 高产铁载体假单胞菌的筛选及其对铁氧化物的利用[J]. 生物技术通报 2015, 31(9) : 177–182. |
| [15] | Sun L, Shao H, Liu L, et al. Diversity of siderophore-producing endophytic bacteria of Cymbidium goeringii roots[J]. Acta Microbiologica Sinica 2011, 51(2) : 189–195. (in Chinese) 孙磊, 邵红, 刘琳, 等. 可产生铁载体的春兰根内生细菌多样性[J]. 微生物学报 2011, 51(2) : 189–195. |
| [16] | Zhang Y, Xu XF, Mo BX. Repression regulations of seed germination[J]. Chinese Bulletin of Life Sciences 2012, 24(2) : 118–122. (in Chinese) 张宇, 徐晓峰, 莫蓓莘. 种子萌发的抑制调控机制[J]. 生命科学 2012, 24(2) : 118–122. |
| [17] | Raaska L, Mattila-Sandholm T. Effects of iron level on the anatagonistic action of siderophores from non-pathogenic Staphylococcus spp[J]. Journal of Industrial Microbiology 1995, 15(6) : 480–485. DOI:10.1007/BF01570018 |
 2017, Vol. 44
2017, Vol. 44