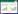扩展功能
文章信息
- 何姝颖, 诸葛斌, 陆信曜, 宗红, 陈雯, 宋健
- HE Shu-Ying, ZHUGE Bin, LU Xin-Yao, ZONG Hong, CHEN Wen, SONG Jian
- 副产物途径的缺失对大肠杆菌合成D-1, 2, 4-丁三醇的影响
- Influence of the deficiency of by-product pathways on biosynthesis of D-1, 2, 4-butanetriol in Escherichia coli
- 微生物学通报, 2017, 44(1): 30-37
- Microbiology China, 2017, 44(1): 30-37
- DOI: 10.13344/j.microbiol.china.160140
-
文章历史
- 收稿日期: 2016-02-14
- 接受日期: 2016-04-15
- 优先数字出版日期(www.cnki.net): 2016-06-21
2. 江南大学 工业生物技术教育部重点实验室 工业微生物研究中心 江苏 无锡 214122;
3. 江南大学化学与材料工程学院 江苏 无锡 214122
2. Key Laboratory of Industrial Biotechnology, Ministry of Education, Research Centre of Industrial Microbiology;
3. Jiangnan University, Wuxi, Jiangsu 214122, China
D-1, 2, 4-丁三醇(D-1, 2, 4-butanetriol,BT)是一种重要的多元醇,广泛用于军工、制药、化妆品等领域[1-4]。其硝基类化合物丁三醇三硝酸酯(BTTN)以热稳定性好、冲击感小、挥发性小等优点[4],正逐步取代三硝酸甘油酯成为新型的火箭推进剂。
目前,工业上所用的BT主要用高温高压NaBH4催化条件下还原苹果酸[5]或2-丁烯-1, 4-二醇(BTD)水合[6]等化学法生产,但是化学法存在不少弊端,如生产条件严苛、催化剂价格昂贵、生产过程易造成环境污染以及副产物较多,不利于后续的分离纯化等[6]。相较于化学法,生物法更环保、经济,由于迄今为止尚未在生物体内发现BT,因此该化合物主要通过人工构建途径生物合成,包括以木糖[7]或苹果酸[8]为底物两种技术路径。其中,基于木糖代谢的BT途径更为高效,主要包括:木糖在木糖脱氢酶(xdh)作用下氧化成木糖酸,木糖酸脱水形成2-酮-3-脱氧-木糖酸(KDX),再在苯甲酰甲酸脱羧酶(mdlC)催化下转化为3, 4-二羟基丁醛,最后在醇脱氢酶(yqhd)作用下[9]生成BT (图 1)。目前,提高BT生产的方法主要有以下两种:一是筛选更高效催化的酶,并调整各基因之间的表达水平,使其达到平衡;二是敲除副产物途径,增加到BT的碳流。数据库信息及文献报道表明,在上述构建的BT合成途径中存在一些竞争碳流的副产物途径(图 1),其中,木糖异构酶(xylA)、木酮糖激酶(xylB)参与底物木糖的代谢,醛缩酶(yagE和yjhH)对中间代谢产物KDX竞争性消耗[10]。
本研究室前期将所筛选到的柄杆菌中的xdh基因和来源于恶臭假单胞菌中的mdlC基因克隆至pEtac质粒后,在大肠杆菌中串联表达,实现了木糖-BT的转化,但其产量仅为0.9 g/L[11]。本文在前期已构建的BT重组菌中敲除上述两个竞争性代谢途径,以明确各副产物途径对BT合成的影响,强化BT生产。
1 材料与方法 1.1 材料 1.1.1 主要试剂和仪器: 蛋白胨、酵母提取物,Oxiod公司;D-木糖,上海国药;D-1, 2, 4-丁三醇,上海阿拉丁化学试剂有限公司;氨苄青霉素(Amp)、卡那霉素(Kan)、异丙基-β-D-硫代半乳糖苷(IPTG),上海生工生物工程有限公司;Taq DNA聚合酶,大连宝生物有限公司;DNA凝胶回收试剂盒、质粒提取试剂盒、DNA marker,上海捷瑞生物工程有限公司;色谱柱Aminex HPX-87H column (300 mm×7.8 mm;9μm),Bio-Rad公司。PCR仪、电转仪,Eppendorf公司。PCR所用引物的合成由苏州泓迅生物科技有限公司完成。 1.1.2 菌株和质粒: 研究中所用菌株和质粒见表 1。| 菌株和质粒Strains and plasmids | 相关特性/用途Characters/Applications | 来源Sources |
| E. coli W3110 | E. coli W3110野生菌 | 本研究中心保藏 |
| E. coli W001 | E. coli W3110 ΔxylAB | 本研究构建 |
| E. coli W031 | E. coli W3110 ΔyagE | 本研究构建 |
| E. coli W032 | E. coli W3110 ΔyjhH | 本研究构建 |
| E. coli W003 | E. coli W3110ΔyagEΔyjhH | 本研究构建 |
| E. coli W004 | E. coli W3110ΔxylABΔyagEΔyjhH | 本研究构建 |
| E. coli W3110/(BT) | 带有质粒pEtac-mdlC-tac-xdh的E. coli W3110 | 本研究中心保藏 |
| E. coli W001/(BT) | 带有质粒pEtac-mdlC-tac-xdh的E. coli W001 | 本研究构建 |
| E. coli W031/(BT) | 带有质粒pEtac-mdlC-tac-xdh的E. coli W031 | 本研究构建 |
| E. coli W032/(BT) | 带有质粒pEtac-mdlC-tac-xdh的E. coli W032 | 本研究构建 |
| E. coli W003/(BT) | 带有质粒pEtac-mdlC-tac-xdh的E. coli W003 | 本研究构建 |
| E. coli W004/(BT) | 带有质粒pEtac-mdlC-tac-xdh的E. coli W004 | 本研究构建 |
| pEtac-mdlC-tac-xdh[11] | pBBR322 origin, Kanr | 本研究中心保藏 |
| pKD46 | Ampr | 本研究中心保藏 |
| pKD4 | Ampr, FRT-kan-FRT | 本研究中心保藏 |
| pCP20 | Ampr | 本研究中心保藏 |
| 注:Kanr:卡那霉素抗性;Ampr:氨苄青霉素抗性. Note: Kanr: Kanamycin resistance; Ampr: Ampicillin resistance. | ||
| 引物名称Primers name | 引物序列Primers sequences (5′→3′) |
| xylAB-K1 | GAACCGAAACCGCAAGAACCGACCAAACATCAATATGATTACGATGCCGCGTGTAGGCTGGAGCTGCTTC |
| xylAB-K2 | GAATATCTCCGGCTCATGCCGCTGAACCCATAGCAATTTAGGCGCAGTAAGTTCCTATTCCGAAGTTCCTATTCTC |
| xylAB-C1 | ATCGGTTTCCAGGGCAC |
| xylAB-C2 | CGCAGACGCAAGTAATCTTTC |
| yagE-K1 | GAATCATTCCCCCTGTCTCCACCATTTTTACCGCCGACGGCCAGCTCGATGCTTCGAAGTTCCTATACTTTCTAGAG |
| yagE-K2 | CGTATCCAGCTGATACATCTGCGGAATTTGCAGCAAGGTCTGATGATACCGGAATTAGCCATGGTCCATATGA |
| yagE-C1 | CGCAGTCCGCGTTGTTCA |
| yagE-C2 | GGTTTTCAGCTGCGCCTTG |
| yjhH-K1 | AAGTTGCCGACTTCCTGATTAATAAAGGGGTCGACGGGCTGTTTTATCTGGTAGGCTGGAGCTGCTTCG |
| yjhH-K2 | TTGCTTCTTCAGATGCTTCAAGAATCGGTGGTAAGCAATATGTCTCTACACCTCCTTAGTTCCTATTCCG |
| yjhH-C1 | GCATTATTCCACCGGTATCCAG |
| yjhH-C2 | GGTAAGCAGCACGTGGACTT |
| 注:下划线部分为该基因的同源臂序列. Note: The underlined sequences indicate homologous sequence to the respective gene. | |
利用Red重组系统,在野生菌E. coli W3110中分别敲除木糖代谢途径的木糖异构酶基因(xylA)、木酮糖激酶基因(xylB)和裂解2-酮-3-脱氧-木糖酸的醛缩酶基因(yagE和yjhH)。转化子菌落PCR验证结果如图 2所示,野生型大肠杆菌xylAB及yjhH敲除前基因片段大小约为900 bp,yagE基因片段大小约为1 100 bp。而敲除后,xylAB与yagE条带大小约为1 600 bp,yjhH基因片段大小约为1 100 bp。根据条带大小挑取正确转化子,并消除其所带质粒和抗性。所得E. coli W3110 ΔxylAB、E. coli W3110 ΔyagE、E. coli W3110 ΔyjhH,双缺失菌株E. coli W3110 ΔyagEΔyjhH及三缺失菌E. coli W3110 ΔxylABΔyagEΔyjhH分别命名为E. coli W001、E. coli W031、E. coli W032、E. coli W003和E. coli W004。将质粒pEtac-mdlC-tac-xdh转入野生菌和缺失菌中,得到BT合成菌。
|
| 图 2 xylAB基因(A)、yagE基因(B)及yjhH基因(C)敲除的PCR验证 Figure 2 PCR verifications of xylAB (A), yagE (B) and yjhH (C) gene knockout mutants 注:M1:2503 DNA marker;1:E. coli野生菌中xylAB基因PCR产物;2:E. coli xylAB缺失菌中PCR产物;3:E. coli野生菌中yagE基因PCR产物;4:E. coli yagE缺失菌中该基因PCR产物;M2:2501 DNA marker;5:E. coli野生菌中yjhH基因PCR产物;6:E. coli yjhH缺失菌中此基因PCR产物. Note: M1: 2503 DNA marker; 1: PCR of xylAB in E. coli W3110; 2: PCR of xylAB in E.coli ΔxylAB; 3: PCR product of yagE in E. coli W3110 wild-type strain; 4: PCR product of yagEinE. coli ΔyagE; M2: 2501 DNA marker; 5: PCR product of yjhH in E. coli W3110 wild-type strain; 6: PCR product of yjhH gene in E. coli ΔyjhH. |
|
|
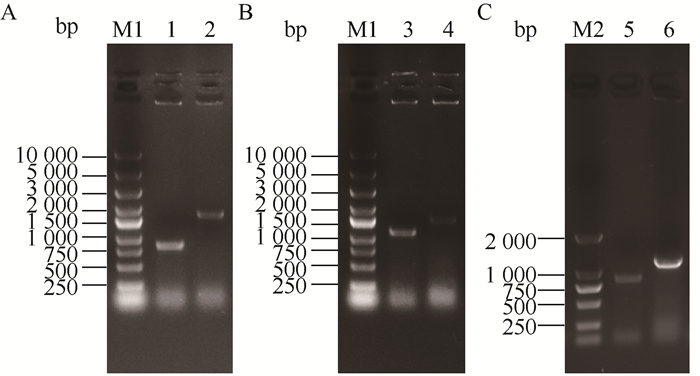
木糖转化为木酮糖随后进入磷酸戊糖途径(PPP),这一途径竞争流向BT的碳源,因此对xylAB进行敲除。如图 3A所示,xylAB的缺失使得重组菌的生物量降低了约57%。与对照菌E. coli W3110/(BT)相比,缺失菌E. coli W001/(BT)的BT积累趋势大致相同,但BT产量下降了20%,而单位菌体产量则提高了约84% (图 3B)。这些结果表明木糖竞争途径的缺失使得BT途径的效率得到了提高,但不利于重组菌的生长,菌体量的降低导致了BT终产量的减少。其原因可能是xylAB缺失使得细胞无法利用木糖进入PPP途径为菌体生长提供能量和碳源。另外,xylAB基因的敲除使得木糖被大量氧化为木糖酸,而下游木糖酸脱水酶催化能力有限,造成木糖酸积累量增加了53%,发酵结束时pH降为4.0 (对照pH约为5.0) (图 4),进一步影响了细胞生长和BT的积累。这与之前报道的敲除xylAB后菌体量下降,木糖酸积累量提高的现象相一致[14]。为了维持较高的菌体量,有学者通过补加葡萄糖[14-15],为菌体提供能量和碳源。而孙文龙的研究结果显示[16],补加其他碳源,不利于菌体有效利用木糖生产BT,因此维持菌体生长与BT途径碳流间的平衡可能是高效生产BT的关键。

|
| 图 3 重组菌利用木糖发酵过程中的生物量(A)和丁三醇产量(B) Figure 3 The biomass (A) and BT titer (B) in the fermentation broth of the recombinant strains |
|
|

|
| 图 4 重组菌利用木糖发酵48 h时木糖酸积累量和pH值 Figure 4 The xylonate titer and the pH value at 48 h in the fermentation broth of the recombinant strains |
|
|
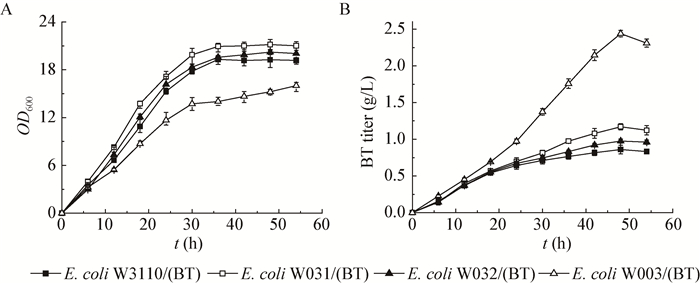
在BT合成途径中,MdlC是来源于恶臭假单胞菌的四聚体蛋白[17],对木糖酸脱水产物KDX的催化能力较弱,难以与宿主中的分支代谢途径(yagE和yjhH)竞争碳流(图 1),影响BT的合成效率。基于此,对yagE和yjhH进行敲除,弱化副产物途径的分流作用。如图 5所示,敲除yagE基因后,E. coli W031/(BT)的生物量相对于出发菌提高了约10%,BT产量提高了36%。单独敲除yjhH基因后,生物量相对于E. coli W3110/(BT)提高了5%,BT产量提高14%。两株菌的单位菌体产量分别提高24%和8% (图 5)。而醛缩酶两基因共同敲除后,重组菌生物量降低了21%,但BT产量提升了184%,达2.44 g/L,高于其它副产物途径敲除的报道[7, 15, 18]。同时,该菌株单位菌体产量提升了258%。上述结果表明,yagE或yjhH基因的单独缺失有利于菌体的生长,而两基因共同缺失影响菌体的积累,关于这两基因对菌体量作用还有待进一步研究。另外,yagE或yjhH基因的单独缺失,对菌株生产BT的能力影响不大,但两基因共同缺失则能使更多的KDX流向BT生产方向,显著提高BT合成效率。已有研究发现,在E. coli MG1655野生菌与yagE、yjhH单缺失菌中构建BT途径后并未检测到BT,但共同敲除这两个基因时,BT产量达0.15 g/L,实现了从无到有的突破[15],与本文结果相似。
|
| 图 5 醛缩酶缺失重组菌利用木糖发酵过程中的生物量(A)和丁三醇产量(B) Figure 5 The biomass (A) and BT titer (B) of the recombinant strains |
|
|
我们注意到敲除KDX代谢途径,木糖酸的积累量有小幅度的下降(分别下降了10%、7%和12%) (图 4),同时敲除两条副产物途径是否可以弱化木糖酸积累对菌体代谢的影响?为进一步提高BT产量,对xylAB、yagE及yjhH三个基因进行共敲除。如图 3所示,重组菌E. coli W004/(BT)生物量相比于E. coli W3110/(BT)下降了72%,BT产量提高了43%,为1.23 g/L,单位菌体产量提高约4倍,为本文所有菌株中单位产量最高者。同时,木糖酸积累量仍比E. coli W3110/(BT)提高了50%,pH降为4.1 (图 4)。这一结果再次验证了xylAB基因对细胞生长及BT高产的重要性,直接敲除并不利于BT的积累。因此,Valdehuesa等[7]和Sun等[18]在xylAB缺失的基础上敲除KDX分支代谢途径并不利于BT的积累和高产,导致产量仅为0.88 g/L和0.3 g/L。
2.5 pH控制下菌体生长及代谢情况重组大肠杆菌在pH非调控自然条件下,发酵前18 h木糖酸大量积累,pH明显下降,这可能会对菌体生长及代谢造成影响。通过添加4 mol/L的NaOH溶液中和发酵液中的木糖酸,使发酵液pH维持在7.0±0.5,发酵结果如图 6所示。重组菌在pH调控条件下,生长速度略有提升(图 6A),30 h左右菌体量达到最高值,最大生物量与调控前无明显区别。细胞代谢方面,pH控制策略下BT积累趋势与之前基本相同(图 6B),但由于发酵环境更有利于BT合成途径中的酶发挥作用,强化该途径效率,木糖酸积累量显著下降(图 6C),BT终产量也有了不同程度的提高,重组菌E. coli W003/(BT)在48 h时BT产量可达3.11 g/L,相较于pH非控制条件提高了27%。

|
| 图 6 pH调控下重组菌利用木糖发酵过程中的生物量(A)、丁三醇产量(B)、48 h时木糖酸积累量(C) Figure 6 The biomass (A), BT titer (B) and xylonate titer at 48 h (C) of the recombinant strains under pH control strategy |
|
|
本研究通过对大肠杆菌中利用木糖合成BT的途径进行分析,敲除木糖及2-酮-3-脱氧-木糖酸的分支代谢途径相关基因(xylAB,yagE,yjhH),考察对菌体生长及产物合成的影响。研究结果表明,单独敲除xylAB基因,有利于强化BT途径效率,但不利于菌体生长和BT积累。yagE或yjhH单独缺失时,由于剩下一个基因的补偿作用,重组菌BT生产能力提高不明显;但两基因共同缺失后,BT合成效率有显著提升,最高产量达2.44 g/L,高于国内外其它敲除副产物途径的报道。两途径共缺失重组菌E. coli W004/(BT)的单位菌体产量最高,但由于xylAB基因的缺失导致菌体量明显降低,不利于高产BT。pH控制下,重组菌合成BT能力有所提升,但对副产物途径相关基因的作用效果影响不大,BT产量最高菌株仍为E. coli W003/(BT),达3.11 g/L。因此,维持生长及BT途径中碳流平衡是提高BT产量的关键,后续研究可以尝试对xylAB的表达量进行调控,实现菌体生长、BT途径效率间的平衡和产物合成的最大化。
| [1] | Tan R, Liu DX. Synthesis of cationic lipids from 1, 2, 4-butanetriol[J]. Tetrahedron Letters 1999, 40(2) : 209–212. DOI:10.1016/S0040-4039(98)02381-8 |
| [2] | Yamaguchi A, Hiyoshi N, Sato O, et al. Enhancement of cyclic ether formation from polyalcohol compounds in high temperature liquid water by high pressure carbon dioxide[J]. Green Chemistry 2009, 11(1) : 48–52. DOI:10.1039/B812318G |
| [3] | Yamada-Onodera K, Norimoto A, Kawada N, et al. Production of optically active 1, 2, 4-butanetriol from corresponding racemate by Microbial stereoinversion[J]. Journal of Bioscience and Bioengineering 2007, 103(5) : 494–496. DOI:10.1263/jbb.103.494 |
| [4] | Niu W, Molefe MN, Frost JW. Microbial synthesis of the energetic material precursor 1, 2, 4-butanetriol[J]. Journal of the American Chemical Society 2003, 125(43) : 12998–12999. DOI:10.1021/ja036391+ |
| [5] | Furukawa Y, Ho S, Ikai K, et al. Process for producing 1, 2, 4-butanetriol: Europe, EP 1061060 B1[P]. 2005-01-12 |
| [6] | Li CF, Xu BG. A review on the synthesis of 1, 2, 4-butantriol[J]. Hunan Chemical Industry 2000, 30(3) : 9–11. (in Chinese) 李赤峰, 徐保国. 1, 2, 4-丁三醇合成工艺述评[J]. 湖南化工 2000, 30(3) : 9–11. |
| [7] | Valdehuesa KNG, Liu HW, Ramos KRM, et al. Direct bioconversion of D-xylose to 1, 2, 4-butanetriol in an engineered Escherichia coli[J]. Process Biochemistry 2014, 49(1) : 25–32. DOI:10.1016/j.procbio.2013.10.002 |
| [8] | Li XH, Cai Z, Li Y, et al. Design and construction of a non-natural malate to 1, 2, 4-butanetriol pathway creates possibility to produce 1, 2, 4-butanetriol from glucose[J]. Scientific Reports 2014, 4 : 5541. |
| [9] | Valdehuesa KNG, Lee WK, Ramos KRM, et al. Identification of aldehyde reductase catalyzing the terminal step for conversion of xylose to butanetriol in engineered Escherichia coli[J]. Bioprocess and Biosystems Engineering 2015, 38(9) : 1761–1772. DOI:10.1007/s00449-015-1417-4 |
| [10] | Liu HW, Ramos KRM, Valdehuesa KNG, et al. Biosynthesis of ethylene glycol in Escherichia coli[J]. Applied Microbiology and Biotechnology 2013, 97(8) : 3409–3417. DOI:10.1007/s00253-012-4618-7 |
| [11] | Sun WL, Lu XY, Zong H, et al. Biosynthesis of D-1, 2, 4-butanetriol by an engineered Escherichia coli[J]. Microbiology China 2014, 41(10) : 1948–1954. (in Chinese) 孙文龙, 陆信曜, 宗红, 等. 代谢工程改造大肠杆菌合成D-1, 2, 4-丁三醇[J]. 微生物学通报 2014, 41(10) : 1948–1954. |
| [12] | Li ZF, Gu ZB, Wang M, et al. Delayed supplementation of glycine enhances extracellular secretion of the recombinant α-cyclodextrin glycosyltransferase in Escherichia coli[J]. Applied Microbiology and Biotechnology 2010, 85(3) : 553–561. DOI:10.1007/s00253-009-2157-7 |
| [13] | Lien OG. Determination of gluconolactone, galactonolactone, and their free acids by hydroxamate method[J]. Analytical Chemistry 1959, 31(8) : 1363–1366. DOI:10.1021/ac60152a035 |
| [14] | Liu HW, Valdehuesa KNG, Nisola GM, et al. High yield production of D-xylonic acid from D-xylose using engineered Escherichia coli[J]. Bioresource Technology 2012, 115 : 244–248. DOI:10.1016/j.biortech.2011.08.065 |
| [15] | Ma PF, Meng J, Zhou J, et al. Biosynthesis of D-1, 2, 4-butanetriol from D-xylose by recombinant Escherichia coli[J]. CIESC Journal 2015, 66(7) : 2620–2627. (in Chinese) 马鹏飞, 蒙坚, 周静, 等. 重组大肠杆菌利用D-木糖合成D-1, 2, 4-丁三醇[J]. 化工学报 2015, 66(7) : 2620–2627. |
| [16] | Sun WL. The cloning of key genes and the recombinant construction involved in the biosynthesis of D-1, 2, 4-butanetriol[D]. Wuxi: Master's Thesis of Jiangnan University, 2014 (in Chinese) 孙文龙.生物法合成D-1, 2, 4-丁三醇关键基因的克隆及重组菌的构建[D].无锡:江南大学硕士学位论文, 2014 |
| [17] | Yep A, Kenyon GL, McLeish MJ. Saturation mutagenesis of putative catalytic residues of benzoylformate decarboxylase provides a challenge to the accepted mechanism[J]. Proceedings of the National Academy of Sciences of the United States of America 2008, 105(15) : 5733–5738. DOI:10.1073/pnas.0709657105 |
| [18] | Sun L, Yang F, Sun HB, et al. Synthetic pathway optimization for improved 1, 2, 4-butanetriol production[J]. Journal of Industrial Microbiology & Biotechnology 2015, 43(1) : 67–78. |
 2017, Vol. 44
2017, Vol. 44