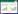扩展功能
文章信息
- 李斌, 聂尧, 徐岩
- LI Bin, NIE Yao, XU Yan
- 高选择性不对称还原N, N-二甲基-3-酮-3-(2-噻吩)-1-丙胺的重组氧化还原酶催化性质及其酶促转化
- Characterization of highly stereoselective oxidoreductase for asymmetric reduction of N, N-dimethyl-3-keto-3-(2-thienyl)-1-propanamine
- 微生物学通报, 2017, 44(1): 1-8
- Microbiology China, 2017, 44(1): 1-8
- DOI: 10.13344/j.microbiol.china.160201
-
文章历史
- 收稿日期: 2016-03-09
- 接受日期: 2016-04-29
- 优先数字出版日期(www.cnki.net): 2016-06-07
2. 江南大学食品生物技术国家重点实验室 江苏 无锡 214122
2. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi, Jiangsu 214122, China
氧化还原酶具有高度的化学选择性(Chemoselectivity)、区域选择性(Regionselectivity)和对应选择性(Enantioselectivity),催化氧化还原过程需要辅酶的参与,特别适合用来催化不对称反应,得到重要的手性化合物,用作工业应用中重要的手性砌块[1]。
度洛西汀,英文名(R)-Duloxetine,化学名(S)-N-甲基-3-(1-萘氧基)-3-(2-噻吩基)-1-丙胺,商品名欣百达,是一种5-羟色胺和去甲肾上腺素再摄取的双重抑制剂(SNRIs)[2]。临床上应用其盐酸盐治疗抑郁症、压力性尿失禁、抑郁症伴发慢性疼痛、糖尿病周围神经病性疼痛[3]。度洛西汀的两种化学组成相同的同分对映异构体中,只有(S)-型具有上述药理活性[4]。目前有很多不对称合成手性度洛西汀的方法[5]。通过逆合成分析可以发现,(S)-N, N-二甲基-3-羟基-3-(2-噻吩)-1-丙胺(DHTP)是制备度洛西汀的一种重要手性中间体,N, N-二甲基-3-酮-3-(2-噻吩)-1-丙胺(DKTP)可以被不对称还原生成(S)-DHTP,因而通过(S)-专一性不对称还原DKTP已经成为高效制备度洛西汀的一种重要方法[2]。
生物法制备手性醇具有高效、专一、立体选择性好、反应条件温和等优点,已经成为制备手性醇的重要手段[6-9]。目前,已经筛选得到多株能够不对称还原DKTP制备度洛西汀中间体(S)-DHTP的微生物,例如Exiguobacterium sp.、Thermoanaerobacter sp.、Candida tropicalis、C.parapsilosis、C.viswanathii、Sporobolomyces salmonicolor AKU4429等[10-15]。其中C. tropicalis、C. viswanathii催化1 g/L DKTP不对称生成(S)-DHTP时,转化率为80%左右、对映体过量值 > 99%,但是反应时间长达60 h,效率低下,大大限制了其工业应用[12-13, 16]。目前国内度洛西汀手性中间体的研究较少,且水平较低[15, 17]。因此,有必要寻找高选择性的氧化还原酶,以实现DKTP不对称生成(S)-DHTP的高效生物反应制备。
本研究从研究室已有的多株立体选择性氧化还原酶重组大肠杆菌出发,通过Ni离子亲和层析法纯化得到重组氧化还原酶,以DKTP为底物,考察不同重组氧化还原酶对DKTP的催化活性和选择性,进一步对高选择性酶促合成(S)-DHTP的重组酶CR2进行性质分析,并考察其在最适条件下不对称还原DKTP的过程。
1 材料与方法 1.1 菌株E. coli BL21/pET21c-adhr、E. coli BL21/ pET21c-c1、E. coli BL21/pET21c-c2、E. coli BL21/pET21c-cr2、E. coli BL21/pET21c-cr4、E. coli BL21/pET21c-krd、E. coli BL21/pET21c-oye、E. coli BL21/pET21c-rcr、E. coli BL21/pET21c-s1、E. coli BL21/pET21c-scr、E. coli BL21/pET21c-scr1、E. coli BL21/pET21c-scr3由江南大学酿造微生物学及应用酶学研究室保藏。
1.2 主要试剂及仪器N, N-二甲基-3-酮-3-(2-噻吩)-1-丙胺(DKTP)、(S)-N, N-二甲基-3-羟基-3-(2-噻吩)-1-丙胺(DHTP)、(R, S)-DHTP均购自百灵威科技有限公司;氨苄青霉素、IPTG、辅酶NAD (P) H、NAD (P)+均购自上海生工生物技术有限公司;正己烷(色谱纯)、异丙醇(色谱纯)购于Damas-beta公司;其他分析纯试剂均购自国药集团化学试剂有限公司。
主要仪器:酶标仪购自Thermo公司;pH计购自Mettler Toledo公司;高效液相色谱仪Agilent 1200购自美国Agilent公司。
1.3 培养基LB培养基(g/L):酵母提取物5.0,蛋白胨10.0,NaCl 10.0,pH 7.0,固体培养基加入20.0 g/L琼脂。培养基的灭菌条件:1×105 Pa,灭菌30 min。
1.4 氧化还原酶的诱导表达及分离纯化挑取氧化还原酶重组菌单菌落接种到含80 mg/L氨苄青霉素的4 mL LB液体培养基中,37 ℃、200 r/min振荡培养过夜,并以2%的接种量转接到含80 mg/L氨苄青霉素的100 mL LB液体培养基中,37 ℃、200 r/min振荡培养至OD600为0.6−0.8时,向培养基中加入0.1 mmol/L IPTG,17℃、200 r/min诱导表达12 h。
将诱导表达后的发酵液离心,收集菌体并用生理盐水洗涤3次,重悬于20 mmol/L Tris-HCl缓冲液(pH 7.0),高压匀浆破碎。4℃条件下12 000 r/min离心收集上清液并用0.22μm滤膜过滤,即为粗酶液。采用Ni离子亲和层析法对重组氧化还原酶进行分离纯化:在4℃条件下,先后用20 mL 20%乙醇、40 mL超纯水冲洗柱子,再用20 mL的Binding buffer (20 mmol/L Tris-HCl,0.3 mol/L NaCl,40 mmol/L咪唑,pH 7.0)平衡柱子,平衡完成后将粗酶液缓慢加入柱中,先后用10 ml Binding buffer、10 ml 60 mmol/L咪唑(20 mmol/L Tris-HCl,0.3 mol/L NaCl,60 mmol/L咪唑,pH 7.0)洗去亲和力较弱的杂蛋白,最后加入Elution buffer (20 mmol/L Tris-HCl,0.3 mol/L NaCl,300 mmol/L咪唑,pH 7.0)进行洗脱,得到目标蛋白液。目标蛋白液经过超滤浓缩后,参照PD-10 Desalting column脱盐柱进行目标蛋白溶液的脱盐,所得蛋白酶液经SDS-PAGE检验其纯度[18]。
1.5 重组氧化还原酶活性及酶学性质检测重组酶酶活测定体系:100 μL体系中含0.1 mol/L Tris-HCl缓冲液(pH 7.5),0.5 mmol/L NAD (P) H,5 mmol/L底物,30℃恒温3 min,最后加入适量纯酶液混合均匀后,开始扫描340 nm处的吸光值变化。重组酶活性测定实验重复3次,取平均值。
1个酶活单位(U)是指每分钟催化氧化1 µmol辅酶NAD (P) H的酶量。
蛋白含量的测定:用Thermo Scientific Nanodrop 8000型检测器检测280 nm处的吸光值E,目标蛋白浓度根据摩尔消光系数换算得到,即蛋白浓度(g/L)=E/摩尔消光系数,重组酶的摩尔消光系数通过在线网站http://www.expasy.org/预测获得。比活计算公式:比活(U/mg)=酶活(U)/蛋白量(mg)。
测定重氧化还原酶的动力学参数时,测定体系为100 μL体系中含0.1 mol/L Tris-HCl缓冲液(pH 7.5),辅酶NAD (P) H 0.5 mmol/L,底物(0.05−0.4 mmol/L)和适量的纯酶液。动力学性质研究实验重复3次取平均值,并利用Lineweaver-Burk作图法获得重组酶的动力学参数。
分别在不同pH梯度(6.0−9.0)和不同温度梯度(20−80 ℃)下测定重组氧化酶的酶活,以确定重组氧化酶的最适pH、最适温度。
将纯化得到的重组氧化还原酶分别置于不同温度(15−70℃)处理12 h,测定其温度稳定性。将重组氧化还原酶在4℃分别置于不同pH梯度(6.0−9.0)处理12 h,测定其酸碱耐受性。
在反应体系中添加终浓度1 mmol/L的金属离子螯合剂EDTA (Na)2,考察其对酶催化活性的影响。随后,在金属离子螯合剂EDTA (Na)2处理后的酶液体系中添加不同种类的金属离子(终浓度1 mmol/L CaCl2、CuSO4、FeSO4、FeCl3、MgSO4、MnCl2、NiSO4、ZnSO4),考察不同金属离子对酶催化活性的影响。
1.6 重组氧化还原酶对DKTP的不对称转化反应体系为2 ml Tris-HCl缓冲液(pH 7.5)中含有5 mmol/L DKTP、等摩尔的辅酶NAD (P) H和适量酶液于30 ℃、200 r/min反应8 h。反应结束后,加入2倍体积乙酸乙酯萃取,有机相用于高效液相色谱仪分析产物光学纯度及产率,本文中的生物转化实验均重复3次取平均值。
在最适反应pH、最适反应温度下,将纯化所得的氧化还原酶与1 g/L底物反应不同时间,测定其底物催化反应特性。
1.7 HPLC检测条件产物检测均在Agilent 1200型液相色谱仪上进行。
DKHP的检测条件:Chiralcel OD-H柱(250 mm×4.6 mm),紫外检测波长241 nm,流动相为正己烷:异丙醇(98:2,体积比),流速0.8 mL/min。出峰时间:(R)-DHTP 16.4 min、(S)-DHTP 18.3 min。
2 结果与分析 2.1 重组氧化还原酶的表达及纯化将12株重组氧化还原酶菌株E. coli BL21/pET21c-adhr、E. coli BL21/pET21c-c1、E. coli BL21/pET21c-c2、E. coli BL21/pET21c-cr2、E. coli BL21/pET21c-cr4、E. coli BL21/pET21c-krd、E. coli BL21/pET21c-oye、E. coli BL21/pET21c-rcr、E. coli BL21/pET21c-s1、E. coli BL21/pET21c-scr、E. coli BL21/pET21c-scr1、E. coli BL21/pET21c-scr3的种子液转接到含氨苄抗性的LB液体培养基中培养,并用IPTG进行诱导,将收集的菌体重悬于Tris-HCl缓冲液中,高压匀浆破碎、离心、过膜得到粗酶液。然后用Ni离子亲和层析法对各重组氧化还原酶进行分离纯化,经SDS-PAGE检验,各重组氧化还原酶条带和理论值一致,如图 1所示。纯化蛋白用于下一步的酶学特性分析。

|
| 图 1 重组氧化还原酶的SDS-PAGE电泳图谱 Figure 1 SDS-PAGE analysis of purified recombinant oxidoreductases 注:M:Marker;1-12:纯化重组氧化还原酶ADHR、C1、C2、CR2、CR4、KRD、OYE、RCR、S1、SCR、SCR1、SCR3. Note: M: Marker; 1-12: Purified recombinant oxidoreductases ADHR, C1, C2, CR2, CR4, KRD, OYE, RCR, S1, SCR, SCR1, SCR3. |
|
|
分别测定12种重组氧化还原酶催化还原DKTP的活性及其相应产物DHTP的立体构型,结果如表 1所示。其中,CR2、KRD催化不对称还原DKTP的产物构象为(S)-型,CR4、OYE不对称还原DKTP的产物结构为(R)-型。在催化(S)-专一性不对称还原DKTP的氧化还原酶中,CR2的比活和选择性均明显高于KRD,且产物为光学纯的(S)-型单一对映体(图 2)。由于度洛西汀的两种对映异构体中只有(S)-型具有药理活性,因此CR2在不对称合成度洛西汀医药中间体的催化转化方面具有较为明显的应用潜力,并以CR2作为目标氧化还原酶进行催化性质的研究。
| 重组氧化还原酶Recombinant oxidoreductases | 基因数据库序列编号GenBank accession No. | 比活Specific activity (U/mg) | 产物构型Product configuration | 光学纯度Optical purity (% e.e.) |
| ADHR | AY267012 | - | - | |
| C1 | AB084515 | - | - | |
| C2 | AB084516 | - | - | |
| CR2 | AB183149 | 1.16 | S | 99.9 |
| CR4 | E59061 | 0.58 | R | 99.9 |
| KRD | AF178079 | 0.39 | S | 32.7 |
| OYE | AB126227 | 1.25 | R | 99.9 |
| RCR | DQ295067 | - | - | |
| S1 | AB036927 | - | - | |
| SCR | DQ675534 | - | - | |
| SCR1 | FJ939565 | - | - | |
| SCR3 | FJ939564 | - | - | |
| 注:e.e.:对映体过量. Note: e.e.: enantiomeric excess. | ||||

|
| 图 2 重组酶CR2不对称还原DKTP的产物分析 Figure 2 Analysis of chiral products from asymmetric reduction of DKTP by purified recombinant CR2 注:A:(R)-DHTP (保留时间,16.4 min)和(S)-DHTP (保留时间,18.3 min)的标准样;B:没有酶作用的DKTP (保留时间,17.3 min);C:反应产物. Note: A: Standard samples (R)-DHTP (retention time, 16.4 min) and (S)-DHTP (retention time, 18.3 min); B: DKTP without enzyme (retention time, 17.3 min); C: Reaction products. |
|
|

|
| 图 3 重组酶CR2的双倒数曲线 Figure 3 Recombinant CR2 double reciprocal curve |
|
|
|
| 图 4 pH对CR2活性的影响 Figure 4 Effect of pH on recombinant CR2 activity |
|
|

|
| 图 5 温度对重组酶CR2活性的影响 Figure 5 Effect of temperature on recombinant CR2 activity |
|
|

|
| 图 6 重组酶CR2的热稳定性 Figure 6 Thermal stability of recombinant CR2 |
|
|
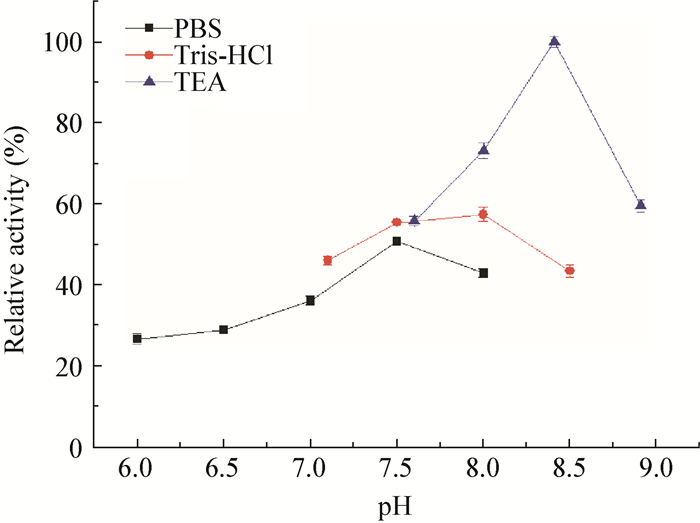
|
| 图 7 pH对CR2稳定性的影响 Figure 7 Effects of pH on recombinant CR2 stability |
|
|
| 化合物Compound | CR2相对酶活Relative activity of CR2 (%) |
| No addition | 100 |
| EDTA (Na)2 | 80 |
| CaCl2 | 23 |
| CuSO4 | 65 |
| FeSO4 | 84 |
| FeCl3 | 35 |
| MgSO4 | 36 |
| MnCl2 | 70 |
| NiSO4 | 63 |
| ZnSO4 | 108 |
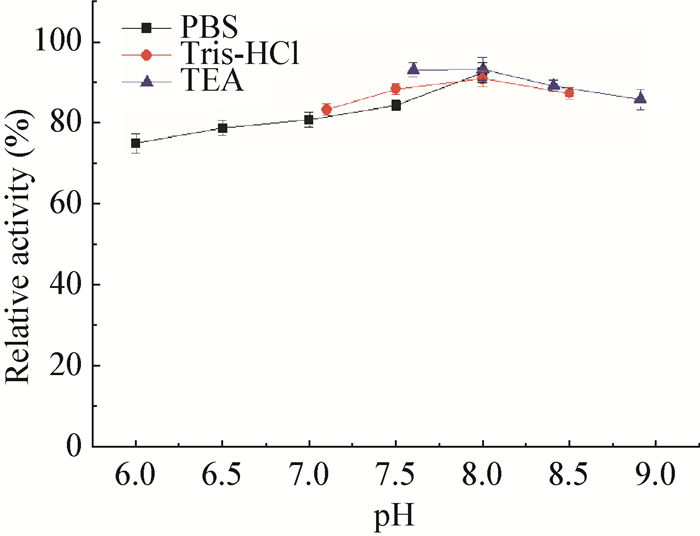
在0.1 mol/L TEA缓冲液(pH 8.4)和35 ℃条件下,将纯化所得CR2催化1 g/L DKTP反应不同时间,HPLC检测反应产物(S)-DHTP的产率和光学纯度,结果如图 8所示。在CR2催化DKTP不对称还原的反应过程中,仅能检测到(S)-DHTP单一对映体产物,产物在反应0−4 h内快速生成和积累,反应4 h产物产率即可达到80%,在反应4−6 h内产率增长速率逐渐减缓,并于反应6 h时产率达到最大值92.1%,后续时间内产率保持稳定。已有文献[12-13, 16]报道,来源于C. viswanathii、C.tropicalis的氧化还原酶催化不对称还原1 g/L DKTP所需的反应时间长达60 h,并且产率只有80%左右。因此,重组氧化还原酶CR2具有进一步高效催化不对称还原DKTP生成度洛西汀中间体(S)-DHTP的应用潜力。
|
| 图 8 CR2最佳反应时间的测定 Figure 8 The determination of optimum reaction time of CR2 |
|
|
(S)-DHTP是生产度洛西汀的重要中间体,可由DKTP不对称还原获得。本研究从具有不同催化特性的多种立体选择性氧化还原酶出发,以DKTP为底物,获得高立体选择性不对称还原DKTP生成度洛西汀中间体(S)-DHTP的立体选择性氧化还原酶CR2。该酶对于DKTP底物具有较强的亲和性,最适pH为pH 8.4 (0.1 mol/L TEA),最适反应温度为35℃,在10−45℃和pH 7.5−8.5条件下较为稳定,Zn2+对该酶的催化活性具有促进作用。在最适条件下,重组氧化还原酶CR2催化不对称还原DKTP获得产物(S)-DHTP的产率达92.1%,光学纯度达99.9%。相比于其他已报道的可作用于DKTP生物合成(S)-DHTP的菌种和氧化还原酶,如Exiguobacterium sp.、Thermoanaerobacter sp.、C. tropicalis、C. viswanathii等菌株及其功能酶[10-13, 16],CR2具有适于转化反应的酶学性质,并能够高立体选择性催化不对称还原DKTP生成度洛西汀中间体(S)-DHTP,具有一定的应用潜力。
| [1] | Schoemaker HE, Mink D, Wubbolts MG. Dispelling the myths-biocatalysis in industrial synthesis[J]. Science 2003, 299(5613) : 1694–1697. DOI:10.1126/science.1079237 |
| [2] | Liu HL, Hoff BH, Anthonsen T. Chemo-enzymatic synthesis of the antidepressant duloxetine and its enantiomer[J]. Chirality 2000, 12(1) : 26–29. DOI:10.1002/(ISSN)1520-636X |
| [3] | Vey EL, Kovelman I. Adverse events, toxicity and post-mortem data on duloxetine: case reports and literature survey[J]. Journal of Forensic and Legal Medicine 2010, 17(4) : 175–185. DOI:10.1016/j.jflm.2010.02.002 |
| [4] | Reddy PRM, Sreeramulu J, Naidu PY, et al. Stability indicating fast LC for the simultaneous estimation of intermediates and degradants of duloxetine hydrochloride[J]. Chromatographia 2010, 71(1/2) : 95–100. |
| [5] | Tang CG, Lin H, Zhang C, et al. Highly enantioselective bioreduction of N-methyl-3-oxo-3-(thiophen-2-yl) propanamide for the production of (S)-duloxetine[J]. Biotechnology Letters 2011, 33(7) : 1435–1440. DOI:10.1007/s10529-011-0578-8 |
| [6] | Xiao ZJ, Du PX, Lou WY, et al. Using water-miscible ionic liquids to improve the biocatalytic anti-Prelog asymmetric reduction of prochiral ketones with whole cells of Acetobacter sp CCTCC M209061[J]. Chemical Engineering Science 2012, 84 : 695–705. DOI:10.1016/j.ces.2012.09.019 |
| [7] | Yamamoto H, Kudoh M. Novel chiral tool, (R)-2-octanol dehydrogenase, from Pichia finlandica: purification, gene cloning, and application for optically active alpha-haloalcohols[J]. Applied Microbiology and Biotechnology 2013, 97(18) : 8087–8096. DOI:10.1007/s00253-012-4643-6 |
| [8] | Hollmann F, Arends IWCE, Holtmann D. Enzymatic reductions for the chemist[J]. Green Chemistry 2011, 13(9) : 2285–2314. DOI:10.1039/c1gc15424a |
| [9] | Wohlgemuth R. Asymmetric biocatalysis with microbial enzymes and cells[J]. Current Opinion in Microbiology 2010, 13(3) : 283–292. DOI:10.1016/j.mib.2010.04.001 |
| [10] | Breuer M. Method for production of (1S)-3-chloro-1-(2-thienyl)-propan-1-ol using alcohol dehydrogenase from thermoanaerobacter: US, US7790436[P]. 2010-09-07 |
| [11] | Wada M, Yoshizumi A, Furukawa Y, et al. Cloning and overexpression of the Exiguobacterium sp. F42 gene encoding a new short chain dehydrogenase, which catalyzes the stereoselective reduction of ethyl 3-oxo-3-(2-thienyl) propanoate to ethyl (S)-3-hydroxy-3-(2-thienyl) propanoate[J]. Bioscience, Biotechnology, and Biochemistry 2004, 68(7) : 1481–1488. DOI:10.1271/bbb.68.1481 |
| [12] | Soni P, Banerjee UC. Biotransformations for the production of the chiral drug (S)-Duloxetine catalyzed by a novel isolate of Candida tropicalis[J]. Applied Microbiology and Biotechnology 2005, 67(6) : 771–777. DOI:10.1007/s00253-004-1870-5 |
| [13] | Soni P, Kansal H, Banerjee UC. Optimization of process parameters for the production of carbonyl reductase by Candida viswanathii in a laboratory-scale fermentor[J]. Journal of Industrial Microbiology & Biotechnology 2008, 35(3) : 167–173. |
| [14] | Guo RY, Nie Y, Mu XQ, et al. A novel aldo-keto reductase for the biocatalytic synthesis of (S)-N, N-dimethyl-3-hydroxy-3-(2-thienyl)-1-propanamine[J]. Chemical Industry and Engineering Progress 2014, 33(9) : 2344–2349. (in Chinese) 郭荣云, 聂尧, 穆晓清, 等. 新型醛酮还原酶不对称转化制备(S)-N, N-二甲基-3-羟基-3-(2-噻吩)-1-丙胺[J]. 化工进展 2014, 33(9) : 2344–2349. |
| [15] | Zhang DL, Chen X, Chi J, et al. Semi-rational engineering a carbonyl reductase for the enantioselective reduction of β-amino ketones[J]. ACS Catalysis 2015, 5(4) : 2452–2457. DOI:10.1021/acscatal.5b00226 |
| [16] | Kansal H, Banerjee UC. Enhancing the biocatalytic potential of carbonyl reductase of Candida viswanathii using aqueous-organic solvent system[J]. Bioresource Technology 2009, 100(3) : 1041–1047. DOI:10.1016/j.biortech.2008.08.042 |
| [17] | Shen YX. Biotransformations of (S)-N, N-dimethyl-3-hydroxy-3-(2-thienyl)-1-propanamine[D]. Yangzhou: Master's Thesis of Yangzhou University, 2009 (in Chinese) 沈云霞.度洛西汀中间体手性醇的生物转化[D].扬州:扬州大学硕士学位论文, 2009 |
| [18] | Qiao YY, Fan DD, Deng JJ, et al. The purification of recombinant human-like colleagen by Ni (Ⅱ)-based immobilized metal ion affinity chromatography[J]. Highlights of Sciencepaper Online 2013, 6(5) : 402–406. (in Chinese) 乔媛媛, 范代娣, 邓建军, 等. 镍离子亲和层析纯化重组类人胶原蛋白[J]. 中国科技论文在线精品论文 2013, 6(5) : 402–406. |
| [19] | Kataoka M, Doi K, Sim T, et al. A novel NADPH-dependent carbonyl reductase of Candida macedoniensis: purification and characterization[J]. Archives of Biochemistry and Biophysics 1992, 294(2) : 469–474. DOI:10.1016/0003-9861(92)90713-7 |
| [20] | Chen XX. Asymmetric enzymatic reduction of prochiral β-ketoesters by enzyme-coupled system[D]. Wuxi: Master's Thesis of Jiangnan University, 2014 (in Chinese) 陈星星.酶偶联法不对称还原潜手性β-酮酯类化合物的研究[D].无锡:江南大学硕士学位论文, 2014 |
 2017, Vol. 44
2017, Vol. 44