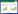扩展功能
文章信息
- 洪文珊, 郑作宜, 陈日荣, 朱华晨, 王嘉
- HONG Wen-Shan, ZHENG Zuo-Yi, CHEN Ri-Rong, ZHU Hua-Chen, WANG Jia
- 血液通路在H5N1高致病性禽流感病毒入侵小鼠中枢神经系统中的作用
- Role of blood pathway in the invasion of highly pathogenic H5N1 avian influenza virus into the central nervous system
- 微生物学通报, 2016, 43(9): 2056-2062
- Microbiology China, 2016, 43(9): 2056-2062
- DOI: 10.13344/j.microbiol.china.150828
-
文章历史
- 收稿日期: 2015-10-27
- 接受日期: 2015-12-15
- 优先数字出版日期(www.cnki.net): 2016-01-06
2. 香港大学新发传染性疾病国家重点实验室 香港 999077
2. State Key Laboratory of Emerging Infectious Diseases, the University of Hong Kong, Hongkong 999077, China
甲型流感病毒感染可引起中枢神经系统症 状——在过去的数次流感大流行甚至是季节性流感中,均有流感患者出现脑炎、脑炎后帕金森症或行为异常等现象的报道[1-4]。虽然,H5N1高致病性禽流感病毒感染引起人的神经系统感染的报道不 多[5-7],但多种感染了H5N1的动物脑内却常常能检测到病毒,有些动物甚至可出现肢体抽搐、偏瘫等症状[8-11]。大量研究表明:神经通路是流感病毒进入中枢神经系统的一个重要渠道[12-15],鼻腔接种的病毒可经嗅球、嗅束上行进入大脑[13, 15],在其他颅神经和外周神经上也可检测到病毒[13]。然而,由于H5高致病性禽流感病毒在HA1-HA2链接位点上具有多碱性氨基酸,这使病毒具备了在多种组织中裂解活化的能力,肺外器官侵袭性成为了H5N1病毒致病性的一个重要特征[16-17]。一个被学界普遍认同的看法是:H5N1亚型流感病毒对肺外器官的侵袭是通过病毒血症实现的。但是,目前尚无证据显示,病毒可以通过血液途径进入中枢神经系统[12, 18]。为此,我们以BALB/c小鼠为动物模型,分别用3株H5N1病毒进行接种感染,从肺、脑、血病毒动力学变化和动态病理性改变入手,探索病毒通过血液途径进入中枢神经系统的可能性。
1 材料与方法 1.1 病毒A/Indonisia/5/2005(IDN5)、Bar-headed Goose/Qinghai/65/2005(QH65)和Duck/Fujian/668/2006 (FJ668) 3株H5N1流感病毒由香港大学李嘉诚医学院新发传染性疾病国家重点实验室提供。本研究开展前已通过实验确定IDN5、QH65和FJ668对BALB/c小鼠的半数致死量(Median lethal dose,MLD50)分别为102.69、102.25和103.42 PFU/mL。所有涉及活病毒的实验操作均在生物安全三级实验室中进行。
1.2 动物85只8−9周龄的雌性BALB/c小鼠(购自北京维通利华公司)随机分为4组,其中3组为感染组,每组(n=25)接种1株H5N1病毒,另1组为对照组(n=10),接种磷酸盐缓冲液(Phosphate buffered saline,PBS)。实验开始前小鼠置于负压小鼠隔离笼及实验室内预适应5 d。感染时,实验组小鼠滴鼻接种25 μL含1 MLD50病毒剂量的稀释液;对照组接种等体积PBS。实验期间每日监测记录小鼠体重及症状。在感染后2、4、6、8 d,麻醉剖杀感染组每组5只小鼠和对照组2只小鼠,取肺、脑和血液样本做病毒及病理检测。实验过程中体重下降超过30%的小鼠予以麻醉剖杀。病亡或低体重处死的小鼠也取样检测。
1.3 主要试剂和仪器:磷酸盐缓冲液,武汉博士德生物工程有限公司;苏木精-伊红,西格玛奥德里奇中国;NP蛋白鼠单克隆抗体,厦门大学夏宁邵教授提供;生物素标记的羊抗鼠IgG抗体,Calbiochem公司;抗神经元特异性烯醇化酶羊多克隆抗体,北京生物合成生物技术有限公司;抗胶质纤维酸性蛋白兔多克隆抗体,Abcam公司;异硫氰酸荧光素标记的鸡抗兔IgG抗体、驴抗羊IgG抗体、罗丹明标记的鸡抗鼠IgG抗体,Santa Cruz公司;QIAamp Viral RNA Mini试剂盒,QIAamp RNA Blood Mini试剂盒,Qiagen公司;SuperScript® III Reverse Transcriptase试剂盒,Invitrogen公司;AmpliTaq® DNA Polymerase,Applied Biosystems公司;Eclipse 80i研究级荧光显微镜,尼康;PCR扩增仪,Applied Biosystems公司。
1.4 肺、脑组织病毒量滴定小鼠左侧肺、脑组织取样后称重并用1 mL的PBS制备组织匀浆。匀浆上清于−80 ℃冻存,滴定时整批同时取出融解,1׃10梯度稀释后以MDCK细胞做空斑滴定。每个样本平行滴定2次,空斑滴定检测下限为12.5 PFU/mL。
1.5 肺、脑组织病理检测小鼠右侧肺、脑组织取样后立刻用4%甲醛固定24 h,随后进行脱水、包埋、连续切片。切片经苏木精-伊红(Hematoxylin-eosin,HE)染色后光镜下观察病理变化。免疫组化(Immunohistochemistry,IHC)染色以抗流感病毒NP蛋白鼠单克隆抗体4 ℃孵育过夜后,涤尽残余未结合一抗,再以生物素标记的羊抗鼠IgG抗体作为二抗,经显色处理后光镜下观察表达病毒NP蛋白的细胞。脑组织切片先分别以抗神经元特异性烯醇化酶(neuron specific enolase,NSE)羊多克隆抗体、抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)兔多克隆抗体和抗流感病毒NP蛋白鼠单克隆抗体4 ℃共孵育过夜后,涤尽残余未结合一抗,再分别以异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的鸡抗兔IgG抗体和驴抗羊IgG抗体、罗丹明(Rhodamine)标记的鸡抗鼠IgG抗体于室温孵育1 h后于荧光显微镜下观察。
1.6 病毒血症检测感染后第2、4、6、8天剖杀小鼠时采集全血样本。一份(250 μL)静置分离血清,如血量足够,则另一份(200 μL)用乙二胺四乙酸二钠(Ethylenediaminetetraacetic acid disodium salt,EDTA-Na2)抗凝处理。随后,用QIAamp Viral RNA Mini Kit提取血清中RNA,用QIAamp RNA Blood Mini Kit提取全血及白细胞中RNA。上述RNA均采用Oligo (dT)15引物和SuperScript® III Reverse Transcriptase试剂盒按说明合成cDNA并用AmpliTaq® DNA Polymerase PCR扩增M基因和H5基因。M基因正向引物:5′-GCAGGTAGATATTG AAAGATG-3′,反向引物:5′-GAAACAAGGTAG TTTTTTACTC-3′;HA基因正向引物:5′-GGGTG AGCTCAGCATGTCCA-3′,反向引物:5′-CCCTG CCATCCTCC CTCTAT-3′。
2 结果 2.1 小鼠病征3株病毒感染的小鼠在滴鼻接种后的2 d内均有体重的轻微上升,然而,在感染后3 d,48%的小鼠开始出现体重下降(图 1)。在感染后8 d,感染组的小鼠平均体重下降10%,相比之下,对照组却有10%的体重增加。各感染组小鼠病征表现较为一致:大部分的小鼠在感染后5 d出现毛发蓬乱、竖起;8 d出现弓背、呼吸困难等重症表现。同时,感染后8 d,在IDN5和QH65组中各有1只小鼠、FJ668组中有2只小鼠出现神经症状,主要表现为偏瘫或后肢瘫痪。从9 d开始各组均有小鼠死亡或因体重过低而采取麻醉处死。
|
| 图 1 小鼠接种H5N1病毒后体重变化曲线图 Figure 1 Body weight changes of the mice inoculated with the H5N1 viruses 注:接种病毒后每天监测小鼠体重,计算各组当天存活小鼠体重变化的平均值和标准差. QH65组小鼠于感染后10 d全部病亡. Note: Body weight changes of the survival mice were monitored daily. The values are means with standard deviation (SD) showed asvertical bars. All mice of the QH65 group died at 10 dpi. |
|
|
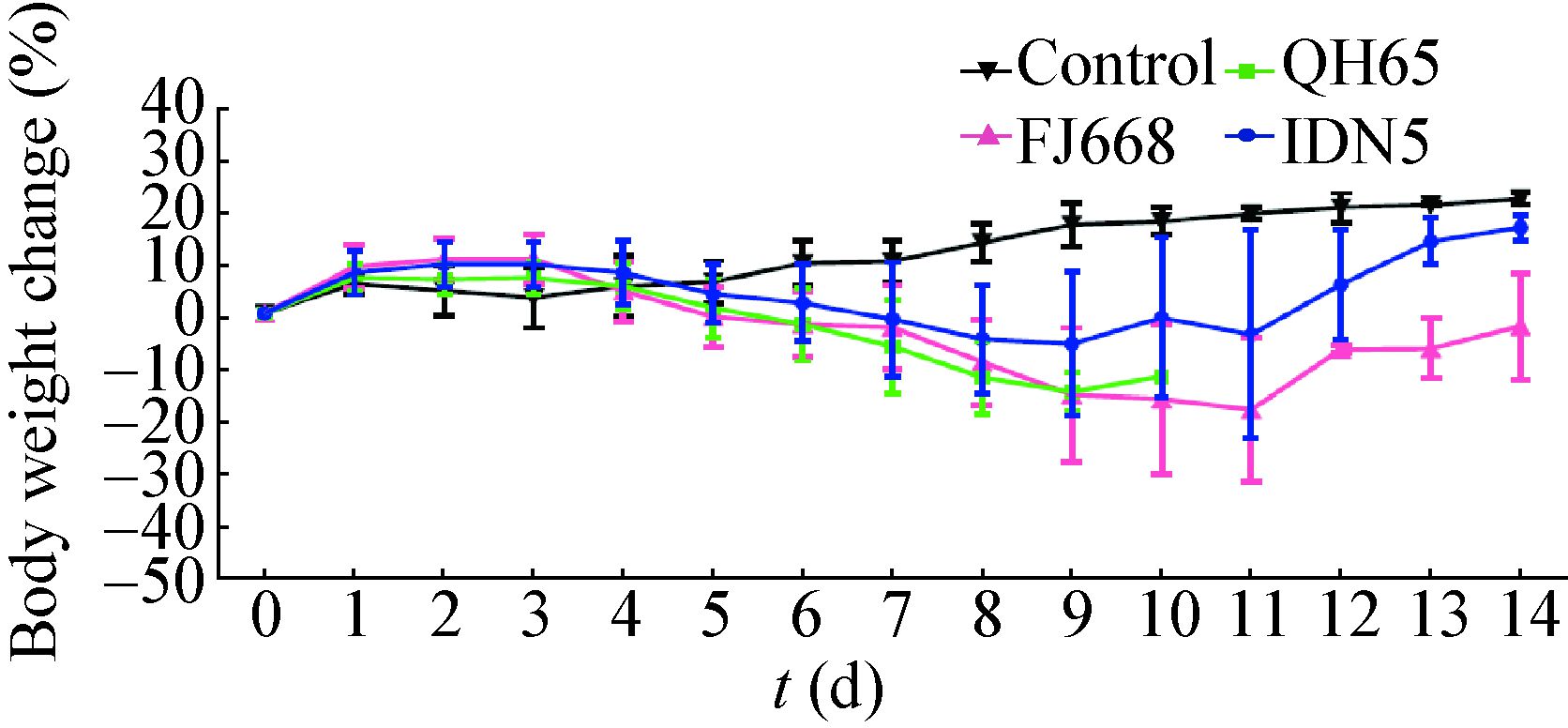
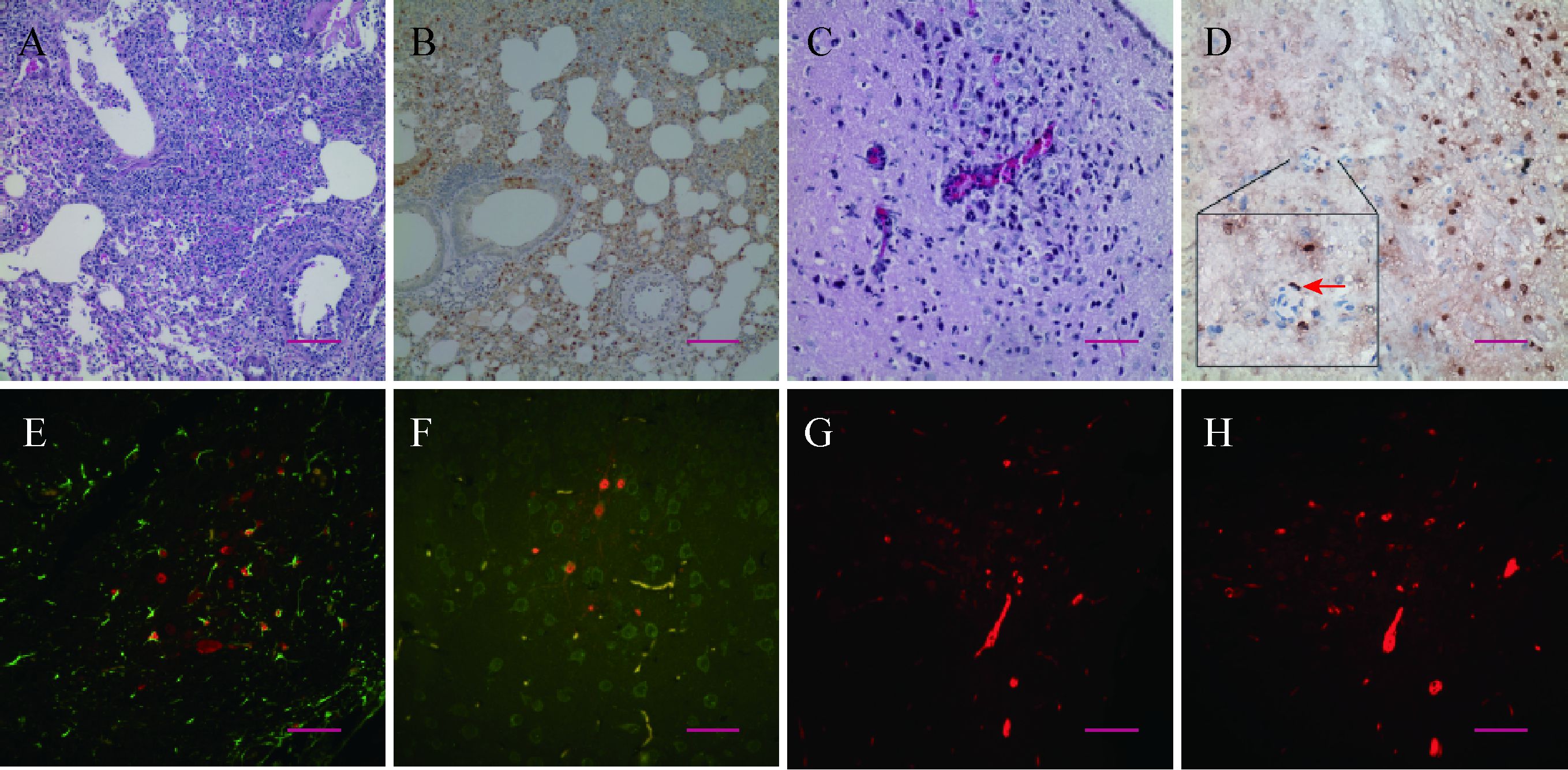
自接种后4 d起,小鼠肺中即可观察到典型的急性间质性支气管肺炎的病理表现。炎症在接下来数日内发展迅速,在HE染色的肺部切片中,可观察到支气管上皮细胞的水肿、肺间质炎性细胞浸润、肺泡间隔增粗等现象。炎性症状在接种后第6−8天的鼠肺中表现更为严重(图 2A)。病毒NP蛋白于接种后2 d即可在小鼠肺中检测到,主要分布于支气管上皮细胞及气管周边结缔组织。在随后的几天,病毒迅速扩散至肺内各细胞中(图 2B)。尽管在接种后8 d开始有小鼠病重死亡,但此时肺中检测到的病毒NP蛋白量反而不及在接种后6 d的样本,提示病毒在肺中的复制高峰在感染后6 d前后;接种后14 d仍存活且无明显病征的小鼠肺中可检测到少量的NP蛋白阳性细胞。肺组织样本匀浆滴定结果显示:肺中病毒滴度自感染后迅速抬升,在感染后6 d达到峰值(106−107 PFU/mL),该水平一直维持到感染后8 d。感染后14 d存活小鼠的肺部病毒可完全清除(图 3A)。
|
| 图 2 小鼠肺、脑病理性变化及病毒NP蛋白检测 Figure 2 Pathogenic changes and detection of the viral NP protein in mice lung and brain 注:A:肺组织切片HE染色(FJ668组小鼠感染后8 d);B:肺组织切片NP蛋白IHC染色(IDN5组小鼠感染后4 d);C:脑组织切片HE染色(FJ668组小鼠感染后8 d);D:脑组织切片NP蛋白IHC染色(QH65组小鼠感染后8 d),方框内为局部放大的脑内小血管,箭头指向血管内皮细胞NP蛋白阳性信号;E−F:脑组织切片免疫荧光双染(e、f分别为FJ668和IDN5组小鼠感染后8 d,FITC标记GFAP和NSE,罗丹明标记NP蛋白);G−H: 脑组织切片NP蛋白荧光染色(IDN5组小鼠感染后9 d,罗丹明标记NP). 标尺长度分别为100 μm (a−b)和50 μm (c−h). Note: A: HE stained lung slice (FJ668,8 dpi); B: IHC stained NP protein in lung (IDN5,4 dpi); C: HE stained brain slice (FJ668,8 dpi); D: IHC stained NP protein in brain (QH65,8 dpi),a vascular endothelial cell with NP positive signal was indicated by an arrow in the enlarged inset; E−F: Double fluorescence stained brain slice (e: FJ668,8 dpi and f: IDN5,8 dpi; FITC-GFAP/NSE,rhodamine-NP protein); G−H: Fluorescence stained brain slice (IDN5,9 dpi,rhodamine-NP protein). Scale bars indicate: 100 μm (A−B) or 50 μm (C−H). |
|
|
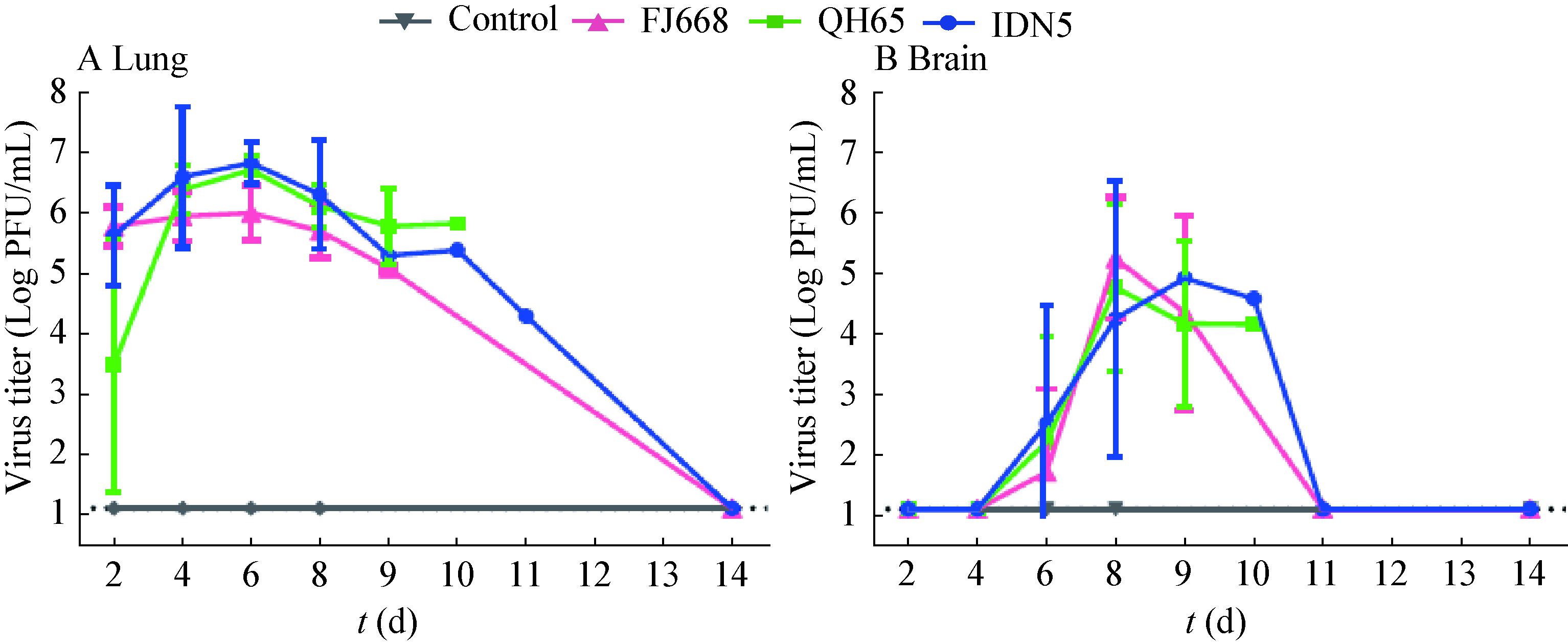
|
| 图 3 小鼠感染H5N1病毒后肺、脑组织中的病毒滴度 Figure 3 Virus titers in lung and brain tissues of the mice inoculated with H5N1 viruses 注:A:肺组织病毒滴度;B:脑组织病毒滴度. 感染后第2、4、6、8天,感染组每组麻醉处死5只小鼠,对照组处死2只小鼠. 病亡或体重过低(>30%)处死的小鼠也取样检测. 每只小鼠均采集左侧肺、脑组织,置于1 mL预冷PBS中制备匀浆. 匀浆离心后取上清PBS 1:10稀释空斑滴定. 每个样本平行检测2次,空斑滴定检测极限:12.5 PFU/mL(图中横虚线). 曲线上各点为各样本每克组织病毒滴度均值及标准差. Note: A: Virus titers in lung; B: Virus titers in brain. Five mice in each virus inoculated group and two mice from the control group were sacrificed at 2,4,6,8 dpi. Mice died of severe infection or significant body weight lost (>30%) were also sampled. The left lung and brain tissues were collected and homogenized in 1 mL pre-cold PBS. Tissue homogenates were centrifuged to collect the supernatant,which were 1:10 diluted and titrated with plaque assay. Each sample was titrated in parallel twice. The detected limit of the plaque forming assay is 12.5 PFU/mL (showed in dotted line). All values indicate the mean virus titers of per gram tissue with standard deviation (s). |
|
|
在感染组的小鼠脑组织中可观察到病毒性脑炎的症状,表现为神经元变性、炎性细胞浸润和血管鞘现象(图 2C)。然而,直至感染后6 d,在IDN5病毒感染组的1只小鼠脑干部位才开始出现少量病毒NP蛋白(约10个NP蛋白阳性细胞);到了感染后8 d,67%的脑组织样本中可检测到分布于大脑皮质中的NP蛋白阳性细胞(图 2D)。免疫荧光双染结果显示:病毒既可感染神经元细胞,又可感染神经胶质细胞(图 2E、F)。在小鼠脑内血管内皮细胞上和脑血管周围神经组织中可检测到NP蛋白阳性细胞(图 2D、G、H)。脑组织匀浆滴定结果显示:直至感染后6 d脑组织中才开始检测到病毒(104−105 PFU/mL),8 d脑中病毒量继续上升,在9、10 d病亡的小鼠脑中也可检测到高滴度的病毒(图 3B)。
2.4 血液中病毒滴度动态变化在小鼠感染病毒后2 d,IDN5组即有一只小鼠的血清可检测到病毒血症(表 1)。感染后4 d,病毒血症的检出率开始增加:在检测的7份全血样品中,有3只小鼠(42.9%)出现了病毒血症,病毒基因可从血清(11.1%)和白细胞(14.3%)中检测到。感染后6 d,病毒血症阳性率明显抬升:9份全血样本全部检出病毒血症(100.0%)。血清和白细胞中病毒基因的检出率分别为27.3%和66.7%。感染后 8 d,血清中已无法检测到病毒基因,但1份白细胞样品中仍可检测到病毒基因存在。
| 接种后(d) Day post inoculation (dpi) | 阳性数/样本数(阳性率) Number of positive/Number of samples (Positive rate) | |||
| 病毒 Virus | 全血 Whole Blood | 血清 Serum | 白细胞 WBC | |
| 2 | IDN5 | 0/2 | 1/2 | 0/2 |
| QH65 | 0/3 | 0/3 | 0/3 | |
| FJ668 | 0/2 | 0/2 | 0/2 | |
| 小计Sub-total | 0/7 (0.0%) | 1/7 (14.3%) | 0/7 (0.0%) | |
| 4 | IDN5 | 2/2 | 1/3 | 0/2 |
| QH65 | 0/2 | 0/3 | 0/2 | |
| FJ668 | 1/3 | 0/3 | 1/3 | |
| 小计 Sub-total | 3/7 (42.9%) | 1/9 (11.1%) | 1/7 (14.3%) | |
| 6 | IDN5 | 2/2 | 2/3 | 2/2 |
| QH65 | 4/4 | 1/5 | 1/4 | |
| FJ668 | 3/3 | 0/3 | 3/3 | |
| 小计 Sub-total | 9/9 (100.0%) | 3/11 (27.3%) | 6/9 (66.7%) | |
| 8 | IDN5 | 0/0 | 0/3 | 0/0 |
| QH65 | 0/1 | 0/3 | 0/1 | |
| FJ668 | 1/1 | 0/2 | 1/1 | |
| 小计 Sub-total | 1/2 (50%) | 0/8 (0.0%) | 1/2 (50.0%) | |
| 总计 In total | 13/25 (52.0%) | 5/35 (14.3%) | 8/25 (32.0%) | |
| 注:接种病毒后第2、4、6、8天麻醉剖杀小鼠取全血,提取血清、全血和白细胞RNA合成cDNA后PCR检测病毒H5和M基因. 病弱未能取得足量血液样本的小鼠只进行血清中的病毒检测. Note: Mice were anesthetized and sacrificed at 2,4,6,8 dpi to collect blood samples. RNAs from whole blood,serum and white blood cells were extracted for cDNA synthesis. PCR was conducted to detect the H5 and M gene. For those failed to collect enough blood samples,virus gene detections were only conducted on serum samples. | ||||
本研究结果表明,H5N1高致病性禽流感病毒感染小鼠后,迅速在肺部高效复制,一方面引起免疫应答和病理变化,一方面引起病毒血症并向肺外器官扩散。病毒在感染早期就可侵入血液,病毒血症的峰值与病毒在肺内复制的高峰几乎同时出现;在肺、血病毒高峰出现时,脑组织中才开始检测到病毒,提示中枢神经系统的感染比肺、血较为延迟。在脑组织血管内皮细胞上,我们检测到了流感病毒的NP蛋白,血管周围也有NP蛋白阳性细胞簇集的现象。上述结果提示:血液通路有可能是H5N1高致病性禽流感病毒入侵中枢神经系统的路径之一。
流感病毒进入中枢神经系统的通路一直为学者们所关注。由于神经细胞对流感病毒易感性高及嗅神经嗅球在鼻腔和前脑中的独特分布,具有嗜神经性的呼吸道病毒得以在感染或鼻腔接种的初期便可通过嗅束上行进入颅脑。然而,血液途径在病毒向中枢神经系统的传播一直未能得到证实。一个可能的原因是脑组织切片常常只能显示小血管的一个横切面,这增加了寻找脑组织血管内皮细胞感染及病毒通过血循环向脑内神经组织播散的证据的难度。有研究表明,病毒可在肺血管内皮细胞中复制[19-21],这为病毒通过感染血管内皮细胞进、出血液循环系统提供了基础。在本研究中,病毒血症的出现、脑血管内皮细胞及脑血管周围神经细胞的感染,以及病毒血症和脑内病毒出现的时间次序均支持H5N1病毒有可能通过血液途径传入中枢神经系统的假说。但是,本研究不排除病毒通过神经通道入颅的可能。小鼠自感染后6 d颅内检测到病毒,随后2 d内脑内病毒滴度剧增(100倍),感染面积广泛扩散,神经元和胶质细胞均大面积受累,均提示中枢神经系统对H5N1病毒是高度易感的,病毒在神经组织中有较好的复制和扩散能力。
在病毒血症的检测实验中,血清样本中检测到病毒基因是血液中存在游离病毒的有效指标,首份病毒血症的阳性样本即检出于感染后2 d的小鼠血清中。这提示在免疫系统充分激活之前,病毒能进入血液循环并向外周散播。随着机体免疫应答的启动,白细胞中病毒检出率也随着上升并逐渐占据主导地位。随后,血清游离病毒也相应减少,提示免疫应答对病毒的清除作用。此前已有研究显示培养的人树突状细胞、T细胞对H5N1病毒易感[22-23],在H5N1感染患者的脾和淋巴结中也能检出病毒[7],但这些细胞除了在抗病毒免疫中发挥作用外,是否能携带病毒并成为其扩散的载体尚待进一步研究。
近3年来,我国仅发生9例人感染H5N1病毒的案例,总发病数较2003−2009年间显著下降,但该病毒的致死率仍然很高[24]。在治疗上,除了经典的神经氨酸酶抑制剂,近年来各机构研发的抗H5N1人源性单克隆抗体也开始展示出抗病毒感染的乐观前景,部分人源性单抗在动物模型中已展现出良好的预防和保护作用[25-27]。由于迄今尚未有药物能阻断病毒经过神经通路的传播,这些经过血循环系统发挥作用的药物将有助于血液中病毒的中和、抑制或清除,继而在一定程度上减少病毒进入中枢神经系统。
| [1] | Bental E. Acute psychoses due to encephalitis following Asian influenza[J]. Lancet , 1958, 2 (7036) : 18–20. |
| [2] | Alakare J, Jurkko R, Kaukonen KM, et al. Viral encephalitis associated with pandemic 2009 (H1N1) influenza A[J]. BMJ Case Reports , 2010 : bcr0220102772. |
| [3] | Nakashita Y, Aoki M. Mild brain hypothermia for influenza encephalitis/encephalopathy and its significance[J]. Japanese Journal of Clinical Medicine , 2000, 58 (11) : 2333–2337. |
| [4] | Okumura A, Nakano T, Fukumoto Y, et al. Delirious behavior in children with influenza: its clinical features and EEG findings[J]. Brain and Development , 2005, 27 (4) : 271–274. DOI:10.1016/j.braindev.2004.07.005 |
| [5] | de Jong MD, van Cam B, Qiu PT, et al. Fatal avian influenza A (H5N1) in a child presenting with diarrhea followed by coma[J]. The New England Journal of Medicine , 2005, 352 (7) : 686–691. DOI:10.1056/NEJMoa044307 |
| [6] | Rajabali N, Lim T, Sokolowski C, et al. Avian influenza A (H5N1) infection with respiratory failure and meningoencephalitis in a Canadian traveller[J]. The Canadian Journal of Infectious Diseases & Medical Microbiology , 2015, 26 (4) : 221–223. |
| [7] | Gao RB, Dong LB, Dong J, et al. A systematic molecular pathology study of a laboratory confirmed H5N1 human case[J]. PLoS One , 2010, 5 (10) : e13315. DOI:10.1371/journal.pone.0013315 |
| [8] | Bissel SJ, Giles BM, Wang GJ, et al. Acute murine H5N1 influenza A encephalitis[J]. Brain Pathology , 2012, 22 (2) : 150–158. DOI:10.1111/bpa.2012.22.issue-2 |
| [9] | Yamamoto Y, Nakamura K, Kitagawa K, et al. Severe nonpurulent encephalitis with mortality and feather lesions in call ducks (Anas platyrhyncha var. domestica) inoculated intravenously with H5N1 highly pathogenic avian influenza virus[J]. Avian Diseases , 2007, 51 (1) : 52–57. DOI:10.1637/0005-2086(2007)051[0052:SNEWMA]2.0.CO;2 |
| [10] | Peng BH, Yun N, Chumakova O, et al. Neuropathology of H5N1 virus infection in ferrets[J]. Veterinary Microbiology , 2012, 156 (3/4) : 294–304. |
| [11] | Perkins LEL, Swayne DE. Varied pathogenicity of a Hong Kong-origin H5N1 avian influenza virus in four passerine species and budgerigars[J]. Veterinary Pathology , 2003, 40 (1) : 14–24. DOI:10.1354/vp.40-1-14 |
| [12] | Yamada M, Bingham J, Payne J, et al. Multiple routes of invasion of wild-type Clade 1 highly pathogenic avian influenza H5N1 virus into the central nervous system (CNS) after intranasal exposure in ferrets[J]. Acta Neuropathologica , 2012, 124 (4) : 505–516. DOI:10.1007/s00401-012-1010-8 |
| [13] | Park CH, Ishinaka M, Takada A, et al. The invasion routes of neurovirulent A/Hong Kong/483/97 (H5N1) influenza virus into the central nervous system after respiratory infection in mice[J]. Archives of Virology , 2002, 147 (7) : 1425–1436. DOI:10.1007/s00705-001-0750-x |
| [14] | Plourde JR, Pyles JA, Layton RC, et al. Neurovirulence of H5N1 infection in ferrets is mediated by multifocal replication in distinct permissive neuronal cell regions[J]. PLoS One , 2012, 7 (10) : e46605. DOI:10.1371/journal.pone.0046605 |
| [15] | Shinya K, Makino A, Hatta M, et al. Subclinical brain injury caused by H5N1 influenza virus infection[J]. Journal of Virology , 2011, 85 (10) : 5202–5207. DOI:10.1128/JVI.00239-11 |
| [16] | Senne DA, Panigrahy B, Kawaoka Y, et al. Survey of the hemagglutinin (HA) cleavage site sequence of H5 and H7 avian influenza viruses: amino acid sequence at the HA cleavage site as a marker of pathogenicity potential[J]. Avian Diseases , 1996, 40 (2) : 425–437. DOI:10.2307/1592241 |
| [17] | Horimoto T, Kawaoka Y. Reverse genetics provides direct evidence for a correlation of hemagglutinin cleavability and virulence of an avian influenza A virus[J]. Journal of Virology , 1994, 68 (5) : 3120–3128. |
| [18] | Reinacher M, Bonin J, Narayan O, et al. Pathogenesis of neurovirulent influenza A virus infection in mice. Route of entry of virus into brain determines infection of different populations of cells[J]. Laboratory Investigation , 1983, 49 (6) : 686–692. |
| [19] | Li AC, Chan RW, Hui CF, et al. Replication and innate host response of influenza A virus in lung microvascular endothelial cells: new insights into systemic infection and pathogenesis[J]. Influenza and Other Respiratory Viruses , 2011, 5 (S1) : 287–288. |
| [20] | Zeng H, Pappas C, Belser JA, et al. Human pulmonary microvascular endothelial cells support productive replication of highly pathogenic avian influenza viruses: possible involvement in the pathogenesis of human H5N1 virus infection[J]. Journal of Virology , 2012, 86 (2) : 667–678. DOI:10.1128/JVI.06348-11 |
| [21] | Chan MC, Chan RW, Yu WC, et al. Influenza H5N1 virus infection of polarized human alveolar epithelial cells and lung microvascular endothelial cells[J]. Respiratory Research , 2009 (10) : 102. |
| [22] | Thitithanyanont A, Engering A, Ekchariyawat P, et al. High susceptibility of human dendritic cells to avian influenza H5N1 virus infection and protection by IFN-αand TLR ligands[J]. Journal of Immunology , 2007, 179 (8) : 5220–5227. DOI:10.4049/jimmunol.179.8.5220 |
| [23] | Li YG, Thawatsupha P, Chittaganpitch M, et al. Higher in vitro susceptibility of human T cells to H5N1 than H1N1 influenza viruses[J]. Biochemical and Biophysical Research Communications , 2008, 371 (3) : 484–489. DOI:10.1016/j.bbrc.2008.04.123 |
| [24] | World Health Organization. Cumulative number of confirmed human cases for avian influenza A(H5N1) reported to WHO, 2003-2015[EB/OL]. http://www.who.int/influenza/human_animal_interface/H5N1_cumulative_table_archives/en/ |
| [25] | Hu HX, Voss J, Zhang GL, et al. A human antibody recognizing a conserved epitope of H5 hemagglutinin broadly neutralizes highly pathogenic avian influenza H5N1 viruses[J]. Journal of Virology , 2012, 86 (6) : 2978–2989. DOI:10.1128/JVI.06665-11 |
| [26] | Tan YR, Ng QY, Jia Q, et al. A novel humanized antibody neutralizes H5N1 influenza virus via two different mechanisms[J]. Journal of Virology , 2015, 89 (7) : 3712–3722. DOI:10.1128/JVI.03014-14 |
| [27] | Itoh Y, Yoshida R, Shichinohe S, et al. Protective efficacy of passive immunization with monoclonal antibodies in animal models of H5N1 highly pathogenic avian influenza virus infection[J]. PLoS Pathogens , 2014, 10 (6) : e1004192. DOI:10.1371/journal.ppat.1004192 |
 2016, Vol. 43
2016, Vol. 43