扩展功能
文章信息
- 崔美岩, 吕好新, 张志霞, 张淼, 张蓓, 陈骏, 谈重芳
- CUI Mei-Yan, L Hao-Xin, ZHANG Zhi-Xia, ZHANG Miao, ZHANG Bei, CHEN Jun, TAN Zhong-Fang
- 青海湖裸鲤肠道乳酸菌多样性与抑菌活性
- Diversity and antimicrobial activity of intestinal lactic acid bacteria isolated from Gymnocypris przewalskii
- 微生物学通报, 2016, 43(9): 2028-2039
- Microbiology China, 2016, 43(9): 2028-2039
- DOI: 10.13344/j.microbiol.china.150834
-
文章历史
- 收稿日期: 2015-10-28
- 接受日期: 2016-03-10
- 优先数字出版日期(www.cnki.net): 2016-04-13
2. 焦作大学 河南 焦作 454000
2. Jiaozuo University, Jiaozuo, He’nan 454000, China
乳酸菌是存在于人和禽畜肠道、食品、物料及少数临床样品中的一大类能发酵糖产生大量乳酸的兼性厌氧菌[1],广泛应用于食品、医药等行业,是一类益生菌。其中来源于鱼类肠道的具有抑菌作用的乳酸菌制剂是一种天然的活性微生态制剂,可通过生物拮抗作用改善肠道微生物的生态环境,维持鱼肠道内微生物菌群的平衡,增强肠道上皮细胞的屏障层,提高动物的免疫功能等,对海鱼、池塘养殖鱼、野生河鱼类改善营养和增强免疫都具有重要的作用[2]。肠道菌的筛选通常以定殖能力强的益生菌为主,其对水产养殖业具有重要的影响。益生菌的成功应用可以减少抗生素的用量,利于环境保护和维持水产养殖业的可持续发展[3]。pirarat等[4]把一株鼠李糖乳杆菌添加到喂养尼罗罗非鱼的饲料中,发现罗非鱼肠道绒毛高度、上皮内的淋巴细胞数目、嗜酸粒细胞数目等显著性增加,对肠道免疫系统的调控起到重要的作用。草鱼肠道分离的短乳酸杆菌具有促进草鱼肠道乳酸菌数量增加、降低水和消化道中弧菌数、调整养殖水体和肠道菌群构成的作用[5]。乳酸菌在水产中的益生作用主要是[6]:(1) 增强免疫,预防病害;(2) 产生有益代谢产物,促进宿主生长;(3) 调控水质,抑制病原菌的生长;(4) 提高饲料效率及营养价值。越来越多不同来源的益生性乳酸菌被应用到水产业上。
青海湖为我国最大的内陆咸水湖泊,自然生态环境的独特性构成了其独特的高寒生态系统[7]。裸鲤是湖中唯一的野生鱼类,1979年在国务院《水产资源繁殖保护条例》中列为我国重要或名贵水生动物,1994年在《中国生物多样性保护行动计划》中列入鱼类优先保护物种二级名录。青海湖裸鲤属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothoracine)、裸鲤属(Gymnocypris),是我国特有种[8]。青海湖裸鲤具有耐盐、耐高寒、抗缺氧等优良特性,但其生长缓慢,加上气候变化及人类活动的加剧,青海湖裸鲤资源严重衰退。近年来对青海湖裸鲤的研究多集中在生长特性及遗传多样性上,对其肠道益生菌群的研究尚属空白。因此,对裸鲤肠道附着优势乳酸菌进行分离与研究具有重要意义。本研究以青海湖裸鲤为对象,10条大鱼(体重>250 g,年龄约5年)和18条小鱼(体重<250 g,约为150 g,年龄约3年),对其肠道内含物附着的乳酸菌进行了分离鉴定,对其生理生化性质、抑菌活性进行检测,以期为鱼肠道乳酸菌资源的开发利用奠定基础。
1 材料与方法 1.1 材料1.1.1 试剂、仪器和培养基:(1) 试剂:TE (10 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0);TES (50 mmol/L Tris-HCl,5 mmol/L EDTA二钠,50 mmol/L NaCl,pH 8.0);TAE (50 mmol/L Tris-乙酸,1 mmol/L EDTA,pH 8.0);Analytical Profile IndexAPI 50CH,bioMerieux,France。
(2) 仪器:PCR扩增仪,Thermo Arktik美国赛默飞公司;GelDocTMXR凝胶成像仪、PoweePac Basic电泳仪,美国伯乐公司。
(3) 培养基[9]:MRS培养基(g/L):蛋白胨10.0,牛肉膏10.0,酵母膏10.0,葡萄糖20.0,乙酸钠5.0,吐温80 1.0,磷酸氢二钾2.0,柠檬酸铵2.0,硫酸镁0.58,硫酸锰0.25。NA培养基(g/L):牛肉膏5.0,蛋白胨10.0,氯化钠5.0。CLO培养基(g/L):蛋白胨15.0,大豆蛋白胨7.5,酵母膏7.5,牛肉膏7.5,柠檬酸铁铵1.0,亚硫酸氢钠1.0,L-半胱氨酸盐酸盐0.75。以上培养基pH均为6.5−7.0,固体培养基琼脂粉加入量为17 g/L。PDA、EMB培养基均购自北京奥博星生物技术有限责任公司。PDA培养基加入质量分数为10%的酒石酸。
1.1.2 样品的采集:2011年9月在中国青海湖采集裸鲤肠道样品,用无菌剪刀解剖取出内脏部分放入无菌食品袋冰水浴保存,24 h内运至实验室立即进行微生物检测。
1.1.3 样品的处理:新鲜的鱼肠用无菌剪刀切碎后取5 g放入45 ml无菌水中,用漩涡振荡器振荡30 s,按10-1、10-3、10-5的稀释梯度各取20 μl涂布在MRS、PDA、EMB、NA培养基中,将1 mL 10-1、10-2样品稀释液75 ℃水浴15 min后涂布在NA及CLO培养基上,每个样品做3个平行。30 ℃倒置培养48 h,MRS及CLO培养基放置于厌氧培养箱。对MRS平板进行菌落计数,根据菌落大小、形态和颜色等特征,挑取单菌落在MRS培养基上划线纯化2次,−80 ℃下保存在10%二甲基亚砜的NB培养基中备用[10]。
1.2 生理生化性质的检测1.2.1 形态特征:观察培养基上单菌落的形状、大小、光泽、颜色、突起等,用革兰氏染色的方法在光学显微镜下观察细胞形态。
1.2.2 生理特征:实验菌株的生理生化性状检测包括耐盐(NaCl)浓度、pH生长范围、温度生长范围试验等[11]。
1.2.3 生化性状:实验菌株的生化性状测定包括:过氧化氢酶试验、发酵葡萄糖产气试验(同型或异型发酵试验)、碳源发酵试验等[12]。
1.3 菌株的分子生物学检测1.3.1 菌落PCR:将实验菌株接种在MRS培养基上并在厌氧培养箱培养48 h,挑取单菌落进行菌落PCR,引物选用的是扩增细菌16S rRNA基因的通用引物:27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)。Mixture混合物由郑州久是生物技术有限公司提供。PCR反应体系(50 μL):Premix Taq 25 μL,27F和1492R (20 μmol/L)各1 μL,补充灭菌蒸馏水至 50 μL,用10 μL无菌枪头在单菌落挑取少许加入反应体系,进行PCR反应。反应条件:94 ℃ 1 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,30个循环;1.0%琼脂糖凝胶中电泳,Marker含有1.5 kb条带。电泳结束后,EB溶液染色,在紫外凝胶成像系统下观察。
1.3.2 DNA提取PCR:将菌株接种于MRS液体培养基30 ℃培养过夜。12 000 r/min离心5 min收集菌体。将收集的菌体用TE缓冲液洗涤2次,溶于360 μL TES缓冲液中,加入溶菌酶放在37 ℃水浴中消化2 h。加入20% SDS到终浓度为2%,60 ℃水浴到菌液澄清。加入5 mol/L高氯酸钠溶液使菌液的终浓度为1 mol/L,同时加入等体积三氯甲烷:异戊醇为24:1 (体积比),10 000 r/min离心10 min,取上清液后加入2倍体积无水乙醇,12 000 r/min离心10 min沉淀DNA,溶于TE缓冲液中,4 ℃保存直至完全溶解,取2 μL在1.0%的琼脂糖凝胶中电泳,电泳缓冲液0.5xTAE,电泳时间30 min,电压是 100 V。电泳结束后,将凝胶置于EB溶液中染色 10 min,用蒸馏水冲洗凝胶,并在紫外凝胶成像系统下观察,剩余的DNA样品于-20 ℃保存备用。
1.3.3 16S rRNA基因序列分析:将PCR产物送到华大基因公司测序,将测序所得长度1 500 bp左右的16S rRNA基因序列在GenBank中使用Blast寻找与其最大相似性的序列。如果测序菌株与标准菌株间的16S rRNA基因相似性在97.5%以上,一般就可判定它们属于同一个种。
1.3.4 构建系统进化树:将测序所得的16S rRNA基因序列和通过Blast在GenBank中得到的标准菌株序列信息一起导入ClustalW软件进行比对,进化树构建使用邻接法(Neighbor-joining),进化树的拓扑结构采用MEGA 5.0软件中序列数据的步长分析法进行1 000次随机采样估算,将枯草芽孢杆菌 Bacillus subtilis NCDO 1769T作为外围菌株[13]。
1.4 抑菌活性的检测采用牛津杯双层平板法对产广谱细菌素乳酸菌进行初筛,排除有机酸、过氧化氢等复筛,对抑菌效果较好的菌株用蛋白酶处理,初步确定抑菌物质是蛋白质类物质。具体做法参照文献[14]。
1.5 数据分析文中涉及的细菌数量均为3个重复的平均值,抑菌试验数据利用SPSS进行统计分析,数据以平均值±标准差(x±s)表示。
2 结果与分析 2.1 裸鲤肠道中微生物的分布情况样品中各类微生物分布情况见表 1。除了大鱼9样品外,其余样品中都检测到乳酸菌的存在,其数量范围为103-108 (菌落单位/新鲜物质g),其中大鱼肠道样品中乳酸菌的数量级为103-104,小鱼肠道
| sample | Counts (cfu/g of FM) of viable microorganisms | ||||||
| LAB | Coliform bacteria | Aerobic bacteria | Bacilli | Mould | Yeast | Clostridium | |
| Big Fish 1 | 1.5×104 | 2.1×104 | 1.4×108 | 5.4×105 | 1.5×107 | 0 | 0 |
| Big Fish 2 | 4.0×103 | 1.6×104 | 3.8×106 | 5.0×102 | 0 | 0 | 0 |
| Big Fish 3 | 5.5×103 | 9.5×103 | 2.2×106 | 5.0×102 | 5.0×106 | 5.0×102 | 0 |
| Big Fish 4 | 5.0×103 | 4.0×103 | 1.5×105 | 0 | 0 | 0 | 0 |
| Big Fish 5 | 2.0×103 | 1.7×104 | 5.5×106 | 0 | 0 | 0 | 0 |
| Big Fish 6 | 1.1×104 | 8.0×103 | 2.0×108 | 5.0×103 | 0 | 0 | 0 |
| Big Fish 7 | 2.0×103 | 2.5×103 | 4.9×106 | 1.6×104 | 1.0×105 | 0 | 0 |
| Big Fish 8 | 2.2×104 | 2.3×104 | 7.7×106 | 0 | 0 | 0 | 0 |
| Big Fish 9 | 0 | 1.8×104 | 2.5×108 | 5.5×105 | 0 | 0 | 0 |
| Big Fish 10 | 1.5×104 | 1.2×104 | 4.5×108 | 0 | 5.0×102 | 0 | 0 |
| Little Fish 1 | 1.3×104 | 6.0×103 | 5.8×106 | 4.6×105 | 0 | 0 | 0 |
| Little Fish 2 | 9.5×106 | 3.4×105 | 2.6×108 | 0 | 5.0×102 | 0 | 0 |
| Little Fish 3 | 1.0×107 | 6.0×105 | 1.6×106 | 0 | 0 | 0 | 0 |
| Little Fish 4 | 1.5×106 | 2.3×105 | 2.1×106 | 1.0×103 | 1.0×103 | 0 | 0 |
| Little Fish 5 | 5.0×106 | 7.0×105 | 1.9×106 | 5.0×102 | 5.0×104 | 0 | 0 |
| Little Fish 6 | 7.1×106 | 1.7×106 | 1.4×106 | 1.0×103 | 0 | 0 | 0 |
| Little Fish 7 | 5.0×107 | 1.2×106 | 4.2×106 | 0 | 5.0×102 | 0 | 0 |
| Little Fish 8 | 7.0×107 | 3.2×106 | 7.9×106 | 0 | 3.5×102 | 0 | 0 |
| Little Fish 9 | 7.0×107 | 3.2×106 | 7.9×106 | 0 | 3.5×102 | 0 | 0 |
| Little Fish 10 | 7.0×107 | 3.8×105 | 1.1×107 | 0 | 0 | 0 | 0 |
| Little Fish 11 | 9.5×106 | 3.4×105 | 2.6×108 | 0 | 5.0×102 | 0 | 0 |
| Little Fish 12 | 1.0×107 | 6.0×105 | 1.6×106 | 0 | 0 | 0 | 0 |
| Little Fish 13 | 1.5×106 | 2.3×105 | 2.1×106 | 1.0×103 | 1.0×103 | 0 | 0 |
| Little Fish 14 | 5.0×106 | 7.0×105 | 1.9×106 | 5.0×102 | 5.0×104 | 0 | 0 |
| Little Fish 15 | 7.1×106 | 1.7×106 | 1.4×106 | 1.0×103 | 0 | 0 | 0 |
| Little Fish 16 | 5.0×107 | 1.2×106 | 4.2×106 | 0 | 5.0×102 | 0 | 0 |
| Little Fish 17 | 7.0×107 | 3.2×106 | 7.9×106 | 0 | 3.5×102 | 0 | 0 |
| Little Fish 18 | 6.3×108 | 1.2×106 | 1.7×108 | 4.5×103 | 0 | 5.0×102 | 0 |
样品中乳酸菌的数量级为104-108,小鱼肠道附着乳酸菌数量要远大于大鱼肠道。在所有样品中,都能检测到大量的大肠杆菌和好氧性菌,其中大肠杆菌数量为103-106,好氧性细菌数量为105-108。在鱼肠道样品中也检测到芽孢杆菌、霉菌的存在,其数量级范围分别是0-105、0-107。只有大鱼3和小鱼18样品中检测到酵母菌,所有样品均未发现梭菌的存在。
2.2 裸鲤肠道中乳酸菌代表菌株生理生化性状对分离自裸鲤肠道样品的47株乳酸菌进行生理生化特征鉴定,结果显示他们都是革兰氏阳性、过氧化氢酶阴性菌。根据这些菌株的形态学、生理生化特性,将其分为9组(A-I)。从每组中随机挑选一株代表菌株,对其生理生化特征进行讨论,代表菌株生理生化特征见表 2。有7组乳酸菌发酵葡萄糖不产CO2,属于葡萄糖同型发酵型乳酸菌;另外2组乳酸菌发酵葡萄糖产CO2,属于异型发酵型乳酸菌。A、B、C三组乳酸菌都能在5-50 ℃的温度范围内很好地生长,说明其具有较强的温度适应能力,其他组乳酸菌在低温和高温的环境中生长能力较弱,尤其是G组乳酸菌表现特别明显。所有乳酸菌都能在3.0%的盐浓度下良好生长,大多数乳酸菌在6.5%的盐浓度环境中能良好生长,但是A组不具有耐盐性,H组表现出弱耐盐性。B、C、H组乳酸菌能在pH 3.0的酸性环境中生长,具有较强的耐酸性,A、B、C、F和I组乳酸菌能在pH 10.0的环境中生长,具有较强的耐碱性。B、C组乳酸菌具有极强的酸碱耐受性,说明其具有广阔的pH生长范围,其他组乳酸菌表现出较弱的耐酸碱性。
| Character | Group A qz1217 | Group B qz1196 | Group C qz1220 | Group D qz1229 | Group E qz1258 | Group F qz1206 | Group G qz1222 | Group H qz1197 | Group I qz1201 |
| Fermentation type | Homo | Homo | Homo | Hetero | Hetero | Homo | Homo | Homo | Homo |
| Growth at | |||||||||
| temperature (℃) | |||||||||
| 5 | + | + | + | w | + | + | w | + | w |
| 10 | + | + | + | + | + | + | w | + | + |
| 45 | + | + | + | w | w | w | w | + | w |
| 50 | + | + | + | w | w | w | w | w | w |
| Growth in NaCl (%) | |||||||||
| 3.0 | + | + | + | + | + | + | + | + | + |
| 6.5 | − | + | + | + | + | + | + | w | + |
| Growth at pH | |||||||||
| 3.0 | w | + | + | w | − | − | − | + | w |
| 3.5 | w | + | + | w | w | + | − | w | w |
| 9.0 | + | + | + | + | + | + | + | + | + |
| 10.0 | + | + | + | w | − | + | w | w | + |
| 注:+:生长;−:不生长;w:弱生长;Homo:同型发酵;Hetero:异型发酵. Note: +: positive; −: negative; w: weakly positive; Homo: homo fermentative; Hetero: hetero fermentative. | |||||||||
裸鲤肠道样品中所分离的乳酸菌代表菌株的碳源发酵特性如表 3所示,所有的菌株都不能发酵利用甘油、赤藓糖醇、D-阿拉伯糖、L-木糖、β-甲基木糖苷、山梨糖、鼠李糖、半乳糖醇、纤维糖、α-甲基-D-甘露糖苷、α-甲基-D-葡萄糖苷、菊糖、
| Item | qz1196 | qz1197 | qz1201 | qz1206 | qz1217 | qz1220 | qz1222 | qz385 | qz386 |
| L-Arabinose | − | + | − | − | − | − | − | − | − |
| Ribose | w | + | + | + | + | + | + | + | + |
| D-xylose | − | + | − | − | − | − | − | + | − |
| Ribitol | − | − | + | − | − | − | − | − | − |
| Galactose | + | + | − | − | + | + | w | + | + |
| Fructose | + | + | + | + | + | + | − | + | + |
| Mannose | + | + | + | + | + | + | − | + | + |
| Mannitol | − | + | + | − | − | + | − | + | − |
| Sorbitol | − | − | + | − | − | + | − | − | − |
| N-Acetyl | − | + | + | w | + | + | w | + | + |
| Amygdalin | − | + | − | − | − | − | − | − | − |
| Arbutin | − | + | − | + | + | − | − | + | − |
| Esculin | + | + | − | − | + | − | − | + | − |
| Salicin | − | + | − | + | + | − | − | + | − |
| Cellobiose | + | + | − | − | + | − | + | + | − |
| Maltose | − | + | + | + | + | + | w | + | + |
| Lactose | − | − | − | − | + | − | − | − | − |
| Melibiose | + | + | − | − | − | − | − | − | − |
| Sucrose | + | + | − | − | − | − | − | + | − |
| Trehalose | − | + | + | + | + | + | + | + | − |
| Starch | − | − | − | − | − | − | − | + | − |
| Gentiobiose | − | − | − | w | − | − | + | w | − |
| D-Tagatose | − | − | − | − | + | − | − | − | − |
| D-Arabitol | − | − | + | − | − | − | − | − | − |
| Gluconate | − | − | + | w | − | − | − | w | − |
| 注:所有菌株都能利用葡萄糖,但都不能利用甘油,赤藓糖醇,D-阿拉伯糖,L-木糖,β-甲基木糖苷,山梨糖,鼠李糖,半乳糖醇,纤维糖,α-甲基-D-甘露糖苷,α-甲基-D-葡萄糖苷,菊糖,松三糖,棉子糖,糖原,木糖醇,D-松二糖,D-来苏糖,D-海藻糖,L-海藻糖,L-阿拉伯醇,2-酮基-葡糖酸盐和5-酮基-葡糖酸盐做碳源. +:90%以上阳性;−:90%以上阴性;w:弱阳性. Note: All strains produced acid from glucose,but failed to produce acid from glycerol,erythritol,D-arabinose,L-xylose,β-methly-xyloside,sorbose,rhamnse,dulcitol,inositol,α-Methyl-D-mannoside,α-Methyl-D-glucoside,synanthrin,melezitose,raffinose,glycogen,xylitol,D-Turanose,D-lyxose,D-Trehalose,T-Trehalose,D-Arabitol,2-keto-gluconate,5-keto-gluconate. +: 90% or more of the strains positive; −: 90% or more of the strains negative; w: weakly positive. | |||||||||
松三糖、棉子糖、糖原、木糖醇、D-松二糖、D-来苏糖、D-海藻糖、L-海藻糖、L-阿拉伯醇、2-酮基-葡糖酸盐和5-酮基-葡糖酸盐做碳源;所有的菌株都能发酵利用葡萄糖作为碳源。
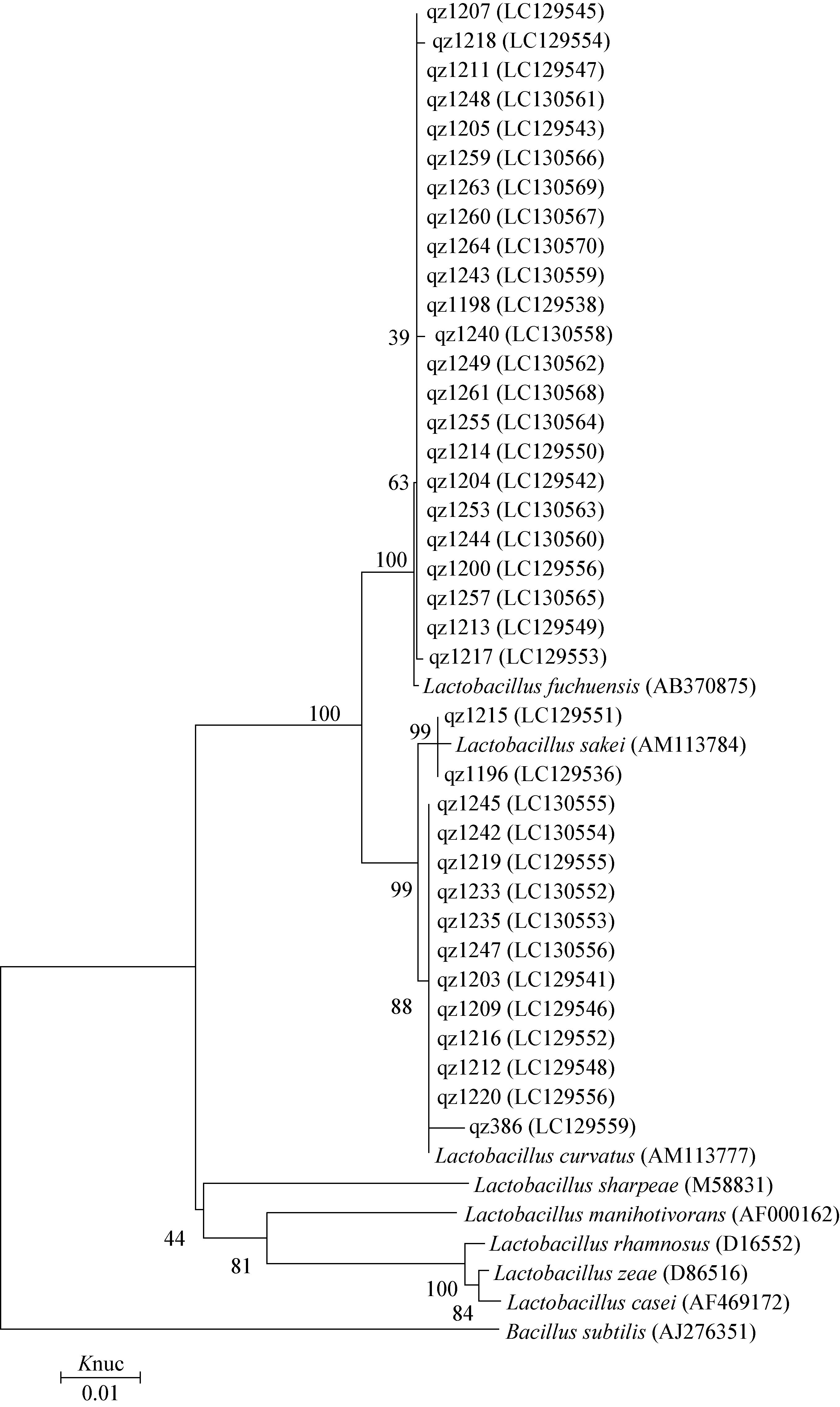
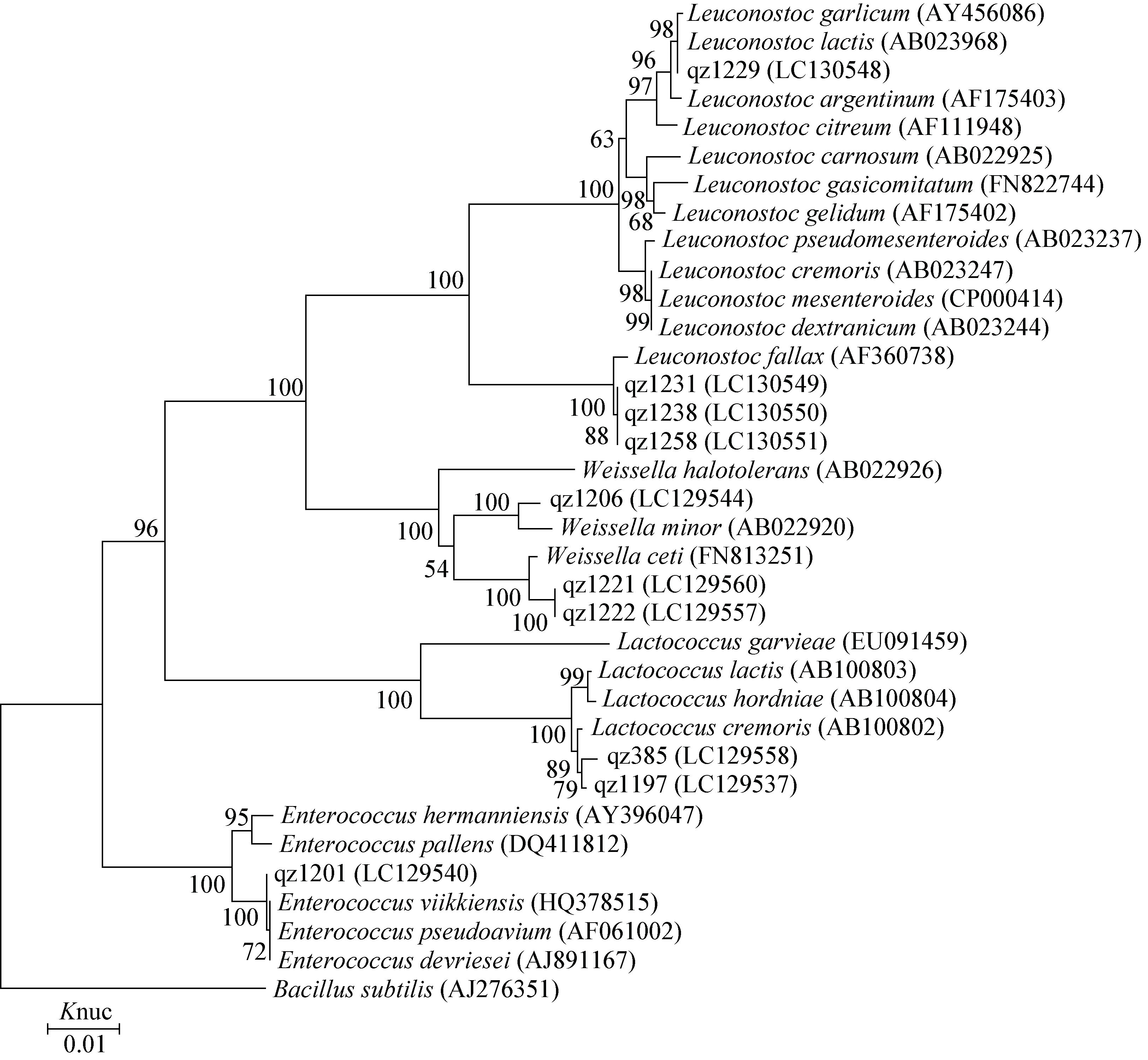
2.4 裸鲤鱼肠道中乳酸菌代表菌株16S rRNA基因序列分析对裸鲤肠道样品中所分离的乳酸菌代表菌株进行16S rRNA基因序列分析,47株乳酸菌通过进化距离邻接法(Neighbor-joining)构建系统进化树如图 1和图 2所示。结合乳酸菌菌株16S rRNA基因序列在DDBJ网站上的Blast比对结果和系统进化树,代表菌株qz1198、qz1200、qz1204、qz1205、qz1207、qz1211、qz1213、qz1214、qz1217、qz1218、qz1240、qz1243、qz1244、qz1248、qz1249、qz1253、qz1255、qz1257、qz1259、qz1260、qz1261、qz1263和qz1264鉴定为Lactobacillus fuchuensis;qz1196和qz1215为Lactobacillus sakei;qz1203、qz1209、qz1212、qz1216、qz1219、qz1220、qz1233、qz1235、qz1242、qz1245、qz1247和qz386为Lactobacillus curvatus;qz1229为Leuconostoc lactis;qz1231、qz1238和qz1258为Leuconostoc fallax;qz1206为Weissella minor;qz1221和qz1222为Weissella ceti;qz1197和qz385为Lactococcus cremoris;qz1201为Enterococcus devriesei。大鱼样品中分离到2个属 4个种的乳酸菌主要是L. fuchuensis (30%)、L. curvatus (40%)、Ln. lactis (10%)和Ln. fallax (20%)。小鱼样品中分离到5个属8个种的乳酸菌,主要是L. fuchuensis (52.8%)、L. curvatus (22.2%)、Ln. fallax (2.8%)、L. sakei (5.6%)、W. minor (2.8%)、W. ceti (5.6%)、Ln. cremoris (5.6%)和E. devriesei (2.8%)。不管是大鱼还是小鱼肠道中,L. fuchuensis都是最多的种,W. minor、W. ceti、Ln. cremoris、E. devriesei等只在小鱼肠道出现。
|
| 图 1 裸鲤肠道样品中乳酸菌杆菌系统进化树 Figure 1 Phylogenetic tree showing the relationship between the 16S rRNA gene sequences of rod-shaped strains in the intestinal of Gymnocypris przewalskii 注:括号中代表菌株在GenBank中的登录号,数字代表序列的进化程度,芽孢杆菌作为外围菌株,序列差异为1%. Note: Reference sequences of the Lactobacillus type strains from the DDBJ database are used for comparison,as well as the accession numbers for all 16S rRNA gene sequences (between brackets). Bootstrap values for 100 replicates are shown at the nodes of the tree. Bacillus subtilis is used as an out group. The bar indicates 1% sequence divergence. |
|
|
|
| 图 2 裸鲤肠道样品中乳酸菌球菌系统进化树 Figure 2 Phylogenetic tree showing the relationship between the 16S rRNA gene sequences of cocci-shaped strains obtained in the intestinal of Gymnocypris przewalskii 注:括号中代表菌株在GenBank中的登录号,数字代表序列的进化程度,芽孢杆菌作为外围菌株,序列差异为1%. Note: Reference sequences of the Leuconostoc,Weissella,Lactococcus,and Enterococcus species type strains from the DDBJ/GenBank/EMBL database are used for comparison,as well as the accession numbers for all 16S rRNA gene sequences (between brackets). Bootstrap values for 100 replicates are shown at the nodes of the tree. Bacillus subtilis is used as an out group. The bar indicates 1% sequence divergence. |
|
|
如表 4所示:39株菌株中对6种指示菌都有抑菌作用的菌株共13株,抑菌率(具有抑菌作用菌株在总数中所占的比例)达到33.33%。其中,33株乳酸菌发酵产物对沙门氏菌ATCC14028有抑菌活性,抑菌率达到84.62%,其次为金黄色葡萄球菌12600、枯草芽孢杆菌63501、藤黄微球菌28001、李斯特氏菌BAA、大肠杆菌30105,抑菌率分别为76.92%、71.79%、61.54%、58.97%、38.46%。本次实验所筛选的13株乳酸菌菌株既能抑制G+菌,也能抑制G−,具有广谱抑菌作用。
| strain name | Indicator strains | ||||||
| staphylococcus aureus12600 | Listeria BAA | Bacillus subtilis 63501 | Micrococcus luteus 28001 | Escherichia coli 30105 | Salmonella ATCC14028 | ||
| qz1196 | 9.62±0.04* | 21.04±0.20 | 12.08±0.05 | 20.98±0.74 | 9.18±0.04 | 12.32±0.90 | |
| qz1197 | − | 17.28±0.35 | 10.64±0.36 | 18.28±0.56 | − | 9.90±0.19 | |
| qz1198 | − | 17.68±0.45 | − | − | − | 12.52±0.05 | |
| qz1200 | − | 10.04±0.13 | 11.06±0.56 | 15.50±1.01 | − | 10.88±0.82 | |
| qz1201 | − | 9.18±0.60 | 11.64±0.42 | 14.96±0.70 | − | 9.96±0.45 | |
| qz1203 | 9.52±0.03 | 13.24±0.24 | 13.94±0.43 | 19.66±0.35 | 11.22±0.67 | 13.34±0.27 | |
| qz1204 | 8.88±0.32 | − | − | − | − | − | |
| qz1205 | 9.48±0.52 | 19.20±0.23 | 14.20±0.25 | 19.20±0.58 | 9.32±0.26 | 12.34±0.37 | |
| qz1206 | 9.32±0.06 | − | 10.30±0.14 | − | − | 8.04±0.09 | |
| qz1207 | 9.68±0.03 | − | − | − | − | − | |
| qz1211 | − | 13.54±0.56 | 11.70±0.56 | 14.70±0.46 | − | − | |
| qz1212 | 11.78±0.38 | 18.88±0.13 | 13.90±0.26 | 21.36±0.34 | 10.12±0.43 | 11.36±0.25 | |
| qz1213 | 10.32±0.35 | − | − | − | − | − | |
| qz1214 | − | 15.02±0.33 | 12.42±0.50 | 14.18±0.37 | − | 11.86±0.29 | |
| qz1216 | 9.22±0.33 | 20.12±0.42 | 19.74±0.52 | 21.04±0.28 | 8.84±0.84 | 11.24±0.82 | |
| qz1217 | − | − | 12.14±0.53 | 11.30±0.17 | − | 19.42±0.03 | |
| qz1218 | − | − | − | − | − | 16.38±0.07 | |
| qz1219 | 11.80±0.46 | 21.66±0.16 | 14.60±0.24 | 16.48±0.88 | 9.60±0.47 | 22.00±0.28 | |
| qz1220 | 11.06±0.52 | 19.88±0.48 | 13.94±0.80 | 23.34±0.45 | 15.02±0.42 | 13.60±0.47 | |
| qz1221 | 8.64±0.52 | − | − | − | − | − | |
| qz1222 | 8.94±0.47 | − | − | − | − | − | |
| qz1229 | 12.36±0.55 | − | − | − | − | 11.10±0.26 | |
| qz1233 | 11.96±0.49 | 17.56±0.32 | 12.06±0.92 | 12.52±0.56 | − | 17.86±0.03 | |
| qz1235 | 12.18±0.61 | 17.92±0.08 | 12.32±0.34 | 12.50±0.46 | − | 16.50±0.67 | |
| qz1238 | 11.88±0.55 | 13.82±0.54 | 9.96±0.38 | 9.44±0.56 | 8.82±0.76 | 14.82±0.12 | |
| qz1240 | 10.30±0.40 | 8.64±0.33 | 8.44±0.73 | 8.34±0.26 | 9.00±0.37 | 11.64±0.35 | |
| qz1243 | 9.72±0.38 | − | − | − | − | 10.20±0.36 | |
| qz1244 | − | − | − | − | − | 11.28±0.69 | |
| qz1245 | 10.22±0.45 | 16.10±0.74 | 14.48±0.56 | 12.88±0.44 | 14.62±0.75 | 16.46±0.05 | |
| qz1247 | 9.88±0.41 | 14.44±0.25 | 13.30±0.06 | 10.60±0.34 | 14.52±0.42 | 15.80±0.67 | |
| qz1248 | 11.96±0.50 | − | 9.52±0.37 | − | 12.82±0.57 | 10.90±0.22 | |
| qz1249 | 11.52±0.52 | − | 10.28±0.35 | 8.16±0.46 | − | 11.58±0.45 | |
| qz1253 | 10.54±0.36 | 8.66±0.60 | 10.26±0.24 | − | 9.50±0.36 | 13.62±0.58 | |
| qz1257 | 11.02±0.47 | − | 8.24±0.83 | 8.10±0.68 | − | 14.80±0.24 | |
| qz1258 | 13.78±0.55 | 14.08±0.21 | 13.78±0.72 | 11.08±0.55 | 1 3.42±0.26 | 17.54±0.32 | |
| qz1259 | 10.16±0.55 | − | − | − | − | 11.72±0.36 | |
| qz1261 | 11.38±0.62 | 10.10±0.34 | 10.16±0.46 | 8.90±0.60 | − | 14.62±0.54 | |
| qz1263 | 10.34±0.44 | 15.30±0.43 | 13.42±0.56 | 10.16±072 | 10.52±0.73 | 17.36±0.05 | |
| qz1264 | 9.78±0.60 | − | 8.52±0.24 | − | − | 11.74±0.46 | |
| 注:*:抑菌圈直径的大小;−:无抑菌能力(直径≤8.0 mm). Note: *: inhibition diameters; −: No antimicrobial activity (diameter ≤ 8.0 mm). | |||||||
对这13株乳酸菌菌株进行酸作用的排除试验,调其发酵上清液pH值为6.0,用牛津杯双层平板法进行抑菌试验。指示菌经过24 h培养后观察,有8株周围有较好的抑菌圈,对指示菌在一定程度上有抑制作用,pH 6.0的乳酸对照孔周围没有出现抑菌圈。结果如表 5所示:8株乳酸菌菌株对G+菌和G−菌仍有一定的抑制作用,说明在排除酸作用后,其无细胞发酵上清液中仍然有抑菌活性物质的存在,其中qz1199和qz1202对指示菌的抑制作用最好。
| strain name | Indicator strains | |||||
| Staphylococcus aureus12600 | Listeria BAA | Bacillus subtilis 63501 | Micrococcus luteus 28001 | Escherichia coli 30105 | Salmonella ATCC 14028 | |
| qz1196 | − | − | 12.50±0.08 | − | − | − |
| qz1199 | − | − | 11.06±0.34 | 10.7±0.34 | − | 9.82±0.04 |
| qz1202 | − | − | 11.04±0.54 | 13.1±0.24 | − | 8.50±0.45 |
| qz1238 | − | − | − | − | 8.60±0.45 | − |
| qz1240 | − | − | − | − | 9.82±0.05 | − |
| qz1245 | − | − | − | − | 9.60±0.09 | − |
| qz1247 | − | − | − | − | 12.52±0.25 | − |
| qz1251 | − | − | − | − | 12.92±0.36 | − |
| 注:−:无抑菌能力(直径≤8.0 mm). Note: −: No antimicrobial activity (diameter ≤ 8.0 mm). | ||||||
乳酸菌在代谢过程中可能产生过氧化氢抑制细菌的生长,尤其是抑制G−菌的生长,因此必需排除过氧化氢的干扰。发酵上清液用过氧化氢酶处理,以未经过氧化氢酶处理的pH 6.0的无细胞发酵上清液作对照,以大肠杆菌30105为指示菌进行抑菌试验,结果如表 6所示,表明3株乳酸菌的发酵上清液经过氧化氢酶处理后仍具有抑菌活性,从而证明发酵液中有另外的抑菌物质对指示菌起抑制作用。
| strain name | 抑菌圈直径Indicator halo (mm) |
| qz1245 | 17.04±0.69 |
| qz1247 | 13.58±0.55 |
| qz1251 | 13.76±0.61 |
排除酸和过氧化氢干扰后,挑取有较强抑菌效果的乳酸菌进行胰蛋白酶和蛋白酶K的酶解试验,其中菌株qz1251能被胰蛋白酶和蛋白酶K较好地裂解,上清液经两种酶处理后无抑菌圈出现,说明其抑菌物质是蛋白质类物质,是一类细菌素。
3 结论国外对于鱼肠道微生物菌群的组成及其多样性等方面的研究进行得较早,国内对肠道微生物的研究相对较晚,且主要集中在人类和禽畜动物[15],而对于鱼肠道微生物菌群的相关研究却比较少。任士菊[16]对新疆冷水鱼肠道菌多样性进行研究,分离的乳酸菌占92.55%,共分为Lactobacillus (73株)、Carrobacterium (70株)、Bacillus (1株)、Leuconostoc (5株) 4个属,发现肉食杆菌属(Carrobacterium)和乳杆菌属(Lactobacillus)是冷水鱼肠道乳酸菌中的优势菌群。青海湖裸鲤也属于冷水鱼,经研究发现其肠道附着非常丰富的微生物资源,优势菌群主要体现在乳杆菌属、好氧细菌,几乎不含酵母菌,无梭菌属。经鉴定乳酸菌被归为5个属,Lactobacillus、Leuconostoc、Weissella、Lactococcus和Enterococcus,其中杆菌属比球菌属多,杆菌比例为78.7%,而取自青藏高原地区其他材料如小麦、燕麦[17]、动物粪便等附着乳酸菌分离株则是明显球菌多于杆菌,至于原因还有待进一步研究。小鱼肠道内附着乳酸菌数量比大鱼肠道多,并且附着乳酸菌种类也比较多,其中Weissella、Lactococcus、Enterococcus三个属都来自于小鱼肠道。可以得出结论:乳酸菌在鱼肠道的数量和种类分布与鱼龄有关。迟骋[18]对鲤肠道菌进行分离,发现气单胞菌属、弧菌属和黄杆菌属为其肠道优势菌群。众多研究显示,鱼类肠道细菌的数量与组成受到种类、发育阶段、生理状况、食性、栖息水域等诸多因素的影响。
马媛等[19]从新疆冷水鱼肠道中分离出20株耐低温乳杆菌,最适生长温度在20 ℃左右,本文筛选出来的qz1217、qz1196、qz1220所在的A、B、C三组乳酸菌在5−50 ℃的温度范围内生长良好,显示出较宽的温度生长范围。Fuller[20]指出,动物所用益生菌应具有生长速度快、能耐受低pH胃肠道环境、能定殖于肠道黏膜、抑制肠道病原菌生长等特点。qz1196、qz1220所在的B、C组在pH 3.0-10.0的范围内生长良好,具有较强的pH耐受性,并且经过抑菌活性的测试,几乎所有乳酸菌都有一定的抑菌能力,显现出较强益生性,这将会拓展绿色环保的鱼用益生素的开发来源。这与任士菊等从冷水鱼肠道中分离出9株疑似产细菌素或多肽成分乳酸菌研究相一致[21]。本研究首次对青海湖裸鲤鱼肠道中附着乳酸菌进行分离与鉴定,将会对水生生物优势微生物资源的开发与利用提供一定的参考。后续将对裸鲤肠道具有抑菌活性的优势乳酸菌进一步进行益生性检测,以期能够筛选到对动物具有益生效应的菌株,添加到动物饲料里拓展乳酸菌在动物饲料行业的应用。
| [1] | Fang CH, Liu J, Xu XH. Research and development on bacteriocin produced by lactic acid bacteria[J]. China Dairy Industry , 2006, 34 (2) : 53–55. (in chinese) 房春红, 刘杰, 许修宏. 乳酸菌素的研究现状和发展趋势[J]. 中国乳品工业 , 2006, 34 (2) : 53–55. |
| [2] | Wang R, Bao XR, Wang XY, et al. The research of antibacterial properties and mechanism about lactobacillus in Fish intestinal[J]. Modernizing Agriculture , 2014 (8) : 49–51. (in chinese) 王融, 包栩睿, 王鑫钰, 等. 鱼类肠道乳酸菌的抑菌特性及机理研究[J]. 现代化农业 , 2014 (8) : 49–51. |
| [3] | Meng XL. Selection and application of probiotics from intestinal tract of Yellow Cartfish Pelteobagrus fulvideaeo[D]. Wuhan: Master’s Thesis of Huazhong Agricultural University, 2010 (in Chinese) 孟小亮. 黄颡鱼肠道益生菌的筛选及其应用研究[D]. 武汉: 华中农业大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010618.htm |
| [4] | Pirarat N, Pinpimai K, Endo M, et al. Modulation of intestinal morphology and immunity in nile tilapia (Oreochromis niloticus) by Lactobacillus rhamnosus GG[J]. Research in Veterinary Science , 2011, 91 (3) : e92–e97. DOI:10.1016/j.rvsc.2011.02.014 |
| [5] | Ding L, Zhou WR, Zhang SY, et al. Application of probiotics in aquaculture and effects on intestinal microflora infish[J]. Feed Industry , 2009, 30 (20) : 27–30. (in chinese) 丁丽, 周维仁, 章世元, 等. 益生菌在水产上的应用及其对鱼类肠道菌群的影响[J]. 饲料工业 , 2009, 30 (20) : 27–30. |
| [6] | Liu Q, Chen Y. Live lactic acid bacteria against pathogens adhesion and its application in aquaculture[J]. China Fisheries , 2006 (11) : 63–64. (in chinese) 刘倩, 陈营. 乳酸菌对病原菌定植的拮抗作用及其在水产养殖中的应用[J]. 中国水产 , 2006 (11) : 63–64. |
| [7] | Chen DQ, Zhang X, Xiong F, et al. Studies on growth characteristics of Gymnocypris przewalskii[J]. Acta Hydrobiologica Sinica , 2006, 30 (2) : 173–179. (in chinese) 陈大庆, 张信, 熊飞, 等. 青海湖裸鲤生长特征的研究[J]. 水生生物学报 , 2006, 30 (2) : 173–179. |
| [8] | Chen DQ, Xiong F, Shi JQ, et al. Research and Conservation of G. przewalskii[M]. Beijing: Science Press, 2011: 1 -7. (in chinese) 陈大庆, 熊飞, 史建全, 等. 青海湖裸鲤研究与保护[M]. 北京: 科学出版社, 2011: 1 -7. |
| [9] | Ni KK, Wang YP, Pang HL. Natural lactic acid bacteria population and silage fermentation of whole-crop wheat[J]. Asian-Australasian Journal of Animal Sciences (AJAS) , 2015, 28 (8) : 1123–1132. DOI:10.5713/ajas.14.0955 |
| [10] | Pang HL, Tan ZF, Qin GY, et al. Phenotypic and phylogenetic analysis of lactic acid bacteria isolated from forage crops and grasses in the Tibetan Plateau[J]. The Journal of Microbiology , 2012, 50 (1) : 63–71. DOI:10.1007/s12275-012-1284-5 |
| [11] | Kozaki M, Uchimura T, Okada S. Experimental Manual for Lactic Acid Bacteria[M]. Tokyo: Asakurasyoten, 1992: 29 -72. |
| [12] | Pang HL. Natural population and taxonomic study of lactic acid bacteria isolated from forage crops and silage[D]. Zhengzhou: Doctoral Dissertation of Zhengzhou University, 2011 (in Chinese) 庞会利. 饮料作物及发酵饲料中自然附着乳酸菌群的分类学研究[D]. 郑州: 郑州大学博士学位论文, 2011 |
| [13] | Pang HL, Zhang M, Qin GY, et al. Identification of lactic acid bacteria isolated from corn stovers[J]. Animal Science Journal , 2011, 82 (5) : 642–653. DOI:10.1111/asj.2011.82.issue-5 |
| [14] | Lü HX, Wang WD, Tan ZF, et al. Screening and identification of a broad spectrum bacteriocin-producing lactic acid bacteria strain Leuconostoc mesenteroide QHH7[J]. China Dairy Industry , 2013, 41 (10) : 8–10. (in chinese) 吕好新, 王巍东, 谈重芳, 等. 一株产广谱细菌素乳酸菌菌株的筛选及鉴定[J]. 中国乳品工业 , 2013, 41 (10) : 8–10. |
| [15] | Shi F. Isolation and Identification of lactobacilli from the digestive tract of broilers and study on their functions[D]. Taian: Master’s Thesis of Shandong Agricultural University, 2010 (in Chinese) 石峰. 鸡肠道乳酸菌的分离鉴定及其功能研究[D]. 泰安: 山东农业大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10434-1011019415.htm |
| [16] | Ren SJ. Study on the lactic acid bacteria biodiversity isolated from the intestinal tract of cold-water fish and the screening of bacteriocin producing strains[D]. Shihezi: Master’s Thesis of Shihezi University, 2014 (in Chinese) 任士菊. 冷水鱼肠道乳酸菌多样性及产细菌素乳酸菌特性研究[D]. 石河子: 石河子大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/article/cdmd-10759-1015511118.htm |
| [17] | Li Y. Lactic acid bacteria resource screening from the Tibet Plateau and preliminary research of application[D]. Zhengzhou: Master’s Thesis of Zhengzhou University, 2013 (in Chinese) 李亚. 青藏高原地区乳酸菌菌种资源筛选与初步应用研究[D]. 郑州: 郑州大学硕士学位论文, 2013 |
| [18] | Chi C. Effects of intestinal dominant bacteria on the immune faction of common carp, cyprinuscarpio[D]. Yangling: Master’s Thesis of North West Agriculture and Forestry University, 2014 (in Chinese) 迟骋. 鲤肠道优势菌对其免疫功能的影响[D]. 杨凌: 西北农林科技大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/article/cdmd-10712-1014430098.htm |
| [19] | Ma Y, Wang JG, Zhou H, et al. Isolation and genetic difference analysis of psychrotrophic Lactobacillius from Xinjiang cold water fish intestinal tract[J]. Journal of Anhui Agricultural Sciences , 2013, 41 (30) : 12034–12037. (in chinese) 马媛, 王俊钢, 周红, 等. 新疆冷水鱼肠道中耐低温乳杆菌的分离筛选及其遗传差异分析[J]. 安徽农业科学 , 2013, 41 (30) : 12034–12037. |
| [20] | Fuller R. Probiotics in man and animals[J]. Journal of Applied Bacteriology , 1989, 66 (5) : 365–378. DOI:10.1111/jam.1989.66.issue-5 |
| [21] | Ren SJ, Wang JG, Zhou H, et al. Screening of lactic acid bacteria with inhibitory activity isolated from intestinal of cold water fish and analysis of its physiological property[J]. Science and Technology of Food Industry , 2014, 35 (14) : 178–181. (in chinese) 任士菊, 王俊钢, 周红, 等. 冷水鱼肠道抑菌活性乳酸菌的筛选及其生理特性分析[J]. 食品工业科技 , 2014, 35 (14) : 178–181. |
 2016, Vol. 43
2016, Vol. 43