扩展功能
文章信息
- 吴晓青, 吕玉平, 任何, 赵晓燕, 赵忠娟, 张广志, 李纪顺, 张新建, 杨合同
- WU Xiao-Qing, Lü Yu-Ping, REN He, ZHAO Xiao-Yan, ZHAO Zhong-Juan, ZHANG Guang-Zhi, LI Ji-Shun, ZHANG Xin-Jian, YANG He-Tong
- 木霉对草酸耐受和消除作用的初步分析
- Tolerance and elimination of oxolic acid by Trichoderma spp.
- 微生物学通报, 2016, 43(9): 1988-1998
- Microbiology China, 2016, 43(9): 1988-1998
- DOI: 10.13344/j.microbiol.china.150692
-
文章历史
- 收稿日期: 2015-09-14
- 接受日期: 2016-02-29
- 优先数字出版日期(www.cnki.net): 2016-03-07
2. 山东省科学院生物研究所 山东济南250014 ;
3. 山东理工大学生命科学学院 山东淄博 255049
2. Biology Institute of Shandong Academy of Sciences,Jinan,Shandong 250014,China ;
3. College of Life Science,Shandong University of Technology,Zibo,Shandong 255049,China
草酸(Oxalic acid,OA)虽然是最简单的有机二元酸,却是许多植物致病菌的致病因子[1]。灰霉菌(Botrytis cinerea)[2]、菌核菌(Sclerotinia sclerotiorum)[3]等草酸分泌型病原菌可在致病初期向侵染环境中分泌草酸,通过降低环境pH、螯合Ca2+、并对植物产生毒害等作用引起和增强致病性[4-5]。已有研究表明,草酸分泌缺陷型灰霉菌和菌核菌的突变体不具备或致病力降低[3, 6]。研究者发现一些木霉具备消除草酸的能力,且该能力与生防功能有关。绿色木霉(T. viride) S7对菌核菌的拮抗作用中,提取物表现出明显的草酸氧化酶(Oxalate oxidase,OXO)活性,最高可降解23%的草酸[7]。另有报道,绿色木霉(T. viride) TvB1、哈茨木霉(T. harzianum) ThB1及康宁木霉(T. koningii)可显著降低齐整小核菌Sclerotium rolfsii所产生的草酸,并直接导致白绢病发病率的降低[8]。筛选具有耐受和消除草酸能力的木霉生防菌,有助于开发针对灰霉病、菌核病等草酸分泌型病害的高效生防菌剂。
哈茨木霉(T. harzianum) LTR-2,原鉴定为绿色木霉(T. viride),后更正为哈茨木霉(T. harzianum),是山东省应用微生物重点实验室发现并分离的 一株木霉菌株,该菌株及其制剂获国家发明专利(ZL200510104385.7),并已在农业部注册为农药。
LTR-2在PDA平板上28 ℃培养5-7 d,对蔬菜灰霉病菌的抑菌谱为10.0 mm,其可湿性粉剂在田间可有效防治番茄、茄子、五彩椒、辣椒、扁豆和黄瓜 6种蔬菜灰霉病,防治效果为71%-81%[9]。草酸耐受平板实验结果表明,LTR-2可耐受80 mmol/L的草酸浓度,其草酸耐受性在42株受测试的木霉菌株中最为突出。本文分析了LTR-2耐受、消除草酸的特性,将作为研究LTR-2消除草酸机制的基础性数据。
1 材料与方法 1.1 试验材料本试验所使用木霉菌株由山东省应用微生物重点实验室分离并保藏,菌株情况详见表 1。
| 采集地 Sampling Site | 菌株编号 Strain code |
| 北京市Beijing | 599-2、600-1、609-1、610-4、610-9 |
| 海南省Hainan | 509-11、510-9、519-1 |
| 河北省Hebei | 5-1 |
| 湖南省Hunan | 409-1、409-6、409-13、428-2、430-9、440-1 |
| 吉林省Jilin | 550-2 |
| 江西省Jiangxi | 538-1、538-5、539-20、539-22 |
| 山东省 Shandong | LTR-2、16-1、16-16、38-7、39-9、48-12 |
| 上海市 Shanghai | 558-4、558-5、558-8、559-3、560-7、560-9、568-2、570-4 |
| 西藏自治区 Tibet | 90-2、90-5、639-1 |
| 新疆自治区 Xinjiang | 200-6、208-7、230-1、679-1 |
| 云南省Yunnan | 288-6 |
1.2.1 含草酸培养基的配制:因草酸在高温高压下分解,因此采用0.22 μm孔径的一次性针头式过滤器对0.5 mol/L的草酸母液进行过滤除菌。将PDB液体培养基(美国BD公司)、PDA培养基(在PDB中添加10.0 g/L琼脂粉)或无碳源的察氏培养基(g/L:NaNO3 3.0,K2HPO4 1.0,MgSO4·7H2O 0.5,KCl 0.5,FeSO4 0.01)在64.73 kPa灭菌30 min,待冷却到50 ℃以下时,按比例添加草酸母液至终浓度。
1.2.2 草酸耐受性测定平板试验:将42株木霉待测菌株于PDA培养基中活化,25 ℃暗培养3 d。用5 mm打孔器取平板边缘菌丝分布均匀处的菌块,菌丝面朝下,分别接种于含20、30 mmol/L的PDA培养基上。菌块距离平板边缘1 cm,置于25 ℃暗培养4 d。设不添加草酸的PDA平板为对照,试验共设3个重复。分别测量草酸平板的菌落半径(r草酸+,mm)和对照平板的菌落半径 (r草酸-,mm),计算草酸耐受率(T草酸,%),公式为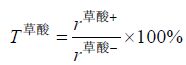
1.2.3 草酸胁迫下木霉的形态观察:将3 d龄LTR-2的5 mm菌块分别接种于含有10、20、50、80和100 mmol/L草酸的PDA培养基上,25 ℃半光照培养10 d,观察并描述菌落形态。在无菌载玻片上涂布分别含有0、10、20、50、80和100 mmol/L草酸的PDA培养基,将3 d龄LTR-2的菌丝分别接种于培养基上,置于无菌培养皿中用封口膜封口。25 ℃培养1 d。直接将载玻片置于显微镜下,观察菌丝、分生孢子梗和厚垣孢子等结构。
1.2.4 木霉消除不同浓度草酸的定量测定:取4 d龄LTR-2的培养平板,用无菌接种针轻轻刮下分生孢子,悬浮在含有0.01% triton的无菌水中,滤纸过滤,制成浓度为107分生孢子/mL的孢子悬浮液。将PDB培养液分装在500 mL三角瓶中,每瓶100 mL。分别往培养基中加入不同量的草酸母液,使其终浓度分别为0、10、20、50、80和100 mmol/L,将 100 μL木霉分生孢子悬浮液接种至各处理三角瓶(初始浓度为104分生孢子/mL),以含有不同浓度 草酸但不接种木霉(以100 μL含有0.01% triton的无菌水代替)的PDB培养液为对照。每处理设3个重复。25℃、160 r/min培养5 d。用预先称重的滤纸抽滤,分离各三角瓶中的木霉菌丝和培养液。将带有菌丝的滤纸置于50 ℃烘箱中,烘烤至恒重,计算菌丝干重。用pH计测定三角瓶培养物滤液的pH。
参考Kim等的方法测定培养物滤液中的草酸含量[10]。
1.2.5 草酸为碳源的木霉培养:以1.2.4的方法制得分生孢子悬浮液。将无碳源的察氏培养基分装在500 mL三角瓶中,每瓶100 mL。添加草酸母液,使其终浓度分别为0、10、20、50、80和100 mmol/L,将100 μL木霉分生孢子悬浮液接种至各处理三角瓶,以含有不同浓度草酸但不接种木霉(以100 μL含有0.01% triton的无菌水代替)的无碳源察氏培养液为对照。每处理设3个重复。25 ℃、160 r/min培养5 d。观察生长情况。
1.2.6 不同时期LTR-2中草酸脱羧酶(Oxalate decarboxylase,OXDC)基因LTR_04445表达水平的Real-time PCR检测:LTR-2总RNA的提取按照OMEGA公司的试剂盒说明书进行,反转录按照Takara公司的试剂盒说明书进行。本实验采用相对定量法分别对培养3、4、5、6、7和8 d的LTR_04445表达水平进行Real-time PCR检测。采用Beacon Designer 7.0引物设计软件设 计引物,F:5′-ATTTCTCCCTCTTCCAGT-3′,R:5′-TCGTAATCTCGTCCTTCT-3′,扩增长度为132 bp的木霉LTR_04445基因片段。Real-time PCR反应体系(15 μL):2×Sybrgreen Premix 7.5 μL,Primer Premix 1.5 μL,cDNA 1 μL,dd H2O 5 μL。反应条件:95 ℃ 2 min;95 ℃ 10 s,58 ℃ 20 s,72 ℃ 20 s,共40个循环。熔解曲线分析条件:65 ℃-95 ℃,间隔0.5 ℃,20 s。具体操作按照Eppendorf公司的说明书进行。
2 结果与分析 2.1 草酸胁迫下木霉菌株的筛选木霉菌株在20 mmol/L和30 mmol/L的草酸胁迫下,菌体生长速度受到不同程度的抑制。由于在24 h内生长缓慢的菌株无法准确测量,且一半以上的木霉菌株生长96 h后即长满平板,本文分析了48 h和 72 h两个时间点的草酸耐受率。在42株测试木霉菌株中,20 mmol/L草酸胁迫下,仅有8株木霉菌株的草酸耐受率在48 h和72 h时达到50%以上,其中LTR-2的草酸耐受能力最强,培养72 h后为73% (图 1A、B)。在30 mmol/L浓度下,所有测试菌株的生长受到抑制,草酸耐受率均未超过50%。其中LTR-2在培养48 h时的草酸耐受率为43.82%,72 h时为39.50%,比其他菌株的草酸耐受性更强(图 1C、D)。
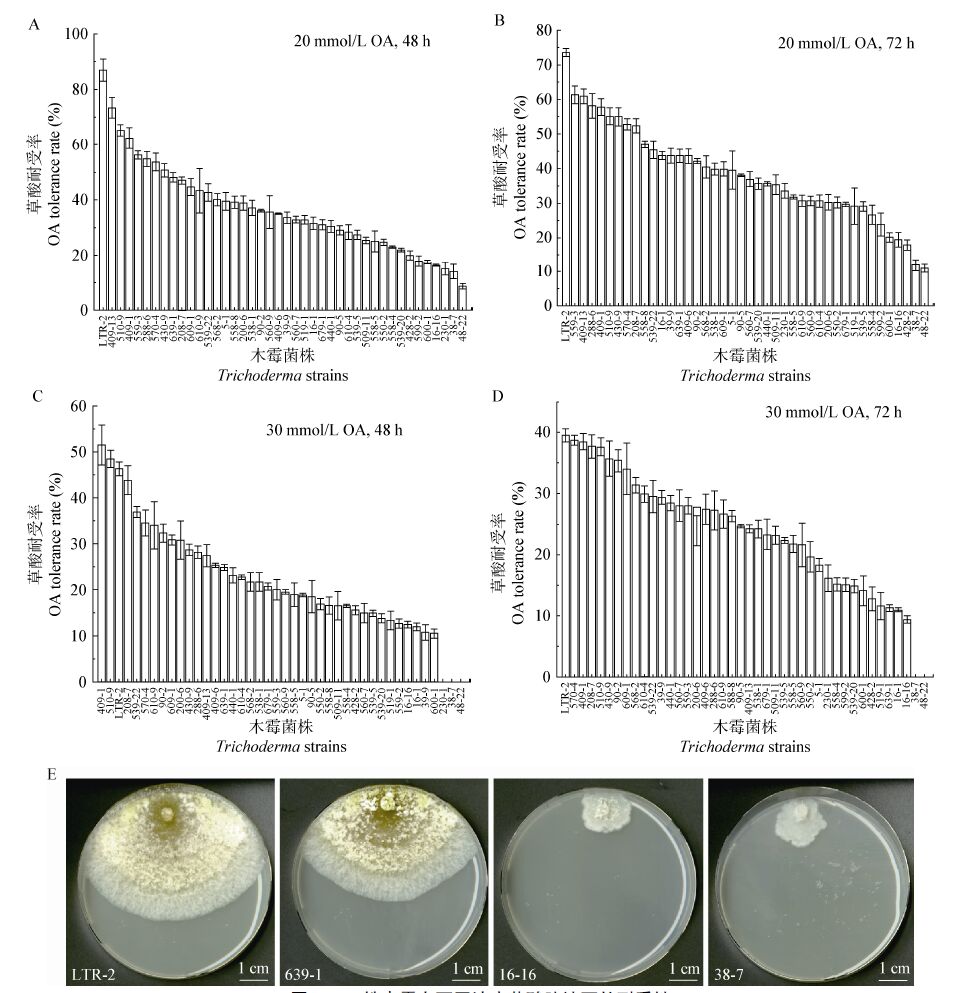
|
| 图 1 株木霉在不同浓度草酸胁迫下的耐受性 Figure 1 OA tolerance of 42 Trichoderma strains under different OA stresses 注:A-B:在含20 mmol/L草酸培养基中培养,其中A为培养48 h,B为培养72 h;C-D:在含30 mmol/L草酸培养基中培养,其中C为培养48 h;D为培养72 h;E:在含20 mmol/L草酸培养基中培养4 d时的菌落形态,以菌株LTR-2、639-1为草酸耐受性较强的木霉代表,以菌株16-16、38-7为草酸耐受性较弱的木霉代表. 培养条件为PDA,25 ℃暗培养. 数据为3个重复的平均值. Note: A-B: cultured under 20 mmol/L OA stress,of which A as cultured for 48 h,B as cultured for 72 h; C-D: cultured under 30 mmol/L OA stress,C: cultured for 48 h,D: cultured for 72 h; E: colony shape of typical strains cultured under 20 mmol/L OA stress for 4 d,LTR-2 and 639-1 represent strong tolerance strains,16-16 and 38-7 represent poor tolerance strains. The strains were cultered on PDA at 25 ℃ in the dark. The data are average of 3 replicates. |
|
|
用于测试的木霉菌株分离自不同地域的土壤、水或生物样品中,生理性质差异较大,在草酸耐受能力上也是如此。从菌落形态角度分析,耐受能力较强的木霉菌株在OA含量为20 mmol/L的条件下可生长为具有正常菌落特征的形态,仅表现为生长速度的差异;耐受能力较弱的木霉菌株在20 mmol/L条件下无法形成正常菌落,无气生菌丝和分生孢子产生,而仅形成致密的不规则菌落形态(图 1E)。
经比对,LTR-2的耐受草酸能力相对较强,我们进一步分析了LTR-2在草酸胁迫下的形态变化特征。
2.2 草酸胁迫下LTR-2的形态学特征将LTR-2分别置于草酸终浓度为0、10、20、50、80和100 mmol/L的PDA平板中25 ℃半光照培养。培养120 h时不添加草酸的平板中,LTR-2已形成大量的菌丝和绿色分生孢子(图 2A)。显微镜观察分生孢子梗由菌丝直立生出,对生,整体像树枝,分枝与分生孢子梗近似直角,末端为小梗,小梗瓶颈,分生孢子球形或长椭圆形(图 2G)。其特征与LTR-2的描述一致[11]。在含10 mmol/L和20 mmol/L草酸的PDA平板中,LTR-2的产孢量明显降低,气生菌丝减少,菌落出现了大块的“露白”(图 2B、C)。不过显微镜观察仍可见正常的分生孢子梗、分生孢子等正常结构(图 2H、I)。当草酸浓度达到50 mmol/L和80 mmol/L时,仍可形成一定的菌落形态,但在培养了120 h后,无明显丝状菌特征,无分生孢子产生。且生长极为缓慢,浓度越高生长越缓(图 2D、E)。显微镜下发现菌丝产生变异,形成串生的厚垣孢子结构,无法观察到分生孢子梗,更无孢子产生(图 2J、K)。不过在50 mmol/L条件下培养8 d后,菌落边缘可再萌发菌丝并产生分生孢子,在新萌发的菌丝中可观察到结构简单的分生孢子梗(图 2L)。当草酸浓度达到100 mmol/L时,LTR-2停止生长(图 2F)。

|
| 图 2 草酸处理后LTR-2的菌落形态和显微结构 Figure 2 Colonies and mycelia morphology of LTR-2 under OA treatment 注:A-F:培养5 d的菌落形态;A:未添加草酸;B:添加10 mmol/L草酸;C:添加20 mmol/L草酸;D:添加50 mmol/L草酸;E:添加80 mmol/L草酸;F:添加100 mmol/L草酸. G-K:培养5 d的显微结构,G:未添加草酸;H:添加10 mmol/L草酸;I:添加20 mmol/L草酸;J:添加50 mmol/L草酸;K:添加80 mmol/L草酸. L:培养8 d时LTR-2在50 mmol/L草酸中的显微结构. 培养条件为PDA 25 ℃半光照培养. Note: A-F: colonies of LTR-2 cultured for 5 d on PDA containing different concentration of OA; A: nil; B: 10 mmol/L; C: 20 mmol/L; D: 50 mmol/L; E: 80 mmol/L; F: 100 mmol/L. G-K: microscopic morphology of LTR-2 cultured for 5 d on PDA containing different concentration of OA. G: nil; H: 10 mmol/L; I: 20 mmol/L; J: 50 mmol/L; K: 80 mmol/L. L: microscopic morphology of LTR-2 cultured on PDA containing 50 mmol/L of OA for 8 d. The strains were cultered on PDA at 25 ℃ in the semi-light. |
|
|
相对于挑菌压片,载玻片上的原位观察可更加直观地反映草酸胁迫下LTR-2的发育特征变化。正常状态下,LTR-2生长24 h时,致密的菌丝生长脉络清晰,并可见大量分生孢子梗形成(图 3A)。受到10 mmol/L草酸的胁迫,培养24 h时,产生大量菌丝,但较为凌乱,且很难观察到分生孢子梗(图 3B)。当草酸浓度进一步增至20 mmol/L时,菌丝较为稀松,可见一些菌丝顶部产生膨大的厚垣孢子(图 3C)。30 mmol/L条件下,菌丝更加稀松,产生大量的球状厚垣孢子(图 3D)。50 mmol/L条件下,菌丝因过于稀疏不容易被观察到,视野被大量的球状厚垣孢子替代(图 3E)。当浓度达到80 mmol/L时,24 h培养时间内无任何菌体结构 产生(图 3F)。

|
| 图 3 草酸处理后LTR-2的原位发育情况 Figure 3 In situ development of LTR-2 treated with different concentration of OA 注:A:未添加草酸;B:添加10 mmol/L草酸;C:添加20 mmol/L草酸,箭头指示顶端厚垣孢子;D:添加30 mmol/L草酸,箭头指示球形厚垣孢子;E:添加50 mmol/L草酸,箭头指示厚垣孢子;F:添加80 mmol/L草酸. 培养条件为PDA 25 ℃暗培养1 d. Note: A: nil; B: 10 mmol/L OA; C: 20 mmol/L OA,the arrow indicates terminal chlamydospore; D: 30 mmol/L,the arrow indicates spherical chlamydospore; E: 50 mmol/L,the arrow indicated spherical chlamydospore; F: 80 mmol/L. The strains were cultered on PDA at 25 ℃ in the dark for 1 d. |
|
|
为了检测LTR-2消除草酸的能力,我们采用了液体培养的方式。结果不添加草酸的液体培养基未能检测出草酸,不添加LTR-2的草酸含量在培养的5 d内没有明显变化;添加了10-100 mmol/L草酸的液体培养液接种LTR-2后,草酸含量有不同程度的降低(图 4A)。草酸消除率由高到低为添加浓度是20>10>80>50>100 mmol/L的草酸,消除率分别为66.50%、55.06%、38.94%、28.43%和6.75% (图 4B)。不添加草酸的培养液初始pH为5.89,培养5 d后pH升高为7.25;但添加了草酸的培养液其初始pH与培养5 d后的pH没有明显变化;接种LTR-2后,没有添加草酸的培养液pH较初始显著降低,添加草酸的培养液pH较初始有不同程度的提高,其中在10、20 mmol/L草酸条件下升高幅度最大(图 4C)。

|
| 图 4 LTR-2消除草酸的作用分析 Figure 4 Effects of OA elimination of LTR-2 under some treatment conditions 注:A:培养滤液中的草酸浓度变化;B:LTR-2对培养滤液中草酸的消除率;C:培养滤液中pH变化;D:LTR-2的菌丝干重. 图中a-f表示培养液中草酸的初始浓度分别为0、10、20、50、80和100 mmol/L;a'-f'表示分别在a-f培养液中接种LTR-2,使每处理的分生孢子初始浓度均为104分生孢子/ml. 数据为3个重复的平 均值. 培养条件为PDB 25 ℃、160 r/min暗培养5 d. Note: A: variation of OA concentration in culture filtrate; B: OA elimination rate of LTR-2; C: variation of pH in culture filtrate; D: dry mass of LTR-2. a-f indicate the initial OA concentration in culture medium are 0,10,20,50,80 and 100 mmol/L,respectively; a'-f' indicate initial concentration of LTR-2 in a-f is 104 spores/mL. The data are average of 3 replicates. The strains were cultured in PDB at 25 ℃ and 160 r/min in the dark for 5 d. |
|
|
有趣的是,在一定浓度的草酸胁迫下,木霉的生长速度有所加快。如图 4D结果所示,在不添加草酸的培养液中,5 d后,LTR-2的菌丝干重为 0.13 g。在添加了10、20 mmol/L草酸的培养液中,菌丝干重分别提高至0.20 g和0.15 g。然而当草酸浓度高于50 mmol/L时,培养5 d时菌丝的生长受到明显的抑制。这些结果表明,一定浓度的草酸胁迫对木霉菌丝的生长具有促进作用,这种作用可能由于营养吸收或某种诱导机制造成。
2.4 LTR-2可利用草酸为碳源缓慢生长为了验证LTR-2是否可以利用草酸为唯一碳源,将液体察氏培养基中的碳源去掉,仅添加不同浓度的草酸培养5 d,检测LTR-2的培养情况。
结果表明,在无碳源的条件下,LTR-2无法生长(图 5A)。在草酸浓度高于50 mmol/L条件下,LTR-2也无法生长(图 5D-F)。仅在含10 mmol/L和20 mmol/L草酸的培养液中,LTR-2可形成细小的绿色菌丝球,其中以10 mmol/L培养液中的菌丝球产生更多(图 5B、C)。结果表明,LTR-2可利用<20 mmol/L浓度的草酸为碳源缓慢生长,也在一定程度上解释了低浓度草酸的促生作用;但在>20 mmol/L浓度下,LTR-2不能利用草酸为碳源生长。

|
| 图 5 LTR-2在以草酸为碳源的察氏培养基中的生长情况 Figure 5 Growth of strain LTR-2 in Czapek-Dox liquid medium under different concentration of OA as sole carbon source 注:A:未添加草酸;B:添加10 mmol/L草酸;C:添加20 mmol/L草酸;D:添加50 mmol/L草酸;E:添加80 mmol/L草酸;F:添加100 mmol/L草酸. 培养条件为25 ℃、160 r/min暗培养5 d. Note: A: nil; B: 10 mmol/L; C: 20 mmol/L; D: 50 mmol/L; E: 80 mmol/L; F: 100 mmol/L. The strains were cultured at 25 ℃,160 r/min in the dark for 5 d. |
|
|
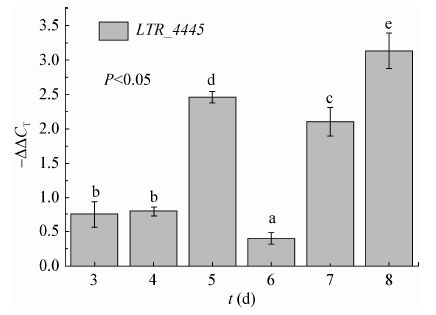
为了进一步验证LTR-2在草酸处理下是否启动了消除草酸的机制,我们对LTR-2的OXDC基因LTR_04445在不同时间点转录水平上的表达情况进行了分析。LTR-2在添加终浓度为20 mmol/L草酸的PDB液体培养基25℃、160 r/min暗培养3-8 d,经Real-time PCR检测,LTR_04445的表达量具有明显浮动(图 6)。
|
| 图 6 各时间点LTR_04445转录水平的表达量变化 Figure 6 Transcriptional levels changes of LTR_04445 at different time points |
|
|
培养2 d时,菌丝尚未大量形成,现有方法难以获得木霉转录组,因此无法分析表达水平。在培养3 d后,菌丝量增加至可检测;直至培养6 d时,处理组培养滤液的pH达到6.0;培养8 d时,菌丝已粘稠,且滤液pH稳定在6.0。因此分析3-8 d的表达水平比较合适。培养3、4 d时,LTR_04445表达量小幅上调,5 d时表达量比之前上调幅度显著增加。但意外的是,培养6 d时,表达量相比对照组有所上调,但上调幅度显著小于3 d和4 d的。而培养7 d时,表达量上调幅度回升,至8 d时,表达量上调幅度为最大。从上述结果得出:(1) 培养液中添加草酸,LTR-2的OXDC基因LTR_04445的表达量发生了上调;(2) 时间动态上,基因的表达量浮动明显,其中5 d、8 d表达量提高幅度最大。结果表明,LTR-2消除培养液中的草酸,启动了草酸代谢机制,但时间动态的表达量浮动现象还需要进一步的研究解释。另外,其他可能存在的机制也需要转录组分析等技术手段进行验证。
3 结论与讨论草酸毒素是菌核菌、灰霉菌等植物病原菌的致病因子:(1) 草酸降低植物组织受侵染区域的环境pH,使几种细胞壁降解酶可产生活性;(2) 草酸螯合植物细胞壁中的Ca2+,形成的草酸钙晶体可阻塞植物导管,也使细胞壁软化和扩大细胞膜的通透性,从而引起细胞器和组织的破坏;(3) 草酸造成的低pH值环境有效抑制植物氧爆的发生;(4) 草酸可干预植物保卫细胞的功能,使气孔不能正常开放,抑制在侵染时脱落酸诱导的气孔关闭行为[12];(5) 草酸是发病初期引发植物细胞死亡的主要原因;(6) 草酸本身具有非特异性植物毒素作用[13]。某些单子叶植物(如大麦、小麦、高粱、玉米、水稻等)在病害侵染时,可分泌草酸降解酶(OXO),但多数双子叶植物无此机制。除了植物自身的消除草酸机制外,目前人工消除草酸的措施通常为直接喷洒碳酸钙,中和草酸为无害的草酸钙(如防治咖啡叶斑病)。但该方法弊端明显:(1) 生成的草酸钙易阻塞气孔,影响植物正常生理功能;(2) 不易到达叶密作物的茎部或根部病害,病害隐患无法消除;(3) 施用一次仅可维持一个作物季,治标不治本;(4) 长期施用对土壤性质造成一定影响。我们的研究表明,木霉LTR-2抑制灰霉病的同时具有消除草酸的作用,木霉耐受草酸作用与抑制灰霉菌有相关性,木霉消除草酸作用与对灰霉菌的抑制率间具有正相关性(P<0.05)。同时,木霉具有丰富的抗病机制,更可诱发植物自身的抗病性,长期施用对土壤肥力也有改良作用,是防治草酸分泌型病害的优秀生防菌候选。但目前,有关木霉耐受、消除草酸的深入研究很少,本文旨在对木霉LTR-2的耐受、消除草酸作用进行初步的探讨,为进一步的防病机制研究提供理论基础。
在病原菌侵染初期所分泌的草酸溶液浓度目前并未见报道。如前述,草酸毒素的分泌可直接造成植物的叶萎(foliar wilting),并可导致豌豆气孔无法正常闭合[14]。草酸毒素还可诱发植物细胞死亡程序(PCD)[15]。据报道,菌核菌粗毒素对向日葵种子萌发和胚根的生长有强烈的抑制作用,甚至造成根尖生长点死亡,对幼苗有很强的致萎活性,可导致茎基部全部坏死,叶片全部干枯[16]。由此可推断病原菌瞬时分泌的草酸溶液浓度较高,但具体浓度有待进一步研究。有研究采用的筛选草酸降解菌的草酸浓度为20-30 mmol/L[17]。我们的研究发现,对于绝大部分木霉在30 mmol/L草酸的胁迫下生长受到严重抑制,其中LTR-2等菌株表现较好,耐受率也未到50%;而在高于80 mmol/L的草酸浓度中,LTR-2几乎无法生长,消除草酸的能力更是大大 降低。
LTR-2在30 mmol/L的草酸环境中,初生的菌丝首先形成了厚垣孢子。厚垣孢子的形成是木霉应对逆境条件的一种生存策略[18]。虽然人们很早就发现了厚垣孢子,并利用其特性开发了更稳定的制剂,但厚垣孢子的形成机制并不明晰。研究表明,不同真菌厚垣孢子的形成机制存在较大差异,而木霉的厚垣孢子形成有可能是多基因共同参与的复杂调控过程,因很难通过T-DNA插入突变的方式获得不产生厚垣孢子的突变菌株[19]。本研究中,在<50 mmol/L的草酸浓度下,LTR-2在24 h内即形成厚垣孢子,再培养5-7 d后,厚垣孢子可在相同的草酸浓度下萌发出比较正常的菌丝,也可形成相对稀少的分生孢子梗,并产生分生孢子,且不再产生大量的厚垣孢子。在这个过程中,LTR-2菌体经历了从“防御”到“适应”的状态转变,其中的机制并不清楚。另外,在液体培养中,10、20 mmol/L浓度的草酸对LTR-2的生长反而起到了促进作用,LTR-2更可利用草酸为碳源进行生长。对于草酸的消除作用,通常等同于降解作用。研究比较多的是主要存在于高等植物中的氧化代谢途径[7]及真菌和细菌中的脱羧代谢途径[20]。木霉的提取物中已发现有OXO酶活性[7],在NCBI上也登记有OXDC氨基酸序列信息。本文Real-time PCR结果也验证了OXDC基因的表达在草酸处理时有所上调。表明草酸代谢途径可能也存在于木霉中,但代谢途径碳的代谢终产物为CO2,而异养型微生物无法利用CO2作为直接碳源。本文2.4提到木霉可利用草酸为碳源生长,并具有从“防御”到“适应”的过程。那么木霉中也许存在降解途径以外的其他消除草酸的途径,比如作为前体转化为大分子营养物质、细胞器隔离等途径。对木霉消除草酸作用的进一步研究,可为筛选针对草酸分泌型病害的高效专型防治木霉提供新靶标。
| [1] | Prusky D, Yakoby N. Pathogenic fungi: leading or led by ambient pH?[J]. Molecular Plant Pathology , 2003, 4 (6) : 509–516. DOI:10.1046/j.1364-3703.2003.00196.x |
| [2] | Nakajima M, Akutsu K. Virulence factors of Botrytis cinerea[J]. Journal of General Plant Pathology , 2014, 80 (1) : 15–23. DOI:10.1007/s10327-013-0492-0 |
| [3] | Liang XF, Liberti D, Li MY, et al. Oxaloacetate acetylhydrolase gene mutants of Sclerotinia sclerotiorum do not accumulate oxalic acid,but do produce limited lesions on host plants[J]. Molecular Plant Pathology , 2015, 16 (6) : 559–571. DOI:10.1111/mpp.2015.16.issue-6 |
| [4] | Amselem J, Cuomo CA, van Kan JA, et al. Genomic analysis of the necrotrophic fungal pathogens Sclerotinia sclerotiorum and Botrytis cinerea[J]. PLoS Genetics , 2011, 7 (8) : e1002230. DOI:10.1371/journal.pgen.1002230 |
| [5] | Manteau S, Abouna S, Lambert B, et al. Differential regulation by ambient pH of putative virulence factor secretion by the phytopathogenic fungus Botrytis cinerea[J]. FEMS Microbiology Ecology , 2003, 43 (3) : 395–366. |
| [6] | Kunz C, Vandelle E, Rolland S, et al. Characterization of a new,nonpathogenic mutant of Botrytis cinerea with impaired plant colonization capacity[J]. New Phytologist , 2006, 170 (3) : 537–550. DOI:10.1111/nph.2006.170.issue-3 |
| [7] | Yadav S, Srivastava AK, Singh DP, et al. Isolation of oxalic acid tolerating fungi and decipherization of its potential to control Sclerotinia sclerotiorum through oxalate oxidase like protein[J]. World Journal of Microbiology and Biotechnology , 2012, 28 (11) : 3197–3206. DOI:10.1007/s11274-012-1130-2 |
| [8] | Paramasivan M, Mohan S, Muthukrishnan N, et al. Degradation of oxalic acid (OA) producing Sclerotium rolfsii (Sacc.) by organic biocides[J]. Archives of Phytopathology and Plant Protection , 2013, 46 (3) : 357–363. DOI:10.1080/03235408.2012.740983 |
| [9] | Dai B, Hu JD, Li JS, et al. Field efficacy of Trichoderma LTR-2 wettable powder against six kinds of vegetable gray mold diseases[J]. Shandong Science , 2014, 27 (5) : 22–27. (in chinese) 戴宝, 扈进冬, 李纪顺, 等. 木霉菌LTR-2可湿性粉剂对6种蔬菜灰霉病的田间防治效果[J]. 山东科学 , 2014, 27 (5) : 22–27. |
| [10] | Kim KS, Min JY, Dickman MB. Oxalic acid is an elicitor of plant programmed cell death during Sclerotinia sclerotiorum disease development[J]. Molecular Plant-microbe interactions , 2008, 21 (5) : 605–612. DOI:10.1094/MPMI-21-5-0605 |
| [11] | Yang HT,Li JS,Chen K,et al. Trichoderma viride LTR-2 and it’s formulation: China,200510104385.7[P]. 2006-06-14 (in Chinese) 杨合同,李纪顺,陈凯,等. 绿色木霉LTR-2菌株及其制剂: 中国,200510104385.7[P]. 2006-06-14 |
| [12] | Li YF, Guan CY. Histopathology,pathogenesis and disease resistance mechanism of sclerotinia rot of colza[J]. Crop Research , 2005 (5) : 327–331. (in chinese) 李玉芳, 官春云. 油菜菌核病菌侵染的组织病理学、致病及抗病机制的研究[J]. 作物研究 , 2005 (5) : 327–331. |
| [13] | Apel K, Hirt H. Reactive oxygen species: Metabolism,oxidative stress,and signal transduction[J]. Proceedings of the National Academy of Science of the United States of America , 2012, 109 (40) : 16360–16365. DOI:10.1073/pnas.1202041109 |
| [14] | Guimares RL, Stotz HU. Oxalate production by Sclerotinia sclerotiorum deregulates guard cells during infection[J]. Plant Physiology , 2004, 136 (3) : 3703–3711. DOI:10.1104/pp.104.049650 |
| [15] | Kabbage M, Williams B, Dickman MB. Cell death control: the interplay of apoptosis and autophagy in the pathogenicity of Sclerotinia sclerotiorum[J]. PLoS Pathogens , 2013, 9 (4) : e1003287. DOI:10.1371/journal.ppat.1003287 |
| [16] | Li DZ, Zhang XY, Liu ZY, et al. Poisoning effects of crude toxin by Sclerotinia sclerotiorum on seed and seedling of sunflower[J]. Journal of Beijing University of Agriculture , 2008, 23 (4) : 21–24. (in chinese) 李得宙, 张笑宇, 刘正垣, 等. 菌核菌粗毒素对向日葵种子及幼苗的毒害作用[J]. 北京农学院学报 , 2008, 23 (4) : 21–24. |
| [17] | Wang T, Wu JS, Wang JS. Screening of oxalic acid-decomposed bacteria and their roles in control of Sclerotinia sclerotiorum[J]. Journal of Nanjing Agricultural University , 2001, 24 (4) : 29–32. (in chinese) 王婷, 吴健胜, 王金生. 草酸降解菌的筛选及其对油菜菌核病的生物防治作用[J]. 南京农业大学学报 , 2001, 24 (4) : 29–32. |
| [18] | Papavizas GC. Trichoderma and Gliocladium: biology,ecology,and potential for biocontrol[J]. Annual Review of Phytopathology , 1985, 23 : 23–54. DOI:10.1146/annurev.py.23.090185.000323 |
| [19] | Yang XY, Li M, Zhang L, et al. Transcriptome analysis of Trichoderma harzianum Th-33 in chlamydospore formation[J]. Chinese Journal of Biological Control , 2015, 31 (1) : 85–95. (in chinese) 杨晓燕, 李梅, 张林, 等. 哈茨木霉Th-33厚垣孢子形成过程的转录组变化分析[J]. 中国生物防治学报 , 2015, 31 (1) : 85–95. |
| [20] | Cunha WG, Tinoco MLP, Pancoti HL. High resistance to Sclerotinia sclerotiorum in transgenic soybean plants transformed to express an oxalate decarboxylase gene[J]. Plant Pathology , 2010, 59 (4) : 654–660. DOI:10.1111/ppa.2010.59.issue-4 |
 2016, Vol. 43
2016, Vol. 43