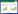扩展功能
文章信息
- 彭艳, 朱天辉, 张博阳, 龙旭梅
- PENG Yan, ZHU Tian-Hui, ZHANG Bo-Yang, LONG Xu-Mei
- 桑氏链霉菌KJ07抗菌蛋白的分离纯化及部分特性
- Isolation,purification and partial characterization of an antifungal protein from Streptomyces sampsonii KJ07
- 微生物学通报, 2016, 43(9): 1980-1987
- Microbiology China, 2016, 43(9): 1980-1987
- DOI: 10.13344/j.microbiol.china.150672
-
文章历史
- 收稿日期: 2015-09-08
- 接受日期: 2016-03-09
- 优先数字出版日期(www.cnki.net): 2016-03-10
链霉菌是一类具有丝状分枝细胞的高 G+C mol%革兰氏阳性细菌[1],广泛存在于不同的自然环境中,土壤中分布居多[2]。相比于其他细菌,链霉菌具有较为复杂的分化发育过程,形态分化的同时伴随着大量具有广泛实际用途和重要经济价值的次级代谢产物生成,能产生多种抗生素[3]和几丁质酶、葡聚糖酶等多种抗菌蛋白[4-8],对许多植物病原菌具有较强的拮抗作用[9-10]。大多数抗菌蛋白不仅具有较强的抗菌作用,而且其相应的编码基因还较容易克隆得到,能为基因工程菌的构建以及转基因抗病植物的培育提供外源基因,因此分离纯化高活力的抗菌蛋白是植物生防研究中一项重要的基础性工作[11]。桑氏链霉菌(S. sampsonii)隶属于链霉菌属,目前国内外关于S. sampsonii的研究鲜有报道,针对其抗菌活性方面,Jain等[12]从菜园土壤样品中筛选出了能分泌多烯类抗生素的 S. sampsonii GS1322,吴浩瑄等利用大孔吸附树脂对S. sampsonii HP-47抗真菌活性物质进行了吸附工艺的研究[13],李姝江等研究了S. sampsonii 112903产几丁质酶特性[14]。对于S. sampsonii抗菌蛋白分离纯化方面,目前报道较少。本实验室从健康的杨树根际土壤中分离得到了一株对杨树紫纹羽病菌具有较强拮抗作用的S. sampsonii KJ07,以杨树紫纹羽病菌Rhizoctonia violacea为指示菌,对S. sampsonii KJ07的抗菌蛋白进行了分离纯化以及部分理化性质的研究,以期为其在植物病害生防上的应用奠定基础。
1 材料与方法 1.1 材料1.1.1 供试菌株:拮抗菌:S. sampsonii KJ07分离自健康杨树的根际土壤;病原菌:杨树紫纹羽病菌R. violacea、栗疫病菌Cryphonectria parasitica、杂交竹梢枯病菌Arthrinium phaeospermum、山茶灰斑病菌Pestalotiopsis guepini、腐皮镰刀菌Fusarium solani、油橄榄果腐病菌Alternaria sp.、核盘菌Sclerotinia sclerotiorum、尖孢镰刀菌F. oxysporum、桉树焦枯病菌Cylindrocladium scoparium和新壳梭孢菌Neofusicoccum parvum,均保存于四川农业大学林学院森林保护学实验室。
1.1.2 发酵培养基:参考赵娜等所用培养基[15]。
1.1.3 主要试剂和仪器:柱层析填充材料为DEAE Sepharose Fast Flow、Sephadex G-50,美国Pharmacia公司;标准蛋白,TaKaRa公司;PEG20000,成都市科隆化学品有限公司。蛋白分离纯化所使用仪器为Biologic LP低压层析系统、Mini-protean Tetra Cell电泳装置,美国Bio-Rad公司;5415D型高速冷冻离心机,德国Eppendorf公司。
1.2 活性粗蛋白的制备将S. sampsonii KJ07菌株接种于小米液体培养基中,25 ℃、140 r/min振荡培养3 d,10 000 r/min离心20 min,取上清液用孔径为0.22 μm的微孔滤膜过滤除菌。采用硫酸铵分级沉淀法[16]获取粗蛋白:取6份100 mL无菌发酵滤液,均以发酵原液为初始浓度,在0 ℃条件下加入硫酸铵分别至饱和度0、20%、40%、50%、60%和80%,4 ℃条件下静置2 h;10 000 r/min离心20 min,分别收集上清液,在上清液中继续加入固体硫酸铵至下一个相邻的更高饱和度,最高加至饱和度100%,4 ℃条件下静置过夜;10 000 r/min离心20 min,分别收集上清液和沉淀,沉淀溶于1/25发酵液 体积的20 mmol/L pH 7.2的PBS中,4 ℃下用8-14 kD的透析袋透析脱盐。采用琼脂平板扩散法测定各沉淀溶解液和上清的抑菌活性,以确定最佳硫酸铵饱和度,即得到粗蛋白。
1.3 抗菌蛋白的纯化1.3.1 DEAE Sepharose Fast Flow弱阴离子交换层析:DEAE Sepharose Fast Flow层析柱(20 cm× 1.5 cm)用1 mol/L的NaCl溶液浸泡30 min后,倒掉NaCl溶液,用蒸馏水洗3-4次,加入0.02 mol/L的PBS缓冲液充分平衡。取2 mL粗蛋白上样后,先用0.02 mmol/L pH 7.2的PBS缓冲液洗脱平衡至基线,再用0.02 mmol/L pH 7.2的PBS和1 mol/L的NaCl进行阶式梯度洗脱,流速为2 mL/min。收集各洗脱蛋白峰,经20 mmol/L pH 7.2的PBS透 析、PEG20000包埋浓缩,各浓缩蛋白峰液均调整至 2 mL,于0.22 μm细菌过滤器过滤,测定其抑菌活性,确定有效层析峰。
1.3.2 Sephadex G-50凝胶过滤层析:以0.02 mol/L pH 7.2的PBS缓冲液充分平衡层析柱(50 cm× 1.5 cm)。取2 mL经离子交换层析收集的有效活性组分上样,用0.02 mol/L pH 7.2的PBS洗脱,流速为0.5 mL/min。收集各洗脱蛋白峰,经透析浓缩后,测定其抑菌活性,确定有效层析峰。
1.3.3 抗菌蛋白的纯度检测:采用不连续的SDS-PAGE法[17]对有效层析峰进行纯度检测,分离胶浓度为12%,浓缩胶浓度为5%。
1.4 抗菌蛋白浓度测定将所收集的抗菌蛋白溶于一定量的蒸馏水,采用Bradford法[18]测定抗菌蛋白浓度。
1.5 蛋白抑菌谱测定及对杨树紫纹羽病菌的抑制作用采用涂布平板法,将0.5 mL上述浓度的无菌抗菌蛋白液涂布于PDA平板上,并分别接种各病菌菌丝块(d=5 mm)至PDA平板中央,培养3-5 d后,观察抑菌效果,以无菌水作为对照。并在3 d后镜检(400×)杨树紫纹羽病菌菌丝生长情况。
1.6 抗菌蛋白部分理化性质测定1.6.1 分子量测定:采用不连续SDS-PAGE法[17]。分离胶浓度为12%,浓缩胶浓度为5%。当样品在浓缩胶中时,电压设置为80 V,当样品进入分离胶电压升为100 V,以考马斯亮蓝R250染色。绘制标准蛋白分子量对数与相对迁移率标准曲线,计算出该抗菌蛋白的分子量。
1.6.2 稳定性测定:参照纪兆林等[19]的方法,用40、60、80、100 ℃水浴和103.4 kPa条件下处理抗菌蛋白液20 min,室温处理为对照;将抗菌蛋白液的pH调至2.0-12.0,不调pH为对照;将2 g/L蛋白酶K与等量抗菌蛋白液混合37 ℃水浴60 min,无菌水混合处理为对照;将不同的20 mmol/L金属离子盐溶液(Ca2+、Mg2+、Na+、Cu2+、Fe3+、K+、Li+、Zn2+)与等量抗菌蛋白液混合,无菌水混合处理为对照。以上各处理和对照分别采用琼脂平板扩散法测定其抑菌活性。
1.7 N端测定及对蛋白质序列库的类似性检索
将分离纯化的抗菌蛋白液经冷冻干燥后送往北京亿谱生物科技有限公司进行测序。采用蛋白测序仪PPSQ-31A (Shimadzu Corporation,日本)协助测定。采用NCBI BLAST程序,以测得的抗菌蛋白的N-末端氨基酸序列为靶序列,通过http://blast.ncbi.nlm.nih.gov网站进行蛋白质序列类似性检索。
2 结果与分析 2.1 不同饱和度硫酸铵的盐析效果S. sampsonii KJ07的发酵液进行分级盐析后,对所得的蛋白和上清液分别进行抑菌活性测定显示(表 1),不同饱和度硫酸铵盐析后抑菌效果差异较显著。硫酸铵饱和度为40%-50%时沉淀的抑菌效果最大,硫酸铵饱和度为100%时,上清液无抑菌活性,说明发酵液中起抗菌作用的活性物质属于蛋白类。为达到最佳盐析效果,选用硫酸铵饱和度为40%-50%。
| 硫酸铵饱和度 Ammonium sulfate saturation (%) | 抑菌直径 Inhibition diameters (mm) | |
| 沉淀 Precipitation | 上清液 Supernatant | |
| 0-20 | 6.3±1.2C | 21.3±1.5a |
| 20-40 | 11.7±1.5B | 19.0±1.0b |
| 40-50 | 28.3±0.6A | 17.7±1.2b |
| 50-60 | 27.3±0.6A | 8.7±1.5c |
| 60-80 | 9.7±1.2B | 2.3±0.6d |
| 80-100 | 3.3±1.5D | 0e |
| 注:不同大写字母表示在p<0.01水平上差异极显著,不同小写字母表示在p<0.05水平上差异显著(LSD检验). | ||
| Note: Different capital letters mean highly significant differences (p<0.01),and different lowercases mean significant differences (p<0.05) (LSD test). | ||
2.2.1 DEAE Sepharose Fast Flow弱阴离子交换层析结果:将40%-50%饱和度的硫酸铵沉淀和透析后得到的粗蛋白经DEAE Sepharose Fast Flow弱阴离子交换层析后,出现8个蛋白洗脱峰(图 1),其中峰6、7具有抑菌活性,以峰7的抑菌活性最大(图 2) 。经SDS-PAGE电泳检测后显示为混合蛋白组分,需做进一步纯化。

|
| 图 1 粗蛋白经DEAE Sepharose Fast Flow弱阴离子交换层析结果 Figure 1 Elution profile of the crude protein by DEAE Sepharose Fast Flow |
|
|

|
| 图 2 洗脱峰6和洗脱峰7的抑菌效果 Figure 2 Inhibitory effect of elution peak 6 and elution peak 7 |
|
|
2.2.2 Sephadex G-50凝胶过滤层析结果:蛋白洗脱峰7经Sephadex G-50凝胶过滤层析,出现2个洗脱峰(图 3),经抑菌活性测定,只有峰7-1含有抗菌活性蛋白(图 4)。经SDS-PAGE电泳检测,抗菌蛋白得到了有效的分离。因此,收集并合并峰7-1的蛋白洗脱液,经蒸馏水透析、冷冻干燥后进行低温保存备用。
|
| 图 3 峰7经Sephadex G-50凝胶过滤层析结果 Figure 3 Elution profile of peak 7 by Sephadex G-50 |
|
|

|
| 图 4 洗脱峰峰7-1抑菌效果 Figure 4 Inhibitory effect of elution peak 7-1 |
|
|
经Bradford法测定,抗菌蛋白浓度为49 mg/L。
2.4 抗菌蛋白抑菌谱测定及对杨树紫纹羽病菌菌丝的影响2.4.1 抗菌蛋白抑菌谱测定:对S. sampsonii KJ07抗菌蛋白的抑菌谱测定(表 2),发现抗菌蛋白对担子菌亚门的杨树紫纹羽病菌R. violacea,子囊菌亚门的栗疫病菌Cryphonectria parasitica、核盘菌Sclerotinia sclerotiorum、新壳梭孢菌Neofusicoccum parvum,半知菌亚门的杂交竹梢枯病菌Arthrinium phaeospermum、山茶灰斑病菌Pestalotiopsis guepini、腐皮镰刀菌Fusarium solani、油橄榄果腐病菌Alternaria sp.、尖刀镰刀菌Fusarium oxysporum和桉树焦枯病菌Cylindrocladium scoparium均有明显清晰但程度不一的抑菌圈,由此证明S. sampsonii KJ07抗菌蛋白的抑菌谱较广。
| 病原真菌 Pathogenic fungi | 抑菌直径 Inhibition diameters (mm) |
| Cryphonectria parasitica | 21.7±0.6 |
| Rhizoctonia violacea | 40.3±1.5 |
| Pestalotiopsis guepini | 48.0±1.0 |
| Fusarium solani | 3.7±0.6 |
| Alternaria sp. | 16.3±1.5 |
| Sclerotinia sclerotiorum | 56.7±1.2 |
| Fusarium oxysporum | 13.3±0.6 |
| Arthrinium phaeospermum | 29.3±0.6 |
| Cylindrocladium scoparium | 7.7±0.6 |
| Neofusicoccum parvum | 58.3±1.5 |
2.4.2 抗菌蛋白对杨树紫纹羽病菌菌丝的影响:经抗菌蛋白处理的杨树紫纹羽病菌菌丝畸形,菌丝隔膜不明显,细胞壁及胞内原生质开始降解,产生黑色物质(图 5B),而对照组菌丝光滑透明,生长正常(图 5A)。

|
| 图 5 抗菌蛋白对杨树紫纹羽病菌菌丝的作用(400×) Figure 5 Effect of the antifungal protein on mycelium growth of R. violacea (400×) 注:A:正常生长的菌丝;B:抗菌蛋白处理过的菌丝. Note: A: Mycelium of R. violacea treated with sterile water; B: Mycelium of R. violacea treated with the antifungal protein. |
|
|
2.5.1 抗菌蛋白分子量的测定:经Sephadex G-50凝胶层析后的抗菌蛋白(峰7-1)通过SDS-PAGE电泳和考马斯亮蓝染色后,只显示出一条条带(图 6),表明其纯度已达到理化性质分析的要求。根据标准蛋白分子量对数与相对迁移率标准曲线(y=-1.056x+2.201,R2=0.982,x为分子量对数,y为相对迁移率),计算出该抗菌蛋白的表观分子 量为28.4 kD。

|
| 图 6 抗菌蛋白SDS-PAGE图谱 Figure 6 SDS-PAGE Spectrum of the antifungal protein 注:M:标准蛋白;P:抗菌蛋白. Note: M: Marker; P: The antifungal protein. |
|
|
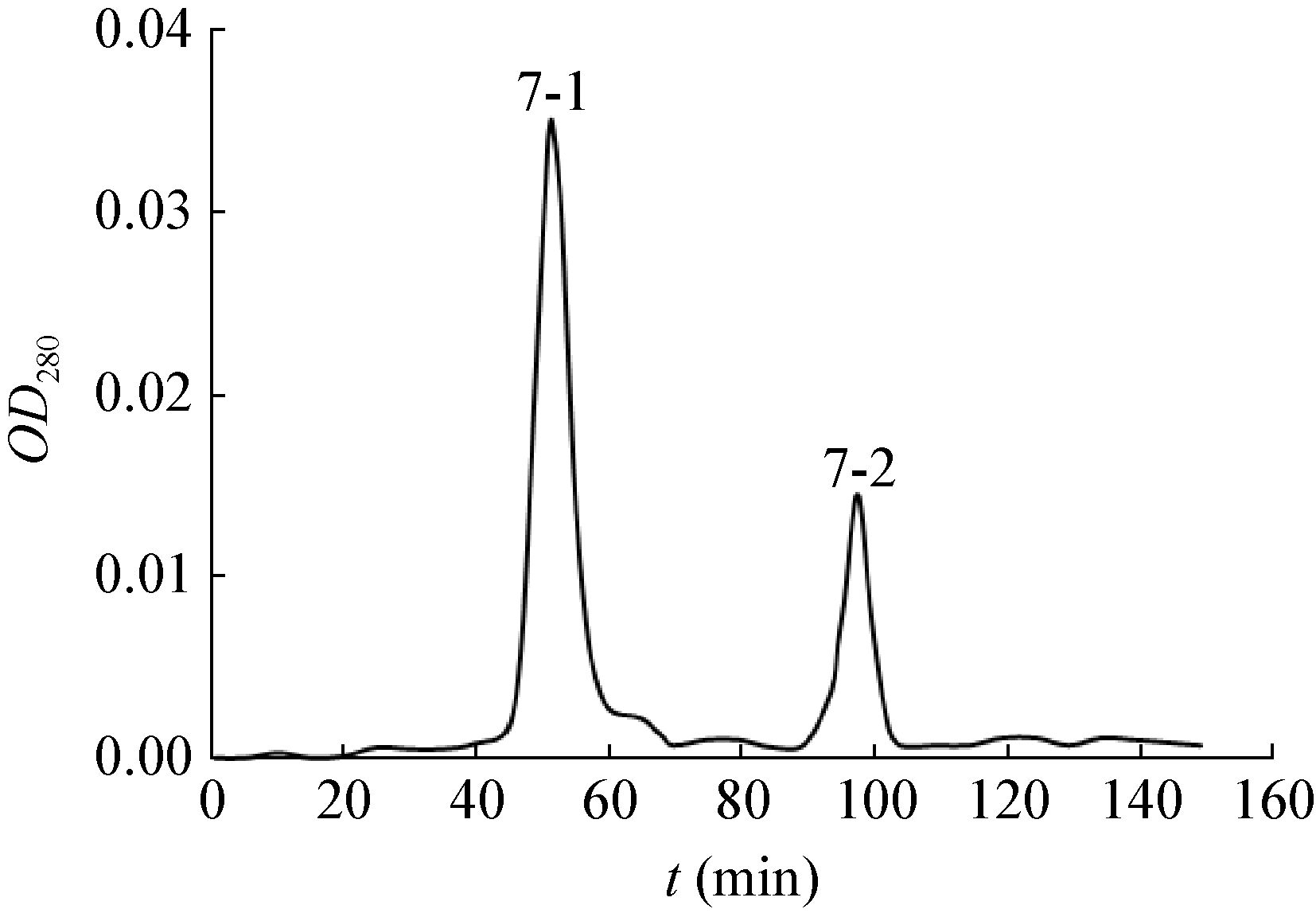
2.5.2 抗菌蛋白稳定性测定:以未经处理抗菌蛋白的抑菌活性为100%,抗菌蛋白的抑菌活性随处理温度的升高而呈现下降的趋势(图 7A),仅处理温度为40 ℃条件时,其抑菌活性与对照差异不显著。当处理温度高于40 ℃时,抑菌活性显著下降。抗菌蛋白经60、80、100 ℃水浴处理后,抑菌活性分别为对照的79.7%、65.8%、58.2%,经103.4 kPa处理20 min,其抑菌活性下降显著,仅为对照的39.2%,由此说明该抗菌蛋白对高温较敏感。
|
| 图 7 不同温度(A)和pH (B)对抗菌蛋白活性的影响 Figure 7 Effect of different temperature (A) and pH (B) on antifungal activity of the antifungal protein 注:不同小写字母表示在p<0.05水平上差异显著(LSD检验). Note: Different lowercases mean significant differences (p<0.05) (LSD test). |
|
|
在pH 2.0-12.0范围内,抗菌蛋白均存在抑菌活性(图 7B)。当pH=6.0时,抑菌活性最强,抑菌直径达25.7 mm。pH<4.0或pH≥8.0时,其抑菌活性下降超过12%,下降显著。说明该抗菌蛋白在弱酸条件下较稳定,抑菌活性较强。
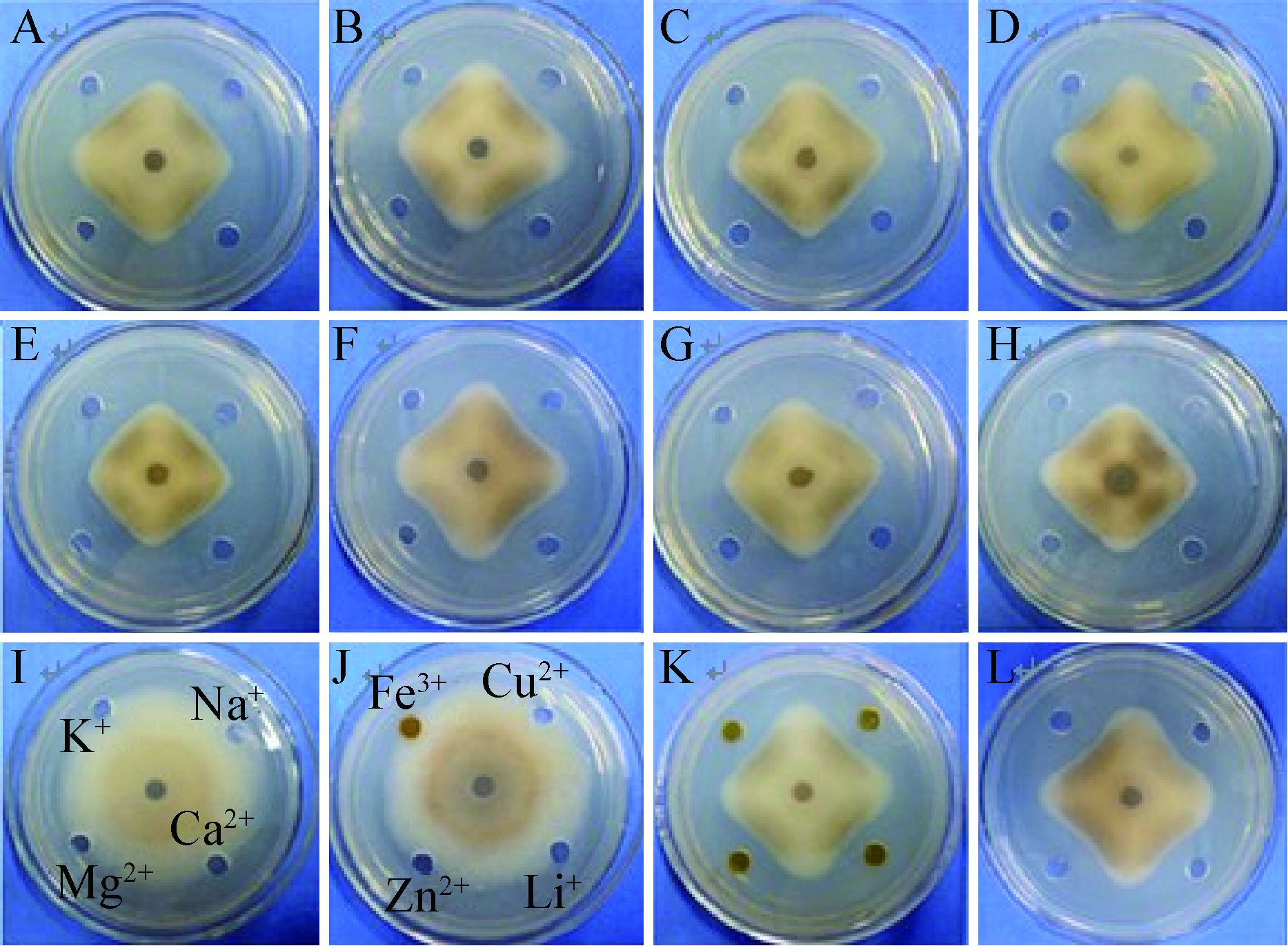
抗菌蛋白经蛋白酶K处理后,抑菌活性为对照的92.4%,表明该抗菌蛋白对蛋白酶K不敏感(图 8B)。抗菌蛋白经不同的金属离子盐溶液(Ca2+、Mg2+、Na+、Cu2+、Fe3+、K+、Li+、Zn2+)处理后,其抑菌活性差异不明显(图 8)。其中Na+、K+、Ca2+、Mg2+、Li+可增强抗菌蛋白抑菌活性,而Cu2+、Fe3+、Zn2+对抑菌活性起到抑制作用。表明该抗菌蛋白受金属阳离子影响。
|
| 图 8 蛋白酶K和金属阳离子对抗菌蛋白活性的影响 Figure 8 Effect of proteinase K and metal cations on antifungal activity of the protein 注:A:抗菌蛋白;B:经1 g/L蛋白酶K处理的抗菌蛋白;C-H、K、L:分别经10 mmol/L Na+、Li+、Mg2+、Cu2+、K+、Ca2+、Fe3+、Zn2+处理的抗菌蛋白;I、J:10 mmol/L的金属阳离子(对照). Note: A: the antifungal protein; B: the antifungal protein treated with 1 g/L proteinase K; C-H,K,L: the antifungal protein treated with 10 mmol/L Na+、Li+、Mg2+、Cu2+、K+、Ca2+、Fe3+、Zn2+; I,J: 10 mmol/L metal cations without the antifungal protein as control. |
|
|
经自动Edman降解法检测,该抗菌蛋白N末端10个氨基酸序列为:NH2-Ala-Thr-Tyr-Glu-Asp- Phe-Pro-Thr-Leu-Gly。以N末端的10个氨基酸序列片段为靶序列,采用NCBI BLAST程序在蛋白质数据库进行类似性检索,显示其与来源于Bacteroides faecichinchillae的假定蛋白(Hypothetical protein) (登录号:WP 025075110.1) 具有100%的相似性,但并未检索到已知的与其相似性较高的抗菌蛋白,以此说明该抗菌蛋白可能是一种新蛋白。
3 讨论菌体发酵液中含复杂多样的次生代谢物质,要将其中的抗真菌蛋白分离纯化出来,首先应对发酵液进行粗提取。目前,粗提取一般采用硫酸铵盐析法和有机溶剂沉淀法[20-21],前者成本低,蛋白不易变性,后者容易引起蛋白变性。因此本实验选择硫酸铵盐析法,对不同饱和度硫酸铵沉淀所得的上清液和沉淀进行抑菌活性测定,发现当硫酸铵饱和度为100%时,上清液无抑菌活性,而沉淀部分具抑菌活性,由此证明S. sampsonii KJ07发酵液中起主要抗菌作用的物质属于蛋白类,为下一步分离纯化奠定基础。
通过对S. sampsonii KJ07发酵液进行硫酸铵盐析分级沉淀,获得抗真菌粗蛋白,经DEAE Sepharose Fast Flow弱阴离子交换层析、Sephadex G-50凝胶过滤层析,收集不同组分,并对各组分进行抑菌活性检测,再经SDS-PAGE电泳检测,分离得到一个分子量约为28.4 kD的抗真菌蛋白。本实验研究表明S. sampsonii KJ07抗真菌蛋白抑菌谱较广,并使杨树紫纹羽病菌菌丝畸形,菌丝隔膜不明显,细胞壁及胞内原生质开始降解,并产生黑色物质,与前人所研究的抗真菌蛋白,如几丁质酶、葡聚糖酶的水解作用机理相似[22-24]。此外,对该抗真菌蛋白稳定性研究表明,在温度≤60 ℃时,其酶活性较稳定,最适pH偏酸性,对蛋白酶K不敏感,金属阳离子Na+、K+、Ca2+、Mg2+、Li+对该抗菌蛋白抑菌活性具有激活作用,而Cu2+、Fe3+、Zn2+对其抑菌活性具有抑制作用,与已报道的抗真菌蛋白如几丁质酶存在诸多共同性质[25-27]。通过N末端测序对蛋白质数据库进行类似性检索,检索结果显示其与来源于Bacteroides faecichinchillae的假定蛋白(Hypothetical protein)具有100%的相似性,但并未检索到与其相似性较高的已知抗菌蛋白。综上,推测S. sampsonii KJ07抗真菌蛋白可能是一种新的蛋白质。由此看来,为明确该抗真菌蛋白的具体类型,还需对其生物合成相关基因做出进一步研究。
| [1] | Wang BJ, Su RR, Zhu GP. The progress of esterase from Streptomyces[J]. Journal of Anhui Normal University (Natural Science) , 2011, 34 (2) : 165–170. (in chinese) 王宝娟, 苏蕊蕊, 朱国萍. 链霉菌酯酶研究进展[J]. 安徽师范大学学报: 自然科学版 , 2011, 34 (2) : 165–170. |
| [2] | Kamensky M, Ovadis M, Chet I, et al. Soil-borne strain IC14 of Serratia plymuthica with multiple mechanisms of antifungal activity provides biocontrol of Botrytis cinerea and Sclerotinia sclerotiorum diseases[J]. Soil Biology and Biochemistry , 2003, 35 (2) : 323–331. DOI:10.1016/S0038-0717(02)00283-3 |
| [3] | Gao F, Wu YH, Wei YY, et al. The effect on fungal diseases of antagonistic Streptomyces sp. 182-2 and primary identification of the antibiotic substance[J]. Chinese Journal of Biological Control , 2008, 24 (2) : 148–153. (in chinese) 高芬, 吴元华, 魏颖颖, 等. 拮抗链霉菌182-2的抑菌防病作用及抗菌物质的初步鉴别[J]. 中国生物防治 , 2008, 24 (2) : 148–153. |
| [4] | Yang SQ, Zhang SP, Yan QJ, et al. Screening of high chitinase-production strain,Streptomyces thermoviolaceus and optimization of fermentation condition[J]. Journal of China Agricultural University , 2013, 18 (2) : 167–173. (in chinese) 杨绍青, 张舒平, 闫巧娟, 等. 高产几丁质酶高温紫链霉菌的筛选和发酵条件优化[J]. 中国农业大学学报 , 2013, 18 (2) : 167–173. |
| [5] | Li JJ, Liu WC, Luo LJ, et al. Expression of Paenibacillus polymyxa β-1,3-1,4-glucanase in Streptomyces lydicus A01 improves its biocontrol effect against Botrytis cinerea[J]. Biological Control , 2015, 90 : 141–147. DOI:10.1016/j.biocontrol.2015.06.008 |
| [6] | Chakraborty S, Khopade A, Kokare C, et al. Isolation and characterization of novel α-amylase from marine Streptomyces sp. D1[J]. Journal of Molecular Catalysis B: Enzymatic , 2009, 58 (1/4) : 17–23. |
| [7] | Wei SJ, Du YN, Li KT, et al. Effect of metabolin from Streptomyces padanus JAU4234 against Rhizoctonia solani[J]. Acta Phytophylacica Sinica , 2012, 39 (5) : 411–417. (in chinese) 魏赛金, 杜亚楠, 李昆太, 等. 稠李链霉菌JAU4234代谢产物对水稻纹枯病菌的作用机制[J]. 植物保护学报 , 2012, 39 (5) : 411–417. |
| [8] | Mander P, Choi Y H, Pradeep G C, et al. Biochemical characterization of xylanase produced from Streptomyces sp. CS624 using an agro residue substrate[J]. Process Biochemistry , 2014, 49 (3) : 451–456. DOI:10.1016/j.procbio.2013.12.011 |
| [9] | Gao XN, Gulpiye, Wang MY, et al. Screening of plant endophytic actinomycetes producing chitinase and its antagonistic activity against Sclerotinia sclerotiorum[J]. Journal of Zhejiang University (Agriculture & Life Sciences) , 2010, 36 (6) : 615–622. (in chinese) 高小宁, 古丽皮艳, 王美英, 等. 产几丁质酶内生放线菌的筛选及其对核盘菌的抑制作用[J]. 浙江大学学报: 农业与生命科学版 , 2010, 36 (6) : 615–622. |
| [10] | Liu Y, Liu JH, Liu WC, et al. The inducing effect of Streptomyces lydicus A02 on tomato resistance to Botrytis cinerea——impact on pathogenesis-related proteins and total phenolics of tomato seedlings[J]. Journal of Agricultural University of Hebei , 2007, 30 (2) : 27–30. (in chinese) 刘宇, 刘建华, 刘伟成, 等. 利迪链霉菌A02诱导番茄抗灰霉病作用机理研究——对植株两种PR蛋白和总酚的影响[J]. 河北农业大学学报 , 2007, 30 (2) : 27–30. |
| [11] | Zhang LN, Zhu TH, Li FL. Identification of Streptomyces purpeofuscus YSSPG3 and purification of its antifungal protein[J]. Acta Phytopathologica Sinica , 2012, 42 (3) : 242–251. (in chinese) 张丽娜, 朱天辉, 李芳莲. 绛红褐链霉菌YSSPG3的鉴定及其抗菌蛋白纯化[J]. 植物病理学报 , 2012, 42 (3) : 242–251. |
| [12] | Jain PK, Jain PC. Isolation,characterization and antifungal activity of Streptomyces sampsonii GS 1322[J]. Indian Journal of Experimental Biology , 2007, 45 (2) : 203–206. |
| [13] | Wu HX, Ren DM, Chen HM, et al. Adsorption technology of Streptomyces sampsonii HP-47 antifungal substances using macroporous resin[J]. Jiangsu Agricultural Sciences , 2011, 39 (4) : 117–120. (in chinese) 吴浩瑄, 任大明, 陈红漫, 等. 大孔吸附树脂对桑氏链霉菌HP-47抗真菌活性物质的吸附工艺[J]. 江苏农业科学 , 2011, 39 (4) : 117–120. |
| [14] | Li SJ, Zhu TH, Peng Y, et al. Characteristics of chitinase-produced by Streptomycete sampsonii with antimicrobial activity and its biocontrol to Rhizoctonia violacea[J]. Journal of Northeast Forestry University , 2014, 42 (3) : 116–121. (in chinese) 李姝江, 朱天辉, 彭艳, 等. 桑氏链霉菌产几丁质酶特性及对杨树紫纹病的生防作用[J]. 东北林业大学学报 , 2014, 42 (3) : 116–121. |
| [15] | Zhao N, Wang HL, Wei SP, et al. Antibacterial activity and active ingredients of Streptomyces albus C-411[J]. Acta Phytophylacica Sinica , 2013, 40 (1) : 73–77. (in chinese) 赵娜, 王海丽, 魏少鹏, 等. 放线菌C-411发酵液抑菌活性及活性成分[J]. 植物保护学报 , 2013, 40 (1) : 73–77. |
| [16] | Cao YC, Li ZJ, Wu ZH, et al. Purification and characterization of extracellular protease of Bacillus licheniformis[J]. Acta Hydrobiologica Sinica , 2006, 30 (3) : 262–268. (in chinese) 曹煜成, 李卓佳, 吴灶和, 等. 地衣芽孢杆菌胞外蛋白酶的纯化及特性分析[J]. 水生生物学报 , 2006, 30 (3) : 262–268. |
| [17] | Zhai CY. Biomolecular Experimental Materials[M]. Chengdu: Sichuan University Press, 2004: 115 -121. (in chinese) 翟朝阳. 生物分子实验教材[M]. 成都: 四川大学出版社, 2004: 115 -121. |
| [18] | Fei Z. The Biochemistry and Molecular Biology Experiment Guidance[M]. Shanghai: Fudan University Press, 2012: 60 -61. (in chinese) 费正. 生物化学与分子生物学实验指导[M]. 上海: 复旦大学出版社, 2012: 60 -61. |
| [19] | Ji ZL, Tang LJ, Zhang QX, et al. Isolation,purification and characterization of antifungal protein from Bacillus licheniformis W10 strain[J]. Acta Phytopathologica Sinica , 2007, 37 (3) : 260–264. (in chinese) 纪兆林, 唐丽娟, 张清霞, 等. 地衣芽孢杆菌W10抗菌蛋白的分离纯化及其理化性质研究[J]. 植物病理学报 , 2007, 37 (3) : 260–264. |
| [20] | Zhou LJ. Studies on antifungal substances produced from marine Streptomyces sp. GB-2[D]. Nanjing: Master’s Thesis of Nanjing Agricultural University,2009 (in Chinese) 周利娟. 海洋链霉菌GB-2产抗真菌物质的研究[D]. 南京: 南京农业大学硕士学位论文,2009 |
| [21] | Zhang BB, Xie CJ, Wei YM, et al. Purification and characterization of an antifungal protein,MCha-Pr,from the intercellular fluid of bitter gourd (Momordica charantia)leaves[J]. Protein Expression and Purification , 2015, 107 : 43–49. DOI:10.1016/j.pep.2014.09.008 |
| [22] | Li DC, Chen S, Lu J. Purification and partial characterization of two chitinases from the mycoparasitic fungus Talaromyces flavus[J]. Mycopathologia , 2005, 159 (2) : 223–229. DOI:10.1007/s11046-004-9096-8 |
| [23] | Zhang QX, Yang RH, Xu JY, et al. Identification of Gliocladium sp. GR-6 and purification and characterization of the β-1,3-glucanase produced by GR-6[J]. Jiangsu Academy of Agricultural Sciences , 2013, 29 (4) : 755–759. (in chinese) 张清霞, 杨荣华, 徐敬友, 等. 粘帚霉GR-6菌株种类鉴定及其β-1,3-葡聚糖酶纯化与酶学性质[J]. 江苏农业学报 , 2013, 29 (4) : 755–759. |
| [24] | Arlorio M, Ludwig A, Boller T, et al. Inhibition of fungal growth by plant chitinases and β-1,3-glucanases[J]. Protoplasma , 1992, 171 (1/2) : 34–43. |
| [25] | Huang XH, Xu L, Chen QX, et al. Effects of metal irons on the chitinase activity from Bacillus thuringenesis[J]. Journal of Agricultural Biotechnology , 2005, 13 (2) : 264–265. (in chinese) 黄小红, 许雷, 陈清西, 等. 金属离子对苏云金芽孢杆菌几丁质酶活力的影响[J]. 农业生物技术学报 , 2005, 13 (2) : 264–265. |
| [26] | Liu Y, Tao J, Yan YJ, et al. Biocontrol efficiency ofBacillus subtilis SL-13 and characterization of an antifungal chitinase[J]. Chinese Journal of Chemical Engineering , 2011, 19 (1) : 128–134. DOI:10.1016/S1004-9541(09)60188-9 |
| [27] | Li L, Yang XS, Liu HQ. Research progress about characteristic and application of chitinase produced by microorganism[J]. Journal of Guangxi University for Nationalities (Natural Science Edition) , 2011, 17 (1) : 92–96. (in chinese) 李丽, 杨雪松, 刘红全. 微生物几丁质酶的特性及其应用的研究进展[J]. 广西民族大学学报: 自然科学版 , 2011, 17 (1) : 92–96. |
 2016, Vol. 43
2016, Vol. 43