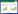扩展功能
文章信息
- 何时义, 丁峰山, 王爱妍, 付鑫, 杨东君, 凌敏
- HE Shi-Yi, DINH Phong-Son, WANG Ai-Yan, FU Xin, YANG Dong-Jun, LING Min
- 鸟分枝杆菌PhoP功能分析及其基因突变株的构建
- Characterization of PhoP of Mycobacterium avium and construction of its mutant harboring defective PhoP gene
- 微生物学通报, 2016, 43(9): 1966-1972
- Microbiology China, 2016, 43(9): 1966-1972
- DOI: 10.13344/j.microbiol.china.160246
-
文章历史
- 收稿日期: 2016-03-25
- 接受日期: 2016-06-07
- 优先数字出版日期(www.cnki.net): 2016-06-21
临床数据表明,近年来HIV阳性患者合并分枝杆菌感染中非结核分枝杆菌(NTM)所占比例不断增大,其中鸟分枝杆菌(Mycobacterium avium,MA)感染比例可高达95%以上[1-4]。鸟分枝杆菌感染的临床症状与肺结核相似,影像学表现也无明显差异,但其治疗方法却与结核病不同[5-6]。因此加强对分枝杆菌的鉴定及其致病机理的研究,对指导临床治疗具有重要意义。
鸟分枝杆菌是细胞内寄生菌,其致病性与其在宿主巨噬细胞内的存活能力有关,而细菌在巨噬细胞中的生存能力主要受二元调控系统的调节。PhoPR二元调控系统是结核分枝杆菌等致病菌最基本、最重要的二元调控系统,在调控细菌的胞内寄生和毒力方面起着重要作用[7, 8-9]。当前二元调控系统的研究热点主要集中在PhoP调节蛋白上,已有不少文献报道了PhoP在结核分枝杆菌中的一系列调节功能,但其在鸟分枝杆菌中的调节作用尚不够明确。随着鸟分枝杆菌全基因组测序的完成,从整体和分子水平上认识PhoP在鸟分枝杆菌中的调节功能将成为可能。本文选取鸟分枝杆菌中4个基因(PhoP及其下游的MAV0127、PhoU、Amt)进行凝胶迁移率移动试验,分析这些基因的启动子与PhoP DNA结合区的相互作用,对鸟分枝杆菌PhoP调控转录的机制做了研究。此外,本研究还通过基因敲除技术,构建了PhoP基因缺失突变株,为进一步深入研究PhoP的功能提供基础。
1 材料与方法 1.1 材料1.1.1 菌株和质粒:鸟分枝杆菌HIV/AIDS临床分离株由广西疾控中心结核病研究所提供。自杀质粒pGMB151、Escherichia coli SPY372λpir、E. coli BL21(DE3)、表达载体pGEX-4T-3均为本课题组保存。
1.1.2 培养基:大肠杆菌培养基为LB培养基[10],37 ℃培养。鸟分枝杆菌培养基为Middle brook 7H9/OADC培养基(液体)和Middle brook 7H10/OADC培养基(固体)[11],购于美国BD公司,37 ℃培养。
1.1.3 主要试剂和仪器:质粒提取试剂盒,天根生化科技(北京)有限公司;DNA胶回收试剂盒,北京全式金公司;各种内切酶、T4 DNA连接酶、Taq DNA聚合酶,宝生物工程(大连)有限公司;Pierce Glutathione Agarose,Thermo Scientific公司。Tpersonal PCR仪,德国Biometra公司;凝胶成像系统UVI-7600Z,英国UVItec公司;电转化仪,美国Bio-Rad公司。
1.1.4 引物:用于扩增PhoP DNA结合区(PhoPC)编码序列的引物为PhoPC-F和PhoPC-R,用于扩增PhoP、MAV0127、PhoU及Amt启动子片段的引物分别为PhoP-F/R、MAV0127-F/R、PhoU-F/R和Amt-F/R,用于构建PhoP突变株的引物包括PhoP-N-F/R和PhoP-C-F/R (图 1),引物的合成委托上海生工生物工程有限公司。各引物的序列见表 1。
|
| 图 1 鸟分枝杆菌PhoP基因缺失用的引物设计 Figure 1 Design of primers for constructed a Mycobacterium avium strain with defective PhoP gene 注:1-720为PhoP基因编码区,PhoP-N-F/R和PhoP-C-F/R为PhoP基因上、下游引物,PCR扩增后将上、下游片段连接成为PhoP基因缺失性同源核苷酸片段,缺失区域为该基因的408-718 bp区域,共309 bp. Note: The sequences 1 to 720 bp were the coding region of the PhoP gene. PhoP-N-F/R and PhoP-C-F/R were two pair primers of upper-stream and down-stream of the PhoP gene which could prepare homologous recombinant DNA fragment of the defective target gene. The deletion region of the PhoP gene was from 408 to 718 bp,309 bp was deleted in total. |
|
|
| 引物 Primers | 序列 Sequences (5′→3′) | 用途 Usage |
| PhoPC-F | CGCGGATCCGCCGAACCACGCAGCGCCCGA (BamH I) | PhoPC蛋白表达 |
| PhoPC-R | CCGCTCGAGGCGCGGTTCCCGCAGCACA (Xho I) | PhoPC蛋白表达 |
| PhoP-F | CGCTGGCCACGCTCAGACCC | 凝胶迁移率移动试验 |
| PhoP-R | GTGGGGGTGGCCGATGTCAT | 凝胶迁移率移动试验 |
| MAV0127-F | AGCTCTCGCGCACGAAATGC | 凝胶迁移率移动试验 |
| MAV0127-R | TTCCAGGCCACCGGGGGTTA | 凝胶迁移率移动试验 |
| PhoU-F | GAAGATCTTCTCCAACCCCA | 凝胶迁移率移动试验 |
| PhoU-R | ACGAAACCCGCCTCGCAGTA | 凝胶迁移率移动试验 |
| Amt-F | CGGGCCAGGGCCCGTCGGGG | 凝胶迁移率移动试验 |
| Amt-R | GGCCGGATCGATTCCGTGCA | 凝胶迁移率移动试验 |
| PhoP-N-F | GGCGGATCCATGACATCGGCCACCCCCACTGACG (BamH I) | 构建PhoP基因突变株 |
| PhoP-N-R | CCGGAATTCGGCCCCGCCCTTGCCGGCGCGCCGC (EcoR I) | 构建PhoP基因突变株 |
| PhoP-C-F | GCCGAATTCTGAGCGCGCGCTCGGCCACCGGCGG (EcoR I) | 构建PhoP基因突变株 |
| PhoP-C-R | CCGGGATCCTGTTCGACTTCGACCAGCGGCCGCA (BamH I) | 构建PhoP基因突变株 |
以鸟分枝杆菌临床分离株基因组DNA为模板,利用引物PhoPC-F和PhoPC-R进行PCR扩增。PCR反应体系(25 μL):10×PCR Buffer (Mg2+ plus) 2.5 μL,dNTP Mixture 2 μL,Taq DNA聚合酶0.5 μL,正、反向引物(20 μmol/L)各0.5 μL,模板(约300 mg/L) 0.5 μL,用超纯水补至25 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。
PCR产物与pGEX-4T-3质粒经BamH Ⅰ和 Xho Ⅰ双酶切后,用T4 DNA连接酶连接,构建重组表达质粒pGEX-PhoPC,转化入E. coli BL21(DE3)感受态细胞,37 ℃培养至OD600=0.4-0.6,加入终浓度1 mmol/L的IPTG,37 ℃诱导2 h。12 000 r/min离心1 min收集菌体,菌体用PBS重悬后超声破碎。12 000 r/min离心10 min,将上清进行SDS-PAGE检测。利用谷胱甘肽琼脂糖珠进行亲和层析(方法见产品说明书),分离纯化上清中的GST-PhoPC融合蛋白。用BCA法测定GST-PhoPC融合蛋白浓度,根据每mg的蛋白加入10 U的凝血酶,室温作用16 h后,过Glutathione Agarose亲和柱,用适量的PBS洗脱,收集流出液进行SDS-PAGE检测。
1.3 PhoP、MAV0127、PhoU、Amt启动子片段的克隆根据鸟分枝杆菌PhoP、MAV0127、PhoU、Amt 4个基因的启动子序列设计相应的引物(表 1),利用PCR (同1.2)扩增各个基因转录起始点上游270 bp长度的启动子片段。PCR产物经胶回收纯化。
1.4 凝胶迁移率移动试验(EMSA)各取PhoP、MAV0127、PhoU和Amt 4个基因的启动子片段1-2 μg分别与6 μg PhoPC蛋白混合,加入相应体积GSM缓冲液(50 mmol/L Tris-HCl pH 8.0,50 mmol/L KCl,10 mmol/L MgCl2,0.5 mmol/L EDTA,10%甘油),使三者反应总体积为20 μl,30 ℃孵育30 min后进行非变性PAGE凝胶电泳,溴化乙啶染色,用凝胶成像系统对非变性胶进行成像。
1.5 PhoP突变株的构建1.5.1 重组自杀质粒的构建及鉴定:以鸟分枝杆菌临床分离株基因组DNA为模板,利用引物PhoP-N-R/F和PhoP-C-R/F进行PCR,反应体系(25 μL):10×PCR Buffer (Mg2+ plus) 2.5 μL,dNTP Mixture 2 μL,10×GC Enhancer 2 μL,Taq DNA聚合酶0.5 μL,正、反向引物(20 μmol/L)各0.5 μL,模板(约300 mg/L) 0.5 μL,用超纯水补至25 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。扩增出PhoP基因的上、下游核苷酸片段,用EcoRⅠ将两个片段酶切之后进行定向连接,得到PhoP基因缺失性同源核苷酸片段;将该片段与自杀质粒pGMB151用BamH Ⅰ酶切后,在T4 DNA连接酶作用下16 ℃连接过夜,将连接产物转化感受态细胞E. coli SPY372λpir,利用氨苄抗性筛选阳性菌落,提取质粒后用PCR和BamH Ⅰ酶切鉴定,将阳性质粒测序。
1.5.2 PhoP基因缺失突变株的筛选及鉴定:将鸟分枝杆菌培养至对数生长期,用0 ℃灭菌水反复洗涤3遍,制备成电转化用感受态细胞。取1 μg重组自杀质粒与50 μL鸟分枝杆菌感受态细胞混合后加入到预冷的0.1 cm电转化杯中,电击参数:2.5 kV,25 μF,200 Ω。电击之后立即加入1 mL 37 ℃预热的不含抗生素的Middle brook 7H9/OADC液体培养基,37 ℃复苏28 h后将菌液涂布于含氨苄青霉素和链霉素的Middle brook 7H10/OADC培养基,37 ℃培养。将在含氨苄青霉素和链霉素的培养基上筛选到的抗性菌落转到含5%蔗糖的Middle brook 7H10/OADC培养基上,以诱导同源重组,利用PCR来筛选发生同源重组的菌株。将重组变异阳性菌株连续传代培养,选取连续3次传代以上都有稳定的完全重组的菌株作为PhoP基因缺失突变株,并经DNA序列分析验证。
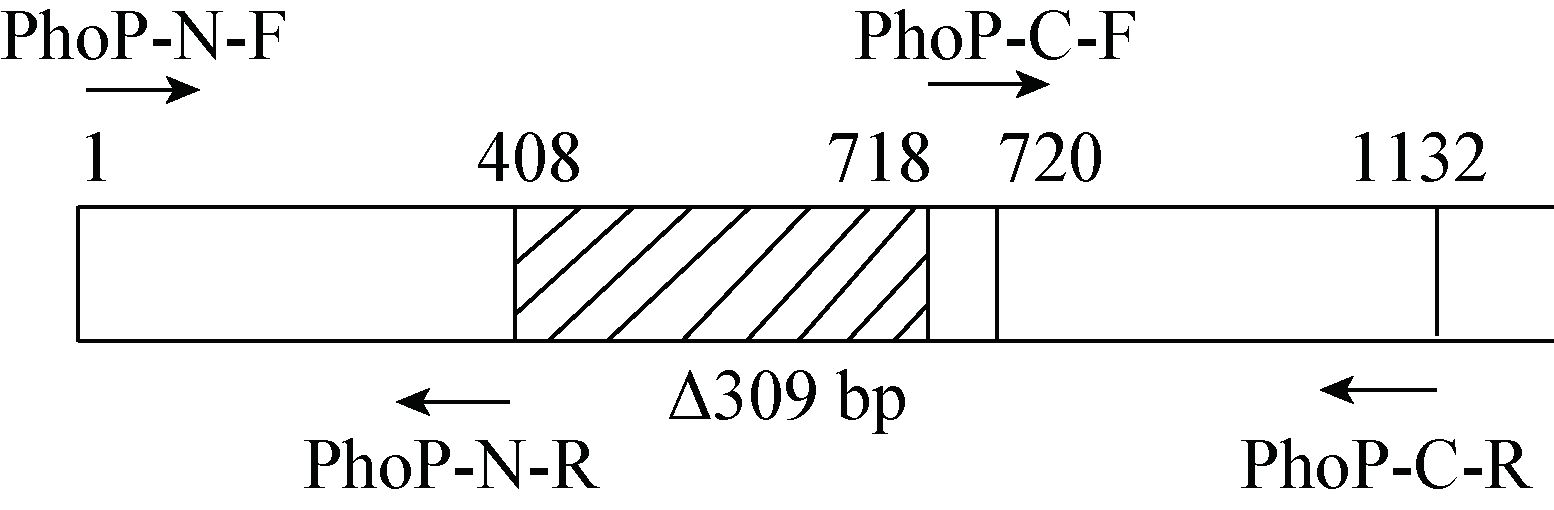
2 结果与分析 2.1 PhoPC编码序列和PhoP、MAV0127、PhoU、Amt启动子片段的PCR扩增利用PCR扩增PhoPC编码序列(312 bp)及PhoP、MAV0127、PhoU、Amt启动子片段(长度均为270 bp),各PCR产物经1%琼脂糖凝胶电泳检测,得到与预期相符的DNA条带(图 2)。
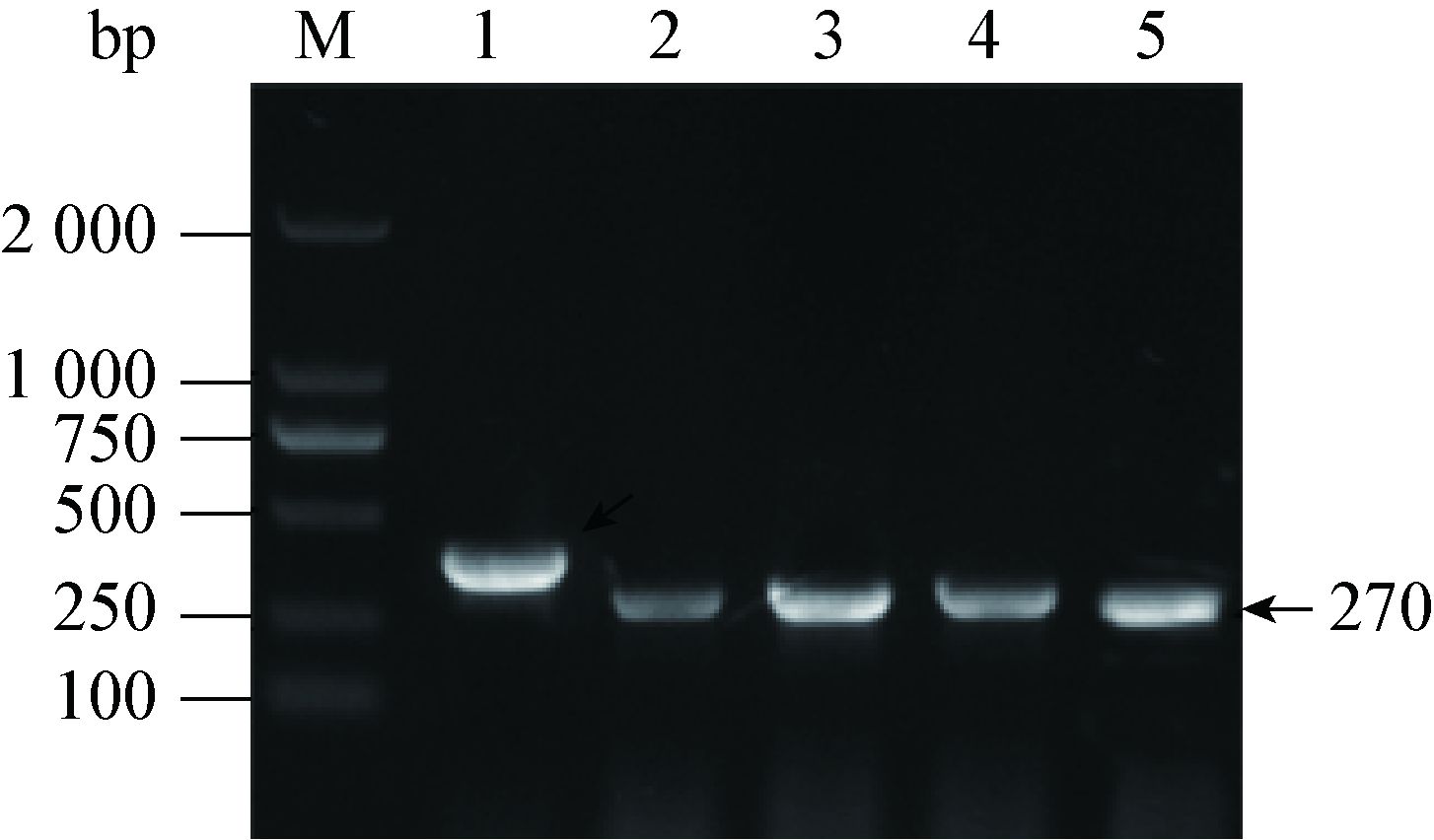
|
| 图 2 PCR扩增结果 Figure 2 Electrophoresis result of PCR amplification 注:M:DNA marker;1:PhoPC编码序列PCR产物;2、3、4、5:PhoP、MAV0127、PhoU和Amt启动子片段. Note: M: DNA marker; 1: DNA fragment of PhoPC; 2,3,4,5 represent of PhoP,MAV0127,PhoU and Amt promotor fragments respectively. |
|
|
将构建的重组表达质粒pGEX-PhoPC转化入E. coli BL21(DE3)感受态细胞,经IPTG诱导表达,菌液通过超声破碎后,进行12% SDS-PAGE电泳。结果显示其上清中有分子量约为39.4 kD的目的蛋白条带出现(图 3中泳道2),表明GST-PhoPC融合蛋白在大
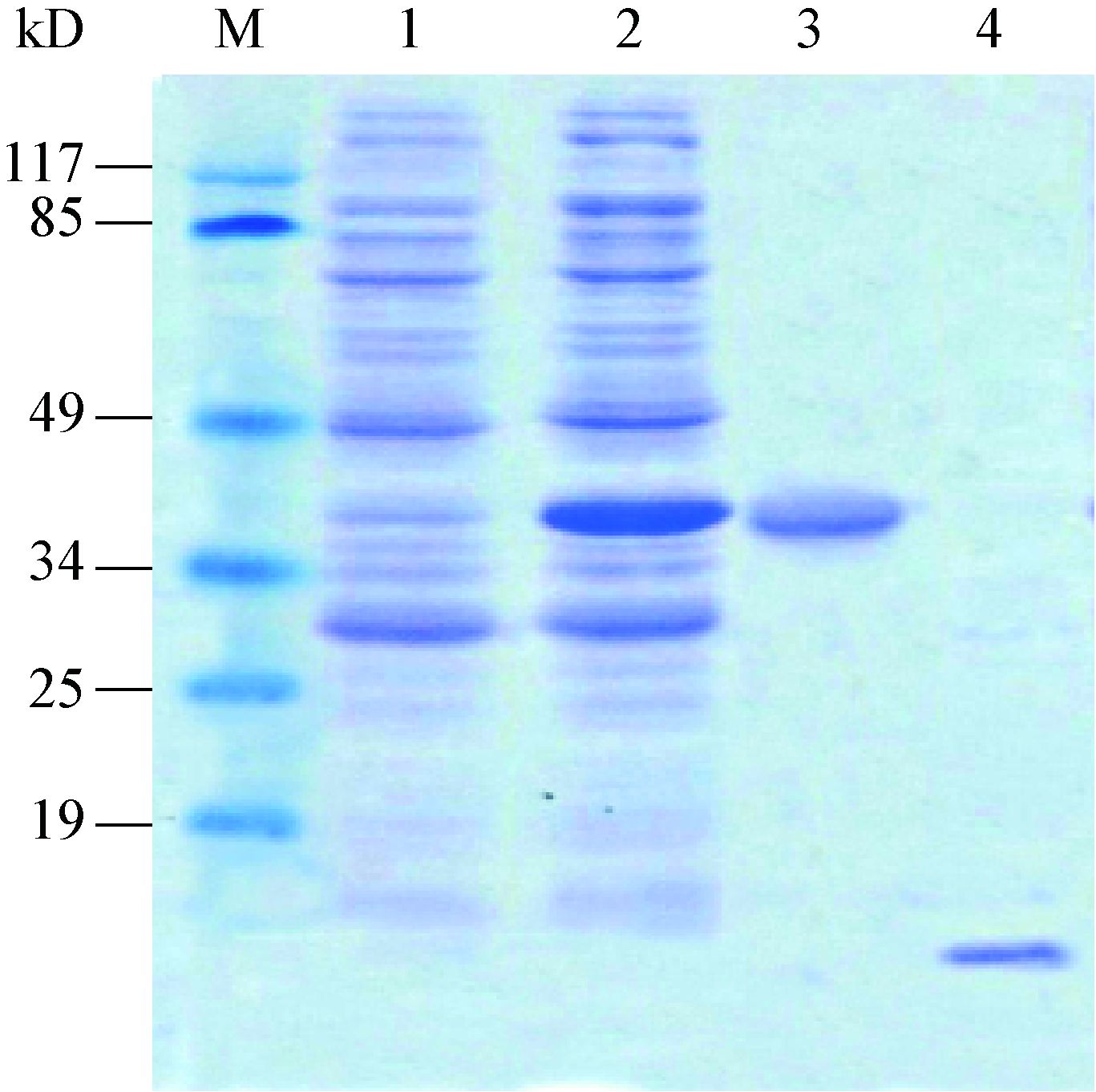
|
| 图 3 PhoPC蛋白的表达与纯化 Figure 3 Expression and purification of PhoPC protein 注:M:蛋白Marker;1、2:分别为含pGEX-4T-3质粒(对照)和pGEX-PhoPC重组质粒菌体的超声破 菌液上清;3:经谷胱甘肽琼脂糖珠纯化后的GST-PhoPC蛋白;4:切除GST标签后的PhoPC蛋白. Note: M: Protein marker; 1,2: The supernatants of E. coli BL21(DE3) cells transformed with pGEX-4T-3 (control) and pGEX-PhoPC,respectively; 3: Purification of GST-PhoPC protein by Glutathione Agarose; 4: PhoPC protein after cleavaged of GST-tag. |
|
|
肠杆菌中得到可溶性表达。上清GST-PhoPC融合蛋白经谷胱甘肽琼脂糖珠分离纯化后用凝血酶切除GST标签,获得分子量约为13.4 kD的PhoPC蛋白(图 3中泳道4)。
2.3 凝胶迁移率移动试验为了研究PhoP及其下游基因MAV0127、PhoU和Amt是否直接受PhoP调控,设计凝胶阻滞试验,以分析PhoP能否与PhoP、MAV0127、PhoU和Amt的启动子片段结合。将适当浓度的PhoPC蛋白分别与PhoP、MAV0127、PhoU和Amt启动子片段混合,在GSM缓冲液中30 ℃孵育30 min后进行非变性PAGE凝胶电泳,结果显示PhoPC能与PhoP、MAV0127和Amt启动子片段结合,而不能与PhoU启动子片段结合(图 4),提示PhoP能直接调控PhoP、MAV0127及Amt基因,而对PhoU基因的调控可能为间接作用。
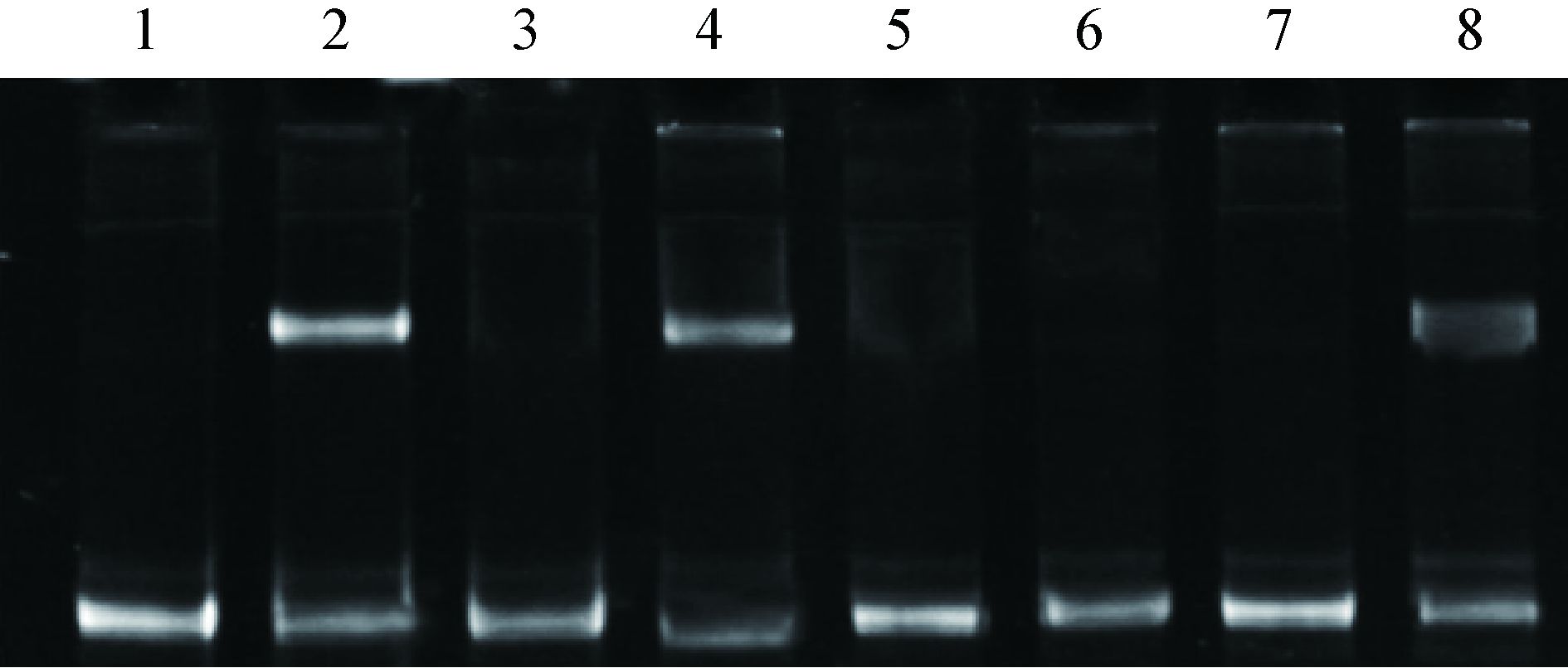
|
| 图 4 凝胶迁移率移动试验结果 Figure 4 Results of electrophoretic mobility shift assay Note: 1: PhoP promoter fragment; 2: PhoPC+PhoP promoter fragment; 3: MAV0127 promoter fragment; 4: PhoPC+MAV0127 promoter fragment; 5: PhoU promoter fragment; 6: PhoPC+PhoU promoter fragment; 7: Amt promoter fragment; 8: PhoPC+Amt promoter fragment. |
|
|
以鸟分枝杆菌临床分离株基因组DNA为模板,用PhoP-N-R/F和PhoP-C-R/F两对引物分别扩增出PhoP基因上、下游同源性核苷酸片段F1 (408 bp)和F2 (618 bp),见图 5。将这两个片段F1和F2用EcoRⅠ消化之后进行定向连接,得到PhoP基因缺失性同源核苷酸片段(F1+F2)。
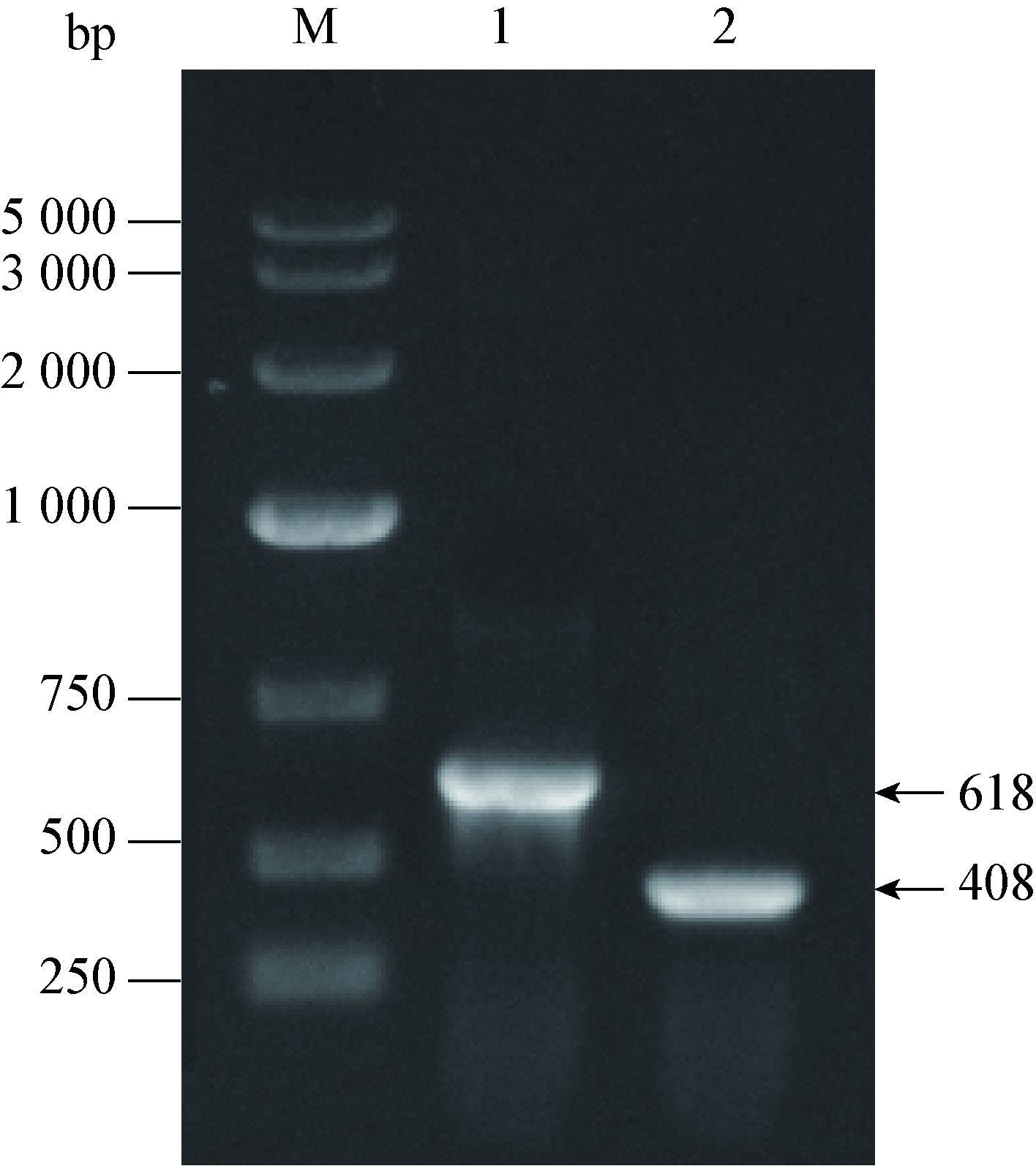
|
| 图 5 鸟分枝杆菌PhoP基因上、下游片段的PCR扩增 Figure 5 PCR amplification of the upper and down-stream fragments of the PhoP gene in Mycobacterium avium 注:M:DNA marker;1:PhoP基因下游片段;2:PhoP基因上游片段. Note: M: DNA marker; 1: Down-stream fragment of the PhoP gene; 2: Upper-stream fragment of the PhoP gene. |
|
|
将PhoP基因缺失性同源核苷酸片段克隆入自杀质粒pGMB151并转化E. coli SPY372λpir,利用氨苄抗性筛选阳性菌落,提取重组质粒,用PhoP-N-F和PhoP-C-R两条引物进行PCR扩增,琼脂糖凝胶电泳检测显示扩增出一条约为1 032 bp的片段,经BamH I酶切后同样也切下同一大小的片段(图 6),结果表明,含PhoP基因缺失性同源核苷酸片段的重组自杀质粒pGMB151构建成功。经DNA序列分析,PhoP基因上、下游两条片段之间309 bp的片段被EcoR I位点的6个碱基所取代。
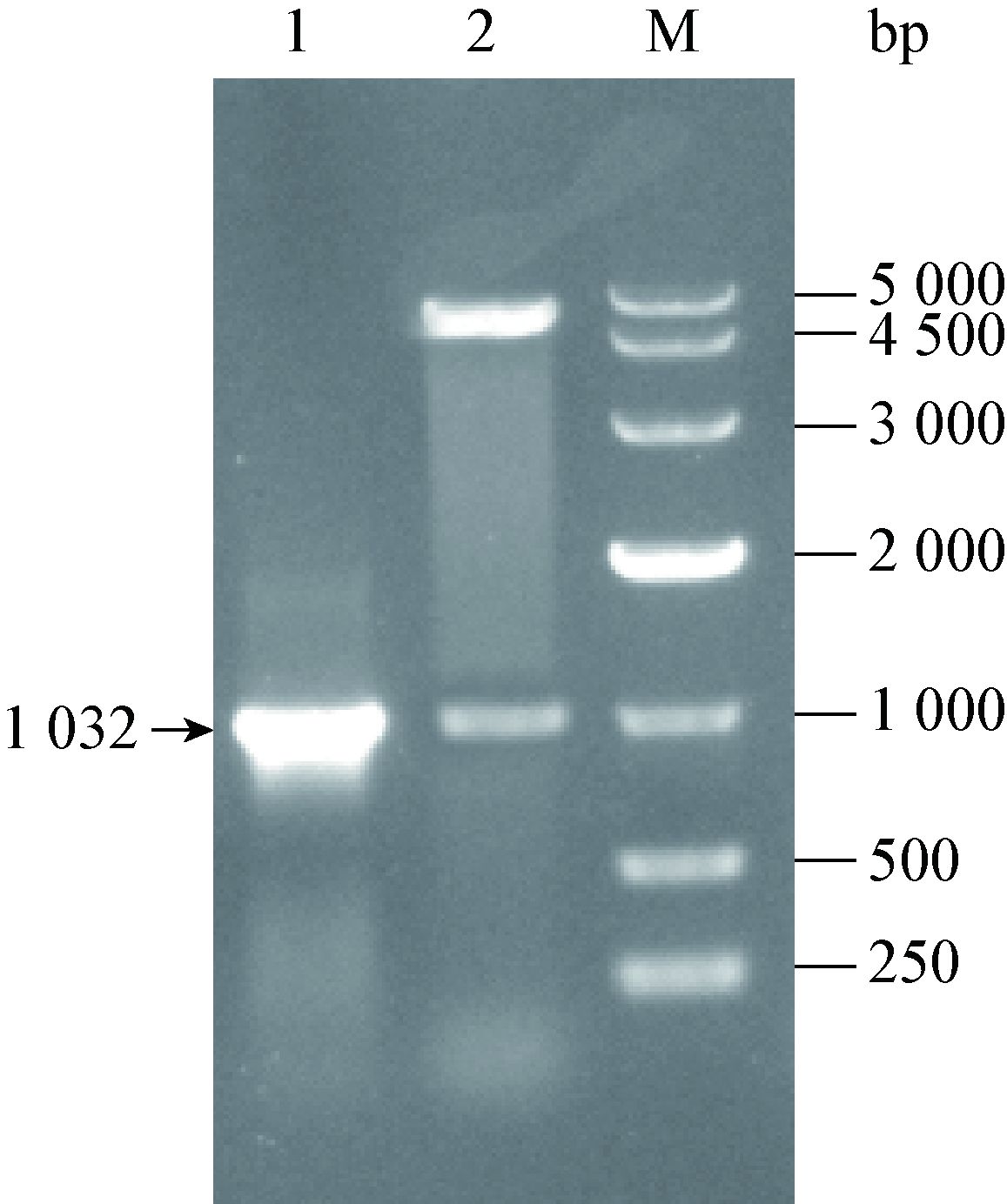
|
| 图 6 重组自杀质粒pGMB151的鉴定 Figure 6 Identification of the recombinant suicide plasmid pGMB151 注:1:重组自杀质粒的PCR鉴定;2:重组自杀质粒的酶切分析;M:DNA marker. Note: 1: PCR identification of the recombinant suicide plasmid; 2: Restriction analysis of the recombinant suicide plasmid; M: DNA marker. |
|
|
经含5%蔗糖Middle brook 7H10/OADC平板上筛选的菌落,用PhoP基因上、下游引物PhoP-N-F和PhoP-C-R进行PCR扩增,筛选发生同源重组的菌株。第一次通过Middle brook 7H10蔗糖平板筛选的菌株,经PCR鉴定发现大部分菌株未发生同源重组,另外有少部分的细菌出现大片段和小片段共存的现象,提示目的基因未完全被置换。将重组突变株进行连续传代培养,经过3-6次的筛选,结果显示菌株已完全重组并稳定存在(图 7)。经DNA序列分析,突变株的PhoP基因已缺失309 bp。
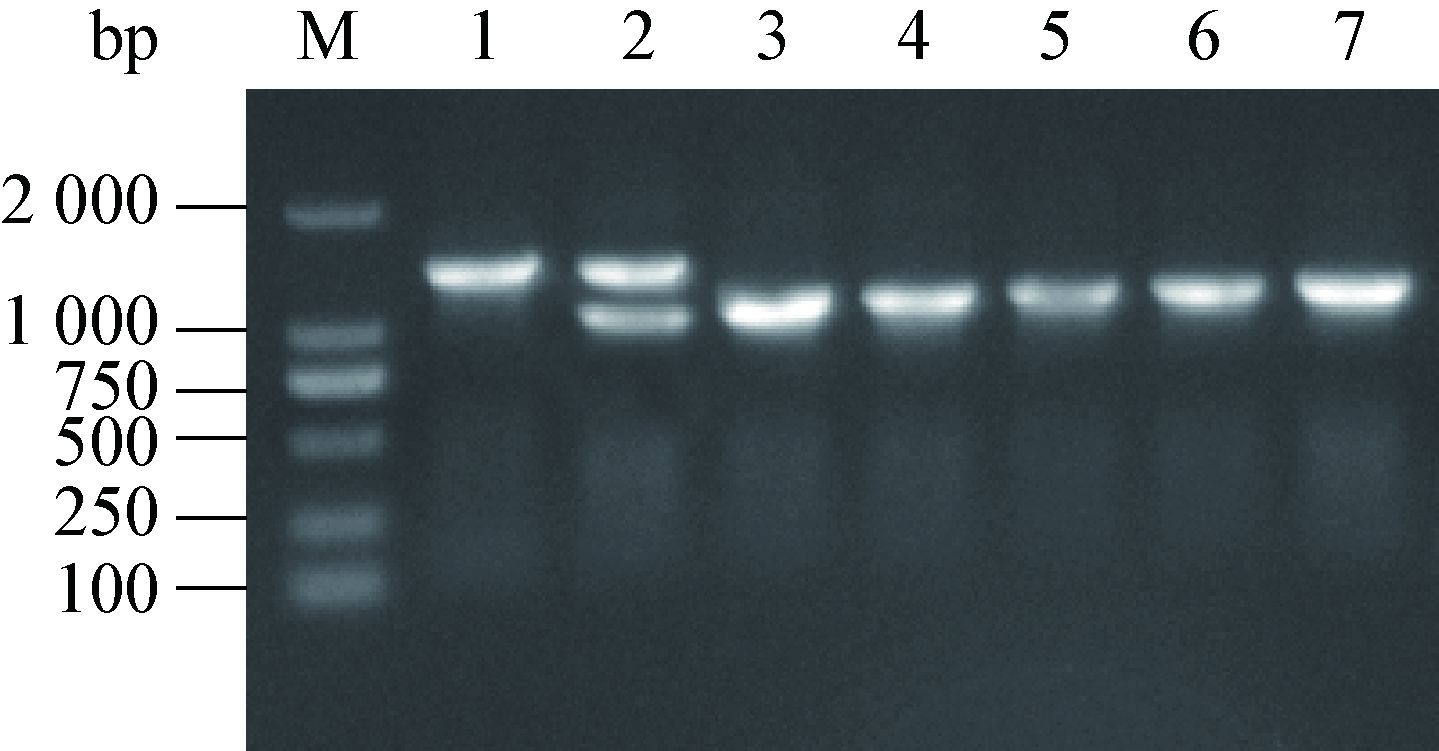
|
| 图 7 鸟分枝杆菌PhoP基因缺失突变株的PCR筛选及稳定性检测 Figure 7 Selection and identification of genetic stability of the Mycobacterium avium strain with defective PhoP gene by PCR 注:M:DNA DL2000 marker;1:鸟分枝杆菌野生株;2:初次筛选时出现的双重组变异;3-7:2-6代鸟分枝杆菌PhoP基因缺失突变株菌落PCR鉴定. Note: M: DNA DL2000 marker; 1: Wild strain of Mycobacterium avium; 2: Bidirectional recombinant variant appeared in the first time selection; 3-7: PhoP deleted mutant strain of 2,3,4,5,6 generation,respectively. |
|
|
PhoP调控基因属于PhoB/OmpR家族,这个家族成员的反应调控器含有两个区域,一个是位于氨基末端的调控区域,另外一个是位于羧基末端的DNA结合区(反应区域)。研究表明,这些反应调控器与其靶基因的启动子结合是通过识别位于启动子上游-35区的串联重复序列结合位点,以二聚体的形式相结合[12]。PhoP 212位的丝氨酸残基(在减毒株H37Ra的PhoP中突变为亮氨酸)是通过氢键与DNA相连。运用含PhoP启动子区域的238 bp的片段与PhoP (H37Rv和H37Ra)的结合试验表明,H37Ra中PhoP的点突变导致了其PhoP与DNA结合力的下降[13, 14],其原因可能是212位丝氨酸突变为含有大量疏水基的亮氨酸,丧失了氢键导致空间排斥,从而与DNA结合的亲和力和特异性受到影响。在以往的工作中,我们曾对一株鸟分枝杆菌HIV/AIDS临床分离株PhoP基因的全长进行克隆与分析,分析显示该鸟分枝杆菌PhoP的基因和氨基酸序列与结核分枝杆菌毒力株H37Rv的相似性分别为86%和94%,其PhoP DNA结合区的氨基酸序列与结核分枝杆菌比较仅有3个氨基酸残基差异[在鸟分枝杆菌中为丙氨酸(137位)、丝氨酸(141位)和丙氨酸(142位),而在结核杆菌毒力株H37Rv中分别为赖氨酸、天冬酰胺和缬氨酸],这表明二者的PhoP有较高的相似性。该分离株PhoP212位的氨基酸残基为丝氨酸残基,这与结核分枝杆菌毒力株H37Rv相同,提示PhoP在鸟分枝杆菌中的作用机制与结核分枝杆菌有相似之处。
为了解鸟分枝杆菌中哪些基因受PhoP直接调控,经生物信息学分析,本文选取了PhoP及其下游MAV0127、PhoU和Amt基因为靶标,通过凝胶迁移率移动试验来验证它们是否与PhoP结合,结果表明PhoP不仅可以直接调控其下游基因MAV0127和Amt的转录水平,还可以调控其自身基因的转录。目前我们正利用DNAaseI足迹实验分析PhoP蛋白与PhoP、MAV0127和Amt启动子上的结合位点,以期获得PhoP调控这些基因的机制。
从整体水平上研究PhoP在鸟分枝杆菌中的调节功能,通常需要构建PhoP突变体。我们利用自杀质粒PGMB151介导的同源重组,构建PhoP基因缺失突变株。结果显示,通过设计特异性引物,经PCR扩增出PhoP基因上、下游片段并定向连接,制备了PhoP基因缺失性同源核苷酸片段,在全长为720 bp的PhoP基因中,缺失了309 bp。为了避免PhoP基因敲除后引起的下游基因移码突变,在设计特异性引物时,通过在引物末端加上酶切位点,以便于PhoP基因上、下游同源核苷酸片段进行定向连接,并且使得缺失区域的碱基数(309 bp)为3的倍数。在筛选PhoP基因缺失突变株的过程中,由于在蔗糖培养基上生长出的耐蔗糖菌株可能含有PhoP基因回复突变株,因此可通过连续传代培养来筛选,以连续传代3次以上都有稳定的完全重组的菌株作为PhoP基因缺失突变株。PhoP是PhoP-PhoR二元调控系统中重要的调控因子,通过PhoP突变或缺失等方法,来研究调节蛋白作用于下游基因后有关转录组或表达谱的变化,以了解PhoP在鸟分枝杆菌致病、持留存活中的作用,将是我们以后要重点开展的工作。
致谢: 本研究得到广西疾病预防控制中心结核病防制所蓝如束所长的协助,在此表示衷心感谢。| [1] | Griffith DE, Aksamit T, Brown-Elliott BA, et al. An official ATS/IDSA statement: diagnosis,treatment,and prevention of nontuberculous mycobacterial diseases[J]. American Journal of Respiratory and Critical Care Medicine , 2007, 175 (4) : 367–416. DOI:10.1164/rccm.200604-571ST |
| [2] | Mirsaeidi M, Machado RF, Carcia JGN, et al. Nontuberculous mycobacterial disease mortality in the United States,1999-2010: a population-based comparative study[J]. PLoS One , 2014, 9 (3) : e91879. DOI:10.1371/journal.pone.0091879 |
| [3] | Gunaydin M, Yanik K, Eroglu C, et al. Distribution of nontuberculous mycobacteria strains[J]. Annals of Clinical Microbiology and Antimicrobials , 2013, 12 : 33. DOI:10.1186/1476-0711-12-33 |
| [4] | Wang HS, Wu QX. The infection of nontuberculosis mycobacteria and AIDS[J]. Foreign Medical Sciences Section of Dermatology and Venereology , 2005, 31 (3) : 166–168. (in chinese) 王洪生, 吴勤学. 非结核分枝杆菌感染与艾滋病[J]. 国外医学皮肤性病学分册 , 2005, 31 (3) : 166–168. |
| [5] | Chinese Society for Tuberculosis, Chinese Medical Association. The diagnosis and treatment of nontuberculosis mycobacteria disease experts consensus[J]. Chinese Journal of Tuberculosis and Respiratory Diseases , 2012, 35 (8) : 572–580. (in chinese) 中华医学会结核病学分会, 《中华结核和呼吸杂志》编辑委员会. 非结核分枝杆菌病诊断与治疗专家共识[J]. 中华结核和呼吸杂志 , 2012, 35 (8) : 572–580. |
| [6] | Sun Q, Sha W. Comparison and analysis of the clinical features in nontuberculosis mycobacteria and tuberculosis lung disease[J]. Chinese Journal of Antituberculosis , 2011, 33 (2) : 120–122. (in chinese) 孙勤, 沙巍. 非结核分枝杆菌肺病与肺结核患者的临床特征对比分析[J]. 中国防痨杂志 , 2011, 33 (2) : 120–122. |
| [7] | Walters SB, Dubnau E, Kolesnikova I, et al. The Mycobacterium tuberculosis PhoPR two-component system regulates genes essential for virulence and complex lipid biosynthesis[J]. Molecular Microbiology , 2006, 60 (2) : 312–330. DOI:10.1111/mmi.2006.60.issue-2 |
| [8] | Pérez E, Samper S, Bordas Y, et al. An essential role for phoP in Mycobacterium tuberculosis virulence[J]. Molecular Microbiology , 2001, 41 (1) : 179–187. DOI:10.1046/j.1365-2958.2001.02500.x |
| [9] | Gonzalo-Asensio J, Mostowy S, Harders-Westerveen J, et al. PhoP: a missing piece in the intricate puzzle of Mycobacterium tuberculosis virulence[J]. PLoS One , 2008, 3 (10) : e3496. DOI:10.1371/journal.pone.0003496 |
| [10] | Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual[M]. New York: Cold Spring Harbor Laboratory Press, 2001: 2344 . |
| [11] | Saito H. Laboratory media for the cultivation of tubercle bacillus[J]. Kekkaku , 1998, 73 (5) : 329–337. |
| [12] | Wang SS, Engohang-Ndong J, Smith I. Structure of the DNA-binding domain of the response regulator PhoP from Mycobacterium tuberculosis[J]. Biochemistry , 2007, 46 (51) : 14751–14761. DOI:10.1021/bi700970a |
| [13] | Gonzalo-Asensio J, Soto CY, Arbués A, et al. The Mycobacterium tuberculosis phoPR operon is positively autoregulated in the virulent strain H37Rv[J]. Journal of Bacteriology , 2008, 190 (21) : 7068–7078. DOI:10.1128/JB.00712-08 |
| [14] | Lee JS, Krause R, Schreiber J, et al. Mutation in the transcriptional regulator PhoP contributes to avirulence of Mycobacterium tuberculosis H37Ra strain[J]. Cell Host & Microbe , 2008, 3 (2) : 97–103. |
 2016, Vol. 43
2016, Vol. 43