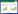扩展功能
文章信息
- 张春芝, 陈贝贝, 雷明瑄, 郭庆功, 陈向东
- ZHANG Chun-Zhi, CHEN Bei-Bei, LEI Ming-Xuan, GUO Qing-Gong, CHEN Xiang-Dong
- 一株奥奈达希瓦氏菌烈性噬菌体的分离、纯化及鉴定
- Isolation,purification and identification of a Shewanella oneidensis MR-1 lytic phage
- 微生物学通报, 2016, 43(9): 1953-1959
- Microbiology China, 2016, 43(9): 1953-1959
- DOI: 10.13344/j.microbiol.china.160114
-
文章历史
- 收稿日期: 2016-01-29
- 接受日期: 2016-04-06
- 优先数字出版日期(www.cnki.net): 2016-05-10
2. 宁夏葡萄酒与防沙治沙职业技术学院 宁夏银川 750199 ;
3. 华中科技大学附属中学 湖北武汉 430074
2. Ningxia Technical College of Wine and Desertification Prevention,Yinchuan,Ningxia 750199,China ;
3. Middle School Attached to HUST,Wuhan,Hubei 430074,China
奥奈达希瓦氏菌(Shewanella oneidensis)为杆状革兰氏阴性的兼性厌氧菌,在淡水沉积物、海湾沉积物和其他各种环境中广泛存在。该类细菌能对硫化汞、铀(U)、砷(As)、2,4-二硝基甲苯、硝酸盐、苏丹红染料等有毒物质进行还原转化,因此在生物修复和环境保护方面具有重要的潜在应用价值[1-7];此外,该菌具有独特的产电性能[8],可被用于合成硒纳米棒、Pd-Au合金等复合纳米材料以及异丁醇等物质[9-11]。
MR-1菌株是奥奈达希瓦氏菌的模式菌株[12],在厌氧条件下可以利用多种电子最终受体完成呼吸作用,例如:Mn(Ⅲ)、Mn(Ⅳ)、Fe(Ⅲ)、Cr(Ⅵ)、U(Ⅵ)、延胡索酸、硝酸盐、硫代硫酸盐等[13]。一些地质学家在实验室条件下利用MR-1以Fe(Ⅲ)氧化物作为电子最终受体进行厌氧呼吸的这一特性,对自然环境中的蒙脱石形成伊利石的过程(异化铁还原过程)进行模拟研究,研究结果受到广泛的关注,已经成为研究微生物成岩作用的重要模式材料[14]。
病毒是超显微、没有细胞结构、专性寄生于活细胞的实体,是地球上生命系统的重要成员。并且病毒在细胞中的存在及活动都会对其宿主的生命活动产生多方面的重要影响。如今,包括噬菌体在内的各类病毒在生态系统中所起的作用越来越受到人们的关注与重视[15-16],但是它们是否在地球微生物成岩过程中扮演一定角色却无人探究,这可能是由于缺乏明确的生物标志物以及未建立起合适的研究方法所导致。
全基因组测序结果表明,MR-1菌株的染色体上存在3个潜在的原噬菌体[17-18],因此有可能开展噬菌体对微生物成岩作用影响的相关研究。但迄今尚无对MR-1烈性噬菌体的研究报道。本研究从下水道的污水中分离得到了一株能感染MR-1菌株的烈性噬菌体M1,并对其性质进行了初步研究。M1的获得为后续研究噬菌体在地球微生物成岩过程中所起的作用提供了实验材料。
1 材料与方法 1.1 菌株实验用菌株Shewanella oneidensis MR-1、Shewanella putrefaciens CN-32由中国地质大学(武汉)董海良教授赠送[14],Shewanella putrefaciens 6514购自中国普通微生物菌种保藏管理中心(菌株编号:1.6514),Shewanella sp. W3-18-1由中国科学院水生生物研究所邱东茹研究员赠送。
Shewanella oneidensis MR-1ΔλΔμ2,敲除了菌株染色体上两个原噬菌体基因组的突变株,由本实验室构建(未发表的结果)。
1.2 主要试剂和仪器Cesium chloride,美国Sigma-Aldrich公司;琼脂糖,西班牙Biowest公司;各种核酸酶,美国Thermo Scientific公司;琼脂粉,美国Becton Dickinson and company公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司;其余试剂均购自国药集团化学试剂有限公司。
透射电子显微镜,日本JEOL公司;超速冷冻离心机,美国Beckman公司;小型高速离心机,德国Eppendorf公司;恒温摇床,上海智城有限公司;恒温培养箱,上海一恒有限公司;电泳仪,北京六一仪器厂;凝胶成像系统,美国Syngene;高压灭菌锅,日本HIRAYAMA公司;超净工作台,江苏苏净安泰有限公司。
1.3 培养基改良LB液体培养基(g/L):酵母提取物5、胰蛋白胨10、氯化钠5。
改良LB半固体培养基(g/L):酵母提取物5、胰蛋白胨10、氯化钠5、琼脂6。
改良LB固体培养基(g/L):酵母提取物5、胰蛋白胨10、氯化钠5、琼脂15。
1.4 样品采集8份样品分别采集于武汉大学枫园周边的地表及下水道的污水,分别记号为1、2、3、4、5、6、7、8。
1.5 噬菌体富集对数期宿主菌制备:将4 ℃保藏的MR-1、CN-32、6514、W3-18-1菌株分别挑取单菌落接种于5 mL液体培养基中,于30 ℃、200 r/min培养过夜。次日,分别取50 μL菌液接种于5 mL新鲜液体培养基中,培养3 h至对数期。
样品处理:将8份样品经过12 000 r/min离心 5 min去除杂质,上清以0.22 μm微孔滤器过滤除菌,于4 ℃保存。
噬菌体的富集:分别取8份样品的滤液1 mL加入到5 mL对数期宿主菌的菌液中,于30 ℃、 200 r/min振荡培养5-6 h,12 000 r/min离心5 min收集上清并过滤,如此重复3次对环境样品进行富集。
1.6 裂菌性的测定分别取50 μL宿主菌MR-1、CN-32、6514、W3-18-1与4 mL半固体培养基混合后倒双层平板,凝固后,分别吸取5 μL已富集的8份样品的滤液点在双层平板上,30 ℃条件下培养过夜。次日,观察有无噬菌斑。
1.7 噬菌体的分离用无菌牙签沾取获得的噬菌斑于1 mL无菌液体培养基中,在涡旋振荡仪上混合均匀,即为原液,进行10倍梯度稀释至10-4,分别取10-3和10-4梯度稀释液100 μL与MR-1宿主菌50 μL混合倒双层平板,30 ℃条件下培养过夜,重复3次,直至在同一双层平板上得到的噬菌斑大小与形态基本一致。
1.8 噬菌体扩增及效价的测定将分离到的噬菌体接种到5 mL对数期MR-1菌液中,于30 ℃、200 r/min振荡培养5-6 h后,收集培养液并以12 000 r/min离心5 min,再以 0.22 μm微孔滤器过滤。取滤液500 μL加入到 50 mL对数期的宿主菌中培养5-6 h,将培养液转移到50 mL离心管中,以10 000 r/min离心5 min,再以0.22 μm微孔滤器过滤,取滤液50 μL进行 10倍梯度稀释后,测定噬菌体效价,30 ℃条件下培养12 h并计数。
1.9 纯化噬菌体及效价的测定由于宿主菌MR-1是含有λso和μso2原噬菌体的溶源菌,正常培养过程中MR-1会不断释放λso和μso2噬菌体颗粒。为了除去λso和μso2原噬菌体对烈性噬菌体性质研究的影响,我们将得到的烈性噬菌体在敲除了λso、μso2原噬菌体的MR-1菌株(MR-1ΔλΔμ2)中进行了进一步纯化。先将噬菌体上清与MR-1菌株混合倒双层平板,30 ℃条件下培养5-6 h,用牙签沾取大而透明的单噬菌斑,以新鲜的液体培养基重悬,并进行10倍梯度稀释,再以MR-1ΔλΔμ2为宿主菌倒双层平板,30 ℃条件下培养12 h,重复挑噬菌斑以MR-1ΔλΔμ2为宿主菌倒双层平板,直到噬菌斑形态单一。
将纯化后的噬菌体扩增培养并测定其效价。
1.10 噬菌体电镜观察噬菌体颗粒的纯化:取经0.22 μm微孔滤器过滤过的噬菌体滤液26 mL,45 000 r/min离心1 h,弃去上清,将沉淀用1 mL SM Buffer重悬过夜,至沉淀完全溶解后,再进行CsCl密度梯度离心 (1.50 g/ml),22 000 r/min离心18 h后分层取样,再将样品层以45 000 r/min离心3 h,弃去上清,将沉淀用50 μl SM Buffer重悬。
电镜样品的制备:取10 μL上述噬菌体滴于封口膜上,将铜网(具有膜的一面朝液滴)置于噬菌体液滴上,2 min后将铜网取下,用滤纸从铜网侧面将多余液体吸干。取10 μL 2%磷钨酸负染液滴于封口膜上,将沾有噬菌体的铜网置于磷钨酸液滴上,1 min后取下,用滤纸从铜网侧面吸干多余负染液,将铜网放在滤纸上自然干燥后用透射电镜观察噬菌体形态并拍照。
1.11 基因组提取、核酸类型鉴定及限制性片段多态性分析取500 μL噬菌体滤液,加入5 μL DNase I,5 μL RNase A和10 μL DNase I Buffer,在37 ℃水浴锅中孵育4 h,利用离心柱形细菌基因组DNA提取试剂盒提取噬菌体基因组,经1%琼脂糖凝胶电泳检测,120 V,40 min。
取噬菌体基因组5 μL,分别加入0.5 μL DNase I和RNase A,37 ℃温育1 h。检测基因组被消化情况,确定其核酸类型。
取噬菌体基因组5 μL,加入0.5 μL Exonuclease III,37 ℃温育1 h。检测基因组被消化的情况,确定其基因组结构。
分别用限制性内切酶Stu I、Nde I和Msc I对噬菌体基因组进行酶切处理2 h,酶切产物经1%琼脂糖凝胶电泳检测进行分析。
1.12 一步生长曲线的绘制将宿主菌MR-1ΔλΔμ2活化培养过夜后,取 50 μL加入到5 mL新鲜的液体培养基中,于30 ℃、200 r/min振荡培养3 h至对数期。之后将其加入到45 mL新鲜液体培养基中进行稀释,并以10 000 r/min进行4 ℃冷冻离心5 min,弃去上清,沉淀用45 mL液体培养基重悬,此时取50 μL菌液稀释涂布测定其活菌量。向上述菌液中加入5 mL噬菌体(MOI值约为12),静置吸附5 min后,立即以10 000 r/min进行4 ℃冷冻离心5 min,弃去上清,沉淀用50 mL液体培养基重悬,记为0时刻,每隔5 min取样,检测胞外噬菌体效价。以取样时间为横坐标,噬菌体效价为纵坐标,绘制一步生长曲线,估算出噬菌体的潜伏期和裂解量。实验设置3个平行。
2 结果与分析 2.1 噬菌体分离根据结果观察发现只有第7号样品在以MR-1为宿主的双层平板上形成了噬菌斑(7号样品取自下水道,有臭味),将其命名为M1。
经双层平板法分离纯化获得的噬菌斑是透明的、边缘清晰、无晕环的圆形噬菌斑,直径约为2.3 mm-2.5 mm (图 1A)。经分离后以MR-1菌株为宿主测定的噬菌体效价约为4.9×109 pfu/mL。
|
| 图 1 M1的噬菌斑形态 Figure 1 Plaques of phage M1 注:A:噬菌体M1感染MR-1宿主所形成的噬菌斑;B:未纯化M1制备物感染MR-1ΔλΔμ2所形成的噬菌斑. 实线箭头为溶原性噬菌斑;虚线箭头为烈性噬菌斑. Note: A: Plaques of phage M1 against MR-1; B: Plaques of unpurified M1 against MR-1ΔλΔμ2. Solid arrows for lysogenic plaques; Dashed arrows for lytic plaques. |
|
|
生物信息学分析显示,菌株MR-1染色体上整合有3个潜在的原噬菌体。我们已经证实其中的λso和μso2是功能完整的溶原噬菌体,它们可以感染敲除这两个原噬菌体的突变株MR-1ΔλΔμ2,形成噬菌斑(未发表的结果)。由于λso和μso2在MR-1菌株正常生长条件下也可以不断释放,为消除它们对M1相关生物学性质研究的影响,将前面得到的含噬菌体M1的滤液以MR-1ΔλΔμ2为宿主进行纯化。如图 1B所示,在以MR-1ΔλΔμ2为宿主制备的双层平板上,除可以观察到与图 1A类似的噬菌斑外,还出现了一些较小的噬菌斑,说明滤液中确实混有溶原性噬菌体颗粒。挑单噬菌斑以MR-1ΔλΔμ2为宿主进行多次纯化,直至在以MR-1ΔλΔμ2为宿主的平板上观察不到较小的噬菌斑。纯化后的M1感染MR-1ΔλΔμ2的效价无明显变化,约为5.5×109 PFU/mL。
2.3 噬菌体形态经透射电镜观察,噬菌体M1头部呈二十面体,头部直径约为55 nm,尾长约为170 nm,尾部可收缩(图 2)。按照国际病毒分类委员会分类标 准[19],其属于肌尾噬菌体科(Myoviridae)。

|
| 图 2 噬菌体M1的电镜照片 Figure 2 Electron microscope of bacteriophage M1 注:实线箭头所指为未收缩尾鞘;虚线箭头所指为收缩尾鞘. Note: Solid arrow for non-contractile tail; Dashed arrow for contractile tail. |
|
|
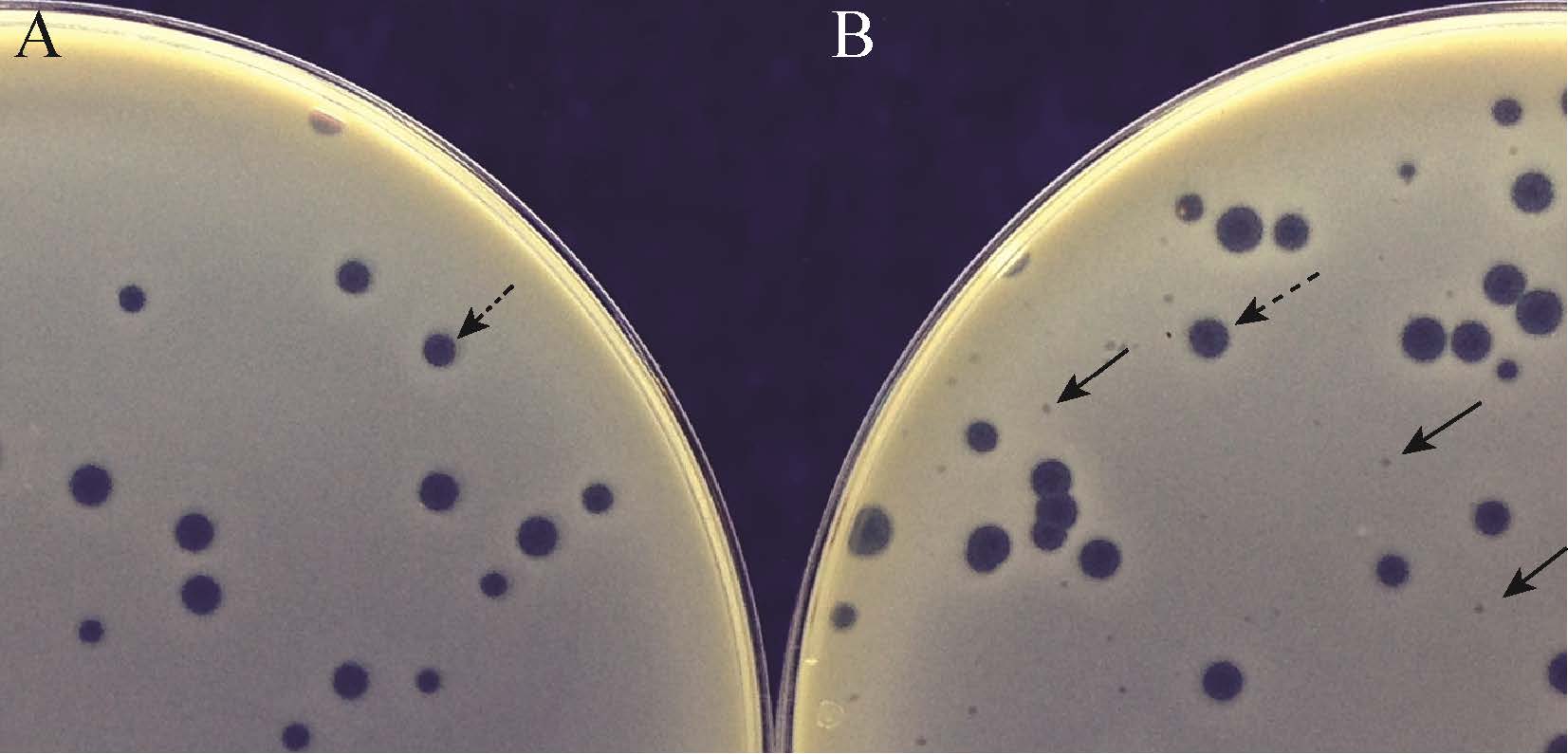
将提取的M1基因组经DNase I和RNase A酶切,发现其仅能被DNase I消化,而对RNase A具有抗性,表明该噬菌体核酸类型为DNA (图 3A)。此外,选用的3种限制性内切酶均可对噬菌体基因组酶切,说明其遗传物质是双链DNA (dsDNA)。据估算,M1基因组大小约为50 kb (图 3B)。
|
| 图 3 噬菌体M1核酸类型分析 Figure 3 Analysis of the nucleic acid type of M1 注:A:M:λ/Hind III DNA marker;1:未处理基因组;2:DNA酶酶切;3:RNA酶酶切. B:4:Stu I酶酶切;5:Nde I酶酶切;6:Msc I酶酶切. C:7:Exonuclease III酶酶切. Note: A: M: λ/Hind III DNA marker; 1: Untreated genome; 2: DNA enzyme digestion; 3: RNA enzyme digestion. B: 4: Stu I enzyme digestion; 5: Nde I enzyme digestion; 6: Msc I enzyme digestion. C: 7: Exonuclease III enzyme digestion. |
|
|
将提取的M1基因组经外切酶Exonuclease III酶切,发现其能被消化,表明该噬菌体基因组结构为线形(图 3C)。
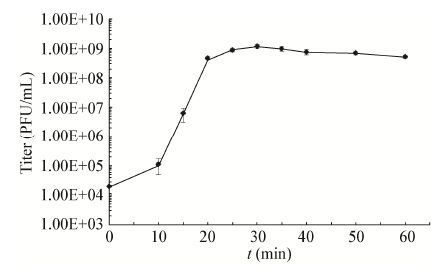
2.5 噬菌体M1的一步生长曲线预实验测定的结果显示,只有在MOI值约为10时,宿主菌MR-1ΔλΔμ2的存活率才能下降到10%以内(结果未显示),因此确定在这个感染复数条件下进行一步生长曲线测定。由图 4可见,在10 min之内噬菌体M1的数量变化不大,10-20 min期间其效价迅速升高,之后效价趋于稳定。由此可以得出,M1感染宿主菌MR-1ΔλΔμ2后完成整个复制循环所需时间约为15-20 min。裂解期的曲线比较平缓,说明可能存在感染不同步的情况。根据暴发末期噬菌体滴度/感染初期宿主菌浓度计算的裂解量仅为10左右。
|
| 图 4 噬菌体M1的一步生长曲线 Figure 4 One-step growth curve of phage M1 |
|
|
迄今为止对希瓦氏菌属噬菌体的研究报道并不多。2007年,Wang等[20]和Jian等[21]对深海细菌Shewanella piezotolerans WP3携带的丝状溶原噬菌体SW1进行了系统研究。该噬菌体基因组大小为 7 718 bp的单链DNA,可感染WP2菌株形成噬菌斑,但只有培养温度低于或等于15 ℃时才能观察到噬菌斑,并且随着温度的降低噬菌体的滴度不断增加;70 ℃处理l0 min完全失活;在4 ℃下主要基因能够高表达。这些性质都与其所处深海低温环境相关。2012年,孔令红[22]以腐败希瓦氏菌Sp225为宿主菌,从污水中分离得到一株烈性噬菌体Spp001,噬菌斑直径为1 mm,电镜观察其形态为蝌蚪形,长约200 nm,有较好的热稳定性,耐碱不耐酸,潜伏期约为10 min,暴发期约为 20 min,裂解量为98。
本实验选用4株希瓦氏菌作为宿主菌,但是只从环境中分离获得一株奥奈达希瓦氏菌MR-1的烈性噬菌体M1。MR-1菌株在1988年首次报道时曾被归为腐败希瓦氏菌[23],直到1999年才确定为奥奈达希瓦氏菌的模式菌株,说明它与腐败希瓦氏菌具有较高的相似性。但我们分离得到的M1并不能感染其它2株腐败希瓦氏菌CN-32菌株和6514菌株,也不能感染另一株未定种的希瓦氏菌W3-18-1菌株,表明该噬菌体对宿主具有高度专一性。电镜观察其形态为蝌蚪形,全长约225 nm,属于肌尾噬菌体科,基因组大小为50 kb左右,为线性双链DNA,与噬菌体Spp001相似。噬菌体M1形成的噬菌斑直径约为2.3 mm-2.5 mm。一步生长曲线测定实验显示,噬菌体M1完成复制循环只需要15-20 min,但裂解量仅为10,明显低于Spp001。实际上,在日常进行M1扩增实验时,得到的效价始终只能维持在109水平,明显低于实验室操作的其它噬菌体,这可能与其裂解量较低 有关。
自然环境中分布着种类和数量都极其丰富的各类病毒,其对生态结构及生态关系影响的研究具有重要意义[15, 16, 24]。M1是迄今为止被报道的第 一株能感染奥奈达希瓦氏菌MR-1的烈性噬菌体,它的发现为系统研究温和噬菌体和烈性噬菌体对该菌异化铁还原过程的影响,了解病毒在地球微生物成岩过程中的可能角度奠定了实验材料基础。
| [1] | Chen Y, Wang H, Si YB. Research on the bioaccesibility of HgS by Shewanella oneidensis MR-1[J]. Environmental Science , 2013, 34 (11) : 4466–4472. (in chinese) 陈艳, 王卉, 司友斌. Shewanella oneidensis MR-1对硫化汞的生物利用性研究[J]. 环境科学 , 2013, 34 (11) : 4466–4472. |
| [2] | Si YB, Sun L, Wang H. Effects of dissimilatory reduction of goethite on mercury methylation by Shewanella oneidensis MR-1[J]. Environmental Science , 2015, 36 (6) : 2252–2258. (in chinese) 司友斌, 孙林, 王卉. Shewanella oneidensis MR-1对针铁矿的还原与汞的生物甲基化[J]. 环境科学 , 2015, 36 (6) : 2252–2258. |
| [3] | Sheng L, Fein JB. Uranium reduction by Shewanella oneidensis MR-1 as a function of NaHCO3 concentration: surface complexation control of reduction kinetics[J]. Environmental Science & Technology , 2014, 48 (7) : 3768–3775. |
| [4] | Wang J, Wu MY, Lu G, et al. Biotransformation and biomethylation of arsenic by Shewanella oneidensis MR-1[J]. Chemosphere , 2016, 145 : 329–335. DOI:10.1016/j.chemosphere.2015.11.107 |
| [5] | Huang JX, Chen X, Li FL, et al. Reductive biotransformation of 2,4-dinitrotoluene by Shewanella oneidensis MR-1 under anaerobic conditions[J]. Microbiology China , 2013, 40 (9) : 1734–1741. (in chinese) 黄杰勋, 陈星, 李非里, 等. 厌氧条件下Shewanella oneidensis MR-1对2,4-二硝基甲苯的还原转化[J]. 微生物学通报 , 2013, 40 (9) : 1734–1741. |
| [6] | Dong YY, Wang JX, Fu HH, et al. A Crp-dependent two-component system regulates nitrate and nitrite respiration in Shewanella oneidensis[J]. PLoS One , 2012, 7 (12) : e51643. DOI:10.1371/journal.pone.0051643 |
| [7] | Ji QY, Liu GF, Zhou JT, et al. Removal of water-insoluble Sudan dyes by Shewanella oneidensis MR-1[J]. Bioresource Technology , 2012, 114 : 144–148. DOI:10.1016/j.biortech.2012.03.014 |
| [8] | Bretschger O, Obraztsova A, Sturm CA, et al. Current production and metal oxide-reduction by Shewanella oneidensis MR-1 wild type and mutants[J]. Applied and Environmental Microbiology , 2007, 73 (21) : 7003–7012. DOI:10.1128/AEM.01087-07 |
| [9] | Deng H, Zheng ZY, Zhao F. Biosynthesis of selemium nanobars by Shewallena oneidensis MR-1[J]. Acta Microbiologica Sinica , 2015, 55 (8) : 1074–1078. (in chinese) 邓欢, 郑志勇, 赵峰. 希瓦氏菌Shewallena oneidensis MR-1合成硒纳米棒[J]. 微生物学报 , 2015, 55 (8) : 1074–1078. |
| [10] | de Corte S, Hennebel T, Fitts JP, et al. Biosupported bimetallic Pd-Au nanocatalysts for dechlorination of environmental contaminants[J]. Environmental Science & Technology , 2011, 45 (19) : 8506–8513. |
| [11] | Jeon JM, Park H, Seo HM, et al. Isobutanol production from an engineered Shewanella oneidensis MR-1[J]. Bioprocess and Biosystems Engineering , 2015, 38 (11) : 2147–2154. DOI:10.1007/s00449-015-1454-z |
| [12] | Venkateswaran K, Moser DP, Dollhopf ME, et al. Polyphasic taxonomy of the genus Shewanella and description of Shewanella oneidensis sp[J]. International Journal of Systematic Bacteriology, , 1999, 49 (2) : 705–724. DOI:10.1099/00207713-49-2-705 |
| [13] | Shi L, Squier TC, Zachara JM, et al. Respiration of metal (hydr) oxides by Shewanella and Geobacter: a key role for multihaem c-type cytochromes[J]. Molecular Microbiology , 2007, 65 (1) : 12–20. DOI:10.1111/mmi.2007.65.issue-1 |
| [14] | Kim J, Dong HL, Seabaugh J, et al. Role of microbes in the smectite-to-illite reaction[J]. Science , 2004, 303 (5659) : 830–832. DOI:10.1126/science.1093245 |
| [15] | Koskella B, Brockhurst MA. Bacteria-phage coevolution as a driver of ecological and evolutionary processes in microbial communities[J]. FEMS Microbiology Reviews , 2014, 38 (5) : 916–931. DOI:10.1111/1574-6976.12072 |
| [16] | Muniesa M, Imamovic L, Jofre J. Bacteriophages and genetic mobilization in sewage and faecally polluted environments[J]. Microbial Biotechnology , 2011, 4 (6) : 725–734. DOI:10.1111/mbt.2011.4.issue-6 |
| [17] | Gödeke J, Paul K, Lassak J, et al. Phage-induced lysis enhances biofilm formation in Shewanella oneidensis MR-1[J]. The ISME Journal , 2011, 5 (4) : 613–626. DOI:10.1038/ismej.2010.153 |
| [18] | Heidelberg JF, Paulsen IT, Nelson KE, et al. Genome sequence of the dissimilatory metal ion-reducing bacterium Shewanella oneidensis[J]. Nature Biotechnology , 2002, 20 (11) : 1118–1123. DOI:10.1038/nbt749 |
| [19] | Feng Y, Liu J, Sun Y, et al. An introduction to current classification and nomenclature of bacterial viruses[J]. Chinese Journal of Veterinary Science , 2013, 33 (12) : 1954–1958. (in chinese) 冯烨, 刘军, 孙洋, 等. 噬菌体最新分类与命名[J]. 中国兽医学报 , 2013, 33 (12) : 1954–1958. |
| [20] | Wang F, Wang FP, Li Q, et al. A novel filamentous phage from the deep-sea bacterium Shewanella piezotolerans WP3 is induced at low temperature[J]. Journal of Bacteriology , 2007, 189 (19) : 7151–7153. DOI:10.1128/JB.00569-07 |
| [21] | Jian HH, Xiao X, Wang FP. Role of filamentous phage SW1 in regulating the lateral flagella of Shewanella piezotolerans strain WP3 at low temperatures[J]. Applied Environmental Microbiology , 2013, 79 (22) : 7101–7109. DOI:10.1128/AEM.01675-13 |
| [22] | Kong LH. Properties of Bacteriophage of Shewanella putrefaciens and its application on fresh keeping effects[D]. Qingdao: Master’s Thesis of Ocean University of China,2012 (in Chinese) 孔令红. 腐败希瓦氏菌噬菌体的性质和防腐应用研究[D]. 青岛: 中国海洋大学硕士学位论文,2012 |
| [23] | Myers CR, Nealson KH. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor[J]. Science , 1988, 240 (4857) : 1319–1321. DOI:10.1126/science.240.4857.1319 |
| [24] | Pacton M, Wacey D, Corinaldesi C, et al. Viruses as new agents of organomineralization in the geological record[J]. Nature Communications , 2014, 5 : 4298. |
 2016, Vol. 43
2016, Vol. 43