扩展功能
文章信息
- 陈利云, 王弋博, 李三相, 汪之波
- CHEN Li-Yun, WANG Yi-Bo, LI San-Xiang, WANG Zhi-Bo
- 甘肃省麦积山景区3种典型裸子植物土壤微生物群落结构分析
- Microbial community structure of three typical gymnosperms soil in scenic area of Maijishan, Gansu Province
- 微生物学通报, 2016, 43(9): 1939-1944
- Microbiology China, 2016, 43(9): 1939-1944
- DOI: 10.13344/j.microbiol.china.150797
-
文章历史
- 收稿日期: 2015-10-17
- 接受日期: 2016-03-23
- 优先数字出版日期(www.cnki.net): 2016-03-23
甘肃省麦积山景区地处西秦岭主脉,是秦岭地区物种多样性最丰富的地区之一,区内自然景观丰富多彩,生态系统保存完整[1],但近年来由于气候和人为原因,景区原始林地面积明显减少,生物多样性和生态稳定性受到严重影响[2-3]。自1973年以来,景区引入了以日本落叶松为主的外来种,建置了大面积的人工林地,对景区内森林生态系统的构建起到了积极的促进作用[4]。大量研究表明日本落叶松能通过改变土壤的微生物群落结构,进而改变本地植物种与土壤微生物之间经过长期协同进化形成的平衡互生关系,从而影响本地植物种的生长和种群更新[5-6]。
珍稀物种保护与合理外来种引种是麦积山景区生物多样性保护的重要举措,而植物物种多样性的变化能通过其根际土壤微生物多样性的变化得以表征,同时土壤微生物群落的变化会对植物物种多样性产生反作用[7],探讨不同植物根际土壤微生物生理群生态多样性特征对了解土著植物种的生存状态及选择适合的植被类型进行生态保护具有重要意义。本研究将传统平板培养与磷酸脂脂肪酸(PLFA)分析法相结合,试图通过对麦积山景区3种典型的裸子植物,土著濒危种红豆杉[Taxus chinensis (Pilg) Rehder.]、土著建群种云杉(Picea asperata Mast)及外来种日本落叶松[Larix kaempferi (Lamb) Carriere.]根际土壤微生物区系的分析比较,以阐明不同植物种类与土壤微生物数量分布及群落结构的关系,为景区珍稀物种的保护与合理外来引种寻求科学的理论依据。
1 材料与方法 1.1 研究区域概况小陇山自然保护区位于甘肃省东南部的天水市,地理坐标为33°31′-34°41′N和104°23′-106°43′E,海拔700-2 500 m,年平均气温7-12 ℃,年均降水量460-800 mm,多集中在7-9月,年蒸发量 989-1 658 mm,相对湿度68%-78%,年日照时数 1 520-2 313 h,无霜期120-218 d,≥10 ℃积温 2 444-3 825 ℃,土壤以山地褐土和山地棕壤为主,属于独特的温凉湿润区和半湿润区大陆性气候。
1.2 研究方法 1.2.1 根际土壤采样: 于2013年7月中旬根据小陇山环境和植被状况特征选择生境相似、生长旺盛的红豆杉、云杉、日本落叶松(编号为Ⅰ、Ⅱ、Ⅲ)样地3个,每样地10 m×10 m,在样地内选取中等大小成年植株5株,采用抖动法采集根际土壤混合为土样,挑出土样中的石砾、植物残留根和其它废弃物后,取部分土壤风干过筛,测定土壤有机质、含水量及pH (表 1)。其余土样过2 mm筛后分为两份,一份立刻进行微生物平板培养,测定可培养微生物特征;另一部分-20 ℃冷冻,一周内测定PLFA。| 植物类型 Plant types | 植物基本特征 Gymnosperm basic characteristics | 土壤理化性质 Soil samples physicochemical property | ||||
| 高度 Height (m) | 胸径 DBH (cm) | 有机质 Organic matter (g/kg) | 含水量 Water content (%) | 土壤pH Soil pH | ||
| Ⅰ | 8.37 | 51.6 | 9.49 | 40.1 | 6.93 | |
| Ⅱ | 17.94 | 77.3 | 10.27 | 42.7 | 6.34 | |
| Ⅲ | 12.33 | 24.9 | 7.62 | 35.5 | 6.70 | |
数据统计分析与整理采用SPSS 15.0软件和Microsoft office excel 2003软件完成。
2 结果与分析 2.1 3种植物根际土壤可培养微生物数量分析3种裸子植物根际土壤微生物数量各有不同,可培养微生物数量分布与植物种类关系密切 (表 2)。3种植物均以细菌数量最多,且以红豆杉含量最高,为18.15×106 CFU/mL;云杉次之,为14.27×106 CFU/mL;日本落叶松最低且与二者间有显著差异。土壤真菌数量以云杉最丰,为 9.40×105 CFU/mL,与红豆杉无显著差异。放线菌数量以红豆杉最丰,云杉次之,但二者间没有显著差异,微生物总数红豆杉与云杉分别为25.67×106 CFU/mL和21.37×106 CFU/mL,日本落叶松最低,为5.31×106 CFU/mL,与红豆杉及云杉间有显著差异。
| 植物种类 Plant types | 细菌 Bacteria (×106 CFU/mL) | 真菌 Fungi (×105 CFU/mL) | 放线菌 Actinomycetes (×105 CFU/mL) | 微生物总数 Total microorganism (×106 CFU/mL) |
| Ⅰ | 18.15a | 8.43a | 66.74a | 25.67a |
| Ⅱ | 14.27b | 9.40a | 61.57a | 21.37a |
| Ⅲ | 3.80c | 6.71b | 8.39b | 5.31b |
| 注:同列小写字母代表 0.05水平的差异显著(Duncan法). 下同 | ||||
| Note: Different letters in the same column mean significant at the 0.05 level. The same below. | ||||
对3种裸子植物根际土壤细菌、真菌和放线菌PLFA含量变化分析表明(表 3),以红豆杉根际土壤总PLFA种类为最丰、云杉次之,日本落叶松最低,与二者间有显著差异,3种植物的细菌和真菌PLFA含量与总PLFA量变化总趋势相似,放线菌PLFA量与总PLFA变化规律差别较大,以红豆杉最高,红豆杉次之,日本落叶松最低,且三者间有显著差异。革兰氏阳性菌与革兰氏阴性菌均比值以日本落叶松最高,且与红豆杉及云杉间有显著差异,真菌与细菌比值以云杉最高,红豆杉次之,二者间无显著差异,日本落叶松则最低。
| 微生物PLFA特征 PLFA characters of different microbial | 植物种类Plant types | ||
| Ⅰ | Ⅱ | Ⅲ | |
| 总PLFA含量 Total PLFA | 16.42±1.07a | 13.99±0.48a | 7.791±0.87b |
| 细菌 Bacteria | 7.247±1.02a | 6.513±0.68a | 4.652±0.13b |
| 真菌 Fungi | 4.872±0.35a | 5.489±0.57a | 1.782±0.62b |
| 放线菌 Actinomyces | 4.303±0.24a | 1.988±0.63b | 1.057±0.02c |
| 革兰氏阳性菌 Total Gram+ | 3.695±0.16a | 3.620±0.47a | 2.751±0.24b |
| 革兰氏阴性菌 Total Gram- | 3.552±0.26a | 2.892±0.35a | 1.901±0.11b |
| 革兰氏阳性菌比革兰氏阴性菌 Gram+/Gram- | 1.042b | 1.252b | 1.447a |
| 真菌比细菌 Fungi/Bacteria | 0.672a | 0.843a | 0.383b |
| 注:数据为3个重复的平均值±标准差,同行中不同字母表示差异显著(p<0.05). | |||
| Note: Data are means ± standard deviation of triplicate. Different letters within rows indicate means are significantly different (p<0.05). | |||
对3种裸子植物根际土壤中占总PLFA含量0.5%以上的15种标记成分分析表明(图 1),含量较高的脂肪酸为18:1ω9c、16:1ω7c、10Me16:0、16:00、i16:0和i15:0,占3种植物脂肪酸总量的40%以上,其中3种脂肪酸16:1ω7c、10Me16:0和i16:0占红豆杉土壤总脂肪酸的6%以上,10Me16:0、i16:0和16:00占云杉总脂肪酸的8%以上,i16:0、16:00和i15:0占日本落叶松总脂肪酸的9%以上。3种植物中含量最高的前5种PLFA生物标记物各不相同,且含量也存在着明显的差异,并呈现不同的变化趋势。

|
| 图 1 3种裸子植物根际土壤微生物PLFA标记物含量分析(%) Figure 1 PLFA biomarkers analysis of microbial in three gymnosperm of rhizosphere soils (%) 注:A、B、C:红豆杉、云杉和日本落叶松,下图同. Note: A,B and C: Taxus chinensis (Pilg) Rehder.,Picea asperata Mast and Larix kaempferi (Lamb) Carriere.. the same below. |
|
|
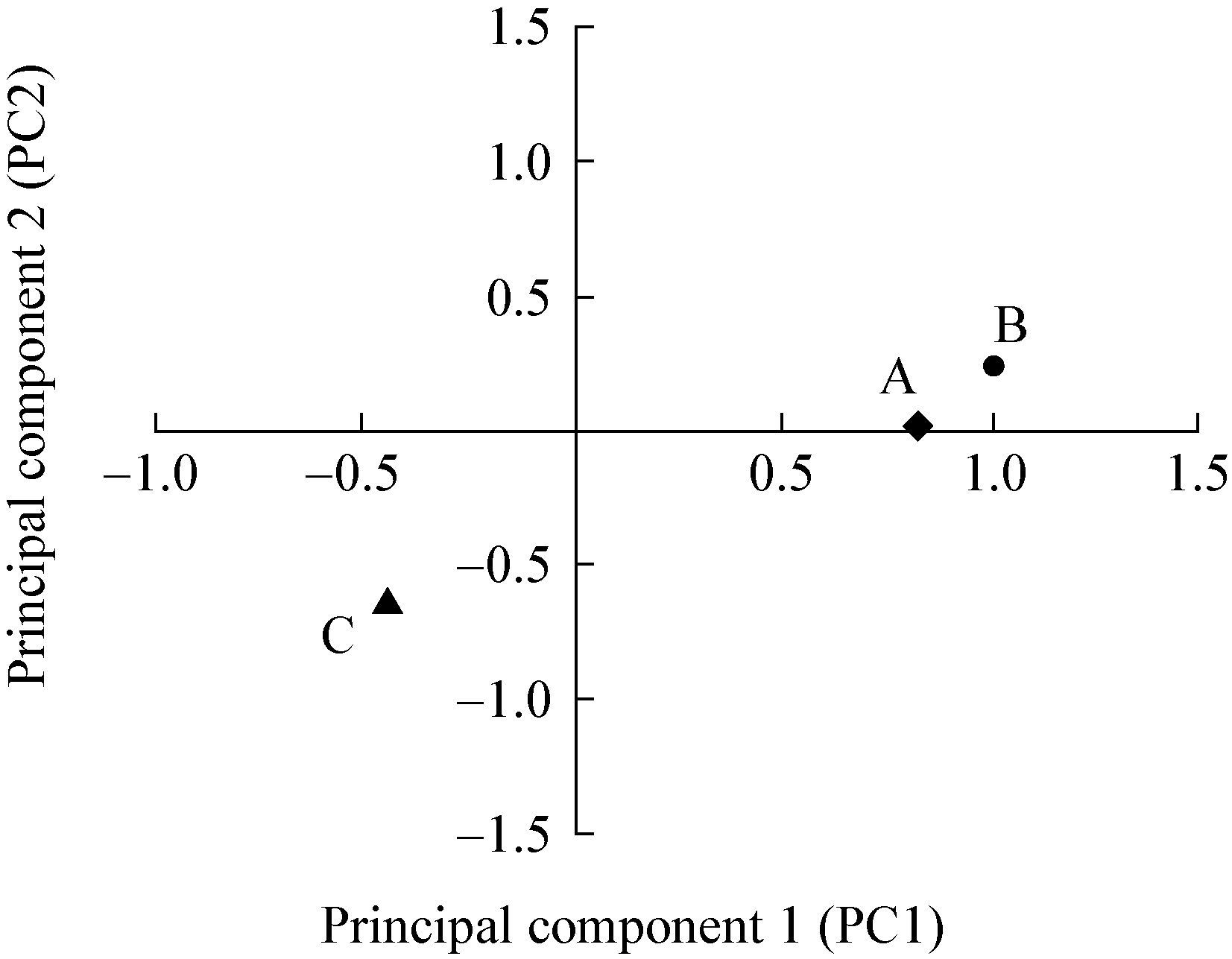
对3种裸子植物根际土壤微生物群落PLFA主成分分析表明,与土壤微生物PLFA生物标记多样性相关的主成分1、2分别解释变量方差的55.47%与34.69% (图 2)。进一步分析发现,红豆杉位于主成分1的正端和主成分2的正端,云杉位于主成分1的正端和主成分2的正、负端交叉点,日本落叶松位于主成分1的负端和主成分2的负端。土壤微生物群落结构可以分成2种类型,红豆杉与云杉具有相似的微生物群落结构,日本落叶松则与前者有明显差异。因此,主成分分析再次证明外来种日本落叶松对土壤微生物的影响强于土著种红豆杉与云杉。
|
| 图 2 3种裸子植物根际土壤微生物脂肪酸主成分分析 Figure 2 Principal component analysis of microbial PLFA in three gymnosperm of rhizosphere soils |
|
|
将3种裸子植物根际土壤可培养微生物数量与PLFA含量特征相结合进行多样性分析显示(表 4),Simpson指数和Shannon-Wiener指数等多样性指数值体现了良好的一致性,均以红豆杉根际土壤微生物多样性指数为最高,云杉次之,日本落叶松为最低,且与前两者间有显著差异,说明外来种日本落叶松根际土壤微生物种群发生了较大的变化,已经改变了本地土壤微生物的结构与特征。
| 土壤类型 Soil types | Simpson (J) | Shannon-Wiener (H) | 均匀度 evenness | Brillouin | McIntosh (Dmc) |
| Ⅰ | 0.79a | 1.42a | 0.73a | 3.35a | 0.76a |
| Ⅱ | 0.72a | 1.37ab | 0.70a | 3.27a | 0.71ab |
| Ⅲ | 0.62b | 1.28b | 0.66b | 3.02b | 0.67b |
| 注:同列不同字母表示差异显著,P<0.05. | |||||
| Note: Different letters in the same column mean significant at the 0.05 level. | |||||
多种研究方法相结合是土壤微生物多样性研究中常用的措施,实验采用传统平板计数法与磷脂脂肪酸图谱(PLFA)法研究了麦积山景区3种典型裸子植物根际土壤微生物的数量分布与群落结构特征。传统平板计数法与PLFA分析法同时显示不同植物之间根际土壤微生物数目、种类及多样性指数间均存在一定的差异,此结果与郑华、张于光、安韶山等的研究结果相一致[14-16]。植物产生的根分泌物是微生物重要的能量物质,能在根系周围营造特殊的根际微生态环境,影响微生物的种类和繁殖,进而影响微生物群落结构和功能及其多样性[17-18]。本研究中3种植物的PLFA图谱组成各不相同,红豆杉与云杉磷酸脂肪酸种类数目相似,而日本落叶松明显减少,同时日本落叶松根际微生物群落组成也发生了明显变化,多样性降低,且cy17:0、i17:0、i15:0等几种脂肪酸变化明显。
与土著种不同,进入新环境的外来种具有比土著种更强的竞争力,赵溪竹等将长白落叶松、兴安落叶松与外来种日本落叶松幼苗光合作用特性进行了比较,结果显示日本落叶松对强光利用能力最强,且不易发生光抑制[19]。牛小云、陈立新等的研究表明,日本落叶松林下枯落物积累多、分解慢,加速了地力的衰退,且近熟林阶段林分郁闭度大,林下植物很难存活[20-21]。本研究中将濒危土著种红豆杉、建群土著种云杉及外来种日本落叶松根际土壤微生物群落结构组成进行分析对比发现,日本落叶松根际土壤微生物组成发生了明显的变化,多样性降低。因此对于麦积山景区,缺乏科学依据的外来种引入及大面积日本落叶松速生林的建植是否会影响景区生物多样性的保护及珍稀植物的生存,还需更进一步的深入研究。
| [1] | Wu GH, Jiang CY. Comprehensive Physical Regionalization in Gansu Province[M]. Lanzhou: Gansu Science and Technology Press, 1998: 28 -48. (in chinese) 伍光和, 江存远. 甘肃省综合自然区划[M]. 兰州: 甘肃科学技术出版社, 1998: 28 -48. |
| [2] | Zhao QS. Malysis on changes of forest resources in Tianshui[J]. Journal of Gansu Forestry Science and Technology , 2001, 26 (1) : 16–21. (in chinese) 赵前生. 天水市国有林区森林资源变化分析[J]. 甘肃林业科技 , 2001, 26 (1) : 16–21. |
| [3] | Fu ZJ, Zhang XY, Liu SY, et al. The summarize of research on the flora and vegetation of the Qinling mountain range[J]. Journal of Southern Agriculture , 1996, 16 (5) : 93–106. (in chinese) 傅志军, 张行勇, 刘顺义, 等. 秦岭植物区系和植被研究概述[J]. 西北植物学报 , 1996, 16 (5) : 93–106. |
| [4] | Mao ZJ, Zhao XZ, Liu LX, et al. Photosynthetic physiological characteristics in response to elevated CO2 concentration of three Larch (Larix) species seedlings[J]. Acta Ecologica Sinica , 2010, 30 (2) : 317–323. (in chinese) 毛子军, 赵溪竹, 刘林馨, 等. 3种落叶松幼苗对CO2升高的光合生理响应[J]. 生态学报 , 2010, 30 (2) : 317–323. |
| [5] | Yang X, Cao J, Dong MX, et al. Effects of exotic Larix kaempferi on forest soil quality and bacterial diversity[J]. Chinese Journal of Applied Ecology , 2008, 19 (10) : 2109–2116. (in chinese) 杨鑫, 曹靖, 董茂星, 等. 外来树种日本落叶松对森林土壤质量及细菌多样性的影响[J]. 应用生态学报 , 2008, 19 (10) : 2109–2116. |
| [6] | Yu XJ, Yu D, Lu ZJ, et al. A new mechanism of invader success: Exotic plant inhibits natural vegetation restoration by changing soil microbe community[J]. Chinese Science Bulletin , 2005, 50 (9) : 896–903. (in chinese) 于兴军, 于丹, 卢志军, 等. 一个可能的植物入侵机制: 入侵种通过改变入侵地土壤微生物群落影响本地种的生长[J]. 科学通报 , 2005, 50 (9) : 896–903. DOI:10.1007/BF02897384 |
| [7] | Che YL, Wang H, Hu HY, et al. Research progresses on analytical technologies used in microbial community structure and diversity[J]. Ecology and Environment , 2005, 14 (1) : 127–133. (in chinese) 车玉伶, 王慧, 胡洪营, 等. 微生物群落结构和多样性解析技术研究进展[J]. 生态环境 , 2005, 14 (1) : 127–133. |
| [8] | Yao HY, Huang CY. Soil Microbial Ecology and Their Experimental Techniques[M]. Beijing: Science Press, 2007: 186 -189. (in chinese) 姚槐应, 黄昌勇. 土壤微生物生态学及其实验技术[M]. 北京: 科学出版社, 2007: 186 -189. |
| [9] | Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review[J]. Biology and Fertility of Soils , 1999, 29 (2) : 111–129. DOI:10.1007/s003740050533 |
| [10] | Bai Z, Zhang M, Yan Y, et al. Effect of long-term fertilization of nitrogen, phosphorus and organic fertilizer on PLFA in Chinese arable mollisol[J]. Journal of Zhejiang University (Agriculture and Life Science Edition) , 2008, 34 (1) : 73–80. (in chinese) 白震, 张明, 闫颖, 等. 长期施用氮、磷及有机肥对农田黑土 PLFA 的影响[J]. 浙江大学学报: 农业与生命科学版 , 2008, 34 (1) : 73–80. |
| [11] | Qi HY, Xue K, Zhang HX. Phospholipid fatty acid analysis and its applications in microbial ecology[J]. Acta Ecologica Sinica , 2003, 23 (8) : 1576–1582. (in chinese) 齐鸿雁, 薛凯, 张洪勋. 磷脂脂肪酸谱图分析方法及其在微生物生态学领域的应用[J]. 生态学报 , 2003, 23 (8) : 1576–1582. |
| [12] | Macnaughton SJ, O̕Donnell AG. Tuberculostearic acid as a means of estimating the recovery (using dispersion and differential centrifugation) of actinomycetes from soil[J]. Journal of Microbiological Methods , 1994, 20 (1) : 69–77. DOI:10.1016/0167-7012(94)90065-5 |
| [13] | Liu B, Hu GP, Zheng XF, et al. Analysis on microbial diversity in the rhizosphere of rice by phospholipid fatty acids biomarkers[J]. Chinese Journal of Rice Science , 2010, 24 (3) : 278–288. (in chinese) 刘波, 胡桂萍, 郑雪芳, 等. 利用磷脂脂肪酸(PLFAs)生物标记法分析水稻根际土壤微生物多样性[J]. 中国水稻科学 , 2010, 24 (3) : 278–288. |
| [14] | Zheng H, Ouyang ZY, Wang XK, et al. Effects of forest restoration patterns on soil microbial communities[J]. Chinese Journal of Applied Ecology , 2004, 15 (11) : 2019–2024. (in chinese) 郑华, 欧阳志云, 王效科, 等. 不同森林恢复类型对土壤微生物群落的影响[J]. 应用生态学报 , 2004, 15 (11) : 2019–2024. |
| [15] | Zhang YG, Wang HM, Li DQ, et al. The community and structure of nitrogen-fixing microorganism in Sanjiangyuan Natural Reserve[J]. Acta Microbiologica Sinica , 2005, 45 (3) : 420–425. (in chinese) 张于光, 王慧敏, 李迪强, 等. 三江源地区不同植被土壤固氮微生物的群落结构研究[J]. 微生物学报 , 2005, 45 (3) : 420–425. |
| [16] | An SS, Li GH, Chen LD. Soil microbial functional diversity between rhizosphere and non- rhizosphere of typical plants in the hilly area of southern Nixia[J]. Acta Ecologica Sinica , 2011, 31 (18) : 5225–5234. (in chinese) 安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性[J]. 生态学报 , 2011, 31 (18) : 5225–5234. |
| [17] | Kapoor R. Root exudation and its application on rhizosphere my coflora[J]. Advances in Microbial Biotechnology , 1999 : 351–362. |
| [18] | Bais HP, Park SW, Weir TL, et al. How plants communicate using the underground information super high way[J]. Trends of Plant Sciences , 2004, 9 (1) : 26–32. DOI:10.1016/j.tplants.2003.11.008 |
| [19] | Zhao XZ, Jiang HF, Mao ZJ. The studies of the photosynthetic characteristics of Larix olgensis herry., Larix kaempferi Carr. and Larix gmelinii Rupr. seedlings[J]. Bulletin of Botanical Research , 2007, 27 (3) : 361–366. (in chinese) 赵溪竹, 姜海凤, 毛子军. 长白落叶松、日本落叶松和兴安落叶松幼苗光合作用特性比较研究[J]. 植物研究 , 2007, 27 (3) : 361–366. |
| [20] | Niu XY, Sun XM, Chen DS, et al. Soil enzyme activities of the litter in Larix kaempferi plantation[J]. Scientia Silvae Sinicae , 2015, 51 (4) : 16–25. (in chinese) 牛小云, 孙晓梅, 陈东升, 等. 日本落叶松人工林枯落物土壤酶活性[J]. 林业科学 , 2015, 51 (4) : 16–25. |
| [21] | Chen LX, Xiao Y. Evolution and evaluation of soil fertility in forest land in Larix gmelinii plantations at different development stages in Daxinganling forest region[J]. Science of Soil and Water Conservation , 2006, 4 (5) : 50–55. (in chinese) 陈立新, 肖洋. 大兴安岭林区落叶松林地不同发育阶段土壤肥力演变与评价[J]. 中国水土保持科学 , 2006, 4 (5) : 50–55. |
 2016, Vol. 43
2016, Vol. 43