扩展功能
文章信息
- 刘泽英, 吕永康, 刘玉香, 范晓军, 孙明星
- LIU Ze-Ying, LYU Yong-Kang, LIU Yu-Xiang, FAN Xiao-Jun, SUN Ming-Xing
- Acinetobacter sp. Y1的氨氮去除性能及其关键酶活性
- Ammonia nitrogen removal characteristic and its key enzymes activity of Acinetobacter sp. Y1
- 微生物学通报, 2016, 43(9): 1931-1938
- Microbiology China, 2016, 43(9): 1931-1938
- DOI: 10.13344/j.microbiol.china.150786
-
文章历史
- 收稿日期: 2015-10-15
- 接受日期: 2015-12-15
- 优先数字出版日期(www.cnki.net): 2016-01-04
2. 太原理工大学环境科学与工程学院 山西 太原 030024 ;
3. 太原理工大学化学化工学院 山西 太原 030024
2. College of Environmental Science and Engineering, Taiyuan University of Technology, Taiyuan, Shanxi 030024, China ;
3. College of Chemistry and Chemical Engineering, Taiyuan University of Technology, Taiyuan, Shanxi 030024, China
氮是造成环境污染和水体富营养化的重要污染物,控制含氮污水的排放越来越受到人们的重 视[1]。异养硝化细菌在利用有机碳源进行生长的同时将含氮化合物硝化生成羟胺、亚硝酸盐、硝酸盐等产物,多数还能同时进行好氧反硝化作用,直接将硝化产物转化为含氮气体,具有经济、高效、易操作等优点[2-3],成为目前最有前景的脱氮方法。
已经发现的异养硝化细菌种类繁多,例如Paracoccus versutus LYM[4]、Alcaligenes faecalis NR[5]、Klebsiella pneumoniae CF-S9[6]、Pseudomonas stutzeri YZN-001[7]和Bacillus methylotrophicus L7[8]等。但是,异养硝化细菌基质范围广泛,硝化和反硝化性能差异明显,氨氮(NH4+-N)去除机理较为复杂[5]。一种路径是NH4+-N在氨单加氧酶作用下被氧化为羟胺,然后由羟胺氧化还原酶(HAO)氧化为亚硝酸盐氮(NO2--N),而后NO2--N在亚硝酸盐还原酶(NIR)、硝酸盐还原酶(NAR)等的催化作用下还原为含氮气体[9-11];另一种路径是通过羟胺直接将NH4+-N氧化为含氮气体[4, 12]。因此,HAO、NIR、NAR是NH4+-N去除过程中的3个关键酶,且两种路径之间的根本区别是HAO催化的羟胺转化途径不同,所以,在异养硝化细菌代谢过程中,HAO占据核心地位[13-14]。HAO是周质蛋白,可以通过渗透压休克法释放。但由于超声波破碎法在实验室应用的普遍性,国内外学者对HAO提取主要采用超声波破碎法[5-6]。目前,异养硝化细菌的相关研究多数还是集中在菌株的筛选和生物学特性上,从酶学角度研究其NH4+-N去除性能的报道较少,NH4+-N去除相关的关键酶的提取和酶活性研究也鲜有报道。
Acinetobacter sp. Y1是从太原焦化污水处理厂活性污泥中筛选到的一株异养硝化菌,在中国普通微生物菌种保藏中心保藏登记号为CGMCC6563。本文研究了菌株Y1的NH4+-N去除性能,采用正交实验优化超声波破碎法提取粗酶的条件,SDS-PAGE分析比较渗透压休克法和超声波破碎法获得的粗酶,检测关键酶HAO、NIR、NAR的酶活性,为从酶学角度深入了解异养硝化细菌的NH4+-N去除性能提供参考。
1 材料与方法 1.1 材料菌株Acinetobacter sp. Y1与甘油混合,冷冻保存在-80 ℃。
硝化培养基(g/L):柠檬酸钠4.902,(NH4)2SO4 0.472,NaCl 0.12,K2HPO4 0.20,MgSO4·7H2O 0.05,MnSO4·4H2O 0.01,FeSO4 0.01,pH 7.0,C/N 14,0.1 MPa灭菌30 min。
1.2 方法 1.2.1 氨氮去除: 性能:将1 mL处于对数生长期的菌株Y1接种到装有100 mL培养基的250 mL锥形瓶中。30 ℃、120 r/min摇床培养,定时取样,测定相应的菌密度(OD600)、NH4+-N、羟胺、NO2--N、硝酸盐氮(NO3--N)、总氮(TN)和COD值。结果取 3个重复实验平均值。 1.2.2 气体检测: 将1 mL处于对数生长期的菌株Y1接种到装有100 mL培养基的250 mL锥形瓶中。没有接种菌株Y1的一组作为对照。0.6 MPa下连续充纯氧5-6 min后,用橡胶塞将锥形瓶口封住,再用封口胶将瓶口密封好。30 ℃、120 r/min摇床培养,每隔6 h取样,培养至48 h。用气相色谱(SP-2100,Beifen-Ruili China)测定N2含量。 1.2.3 超声波破碎: 将1 mL处于对数生长期的菌株Y1接种到装有100 mL培养基的250 mL锥形瓶中,30 ℃、120 r/min摇床培养16 h。将菌液4 ℃、10 000 r/min离心20 min,弃上清收集菌体。用 0.01 mol/L pH 7.4的磷酸盐缓冲液洗3次,重悬菌体于离心管中,用超声波细胞粉碎机破碎,工作条件按单因素和正交试验表进行。超声波破碎后,将破碎液4 ℃、14 000 r/min离心20 min,上清即为粗酶液。用考马斯亮蓝法测定粗酶液在595 nm下的吸光度,以此表征细胞破碎的效果。结果取3个重复实验平均值。 1.2.4 渗透压休克法: 将培养好的菌液4 ℃、 10 000 r/min离心20 min,弃上清收集菌体。用去离子水洗3次,重悬菌体于含0.5 mol/L蔗糖和 1.3 mmol/L EDTA二钠盐的Tris-HCl缓冲液 (20 mmol/L,pH 8.0)中,室温下轻轻振荡15 min后4 ℃、10 000 r/min离心20 min,弃上清;将菌体重悬于Tris-HCl缓冲液(20 mmol/L,pH 8.0),室温下轻轻振荡15 min,4 ℃、14 000 r/min离心20 min取上清。 1.2.5 HAO、NIR、NAR酶活性测试: HAO测定的体系包括0.050 mmol/L Tris-HCl (pH 7.4),0.001 mmol/L K3[Fe(CN)6],0.004 mmol/L EDTA,酶液,加入羟胺开始反应,30 ℃孵育15 min,根据反应体系中羟胺的减少量测定HAO的活性[15]。NIR、NAR酶测定体系包括10 mmol/L磷酸盐缓冲溶液(pH 7.4),0.200 mmol/L NADH,酶液,分别加入亚硝酸钠、硝酸钠开始反应,30 ℃孵育15 min,根据反应前后亚硝酸钠、硝酸钠的减少量分别测定NIR、NAR的活性[16]。 蛋白浓度的测定用Bradford Protein Assay Kit (Sangon,China)。一个酶活单位(U)定义为每分钟催化1 μmol反应物所需的酶量。酶比活力(U/mg)定义为每毫克蛋白所具有的酶活力单位。 1.2.6 分析方法: 菌密度(OD600)采用可见分光光度计测定;氨氮采用纳氏试剂光度法;羟胺用8-羟基喹啉光度法;亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法;硝氮采用酚二磺酸光度法;总氮采用碱性过硫酸钾消解紫外分光光度法;COD采用消解比色法;粗酶溶出量采用考马斯亮蓝染色法;N2由气相色谱测定[17-18]。 2 结果与讨论 2.1 菌株的氨氮去除性能如图 1所示,菌株Y1生长的迟缓期较短,4 h后进入对数生长期,4-12 h时生长速度最快,最大生长速率(μmax)达到0.11 h-1,24 h时基本进入稳定期,OD600可达1.280。12 h时,97%的NH4+-N被去除,相应的硝化速率达到7.83 mg/(L·h),24 h时,NH4+-N降解率达到98%以上。Acinetobacter sp. HA2[19]、Klebsiella pneumoniae CF-S9[6]、Rhodococcus sp. CPZ24[20]的硝化速率分别为3.03、4.3、3.4 mg/(L·h),均低于菌株Y1的降解速率。定性实验检测到NH4+-N去除过程中有N2产生,36 h时达到稳定值,约为53.74%。硝化过程中,培养基中羟胺、NO2--N、NO3--N都没有积累,可能是NH4+-N去除过程中没有生成这3种中间代谢物,也可能是生成后在HAO、NIR和NAR的催化作用下迅速进入下一步转化。

|
| 图 1 菌株Y1的生长、NH4+-N和TN去除性能 Figure 1 The growth,NH4+-N and TN removal characteristics of strain Y1 |
|
|
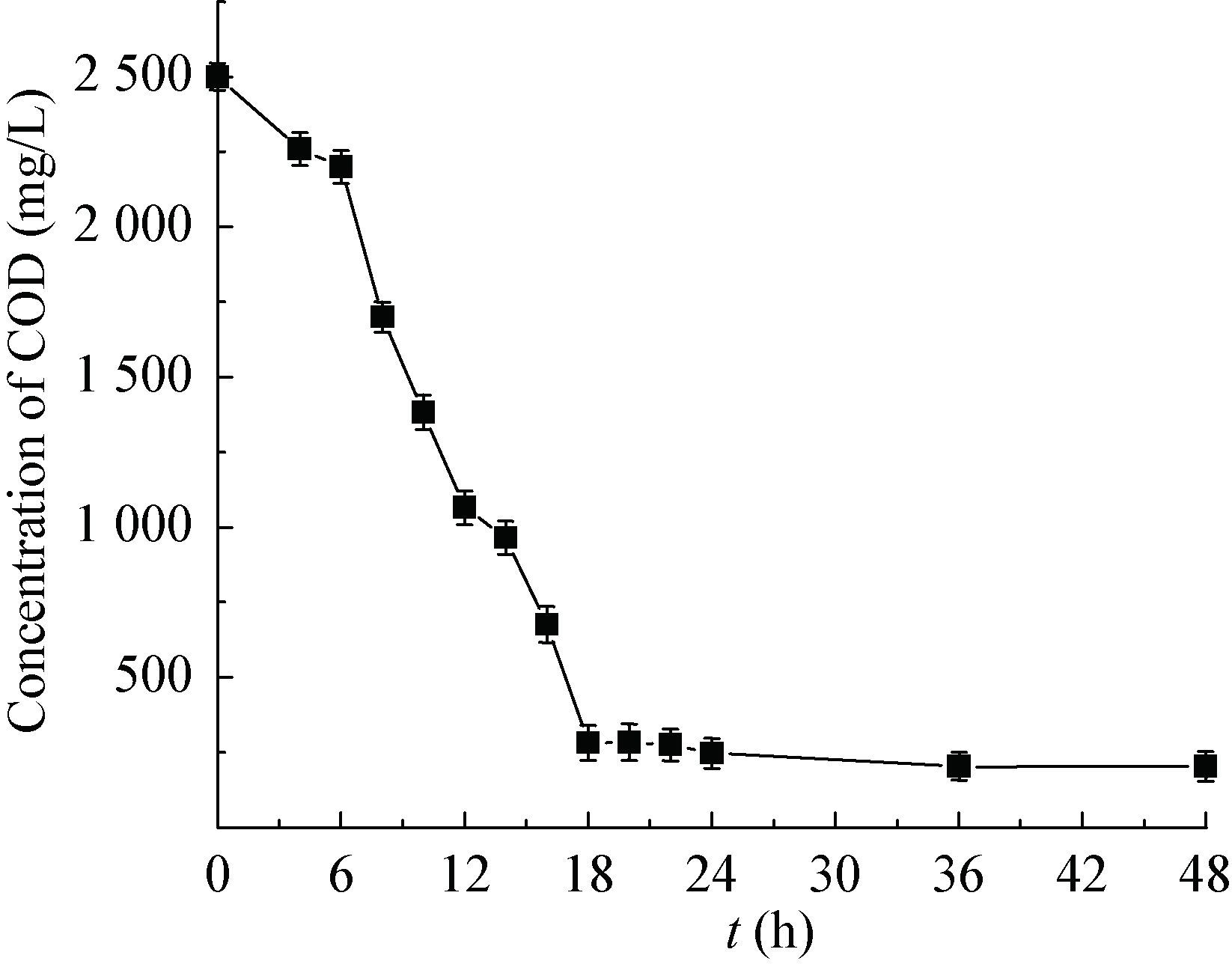
如图 1、2所示,在菌株Y1的作用下,TN、COD快速降低,24 h时,TN、COD的降解率分别达到94%、92%。证明菌株Y1不仅具有良好的NH4+-N、TN去除性能,也能高效分解有机物,可以充分地利用有机碳源生长并合成生命体,具有异养微生物的特性。相比之下,Bacillus sp. LY和Brevibacillus sp. LY对TN的降解率分别为69.12%和35.16%,对COD的降解率分别为71.7%和52.16%[21],远低于菌株Y1的性能。
|
| 图 2 菌株Y1的COD去除性能 Figure 2 The COD removal characteristic of strain Y1 |
|
|

|
| 图 3 粗酶溶出量与超声波破碎功率(A)、工作与间歇时间(B)、OD600 (C)、总工作时间(D)的关系 Figure 3 Relationship between A595 and ultrasonic power (A),work/interval time (B),OD600 (C),total work time (D) 注:A:工作与间歇时间分别为4 s和7 s,OD600=1.250,总工作时间20 min;B:超声波破碎功率50 W,间歇时间7 s,< italic>OD600=1.250,总工作时间20 min;C:超声波破碎功率50 W,工作与间歇时间分别为4 s和7 s,总工作时间20 min;D:超声波破碎功率50 W ,工作与间歇时间分别为4 s和7 s,OD600=1.250. Note: A: Work/interval time 4/7 s,OD600=1.250,total work time 20 min; B: Ultrasonic power 50 W,interval time 7 s,OD600=1.250,total work time 20 min; C: Ultrasonic power 50 W,work/interval time 4/7 s,total work time 20 min; D: Ultrasonic power 50 W,work/interval time 4/7 s,OD600=1.250. |
|
|
| 水平 Levels | 因素 Factors | |||
| A功率 Ultrasonic power (W) | B工作与间歇时间 Work/interval time (s) | C菌液密度 OD600 | D总工作时间 Total work time (min) | |
| 1 | 37 | 3/7 | 1.027 | 15 |
| 2 | 50 | 4/7 | 1.250 | 20 |
| 3 | 62 | 5/7 | 1.665 | 25 |
| 实验 Tests | A功率 Ultrasonic power (W) | B工作与间歇时间 Work/interval time (s) | C菌液密度 OD600 | D总工作时间 Total work time (min) | A595 |
| 1 | 1 | 1 | 1 | 1 | 0.346 |
| 2 | 1 | 2 | 2 | 2 | 0.869 |
| 3 | 1 | 3 | 3 | 3 | 0.688 |
| 4 | 2 | 1 | 2 | 3 | 0.922 |
| 5 | 2 | 2 | 3 | 1 | 0.665 |
| 6 | 2 | 3 | 1 | 2 | 0.597 |
| 7 | 3 | 1 | 3 | 2 | 0.801 |
| 8 | 3 | 2 | 1 | 3 | 0.567 |
| 9 | 3 | 3 | 2 | 1 | 0.703 |
| T1 | 1.903 | 2.069 | 1.510 | 1.714 | |
| T2 | 2.184 | 2.101 | 2.494 | 2.267 | |
| T3 | 2.071 | 1.988 | 2.154 | 2.177 | |
| R | 0.281 | 0.113 | 0.984 | 0.553 |

|
| 图 4 HAO两种不同提取方法的SDS-PAGE分析 Figure 4 SDS-PAGE analysis of two different extraction methods 注:M:蛋白Marker;1:渗透压休克法;2:超声波破碎法. Note: M: protein marker; 1: osmotic shock method; 2: ultrasonic crushing method. |
|
|
根据正交实验得出的最佳工作条件对菌株Y1进行超声波破碎获得粗酶液,检测关键酶HAO、NIR和NAR酶活性,结果如表 3所示。菌株Y1的HAO酶活力为0.033 U/mL,比活力为0.011 U/mg。本实验与其他文献中报道的HAO比活力具有相当的可比性,Alcaligenes faecalis NR[5]、Acinetobacter calcoaceticusHNR[24]、Klebsiella pneumoniae CF-S9[6]的HAO酶比活力与菌株Y1为一个数量级,分别为0.016、0.051和0.011 U/mg。而Agrobacteriumsp. LAD9、Achromobactersp. GAD3、Comamonas sp. GAD4的HAO相对酶活力仅为0.94×10-4、0.31×10-4和0.178×10-3 U/mg[28]。渗透压休克法得到的HAO酶活力为0.212 U/mL,比活力为0.067 U/mg,均高于超声波破碎法得到的HAO。因此渗透压休克法比超声波破碎法得到的粗酶液中HAO酶含量高,杂蛋白含量低,更有利于HAO的提取和进一步的分离纯化。
| 酶 Enzyme | 酶活 Enzyme activity (U/mL) | 比活力 Specific activity (U/mg) |
| HAO1 | 0.212 | 0.067 |
| HAO2 | 0.033 | 0.011 |
| NIR | 0.006 | 0.002 |
| NAR | 0.054 | 0.018 |
| 注:HAO1:渗透压休克法得到的HAO;HAO2:超声波破碎法得到的HAO. | ||
| Note: HAO1: HAO obtained from osmotic shock method; HAO2: HAO obtained from ultrasonic crushing method. | ||
NIR、NAR的酶活力和比活力分别为0.006、 0.054 U/mL和0.002、0.018 U/mg。Klebsiella pneumoniae CF-S9[6]的NIR、NAR比活力分别为0.018、0.007 U/mg。Providencia rettgeri YL[14]的NIR、NAR比活力分别为0.041、0.031 U/mg。
酶活性测试结果显示,在NH4+-N去除过程中,HAO、NIR、NAR都有一定量的表达。即NH4+-N去除过程中的代谢产物(羟胺、NO2--N、NO3--N)在HAO、NIR、NAR的催化作用下得到进一步转化。HAO酶活性较高,但NO2--N在培养基中没有积累,可能是有一部分羟胺在HAO作用下直接还原为N2[4]。
3 结论(1) Acinetobacter sp. Y1在柠檬酸钠为碳源、硫酸铵为氮源的条件下生长24 h,OD600可达1.280,对氨氮、总氮、COD的降解率分别高达98%、94%、92%,硝化过程羟胺、NO2--N、NO3--N不积累,反硝化产生N2。
(2) 超声波破碎法对HAO、NIR、NAR进行粗酶提取的最佳工作条件为:OD600=1.250,总工作时间20 min,破碎功率50 W,工作与间歇时间分别为4 s和7 s。
(3) 超声波破碎法得到的HAO、NIR、NAR的比活力分别为0.011、0.002、0.018 U/mg。渗透压休克法得到的HAO比活力为0.067 U/mg,更适合用来提取HAO。
| [1] | Yang Q, Li XM, Zeng GM, et al. Study progress on mechanism for simultaneous nitrification and denitrification[J]. Microbiology China , 2003, 30 (4) : 88–91. (in chinese) 杨麒, 李小明, 曾光明, 等. 同步硝化反硝化机理的研究进展[J]. 微生物学通报 , 2003, 30 (4) : 88–91. |
| [2] | Joo HS, Hirai M, Shoda M. Piggery wastewater treatment using Alcaligenes faecalis strain No.4 with heterotrophic nitrification and aerobic denitrification[J]. Water Research , 2006, 40 (16) : 3029–3036. DOI:10.1016/j.watres.2006.06.021 |
| [3] | Marazioti C, Kornaros M, Lyberatos G. Kinetic modeling of a mixed culture of Pseudomonas denitrificans and Bacillus subtilis under aerobic and anoxic operating conditions[J]. Water Research , 2003, 37 (6) : 1239–1251. DOI:10.1016/S0043-1354(02)00463-3 |
| [4] | Shi Z, Zhang Y, Zhou JT, et al. Biological removal of nitrate and ammonium under aerobic atmosphere by Paracoccus versutus LYM[J]. Bioresource Technology , 2013, 148 : 144–148. DOI:10.1016/j.biortech.2013.08.052 |
| [5] | Zhao B, An Q, He YL, et al. N2O and N2 production during heterotrophic nitrification by Alcaligenes faecalis strain NR[J]. Bioresource Technology , 2012, 116 : 379–385. DOI:10.1016/j.biortech.2012.03.113 |
| [6] | Padhi SK, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation , 2013, 78 : 67–73. |
| [7] | Zhang JB, Wu PX, Hao B, et al. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001[J]. Bioresource Technology , 2011, 102 (21) : 9866–9869. DOI:10.1016/j.biortech.2011.07.118 |
| [8] | Zhang QL, Liu Y, Ai GM, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology , 2012, 108 : 35–44. DOI:10.1016/j.biortech.2011.12.139 |
| [9] | Kim JK, Park KJ, Cho KS, et al. Aerobic nitrification-denitrification by heterotrophic Bacillus strains[J]. Bioresource Technology , 2005, 96 (17) : 1897–1906. DOI:10.1016/j.biortech.2005.01.040 |
| [10] | Khardenavis AA, Kapley A, Purohit HJ. Simultaneous nitrification and denitrification by diverse Diaphorobacter sp[J]. Applied Microbiology and Biotechnology , 2007, 77 (2) : 403–409. DOI:10.1007/s00253-007-1176-5 |
| [11] | Wan CL, Yang X, Lee DJ, et al. Aerobic denitrification by novel isolated strain using NO2--N as nitrogen source[J]. Bioresource Technology , 2011, 102 (15) : 7244–7248. DOI:10.1016/j.biortech.2011.04.101 |
| [12] | Joo HS, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4[J]. Journal of Bioscience and Bioengineering , 2005, 100 (2) : 184–191. DOI:10.1263/jbb.100.184 |
| [13] | Wehrfritz JM, Reilly A, Spiro S, et al. Purification of hydroxylamine oxidase from Thiosphaera pantotropha. Identification of electron acceptors that couple heterotrophic nitrification to aerobic denitrification[J]. FEBS Letters , 1993, 335 (2) : 346–250. |
| [14] | Chen Q, Ma T, Wang T. Separation and purification of hydroxylamine oxidase from Agrobacterium tumefaciens LAD9[J]. Biotechnology Bulletin , 2014 (7) : 69–73. (in chinese) 陈倩, 马涛, 王婷. 异养硝化好氧反硝化菌株Agrobacterium tumefaciens LAD9羟胺氧化酶的分离纯化[J]. 生物技术通报 , 2014 (7) : 69–73. |
| [15] | Wang Y, Liu YX, An H, et al. Influence of metal ions on nitrogen removal and NO2−-N accumulation by Alcaligenes faecalis C16[J]. Microbiology China , 2014, 41 (11) : 2254–2263. (in chinese) 王瑶, 刘玉香, 安华, 等. 金属离子对粪产碱杆菌C16的脱氮和亚硝酸盐积累的影响[J]. 微生物学通报 , 2014, 41 (11) : 2254–2263. |
| [16] | Zhao B, He YL, Huang J, et al. Heterotrophic nitrogen removal by Providencia rettgeri strain YL[J]. Journal of Industrial Microbiology & Biotechnology , 2010, 37 (6) : 609–616. |
| [17] | Frear DS, Burrell RC. Spectrophotometric method for determining hydroxylamine reductase activity in higher plants[J]. Analytical Chemistry , 1955, 27 (10) : 1664–1665. DOI:10.1021/ac60106a054 |
| [18] | State Environmental Protection Administration, Editorial Board of Water and Exhausted Water Monitoring Analysis Method. Water and Exhausted Water Monitoring Analysis Method[M].4th edition. Beijing: China Environmental Science Press, 2002: 211 -285. (in chinese) 国家环境保护总局, 水和废水检测分析方法编委会. 水和废水监测分析方法[M].第4版. 北京: 中国环境科学出版社, 2002: 211 -285. |
| [19] | Yao S, Ni JR, Ma T, et al. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2[J]. Bioresource Technology , 2013, 139 : 80–86. DOI:10.1016/j.biortech.2013.03.189 |
| [20] | Chen PZ, Li J, Li QX, et al. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24[J]. Bioresource Technology , 2012, 116 : 266–270. DOI:10.1016/j.biortech.2012.02.050 |
| [21] | Lin Y, Kong HN, He YL, et al. Isolation and characterization of heterotrophic nitrifying bacteria[J]. Environmental Science , 2006, 27 (2) : 324–328. (in chinese) 林燕, 孔海南, 何义亮, 等. 异养硝化细菌的分离及其硝化特性实验研究[J]. 环境科学 , 2006, 27 (2) : 324–328. |
| [22] | An Q, Zhao B, He YL. Heterotrophic nitrification capability and its enzyme activity of Alcaligenes faecalis strain NR[J]. Journal of Shanghai Jiao Tong University (Natural Edition) , 2012, 46 (5) : 774–779. (in chinese) 安强, 赵彬, 何义亮. 异养硝化菌Alcaligenes faecalis strain NR的硝化性能及其酶活性[J]. 上海交通大学学报: 自然版 , 2012, 46 (5) : 774–779. |
| [23] | Shi RL, Wang LP, Liu YP. Conditions of ultrasonic wave disruption for recombination E. coli of alginate lyase[J]. Hunan Agricultural Sciences , 2010 (21) : 98–101. (in chinese) 石荣莲, 汪立平, 刘玉佩. 重组褐藻胶裂解酶基因工程菌超声波破碎条件研究[J]. 湖南农业科学 , 2010 (21) : 98–101. |
| [24] | Zhao B, He YL, Hughes J, et al. Heterotrophic nitrogen removal by a newly isolated Acinetobacter calcoaceticus HNR[J]. Bioresource Technology , 2010, 101 (14) : 5194–5200. DOI:10.1016/j.biortech.2010.02.043 |
| [25] | Chen Z, Jia HY, Yan QJ, et al. Optimization of fermentation conditions of recombinant β-xylosidase extracellularly expressed in E. coli[J]. Microbiology China , 2013, 40 (2) : 212–219. (in chinese) 陈洲, 贾会勇, 闫巧娟, 等. 重组大肠杆菌高效分泌表达β-木糖苷酶发酵条件的优化[J]. 微生物学通报 , 2013, 40 (2) : 212–219. |
| [26] | Malik A, Jenzsch M, Lübbert A, et al. Periplasmic production of native human proinsulin as a fusion to E. coli ecotin[J]. Protein Expression and Purification , 2007, 55 (1) : 100–111. DOI:10.1016/j.pep.2007.04.006 |
| [27] | Ramanan RN, Tan JS, Mohamed MS, et al. Optimization of osmotic shock process variables for enhancement of the release of periplasmic interferon-α2b from Escherichia coli using response surface method[J]. Process Biochemistry , 2010, 45 (2) : 196–202. DOI:10.1016/j.procbio.2009.09.007 |
| [28] | Chen Q, Ni JR. Heterotrophic nitrification-aerobic denitrification by novel isolated bacteria[J]. Journal of Industrial Microbiology & Biotechnology , 2011, 38 (9) : 1305–1310. |
 2016, Vol. 43
2016, Vol. 43