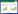扩展功能
文章信息
- 彭晓茜, 王娓
- PENG Xiao-Qian, WANG Wei
- 内蒙古温带草原土壤微生物生物量碳的空间分布及驱动因素
- Spatial pattern of soil microbial biomass carbon and its driver in temperate grasslands of Inner Mongolia
- 微生物学通报, 2016, 43(9): 1918-1930
- Microbiology China, 2016, 43(9): 1918-1930
- DOI: 10.13344/j.microbiol.china.160123
-
文章历史
- 收稿日期: 2016-01-31
- 接受日期: 2016-04-01
- 优先数字出版日期(www.cnki.net): 2016-05-04
土壤微生物在陆地生态系统中扮演着重要角色,在碳循环、养分循环[1-3]、调节和维持植物多样性[4-5]等方面具有重要作用。作为生态系统的重要分解者[6],土壤微生物直接参与土壤中有机质矿化、腐殖质形成、土壤养分转化与循环等过程[7-8]。其中,土壤微生物量碳是植物营养物质的源和库,虽只占土壤有机碳库的小部分,但在一定程度上影响着植物的营养、土壤有机质和养分转化与循环,代表着土壤养分的活性部分,反映了土壤的肥力状况[8]。此外,土壤微生物量碳对环境变化非常敏感,能够作为生态系统的功能变化、土壤质量及有机质变化的早期预测指标[9]。
以往的研究表明,土壤微生物量碳的垂直分布呈现一定的规律,随着土壤深度的增加显著减少[10-11]。土壤养分[12]、pH[13]、温度[14]、含水量[14-15]等环境因子均会影响土壤微生物量碳。土壤环境随着土壤深度的增加而发生改变,土壤微生物对生物化学循环的影响遍及整个土壤剖面[16]。然而,以往关于环境因子对土壤微生物量碳的研究主要集中在有机质丰富的表层土壤,深层土壤环境对微生物量碳的影响程度是否与表层土壤一致尚不清楚[17]。
早期对土壤微生物量碳的研究主要集中在农田土壤肥力领域。随着全球气候变暖,碳循环越来越受到广泛关注,土壤微生物量碳的研究也逐渐扩展到森林、湿地和草地生态系统等领域[18]。内蒙古是我国温带草原的主要分布区,草原面积约占全区总面积的67%,占全国草地面积的22%[19]。内蒙古温带草原大部分位于生态脆弱带上,生态地理位置特殊,对气候和环境的变化非常敏感。不同的草地类型也会对土壤微生物产生不同的生态效应。因此,探讨温带草原土壤微生物量碳的空间分布以及驱动因子,为预测我国北方温带草原土壤微生物对全球气候变化的响应、草原土壤养分状况和健康状态的评价以及草原生态环境的修复和治理均具有重要意义。然而,对于我国温带草原土壤微生物量碳的空间分布还缺乏系统的研究。
本文在统一的采样时间和实验方法的前提下,探讨内蒙古地区不同草地类型和不同土壤深度微生物量碳的变化情况及驱动因子。我们提出以下科学假设:(1) 由于草甸草原具备较好的水分条件,生物多样性最高,而荒漠草原降水最少,生物多样性最低,微生物量碳呈现出草甸草原最高、荒漠草原最低的分布格局;(2) 随着土壤深度的增加,土壤环境趋于稳定,环境因子对微生物量碳的影响随之减弱。
1 材料与方法 1.1 研究区域概况研究区域位于内蒙古自治区境内,该区域属于温带大陆性季风气候,年均温(MAT)范围为-1.9-7.5 ℃,年降水(MAP)范围为198-433 mm。自东向西,气候由湿润、半湿润过渡到半干旱、干旱,MAT逐渐增加,MAP逐渐减小。草甸草原主要分布于内蒙古自治区的东部地区,物种丰富度最高,其优势种为贝加尔针茅(Stipa baicalensis)、羊草(Leymus chinensis)等;典型草原主要分布于中部地区,物种丰富度居中,主要建群种有大针茅(Stipa grandis)、克氏针茅(Stipa kirylovii)、冷蒿(Artemisia frigida),伴生种由旱生杂草、灌木及半灌木组成;荒漠草原主要分布于内蒙古自治区的中西部,物种丰富度最低,主要分布有短花针茅(Stipa breviflora)、冰草(Agropyron cristatum)、冷蒿(Artemisia frigida)、栉叶蒿(Neopallasia pectinata)等。
1.2 样地选择在研究区域按照MAT、MAP梯度,沿着经纬度从东到西、从北到南选取17个样点,样点周围均为人为干扰较小的未利用地或放牧区。其中包括5个草甸草原、6个典型草原和6个荒漠草原(图 1,表 1)。

|
| 图 1 内蒙古17个草原样点位置分布图 Figure 1 Location distribution map of 17 study sites along climatic transect of Inner Mongolia |
|
|
| 样点位置 Locations of study sites | 经纬度 Longitude and latitude | 草地类型 Grassland type | 优势种和亚优势种 Dominant and subdominant plant species | 年降雨量 MAP (mm) | 年均温 MAT (℃) |
| 额尔古纳市 ER | E 119°22′53.04′′ N 50°10′22.35′′ | 草甸草原 | 贝加尔针茅、羊草、委陵菜 | 368 | -1.7 |
| 东乌珠穆沁旗 DW | E 118°24′45.10′′ N 45°47′56.74′′ | 草甸草原 | 贝加尔针茅、羊草、扁蓿豆 | 327 | 0.6 |
| 陈巴尔虎旗 OB | E 119°12′45.75′′ N 49°59′51.24′′ | 草甸草原 | 贝加尔针茅、羊草、委陵菜 | 368 | -1.9 |
| 多伦县B DLB | E 116°40′47.76′′ N 42°27′59.04′′ | 草甸草原 | 菊叶委陵菜、地榆 | 390 | 0.6 |
| 围场县 SH | E 117°8′45.56′′ N 42°33′54.43′′ | 草甸草原 | 羊草、委陵菜、蓬子菜 | 433 | 0.6 |
| 阿巴嘎旗 AB | E 114°56′48.72′′ N 44°1′59.88′′ | 典型草原 | 克氏针茅、冷蒿、羊草 | 249 | 1.0 |
| 锡林浩特市 XL | E 116°33′9.36′′ N 43°32′25.8′′ | 典型草原 | 羊草、大针茅、冷蒿 | 329 | 1.6 |
| 正镶白旗 ZB | E 115°17′12.06′′ N 42°23′40.38′′ | 典型草原 | 克氏针茅、银灰旋花 | 326 | 2.7 |
| 多伦县 DL | E 116°17′ N 42°02′ | 典型草原 | 克氏针茅、冷蒿、胡枝子 | 389 | 1.4 |
| 鄂尔多斯东胜区 DS | E 109°48′9.9′′ N 39°50′48.24′′ | 典型草原 | 克氏针茅、羊草、冷蒿、 | 357 | 6.7 |
| 伊金霍洛旗 YJ | E 109°24′49.38′′ N 39°31′49.92′′ | 典型草原 | 羊草、胡枝子 | 382 | 5.7 |
| 苏尼特左旗A SLA | E 113°6′55.38′′ N 44°35′25.68′′ | 荒漠草原 | 短花针茅、冰草、冷蒿、多根葱 | 204 | 1.0 |
| 苏尼特左旗B SLB | E 114°4′13.8′′ N 43°53′22.5′′ | 荒漠草原 | 木地肤、隐子草、短花针茅、冷蒿 | 223 | 2.1 |
| 苏尼特右旗 SR | E 112°21′35.58′′ N 42°32′55.56′′ | 荒漠草原 | 短花针茅、小叶锦鸡儿、冷蒿 | 198 | 3.8 |
| 四子王旗 SZ | E 111°53′55.86′′ N 41°46′37.14′′ | 荒漠草原 | 短花针茅、隐子草、栉叶蒿 | 227 | 3.5 |
| 达茂旗 DM | E 110°25′5.64′′ N 41°36′58.08′′ | 荒漠草原 | 短花针茅、羊草、冷蒿、栉叶蒿 | 267 | 7.5 |
| 鄂托克旗 ET | E 107°57′40.38′′ N 38°58′19.2′′ | 荒漠草原 | 茵陈蒿、栉叶蒿 | 267 | 7.5 |
总有机碳分析仪(Multi N/C3100),德国耶拿分析仪器股份公司;温湿度传感器(WET-2 sensor),英国Delta-T仪器有限责任公司;pH计(Model PHS-2),上海仪电科学仪器股份有限公司;激光粒度分析仪(Mastersizer 2000),英国马尔文仪器有限公司;元素分析仪(Vario EL III),德国ELEMENTAR公司。
1.4 试验方法于2013年7月底进行采样,采用随机取样的方法,每个样点选取3个1 m×1 m的样方,各样方间隔大于10 m。齐地面收集每个样方内的所有植株,洗净风干后测定干重。在每个样方内挖一个长、宽、高均为1 m的土壤剖面,在剖面上分0-10 cm、10-20 cm、20-40 cm、40-60 cm、60-100 cm五层进行取土。在每个样方内的每层土壤中取长宽分别为50 cm和10 cm的土块,将土壤中的根系全部挑出,同时去除土壤中的其它植物残体(如茎、叶)、土壤动物(如鞘翅目昆虫残骸)以及砂砾等异物。最后,将土壤过2 mm筛,以确保后续室内实验测定的土壤元素和微生物量碳不包括动植物残体的元素和生物量碳。用封口袋收集过筛后的土壤,放于保温盒中保存,并尽快运回实验室-20 ℃冷冻保存。根系样品洗净风干后测定干重。
土壤微生物量碳采用氯仿熏蒸法[20]进行测定。用总有机碳分析仪测定浸提液中的总有机碳含量,微生物量碳的校正系数为0.45[21]。在野外使用温湿度传感器测定土壤温度和含水量。土壤pH值的测定需称取相当于10 g干土重的鲜土,加入25 mL去离子水,摇匀后静置30 min用pH计进行读数。土壤粒度采用激光粒度分析仪进行测定。土壤碳(C)、氮(N)元素含量采用元素分析仪进行测定,土壤全磷(P)含量测定用H2SO4-HClO4消煮后,采用钼蓝比色法进行测定。
1.5 统计分析统计分析前先对数据进行对数变换,以服从正态分布。对各生物因子和非生物因子进行描述性统计分析,对土壤微生物量碳和各因子进行相关分析,对0-10 cm表层土壤微生物量碳和10-100 cm各土层微生物量碳进行相关分析,对不同草地类型和土壤深度的微生物量碳及影响因子进行方差分析。为深入分析各因子对土壤微生物量碳的影响随土壤深度的变化情况,采用多元线性回归进行模拟,选择AICc值最小的模型为最优模型。描述性统计分析、相关分析、方差分析在Spss 18.0中完成,多元线性回归和箱式图的绘制在R3.2.0[22]中完成,微生物量碳垂直分布图的绘制在SigmaPlot 12.0中完成。
2 结果与分析 2.1 土壤理化性质不同草地类型的土壤理化性质变化特征见表 2-4。在3种草地类型中,草甸草原的土壤温度、土壤pH值最低,荒漠草原最高;草甸草原的土壤含水量、粘粒含量、土壤养分元素含量均最高,荒漠草原最低。随着土壤深度的增加,土壤温度均显著下降(p<0.05)。草甸草原的土壤含水量随着深度增加呈现降低的趋势,但差异不显著(p>0.05),而典型草原和荒漠草原的土壤温度并未沿着土壤剖面呈现显著变化。土壤pH值随着深度的增加而显著增加(p<0.05),变化范围为6.4-9.7。在典型草原和荒漠草原中,土壤粘粒含量随着深度的增加显著降低(p<0.05),而荒漠草原的土壤粘粒含量保持稳定。随着土壤深度的增加,土壤C、N、P含量显著减少(p<0.05)。
| 类型 Type | 0-10 cm | 10-20 cm | 20-40 cm | 40-60 cm | 60-100 cm |
| ST (℃) | 22.17±0.84a | 20.5±0.73ab | 18.89±0.62bc | 17.61±0.63cd | 16.17±0.60d |
| SM (%) | 15.32±1.04a | 14.76±1.18a | 14.88±1.19a | 14.67±0.81a | 13.02±0.86a |
| pH | 6.96±0.14a | 6.98±0.16a | 7.23±0.19ab | 7.62±0.20ab | 7.89±0.26b |
| Clay (%) | 4.79±0.66a | 6.56±0.71a | 5.08±0.67a | 5.31±0.83a | 5.39±0.76a |
| STC (mmol/kg) | 2 704.80±267.93a | 1 959.06±246.22b | 1 808.98±257.09bc | 1 637.94±187.19bc | 1 174.76±91.48c |
| STN (mmol/kg) | 204.66±17.69a | 147.21±14.51b | 135.03±15.25bc | 103.30±11.03cd | 71.43±5.60d |
| STP (mmol/kg) | 15.29±1.32a | 14.31±1.54ab | 13.06±1.36ab | 12.64±1.22ab | 10.78±1.20b |
| RB (g/m2) | 352.25±62.29a | 145.33±20.10b | 154.63±11.00b | 69.45±6.44c | 34.14±6.44d |
| 注:表格中的数值表示平均值±标准误,同一行不同小写字母表示不同土壤深度下差异显著(p<0.05). ST:土壤温度;SM:土壤含水量;Clay:粘粒含量;STC:土壤全碳含量;STN:土壤全氮含量;STP:土壤全磷含量;RB:根生物量. | |||||
| Note: Values in this table was means ± standard error. Different small letters in the same line are significantly different at the 0.05 level. ST: soil temperature; SM: soil moisture; Clay: clay content; STC: soil total carbon content; STN: soil total nitrogen content; STP: soil total phosphorous content; RB: root biomass. | |||||
| 类型 Type | 0-10 cm | 10-20 cm | 20-40 cm | 40-60 cm | 60-100 cm |
| ST (℃) | 26.48±0.67a | 24.24±0.60b | 23.42±0.63b | 22.69±0.67bc | 20.96±0.66c |
| SM (%) | 4.76±0.55a | 4.84±0.36a | 5.32±0.49a | 4.92±0.44a | 4.40±0.46a |
| pH | 7.97±0.13a | 8.13±0.15ab | 8.31±0.16abc | 8.45±0.14bc | 8.64±0.11c |
| Clay (%) | 3.31±0.39a | 3.39±0.34a | 3.08±0.31a | 2.24±0.27b | 1.89±0.14b |
| STC (mmol/kg) | 1 256.76±86.40a | 1 213.49±144.94a | 910.19±128.36ab | 798.70±114.32b | 793.33±146.35b |
| STN (mmol/kg) | 95.12±7.63a | 83.13±8.16a | 55.94±5.85b | 42.04±4.57b | 42.91±10.52b |
| STP (mmol/kg) | 10.68±0.31a | 8.65±0.46ab | 6.66±0.57b | 6.55±0.74b | 7.49±2.15b |
| RB (g/m2) | 167.71±41.30a | 58.23±7.27b | 45.93±6.10b | 16.88±3.03c | 16.63±4.05c |
| 类型 Type | 0-10 cm | 10-20 cm | 20-40 cm | 40-60 cm | 60-100 cm |
| ST (℃) | 30.06±0.91a | 27.63±0.76ab | 26.65±0.67bc | 25.82±0.79bc | 25.11±0.93c |
| SM (%) | 2.59±0.51a | 2.92±0.29a | 3.03±0.28a | 3.15±0.35a | 2.97±0.47a |
| pH | 8.17±0.10a | 8.22±0.76a | 8.34±0.06ab | 8.58±0.09bc | 8.81±0.10c |
| Clay (%) | 4.59±0.65a | 4.32±0.44a | 3.48±0.47ab | 2.28±0.29b | 2.74±0.48b |
| STC (mmol/kg) | 610.59±79.96a | 578.16±72.89a | 581.46±52.77a | 453.69±63.94a | 408.15±66.95a |
| STN (mmol/kg) | 68.03±7.87a | 64.52±6.95a | 52.98±3.69a | 36.71±3.18b | 22.36±1.47b |
| STP (mmol/kg) | 9.00±0.68a | 8.66±0.85ab | 7.93±0.71ab | 6.65±0.70bc | 5.53±0.62c |
| RB (g/m2) | 142.67±26.89a | 61.16±13.98b | 41.45±8.24b | 17.02±4.04c | 13.14±2.68d |
土壤微生物量碳的变化特征见图 2,同一草地类型不同样点间的变异系数以及不同草地类型间的变异系数如表 5所示。草地类型间微生物量碳的变异系数反映了不同草地类型间微生物量碳的变化程度。3种草地类型土壤微生物量碳含量总体表现为草甸草原>典型草原>荒漠草原。其中,在典型草原中,鄂尔多斯东胜区和伊金霍洛旗两个样点的土壤微生物量碳偏低,接近荒漠草原;荒漠草原中的达茂样点微生物量碳异常高,接近典型草原,鄂托克样点土壤微生物量碳偏低,表层土壤微生物量碳仅为1.95 mmol/kg。在0-10 cm表层土壤中,草地类型间的变异系数高于草甸草原和典型草原,低于荒漠草原;在10-20 cm和40-100 cm土壤层中,草地类型间的变异系数高于草甸草原和荒漠草原,低于典型草原;在20-40 cm土壤层中,草地类型间的变异系数高于草甸草原、典型草原和荒漠草原。在0-100 cm土壤层中,草甸草原样点间的土壤微生物量碳的变异系数低于典型草原和荒漠草原。随着土壤深度的增加,草地类型间的变异系数以及同一草地类型不同样点间的变异系数均呈现增大的趋势。
|
| 图 2 3种草地类型土壤微生物量碳的垂直分布 Figure 2 Vertical patterns of soil microbial biomass C in three grassland types 注:图中横轴中的字母表示各样点名称的缩写. A:草甸草原;B:典型草原;C:荒漠草原;D:3种草地类型. Note: Letters in horizontal axis were abbreviations of our study sites. A: meadow steppe; B: typical steppe; C: desert steppe; D: three grassland types. |
|
|
| 草地类型 Grassland type | 0-10 cm | 10-20 cm | 20-40 cm | 40-60 cm | 60-100 cm |
| 草甸草原 Meadow steppe | 36.32 | 38.37 | 37.76 | 33.82 | 48.02 |
| 典型草原 Typical steppe | 44.09 | 63.81 | 48.43 | 66.68 | 90.78 |
| 荒漠草原 Desert steppe | 66.52 | 48.73 | 38.56 | 50.09 | 68.08 |
| 草地类型间Among grassland types | 56.50 | 58.85 | 62.08 | 58.76 | 72.18 |
随着土壤深度的增加,3种草地类型的土壤微生物量碳含量均显著减少(p<0.05)。草甸草原土壤微生物量碳从表层的31.71 mmol/kg减少到 4.11 mmol/kg,典型草原土壤微生物量碳从表层的19.71 mmol/kg减少到2.08 mmol/kg,荒漠草原从表层的14.2 mmol/kg减少到2.25 mmol/kg。表层 (0-10 cm)土壤微生物量碳与其他土层(10-100 cm)土壤微生物量碳的相关分析如图 3所示。本研究结果表明,0-10 cm土壤微生物量碳与10-20 cm以及20-40 cm土壤微生物量碳均有良好的相关关系,相关指数均高于0.5。然而,随着土壤深度的增加,表层土壤与深层土壤的微生物量碳相关性减弱,与60-100 cm的土壤微生物量碳的相关指数 不到0.2。

|
| 图 3 表层(0-10 cm)土壤微生物量碳与其它土层(10-100 cm)土壤微生物量碳的关系 Figure 3 Linear correlations between soil microbial biomass C at 0-10 cm soil layer and other layers (10-100 cm) |
|
|
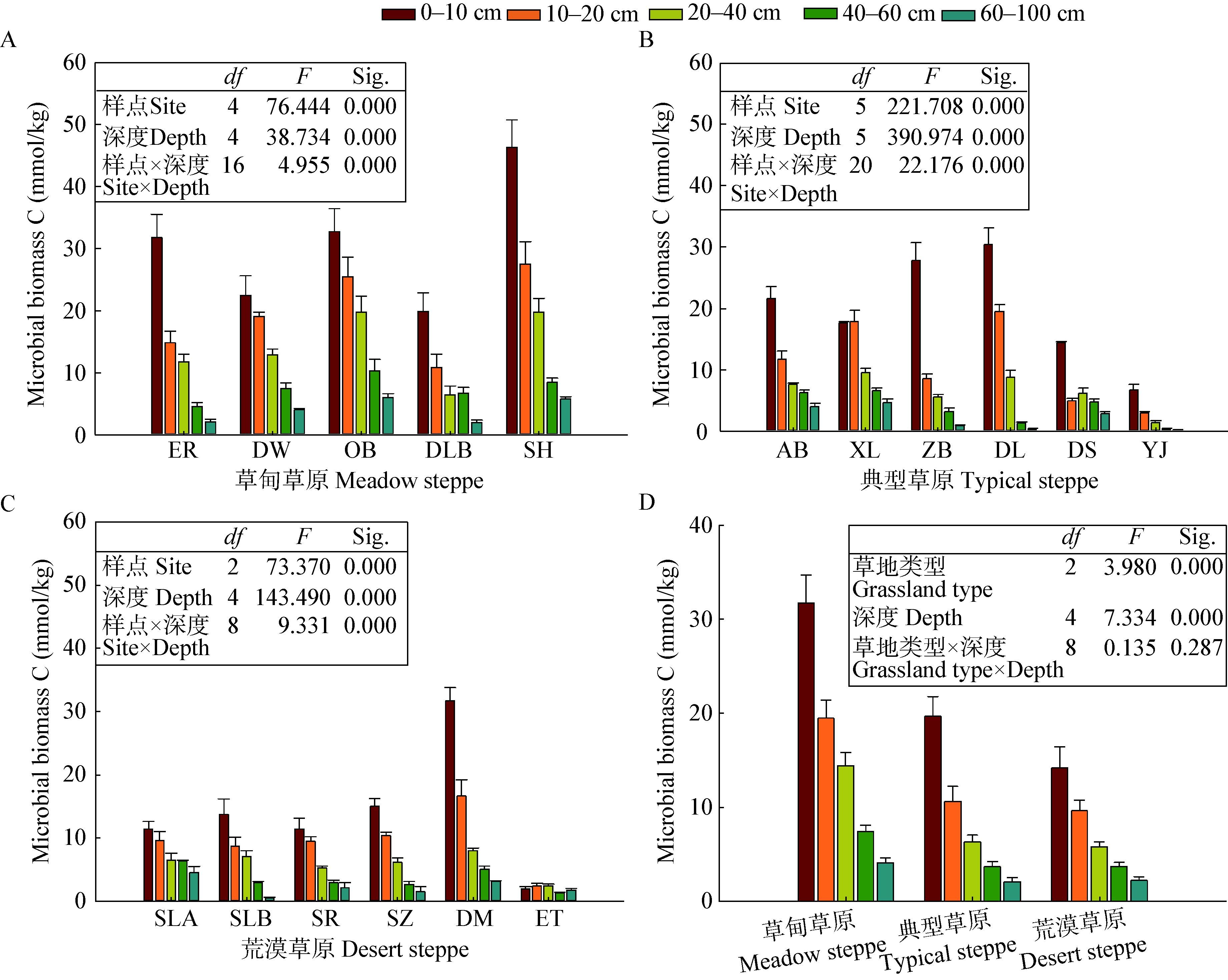
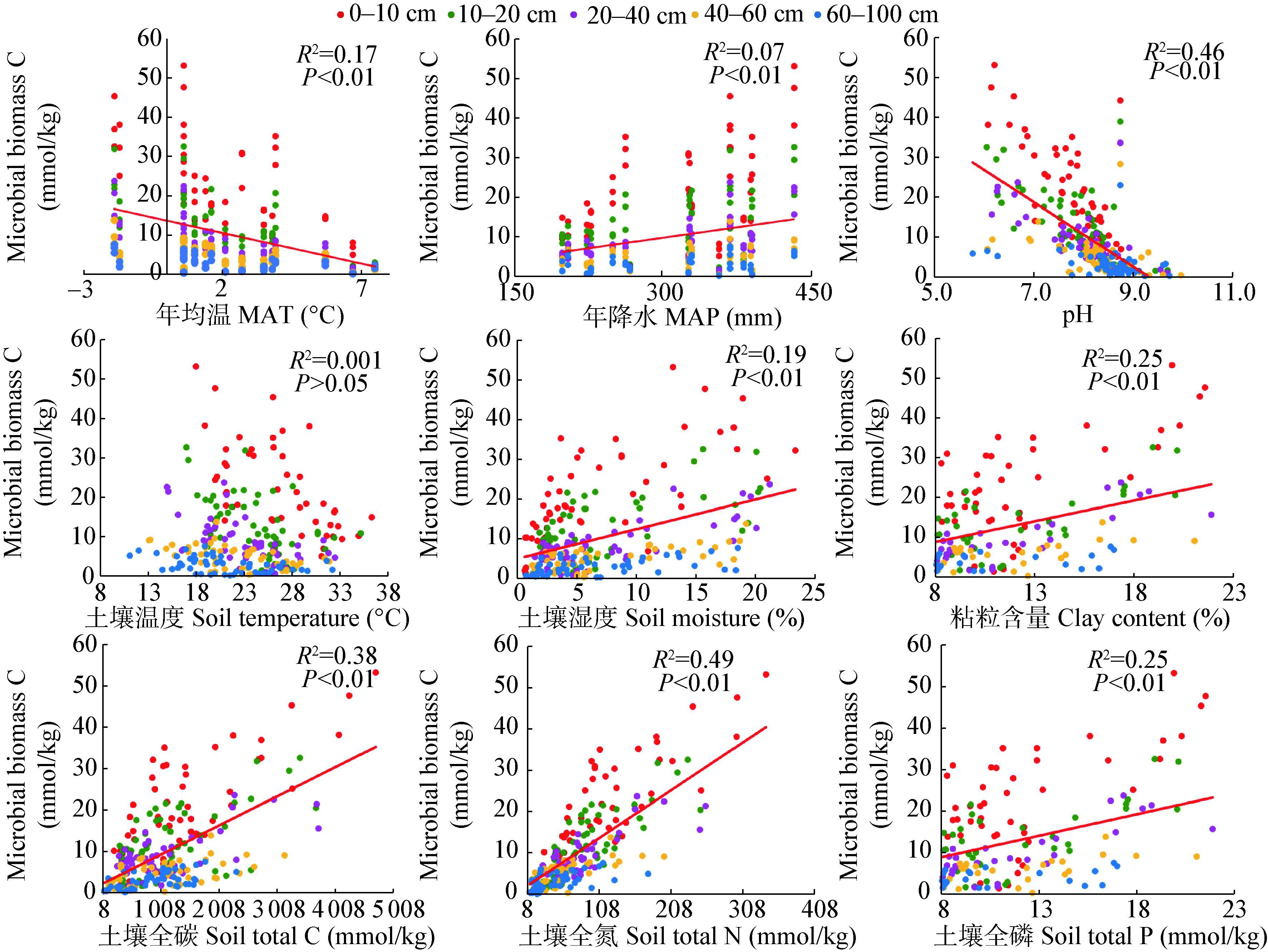
土壤微生物量碳与非生物因子的相关关系如图 4所示,与生物因子的相关关系如图 5所示。在0-100 cm剖面中,土壤微生物量碳与年降水、土壤含水量、粘粒含量、土壤养分元素、地上生物量、地下生物量呈显著正相关,与年均温和土壤pH值呈显著负相关关系(p<0.01),与土壤温度无显著相关关系(p>0.05)。
|
| 图 4 土壤微生物量碳与非生物因子之间的相关性 Figure 4 Linear correlations between soil microbial biomass C and abiotic factors |
|
|
|
| 图 5 土壤微生物量碳与生物因子之间的相关性 Figure 5 Linear correlations between soil microbial biomass C and biotic factors |
|
|
土壤微生物量碳与非生物因子、生物因子的相关指数随着土壤深度的增加变化情况如表 6所示,多元线性回归结果如表 7所示。相关分析结果表明,随着土壤深度的增加,微生物量碳与非生物因子的相关性呈现减弱的趋势,且非生物因子与微生物量碳的相关性大于生物因子与微生物量碳的相关性。多元线性回归结果表明在3种草地类型中,随着土壤深度的增加,非生物因子和生物因子对土壤微生物量碳的总解释率也呈现减小的趋势。
| 土壤深度 Soil depth (cm) | 非生物因子 Abiotic factors | 生物因子 Biotic factors | ||||||||||
| MAT | MAP | ST | SM | pH | Clay | STC | STN | STP | AB | RB | ||
| 0-10 | 0.45 | 0.28 | 0.29 | 0.46 | 0.74 | 0.48 | 0.58 | 0.69 | 0.48 | 0.09 | 0.34 | |
| 10-20 | 0.52 | 0.15 | 0.28 | 0.37 | 0.63 | 0.27 | 0.36 | 0.62 | 0.27 | 0.13 | 0.06 | |
| 20-40 | 0.53 | 0.22 | 0.35 | 0.58 | 0.73 | 0.43 | 0.48 | 0.68 | 0.43 | 0.11 | 0.35 | |
| 40-60 | 0.38 | 0.05 | 0.26 | 0.37 | 0.36 | 0.29 | 0.22 | 0.48 | 0.30 | 0.15 | 0.27 | |
| 60-100 | 0.23 | 0.02 | 0.17 | 0.25 | 0.31 | 0.30 | 0.38 | 0.34 | 0.30 | 0.05 | 0.02 | |
| 注:MAT:年均温;MAP:年降水;ST:土壤温度;SM:土壤含水量;Clay:粘粒含量;STC:土壤全碳含量;STN:土壤全氮含量;STP:土壤全磷含量;AB:地上生物量;RB:根生物量. | ||||||||||||
| Note: MAT: mean annual temperature; MAP: mean annual precipitation; ST: soil temperature; SM: soil moisture; Clay: clay content; STC: soil total carbon content; STN: soil total nitrogen content; STP: soil total phosphorous content; AB: aboveground biomass; RB: root biomass. | ||||||||||||
| 土壤深度 SD (cm) | 草甸草原 Meadow steppe | 典型草原 Typical steppe | 荒漠草原 Desert steppe | ||||||||
| 最优模型 Best model | AICc | Adjusted R2 | 最优模型 Best model | AICc | Adjusted R2 | 最优模型 Best model | AICc | Adjusted R2 | |||
| 0-10 | MBC~ST +STN+AB | -17.65 | 0.74 | MBC~MAP+ pH+ST+RB | -27.12 | 0.90 | MBC~MAT+SM | -28.17 | 0.94 | ||
| 10-20 | MBC~MAT +STC+AB | -15.26 | 0.71 | MBC~RB+STC | 29.31 | 0.96 | MBC~MAT+SM +AB+RB+STC | 41.21 | 0.95 | ||
| 20-40 | MBC~MAP+pH | -18.44 | 0.68 | MBC~MAP +STN+STP | -0.80 | 0.77 | MBC~MAP+pH | -15.49 | 0.73 | ||
| 40-60 | MBC~MAP+STN | -22.55 | 0.68 | MBC~MAP+ ST+STC+STP | 16.69 | 0.73 | MBC~MAT +MAP+STP | -7.79 | 0.65 | ||
| 60-100 | MBC~MAP+pH | -8.17 | 0.65 | MBC~MAT +MAP+STP | 7.95 | 0.74 | MBC~MAT +MAP+STP | 7.80 | 0.54 | ||
| 注:SD:土壤深度;MBC:微生物量碳;MAT:年均温;MAP:年降水;ST:土壤温度;SM:土壤含水量;Clay:粘粒含量;STC:土壤全碳含量:STN:土壤全氮含量;STP:土壤全磷含量;AB:地上生物量;RB:根生物量. | |||||||||||
| Note: SD: soil depth; MBC: microbial biomass; MAT: mean annual temperature; MAP: mean annual precipitation; ST: soil temperature; SM: soil moisture; Clay: clay content; STC: soil total carbon content; STN: soil total nitrogen content; STP: soil total phosphorous content; AB: aboveground biomass; RB: root biomass. | |||||||||||
研究表明,同一草地类型不同样点的土壤微生物量碳存在极显著差异(p<0.001),表明各样点之间存在较高的空间异质性。各个样点虽然属于同种草地类型,但气候条件存在差异,年均温、年降水、土壤pH值不同,优势种和亚优势种存在差异,气候、土壤理化性质以及生物因素的差异引起了微生物量碳的差异。其中,典型草原中的伊金霍洛旗样点表层土壤pH值超过8.5,深层土壤pH值超过9.0,土壤碱性太高抑制了微生物的生长[13],导致该地区土壤微生物量碳含量过低。荒漠草原中的达茂样点微生物碳含量异常高,可能与其靠近白云鄂博铁矿有关,由于铁矿附近土壤重金属含量较高,存在耐高温、耐盐碱的微生物种类,从而造成微生物量碳含量较高[23-25]。
草甸草原的土壤微生物量碳最高,典型草原次之,荒漠草原最低,这与我们的第一个假设一致。随着经纬度的变化微生物量碳呈现从东向西、从北向南逐渐减小的趋势,与年降水量的变化趋势一致。这是因为降水是土壤水分的重要来源,对地下生物化学循环具有重要的调控作用[26]。此外,微生物主要以植物残体为营养源,植物的质与量的差异必定会导致土壤微生物量碳在不同的草地类型中分布存在差异性。由表 2-4和图 6可知,本研究中不同草地类型的地上生物量和根生物量存在显著差异,草甸草原的地上生物量为235.16 g/m2,显著高于典型草原(193.99 g/m2)和荒漠草原(71.06 g/m2)。同时,不同深度的根生物量也呈现出草甸草原高于典型草原和荒漠草原的规律(表 2-4)。较高的地上生物量为土壤提供了大量的凋落物,发达的植物根系产生大量的分泌物,为土壤微生物提供了丰富的能源物质,促进了土壤微生物的生长繁殖和土壤养分的积累[27]。不同草地类型土壤表面的植被覆盖度也存在显著差异,引起了土壤温度和湿度的差异,进而对土壤微生物产生影响[28]。

|
| 图 6 不同草地类型的地上生物量 Figure 6 Aboveground biomass in three grassland types |
|
|
土壤微生物量碳的垂直分布呈现一定的规律性,以表层0-10 cm最高,随着土壤深度的增加而减小,与以往的研究结果一致[29-31]。表层土壤积累了较多的枯枝落叶和腐殖质,含有丰富的有机质,同时表层积聚了大量植物根系,而植物根系的分泌物含量高,为微生物的生长提供了较丰富的养 分[29, 32]。此外,表层土壤水热和通气状况良好,为微生物的生长和繁殖提供了良好的环境条件[29, 32]。表层土壤与深层土壤微生物量碳的相关分析结果表明,表层土壤微生物量碳与10-40 cm土壤微生物量碳有较强的相关性(R2>0.5),而与40-100 cm的土壤微生物量碳相关性较弱(R2<0.3)。因此,随着土壤深度的增加,深层土壤微生物量碳与表层土壤微生物量碳的相关性逐渐减弱。
3.2 土壤微生物量碳的影响因素土壤微生物量碳是土壤有机碳的灵敏指示因子,本研究中土壤微生物量碳与土壤全C、N、P含量显著正相关,与Tischer等的研究结果一致[33],表明土壤微生物量碳与土壤养分变化趋势一致。此外,本研究中土壤微生物量碳与粘粒含量具有显著正相关关系,表明了养分含量高、通气状况好的土壤微生物量碳也高,这是土壤肥力、土壤环境状况与土壤微生物协同发展的结果。良好的土壤环境促进了微生物的生长和繁殖,反过来,土壤微生物也会促进土壤养分的矿化和固持,改善土壤的结构和养分状况。因此,土壤微生物量碳可以作为评价土壤肥力状况的指标。
相关分析结果表明土壤微生物量碳与MAP和土壤含水量存在极显著正相关关系。赵彤等对黄土丘陵区土壤微生物量碳的研究也表明,土壤微生物量碳与土壤水分显著正相关[34]。本研究区域为半干旱气候,水分对微生物生长的限制作用更加明显。水分作为微生物原生质的重要组成部分,对微生物自身的基本特征产生了极大的影响,是维持微生物正常代谢必不可缺的物质[14],同时还通过影响土壤通气性、土壤呼吸以及底物扩散等间接影响土壤微生物量碳[18]。
本研究中土壤微生物量碳与土壤pH值显著负相关,与以往大多数研究结果一致[35-36]。在本研究中,位于内蒙古西部地区的荒漠草原土壤碱性最高,0-10 cm的表层土壤pH值高达8.17,微生物量碳最低。草甸草原的土壤pH值接近中性,微生物量碳含量最高。土壤pH通过影响土壤胞外酶活力和细胞膜的稳定性来影响微生物对土壤养分的吸收[37-38],从而影响土壤微生物量碳。大多数土壤微生物原生质的pH接近中性,最适酸碱度为中 性[39]。土壤微生物量碳与pH值的负相关关系正好证明了微生物更倾向于中性或酸性土壤。
随着土壤深度的增加,非生物因子与微生物量碳的相关性减弱,且多元线性回归的最佳模型的R2也减小,表明环境因子对土壤微生物量碳的影响逐渐减弱,这与我们的第二个假设一致。表层土壤比深层土壤经历了更大的温度和水分变化,且不稳定有机质含量更高[40],土壤根系更加丰富[41],而深层土壤的环境条件趋于稳定,对微生物的影响也就随之减弱。深层的土壤具备较强的缓冲力,在一定程度上减弱了环境因子对微生物量碳的影响作用[40]。此外,本研究表明,在0-100 cm的土壤剖面中,非生物因子对微生物量碳的影响大于生物因子,可能是由于地上生物量、根生物量等生物因子在一定程度上受到气候和土壤理化性质等非生物因子的影响[42-44]。
4 结论本研究通过对内蒙古17个草原样点的土壤微生物量碳、土壤理化性质、地上生物量和根生物量的测定,发现不同草地类型间以及不同土壤深度微生物量碳存在显著差异。在该研究区域中,草甸草原土壤微生物量碳最高,典型草原次之,荒漠草原最低。表层土壤微生物量碳能较好地预测10-40 cm的土壤微生物量碳,但与40-100 cm的土壤微生物量碳的相关性较弱。随着土壤深度的增加,土壤微生物量碳显著减少,非生物因子和生物因子对微生物量碳的影响显著减小。本研究深入分析了内蒙古温带草原土壤微生物量碳空间分布的差异,探索了环境因子和生物因子在土壤剖面上对微生物量碳的影响,为深入研究草原生态系统对全球气候变化的响应以及退化草地的修复治理提供了理论依据。
| [1] | Balser TC, Firestone MK. Linking microbial community composition and soil processes in a California annual grassland and mixed-conifer forest[J]. Biogeochemistry , 2005, 73 (2) : 395–415. DOI:10.1007/s10533-004-0372-y |
| [2] | King GM. Enhancing soil carbon storage for carbon remediation: potential contributions and constraints by microbes[J]. Trends in Microbiology , 2011, 19 (2) : 75–84. DOI:10.1016/j.tim.2010.11.006 |
| [3] | Trivedi P, Anderson IC, Singh BK. Microbial modulators of soil carbon storage: integrating genomic and metabolic knowledge for global prediction[J]. Trends in Microbiology , 2013, 21 (12) : 641–651. DOI:10.1016/j.tim.2013.09.005 |
| [4] | Zak DR, Holmes WE, White DC, et al. Plant diversity, soil microbial communities, and ecosystem function: are there any links?[J]. Ecology , 2003, 84 (8) : 2042–2050. DOI:10.1890/02-0433 |
| [5] | Fisher MC, Henk DA, Briggs CJ, et al. Emerging fungal threats to animal, plant and ecosystem health[J]. Nature , 2012, 484 (7393) : 186–194. DOI:10.1038/nature10947 |
| [6] | Floudas D, Binder M, Riley R, et al. The Paleozoic origin of enzymatic lignin decomposition reconstructed from 31 fungal genomes[J]. Science , 2012, 336 (6089) : 1715–1719. DOI:10.1126/science.1221748 |
| [7] | Kandeler E, Tscherko D, Spiegel H. Long-term monitoring of microbial biomass, N mineralization and enzyme activities of a Chernozem under different tillage management[J]. Biology and Fertility of Soils , 1999, 28 (4) : 343–351. DOI:10.1007/s003740050502 |
| [8] | Yu WT, Jiang ZS, Liu M, et al. Effect of different land use patterns on soil microbial biomass carbon[J]. Chinese Journal of Soil Science , 2008, 39 (2) : 282–286. (in chinese) 宇万太, 姜子绍, 柳敏, 等. 不同土地利用方式对土壤微生物生物量碳的影响[J]. 土壤通报 , 2008, 39 (2) : 282–286. |
| [9] | He ZL. Soil microbial biomass and its significance in the evaluation of nutrient cycling and environmental quality[J]. Soils , 1997 (2) : 61–69. (in chinese) 何振立. 土壤微生物量及其在养分循环和环境质量评价中的意义[J]. 土壤 , 1997 (2) : 61–69. |
| [10] | Xu XF, Thornton PE, Post WM. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems[J]. Global Ecology and Biogeography , 2013, 22 (6) : 737–749. DOI:10.1111/geb.12029 |
| [11] | Blume E, Bischoff M, Reichert JM, et al. Surface and subsurface microbial biomass, community structure and metabolic activity as a function of soil depth and season[J]. Applied Soil Ecology , 2002, 20 (3) : 171–181. DOI:10.1016/S0929-1393(02)00025-2 |
| [12] | Cleveland CC, Liptzin D. C:N:P stoichiometry in soil: is there a “Redfield ratio” for the microbial biomass?[J]. Biogeochemistry , 2007, 85 (3) : 235–252. DOI:10.1007/s10533-007-9132-0 |
| [13] | Pietri JCA, Brookes PC. Substrate inputs and pH as factors controlling microbial biomass, activity and community structure in an arable soil[J]. Soil Biology and Biochemistry , 2009, 41 (7) : 1396–1405. DOI:10.1016/j.soilbio.2009.03.017 |
| [14] | Zhou XQ, Chen CR, Wang YF, et al. Soil extractable carbon and nitrogen, microbial biomass and microbial metabolic activity in response to warming and increased precipitation in a semiarid Inner Mongolian grassland[J]. Geoderma , 2013, 206 : 24–31. DOI:10.1016/j.geoderma.2013.04.020 |
| [15] | Tiemann LK, Billings SA. Tracking C and N flows through microbial biomass with increased soil moisture variability[J]. Soil Biology and Biochemistry , 2012, 49 (6) : 11–22. |
| [16] | Buss HL, Bruns MA, Schultz MJ, et al. The coupling of biological iron cycling and mineral weathering during saprolite formation, Luquillo Mountains, Puerto Rico[J]. Geobiology , 2005, 3 (4) : 247–260. DOI:10.1111/gbi.2005.3.issue-4 |
| [17] | Stone MM, DeForest JL, Plante AF. Changes in extracellular enzyme activity and microbial community structure with soil depth at the Luquillo Critical Zone Observatory[J]. Soil Biology and Biochemistry , 2014, 75 : 237–247. DOI:10.1016/j.soilbio.2014.04.017 |
| [18] | He YT, Dong YS, Qi YC, et al. Advances in researches on soil microbial biomass of grassland ecosystems and its influencing factors[J]. Progress in Geography , 2010, 29 (11) : 1350–1359. (in chinese) 何亚婷, 董云社, 齐玉春, 等. 草地生态系统土壤微生物量及其影响因子研究进展[J]. 地理科学进展 , 2010, 29 (11) : 1350–1359. |
| [19] | Mu SJ, Li JL, Yang HF, et al. Spatio-temporal variation analysis of grassland net primary productivity and its relationship with climate over the past 10 years in Inner Mongolia[J]. Acta Prataculturae Sinica , 2013, 22 (3) : 6–15. (in chinese) 穆少杰, 李建龙, 杨红飞, 等. 内蒙古草地生态系统近10年NPP时空变化及其与气候的关系[J]. 草业学报 , 2013, 22 (3) : 6–15. |
| [20] | Vance ED, Brookes PC, Jenkinson DS. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry , 1987, 19 (6) : 703–707. DOI:10.1016/0038-0717(87)90052-6 |
| [21] | Joergensen RG, Mueller T. Fumigation-extraction method to estimate soil microbial biomass: calibration of the kEN value[J]. Soil Biology and Biochemistry , 1996, 28 (1) : 33–37. DOI:10.1016/0038-0717(95)00101-8 |
| [22] | R Development Core Team. R: a language and environment for statistical computing[C]. Vienna, Austria: The R Foundation for Statistical Computing, 2006 |
| [23] | Li X. Three special bacteria from Baiyun’ebo rare earth mining area[J]. Journal of Microbiology , 2008, 28 (1) : 98–100. (in chinese) 李琇. 白云鄂博稀土矿区的三株特殊细菌[J]. 微生物学杂志 , 2008, 28 (1) : 98–100. |
| [24] | Guo W, Fu RY, Zhao RX, et al. Distribution characteristic and current situation of soil rare earth contamination in the Bayan Obo Mining Area and Baotou Tailing Reservoir in Inner Mongolia[J]. Environmental Science , 2013, 34 (5) : 1895–1900. (in chinese) 郭伟, 付瑞英, 赵仁鑫, 等. 内蒙古包头白云鄂博矿区及尾矿区周围土壤稀土污染现状和分布特征[J]. 环境科学 , 2013, 34 (5) : 1895–1900. |
| [25] | Fan YJ, Yan W, Wang LY, et al. Characteristics of soil actinomycetes in Baiyun Obo rare earth mine area[J]. Journal of Microbiology , 2011, 31 (4) : 6–11. (in chinese) 樊永军, 闫伟, 王黎元, 等. 白云鄂博稀土矿区土壤中放线菌特征调查研究[J]. 微生物学杂志 , 2011, 31 (4) : 6–11. |
| [26] | Austin AT, Yahdjian L, Stark JM, et al. Water pulses and biogeochemical cycles in arid and semiarid ecosystems[J]. Oecologia , 2004, 141 (2) : 221–235. DOI:10.1007/s00442-004-1519-1 |
| [27] | Ding LL, Qi B, Shang ZH, et al. The characteristics of soil microorganism quantity under different alpine grasslands in eastern Qilian Mountain[J]. Journal of Agro-Environment Science , 2007, 26 (6) : 2104–2111. (in chinese) 丁玲玲, 祁彪, 尚占环, 等. 东祁连山不同高寒草地型土壤微生物数量分布特征研究[J]. 农业环境科学学报 , 2007, 26 (6) : 2104–2111. |
| [28] | Wendu RL, Li G, Zhang JN, et al. The study of soil microbial biomass and soil enzyme avtivity on different grassland in Hulunbeier, Inner Mongolia[J]. Acta Prataculturae Sinica , 2010, 19 (5) : 94–102. (in chinese) 文都日乐, 李刚, 张静妮, 等. 呼伦贝尔不同草地类型土壤微生物量及土壤酶活性研究[J]. 草业学报 , 2010, 19 (5) : 94–102. |
| [29] | Yan RR, Yan YC, Xin XP, et al. Changes in microorganisms and enzyme activities in soil under different grazing intensities in meadow steppe, Inner Mongolia[J]. Ecology and Environmental Sciences , 2011, 20 (2) : 259–265. (in chinese) 闫瑞瑞, 闫玉春, 辛晓平, 等. 不同放牧梯度下草甸草原土壤微生物和酶活性研究[J]. 生态环境学报 , 2011, 20 (2) : 259–265. |
| [30] | Sheng H, Zhou P, Yuan H, et al. Profile of soil microbial biomass carbon in different types of subtropical paddy soils[J]. Environmental Science , 2013, 34 (4) : 1576–1582. (in chinese) 盛浩, 周萍, 袁红, 等. 亚热带不同稻田土壤微生物生物量碳的剖面分布特征[J]. 环境科学 , 2013, 34 (4) : 1576–1582. |
| [31] | Peng PQ, Zhang WJ, Tong CL, et al. Soil C, N and P contents and their relationships with soil physical properties in wetlands of Dongting Lake floodplain[J]. Chinese Journal of Applied Ecology , 2005, 16 (10) : 1872–1878. (in chinese) 彭佩钦, 张文菊, 童成立, 等. 洞庭湖湿地土壤碳、氮、磷及其与土壤物理性状的关系[J]. 应用生态学报 , 2005, 16 (10) : 1872–1878. |
| [32] | Gao XF, Han GD, Zhang G, et al. Effects of grazing on soil microorganisms and their seasonal changes in desert steppe[J]. Chinese Journal of Soil Science , 2007, 38 (1) : 145–148. (in chinese) 高雪峰, 韩国栋, 张功, 等. 放牧对荒漠草原土壤微生物的影响及其季节动态研究[J]. 土壤通报 , 2007, 38 (1) : 145–148. |
| [33] | Tischer A, Potthast K, Hamer U. Land-use and soil depth affect resource and microbial stoichiometry in a tropical mountain rainforest region of southern Ecuador[J]. Oecologia , 2014, 175 (1) : 375–393. DOI:10.1007/s00442-014-2894-x |
| [34] | Zhao T, Yan H, Jiang YL, et al. Effects of vegetation types on soil microbial biomass C, N, P on the Loess Hilly Area[J]. Acta Ecologica Sinica , 2013, 33 (18) : 5615–5622. (in chinese) 赵彤, 闫浩, 蒋跃利, 等. 黄土丘陵区植被类型对土壤微生物量碳氮磷的影响[J]. 生态学报 , 2013, 33 (18) : 5615–5622. DOI:10.5846/stxb |
| [35] | Kang J. Soil enzymatic activity in different grassland types on the western slopes of the Helan mountains, China[D]. Lanzhou: Master’s Thesis of Lanzhou University, 2006(in Chinese). 康健. 贺兰山西坡不同草地类型土壤微生物碳-氮特征[D]. 兰州: 兰州大学硕士学位论文, 2006 http://cdmd.cnki.com.cn/article/cdmd-10730-2006088228.htm |
| [36] | Bardgett RD, Jones AC, Jones DL, et al. Soil microbial community patterns related to the history and intensity of grazing in sub-montane ecosystems[J]. Soil Biology and Biochemistry , 2001, 33 (12/13) : 1653–1664. |
| [37] | Wang RZ, Filley TR, Xu ZW, et al. Coupled response of soil carbon and nitrogen pools and enzyme activities to nitrogen and water addition in a semi-arid grassland of Inner Mongolia[J]. Plant and Soil , 2014, 381 (1/2) : 323–336. |
| [38] | Sinsabaugh RL, Lauber CL, Weintraub MN, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters , 2008, 11 (11) : 1252–1264. |
| [39] | Zhang TX. Soil microbial and its affect factors in Pinus tabulaeformis forestland in Haihe river basin[D]. Beijing: Doctoral Dissertation of Beijing Forestry University, 2015(in Chinese). 张天雪. 海河流域油松林地土壤微生物特征及影响因素研究[D]. 北京: 北京林业大学博士学位论文, 2015 http://cdmd.cnki.com.cn/article/cdmd-10022-1015319496.htm |
| [40] | Yang YH, Fang JY, Guo DL, et al. Vertical patterns of soil carbon, nitrogen and carbon: nitrogen stoichiometry in Tibetan grasslands[J]. Biogeosciences Discussions , 2010, 7 (1) : 1–24. DOI:10.5194/bgd-7-1-2010 |
| [41] | Jackson RB, Banner JL, Jobbágy EG, et al. Ecosystem carbon loss with woody plant invasion of grasslands[J]. Nature , 2002, 418 (6898) : 623–626. DOI:10.1038/nature00910 |
| [42] | Kivlin SN, Treseder KK. Soil extracellular enzyme activities correspond with abiotic factors more than fungal community composition[J]. Biogeochemistry , 2014, 117 (1) : 23–37. DOI:10.1007/s10533-013-9852-2 |
| [43] | Milchunas DG, Vandever MW. Grazing effects on aboveground primary production and root biomass of early-seral, mid-seral, and undisturbed semiarid grassland[J]. Journal of Arid Environments , 2013, 92 : 81–88. DOI:10.1016/j.jaridenv.2013.01.012 |
| [44] | Mcgranahan DA, Daigh AL, Veenstra JJ, et al. Connecting soil organic carbon and root biomass with land-use and vegetation in temperate grassland[J]. The Scientific World Journal , 2014, 2014 : 487563. |
 2016, Vol. 43
2016, Vol. 43