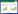1. College of Life Sciences, Hebei Normal University, Shijiazhuang, Hebei 050024, China
;
2. The radiation research center of Beijing, Beijing 101113,China
;
3. State Key Laboratory of Medicinal Chemical Biology, Nankai University, Tianjin 300071, China
Received: August 24, 2015; Accepted: February 29, 2016; Published online(www.cnki.net): March 09, 2016
Foundation item: The Research Foundation of the Education Bureau of Hebei Province (No. QN20131028); The Open Fund of the State Key Laboratory of Medicinal Chemical Biology (No. 20130270); The Doctoral Startup Foundation of Hebei Normal University of Science and Technology (No. L2012B10)
羟脯氨酸(Hydroxyproline,Hyp)是胶原蛋白的主要组成成分[1],包括顺式-3-L-羟脯氨酸、反 式-3-L-羟脯氨酸、顺式-4-L-羟脯氨酸和反式-4-L-羟脯氨酸4种立体异构体。其中,顺式-4-L-羟脯氨酸(cis-4-L-hydroxyproline,cis-4-Hyp)是合成宜他霉素和微鞘藻素两种肽类抗生素的原料,并且临床上被认为可作为抗癌药物[2],因此cis-4-Hyp的生产和应用一直受到业界的广泛关注。目前cis-4-Hyp的生产主要采用化学提取工艺,但存在污染严重、生产成本高和分离纯化困难等缺点[3-5],因此亟需进行低污染、低成本、高转化率的生物转化法的研究与应用。
cis-4-Hyp最早发现于鹅膏蕈菌毒素鬼笔环肽中[6],也可游离存在于檀香中[7],但至今未清楚在这种植物中cis-4-Hyp的生物合成途径[8-9]。2006年Bontoux等研究发现,许多微生物含有顺式-4-L-脯氨酸羟化酶(cis-4-Proline hydroxylase,cis-P4H)[10],能将L-脯氨酸转化为cis-4-Hyp。2009年Hara和Kino从苜蓿中华根瘤菌(Sinorhizobium meliloti)和百脉根根瘤菌(Mesorhizobium loti)中分离鉴定出两种cis-P4H,证实了这两种酶均可以特异地将L-脯氨酸催化生成cis-4-Hyp,但酶活力比较低[11]。进行cis-P4H基因的高效表达和建立有效的转化方法成为实现cis-4-Hyp生物转化的关键。本研究以苜蓿中华根瘤菌中的cis-P4H基因为基础,进行cis-P4H高效表达菌
株的构建及全细胞转化法制备cis-4-Hyp的研究,以期为cis-4-Hyp的工业化生产提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒:
大肠杆菌
Escherichia coli BL21-CodonPlus和质粒pET-M-3C
[12]均由本实验室保藏。
1.1.2 主要试剂和仪器:
质粒抽提试剂盒和琼脂糖凝胶DNA回收试剂盒,北京全式金生物技术有限公司;限制性内切酶和T4 DNA连接酶,宝生物工程(大连)有限公司;
Taq2×Master mix,天津纽赛生物技术有限公司;异丙基硫代-β-D-半乳糖苷(IPTG)、头孢替安、氯甲酸(9-芴甲基)酯和氨苄青霉素,北京索来宝生物科技有限公司。镍柱,通用电气(中国)有限公司北京办事处;超声波破碎仪,宁波新芝生物科技股份有限公司;超速冷冻离心机,贝克曼库尔特商贸(中国)有限公司;mySPEC超微量分光光度计,环亚生物科技有限公司(APG Bio Ltd);紫外分光光度计,德国艾本德股份公司;高效液相色谱仪,上海伍丰科学仪器有限公司。
1.1.3 培养基:
LB培养基
[13],除特殊说明外,所用LB培养基均含有100 mg/L氨苄青霉素和25 mg/L氯霉素。
1.2 工程菌的构建
1.2.1 cis-P4H基因的优化:
cis-P4H基因序列来源于GenBank (登录号FU758039.1)。为了使来源于苜蓿中华根瘤菌的
cis-P4H在大肠杆菌中高效表达,在不改变氨基酸序列的条件下,利用密码子优化软件JCAT
[14],通过同义转换调整密码子的偏好性,将
cis-P4H基因的低使用率密码子替换为在大肠杆菌中高使用率密码子,并保持其G+C含量在50%左右。然后利用RNAstructure 5.3软件预测
cis-P4H基因的mRNA二级结构,计算出mRNA的二级结构的自由能△
G,并调整mRNA二级结构,以便后期基因的转录和翻译。为了便于基因操作,在优化好的
cis-P4H基因5′和3′端分别加入
EcoR Ⅰ和
Hind Ⅲ酶切位点,委托生工生物工程(上海)股份有限公司合成。
1.2.2 工程菌的构建与验证:
将新合成的
cis-P4H基因经
EcoR Ⅰ和
Hind Ⅲ双酶切后,连接到经同样酶双酶切的pET-M-3C质粒上,构建重组质粒pET-M-3C-
cis-P4H。将重组质粒转化至大肠杆菌BL21-CondonPlus感受态中,涂布在含有氨苄青霉素和氯霉素抗性的LB固体培养基平板上,37 ℃培养过夜,挑选阳性重组子,提取重组质粒并进行PCR和双酶切验证。上游引物T7:5′-TAATACGACT CACTATAGGG-3′,下游引物T7
ter:5′-TGCTAGTTA TTGCTCAGCGG-3′。PCR反应体系(50 μL)为:
Taq 2×Master mix 25 μL,上、下游引物各(10 μmol/L) 1 μL,模板DNA 1 μL,超纯水22 μL。PCR扩增条件为:94 ℃ 5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 5 min。
1.3 cis-P4H的酶活及稳定性测定
1.3.1 cis-P4H的诱导表达和纯化:
挑取工程菌单菌落至5 mL液体LB培养基中,37 ℃、180 r/min连续培养三代。将第三代菌液以10%的接种量接种至300 mL的LB培养基中,37 ℃、180 r/min培养至
OD600值为0.9时,加入IPTG至终浓度0.2 mmol/L,16 ℃、140 r/min培养过夜,空白对照为未加IPTG的工程菌。8 000 r/min离心10 min收集菌体,菌体悬浮至10 mL缓冲液(50 mmol/L PIEPS pH 7.0,100 mmol/L NaCl)中进行超声波破碎。将菌体破碎液18 000 r/min离心40 min,收集上清,采用镍柱纯化蛋白,脱盐柱(PD-10)除去咪唑和NaCl,mySPEC分光光度计定量蛋白浓度,SDS-PAGE进行蛋白纯度检测,考马斯亮蓝染色。
1.3.2 菌体密度(OD600)测定:
将菌液稀释适当倍数,用Eppendorf可见分光光度计在600 nm下测定吸光值,LB液体培养基做空白对照。
OD600=吸光值x稀释倍数。
1.3.3 cis-P4H酶活测定:
向反应体系(50 mmol/L 1,4-哌嗪二乙磺酸pH 7.0,5 mmol/L L-脯氨酸,5 mmol/L α-酮戊二酸,0.5 mmol/L硫酸亚铁,1 mmol/L维生素C)加入25 μL的酶液,终体积为 1 mL。25 ℃、140 r/min反应10 min后将反应体系放于沸水中煮10 min以终止反应,采用HPLC测定
cis-4-Hyp的生成量。根据
cis-4-Hyp的生成量计算酶活。酶活单位(U)定义为在给定反应条件下,1 min生成1 μmol
cis-4-Hyp所需的酶量。
1.3.4 cis-4-Hyp:
定量检测:取1 mL反应液,12 000 r/min离心10 min,弃沉淀,上清液备用。配制
cis-4-Hyp和L-脯氨酸标准品混合溶液(浓度均为5 mmol/L)。取混合标准溶液或反应液上清500 μL,依次加入250 μL 120 mmol/L的四硼酸钠,50 μL 0.07 mmol/L氯甲酸(9-芴甲基)酯(FMOC-Cl)乙腈溶液,蒸馏水200 μL,摇匀,常温下反应2 min,用0.22 μm微孔滤膜过滤后进样分析。参考Castelain等
[15]和Klein等
[16]方法对制备好的样品进行HPLC (C
18,4.6 mm×250 mm×5 μm,Wondasil)检测。流动相:A为0.1%三氟乙酸,B为纯乙腈。梯度洗脱程序:0-5 min,A:B (70%:30%);5-10 min,A:B (48%:52%);10-20 min,A:B (44%:56%);20-25 min,A:B (42%:58%);25-30 min,A:B (70%:30%);流速为1 mL/min。检测波长为260 nm;柱温为28 ℃;进样量为10 μL,同时以
cis-4-Hyp标准品制作标准曲线。
1.3.5 cis-P4H的稳定性测定:
将纯化后的
cis-P4H置于pH 7.0的缓冲液中,25 ℃下放置10 h,每隔1 h按1.3.3所述方法检测酶活力,每组样品重复3次。
1.4 转化条件的优化
1.4.1 转化体系与转化:
方法:按1.3.1所述方法,将工程菌培养至
OD600值为0.9时加入IPTG至终浓度0.2 mmol/L,28 ℃、140 r/min诱导培养5 h。离心收集菌体,以菌体做酶源,按每克菌体加10 mL的转化液(100 mmol/L 1,4-哌嗪二乙磺酸pH 7.0,200 mmol/L L-脯氨酸,200 mmol/L α-酮戊二酸,6 mmol/L硫酸亚铁,8 mmol/L维生素C,20 mg/L头孢替安)构建转化体系
[17],25 ℃、140 r/min条件下反应,每隔20 h取样一次,用HPLC检测转化体系中
cis-4-Hyp的生成量并计算L-脯氨酸转化率,检测方法同1.3.4。L-脯氨酸转化率=(
cis-4-Hyp生成量/L-脯氨酸量)×100%。
1.4.2 诱导起始菌体浓度(OD600)的优化:
将工程菌分别培养至
OD600值为0.5、0.7、0.9、1.3,按照1.4.1的方法构建转化体系并测定不同诱导起始菌体浓度对L-脯氨酸转化率的影响,每个处理3次重复。
1.4.3 转化体系pH的优化:
采用优化的诱导起始菌体浓度,按照1.4.1的方法构建转化体系并测定转化体系pH为5.5、6.0、6.5、7.0、7.5时对L-脯氨酸转化率的影响,每个处理3次重复。
1.4.4 转化温度的优化:
采用优化的诱导起始菌体浓度和转化体系pH,按照1.4.1的方法构建转化体系并测定转化温度为20、25、28、37 ℃对L-脯氨酸转化率的影响,每个处理3次重复。
1.4.5 正交试验:
参考单因素筛选的结果,以诱导起始菌体浓度(
OD600)、转化体系pH、转化温度为考察因素,按正交设计表L
9(3
3)设计3个因素、 3个水平的正交试验,根据L-脯氨酸转化率确定三因素最优组合。
1.4.6 转化时间的优化:
依据正交试验优化结果构建转化体系,测定转化时间为20、40、60、80、100 h时L-脯氨酸转化率,确定L-脯氨酸转化率最高的转化时间,每个处理3次重复。
2 结果与分析
2.1 工程菌的构建及验证
2.1.1 cis-P4H基因的优化结果:
如
图 1所示,优化后的
cis-P4H基因共改变了179个核苷酸和159个密码子,G+C含量为51.95%。计算得知优化前的mRNA折叠能△
G为-987.437 kJ/mol,优化后的mRNA折叠能△
G为-1 088.99 kJ/mol。
2.1.2 工程菌的验证:
按照新合成的基因序列,
cis-P4H基因分子量大小应为855 bp。PCR结果显示(
图 2),通过通用引物扩增出一条约为1 105 bp的条带,由于通用引物选自质粒,扩增产物带有质粒部分片段,因此条带大于855 bp。对重组质粒双酶切结果显示,质粒中含有分子量约为855 bp (
图 3)的片段,与预期分子量相符,含有重组质粒pET-M-3C-
cis-P4H的菌株即为构建好的工程菌。
2.2 cis-P4H酶活及稳定性
2.2.1 cis-P4H的诱导表达和纯化:
工程菌诱导表达及纯化后的蛋白电泳检测结果如
图 4所示。未经IPTG诱导的工程菌菌体破碎液(泳道1)没有目的蛋白,诱导后菌体破碎液(泳道2)、上清液(泳道3)和沉淀(泳道4)均出现一条分子量约为32.0 kD的条带,与目的蛋白理论分子量32.0 kD一致,表明
cis-P4H在工程菌中诱导表达成功。泳道7为经镍柱纯化后的
cis-P4H,分子量约为32 kD且呈单一条带。经测定蛋白浓度为4 g/L。
2.2.2 cis-P4H酶活:
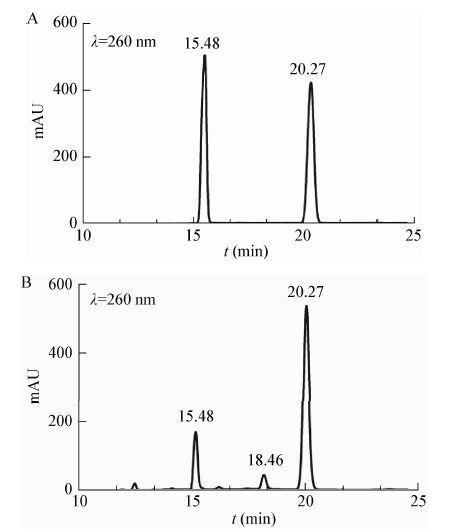
采用氯甲酸(9-芴甲基)酯对
cis-4-Hyp标准品、L-脯氨酸及
cis-P4H的催化反应产物进行衍生化处理后,利用HPLC分析,由
图 5A可知,
cis-4-Hyp标准品出现的保留时间为15.48 min,L-脯氨酸出现的保留时间为20.27 min。
图 5B在15.48 min出现保留峰,表明该物质为
cis-P4H的催化反应产物
cis-4-Hyp,20.27 min出现的保留峰应为剩余的底物L-脯氨酸。此外
cis-P4H的催化反应产物还在18.46 min出现一个保留峰,推测应为其他副产物。然后根据
cis-4-Hyp的生成量计算
cis-P4H的酶活并通过酶活与比活换算公式,得出
cis-P4H的比活为2.65 U/mg。
2.2.3 cis-P4H的稳定性:
如
图 6所示,
cis-P4H随着反应时间的延长,酶活力迅速下降。当处理时间达到6 h后,酶活力几乎为0。计算得知其半衰期为2.32 h,稳定性较差。
2.3 转化条件的优化
2.3.1 诱导起始菌体浓度、转化体系pH及转化温度的优化:
诱导起始菌体浓度(
OD600)、转化体系pH及转化温度的优化结果如
图 7所示。
图 7A显示,诱导
cis-P4H表达的最佳起始菌体浓度为
OD600=0.9;
图 7B和
图 7C显示,转化体系的适宜pH为6.5,转化温度为28 ℃。
2.3.2 正交试验结果:
以诱导起始菌体浓度(
OD600)、转化体系pH、转化温度为考察因素,按L
9(3
3)正交表设计的试验方案及结果如
表 1所示,由
R值(极差)的大小判断,对L-脯氨酸转化率影响程度从大到小依次为
A>
B>
C,即影响因素最大的为诱导起始菌体浓度(
OD600),其次是转化体系pH,影响因素最小的是转化温度。
K值大小反映每个因素在不同水平下对L-脯氨酸转化率影响程度,
K值越大对L-脯氨酸转化率影响程度越大。从3个因素各自的
K值中选择最大值组合在一起便得到三因素的最优组合,因此最适转化条件为
A2B2C3,即采用
OD600为0.9时加入IPTG诱导培养后获得的菌体构建转化体系,转化体系pH为6.5,转化温度为31 ℃。在正交试验确定的转化条件下,L-脯氨酸转化率达到83.33%,比单因素筛选结果组合条件下的L-脯氨酸转化率68.23%提高了1.22倍。
表 1 正交试验L9(33)结果及极差分析
Table 1 The analysis of range and results of orthogonal experiment
|
实验号
Medium No.
|
A
OD600
|
B
pH
|
C
Temperature
(℃)
|
转化率
Transformation rate (%)
|
|
1
|
1 (0.7)
|
1 (6.0)
|
1 (25)
|
37.25
|
|
2
|
1 (0.7)
|
2 (6.5)
|
2 (28)
|
45.13
|
|
3
|
1 (0.7)
|
3 (7.0)
|
3 (31)
|
29.81
|
|
4
|
2 (0.9)
|
1 (6.0)
|
2 (28)
|
56.97
|
|
5
|
2 (0.9)
|
2 (6.5)
|
3 (31)
|
83.33
|
|
6
|
2 (0.9)
|
3 (7.0)
|
1 (25)
|
37.30
|
|
7
|
3 (1.1)
|
1 (6.0)
|
3 (31)
|
36.04
|
|
8
|
3 (1.1)
|
2 (6.5)
|
1 (25)
|
49.58
|
|
9
|
3 (1.1)
|
3 (7.0)
|
2 (28)
|
50.23
|
|
K1
|
37.40
|
43.42
|
41.38
|
|
|
K2
|
59.20
|
59.35
|
49.73
|
|
|
K3
|
45.28
|
39.11
|
50.78
|
|
|
R
|
21.80
|
20.24
|
9.40
|
|
2.3.3 最适转化时间的确定:
结果如
图 8所示,当转化时间为60 h时,L-脯氨酸的转化率最高,然而随后L-脯氨酸的转化率开始下降,并且根据HPLC结果显示,18.46 min处的保留峰的面积逐渐变大,推测原因可能是随着转化时间的延长,
cis-4-Hyp部分分解为其他物质,因此确定最适转化时间为60 h。
3 讨论
生物转化是利用酶或者生物有机体(细胞、细胞器、组织等)作为催化剂进行化学转化的过程,因具有特异的立体选择性、对环境友好、产率高等特点而备受关注。近年来,在反式-4-L-羟脯氨酸的生物转化及工业化生产方面有一定的研究。Shibasaki等将反式-4-L-脯氨酸羟化酶基因片段重组到载体并转化至大肠杆菌,实现了反式-4-L-脯氨酸羟化酶的异源表达。该基因工程菌在发酵罐中发酵100 h后反式-4-L-羟脯氨酸的产量为41 g/L[18]。刘合栋等通过优化反式-4-脯氨酸羟化酶基因和发酵条件,使得工程菌在发酵罐中发酵48 h后反式-4-L-羟脯氨酸的产量为42.5 g/L[19],大大提高了生产效率。cis-P4H和反式-4-L-脯氨酸羟化酶有着相似的分子结构和酶学性质。依据反式-4-L-羟脯氨酸的生物转化思路进行cis-P4H的异源表达,有望实现cis-4-Hyp的生物转化。本研究依据大肠杆菌对密码子偏好性进行了cis-P4H基因密码子优化,通过表达载体的构建和转化得到了能够高效表达cis-P4H的大肠杆菌BL21-CodonPlus工程菌。该工程菌中cis-P4H的比活为2.65 U/mg,比Hara和Kino报道的两种cis-P4H的比活提高了约3.8倍。表明通过密码子优化可以使cis-P4H基因更适合在大肠杆菌中表达,从而实现提高酶活性的目的。
得到高效表达的工程菌后就是建立有效的cis-4-Hyp生物转化法。通过研究发现cis-P4H在体外的稳定性较差,且提取费时、成本高,利用酶催化生产cis-4-Hyp没有应用价值。全细胞催化是利用完整的生物有机体作为催化剂进行化学转化的过程,本研究以离心获得的菌体为酶源,在含有底物L-脯氨酸的转化液中实现了cis-4-Hyp的生物转化,通过单因素和正交试验设计确定的最优转化条件为:将工程菌培养至OD600值为0.9时加入
IPTG至终浓度0.2 mmol/L,诱导5 h后收集菌体,用含有底物L-脯氨酸的转化液(pH 6.5)重悬,在31 ℃下转化60 h。全细胞催化过程是一个复杂的细胞学和酶学过程,Falcioni等的研究表明羟脯氨酸的转化效率取决于重组大肠杆菌对底物L-脯氨酸的摄取速率以及脯氨酸在细胞内的分解代谢速率[20]。本研究在转化体系中添加了头孢替安,头孢替安作为一种抗生素可以分解大肠杆菌的细胞壁,利于底物L-脯氨酸的进入和产物cis-4-Hyp的释放,因而推测本研究L-脯氨酸的高转化率可能与加入头孢替安增加了菌体细胞通透性有关。当然,本研究只是为cis-4-Hyp的工业化生产提供了科学依据,最终实现真正产业化仍有很长的路要走。Theodosiou等报道指出,通过敲除putA可以提高脯氨酸的利用率[21],在后续研究中计划尝试敲除putA以进一步提高L-脯氨酸转化率;同时,在本研究结果基础上,拟通过高密度发酵技术获得大量菌体、放大转化体系,继续优化转化条件,以期为实现cis-4-Hyp的工业化生产奠定基础。






 2016, Vol. 43
2016, Vol. 43