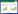扩展功能
文章信息
- 王正, 吴玲玉, 刘玉洁, 张雪洪, 黄显清
- WANG Zheng, WU Ling-Yu, LIU Yu-Jie, ZHANG Xue-Hong, HUANG Xian-Qing
- 假单胞菌H78中PhoR/B系统对磷元素吸收及其藤黄绿菌素合成的调控
- Regulation of PhoR/B system on utilization of phosphorus and Plt biosynthesis in Pseudomonas sp. H78
- 微生物学通报, 2016, 43(9): 1881-1886
- Microbiology China, 2016, 43(9): 1881-1886
- DOI: 10.13344/j.microbiol.china.160256
-
文章历史
- 收稿日期: 2016-03-29
- 接受日期: 2016-05-16
- 优先数字出版日期(www.cnki.net): 2016-06-08
双组分系统广泛存在于微生物中,由感应外界环境信号变化的组氨酸蛋白激酶和一个应答调节蛋白组成。而磷元素作为微生物生长所需要的重要营养物质,磷离子代谢和平衡受到PhoR/PhoB双组分系统严格的调控,PhoR蛋白属于组氨酸蛋白激酶,可以感受外界磷离子浓度变化,发生自我磷酸化,然后将磷酸基团转移到应答调节蛋白PhoB,激活PhoB调控靶基因的表达[1]。PhoR/B系统存在于多种细菌中,可以调控细菌糖代谢、运动性、抗氧化性以及毒力等多个方面,也有文献报道PhoR/B系统可以调控抗生素的合成[2]。
假单胞菌(Pseudomonas protegens) H78分离于油菜根际,能够分泌多种抗菌物质,包括藤黄绿菌素(Plt)、硝吡咯菌素、2,4-二乙酰基间苯三酚以及氢氰酸等,具有较好的生防功能。Plt属于聚酮类的广谱型抗生素,具有良好的抗卵菌和真菌作用[3],尤其对植物致病菌终极腐霉具有很好的抑制作用,但其在野生型菌株中产量很低。然而PhoR/B系统在假单胞菌中调控研究较少,目前尚未发现关于PhoR/B系统对Plt合成调控的报道,因此研究其调控机制有重要的意义。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒: 研究中所用到的菌株和质粒见表 1。| Strains/plasmids | Genotype and relevant characteristics | Reference |
| P. protegens | ||
| H78 | Wild type,Spr | This lab |
| H78ΔphoBR | In frame deletion of phoB and phoR | This study |
| E. coli | This lab | |
| DH5α | supE44 ΔlacU169(Φ80 lacZΔM15) hsdR17 recA1 endA1 gyrA96 thi-1 relA1 | This lab |
| S17 | res- pro mod+ integrated copy of RP4,mob+ | This lab |
| Plasmids | ||
| pK18mobsacB | Broad-host-range gene replacement vector; sacB,Kmr | [4] |
| pK18-phoBR | pK18mobsacB with Xba I- EcoR I insert of 454 bp and 471 bp segments flanking phoB and phoR,Kmr | This study |
| pME6015 | pVS1-p15 A shuttle vector for constructing the translational lacZ fusions,Tcr | This lab |
| p6015-pstS | A pstS′-′lacZ translational fusion containing a 252 bp fragment covering -237 bp to +15 bp (relative to the pstS translational start site) in pME6015,Tcr | This study |
常规分子生物学实验方法参照文献[6]。依据假单胞菌株H78的全基因组序列设计引物。扩增用于phoBR基因敲除的上游片段,所用引物对:phoBR-P1:5′-GCTCTAGATGTGGTTGTCAGGAA TCGGAC-3′ (下划线为Xba I的识别位点,下同);phoBR-P2:5′-TGGTGATGTAGTCGTCGGCTCC-3′。扩增用于phoBR基因敲除的下游片段,所用引物对:phoBR-P3:5′-AGCCGACGACTACATCA CCACATCACCCTGGAAGCCGACG-3′;phoBR-P4:5′-GCGAATTCCAAGTTACGCAATGTAGCGGC-3′ (EcoR I)。以pstS′-F:5′-CCGGAATTCCCACCACC CTGTAGCCGCTCAGG-3′ (EcoR I)和pstS′-R:5′-AAAACTGCAGACGCTTCAGTTTCATGCCTTACT-3′ (Pst I)为引物对,H78基因组为模板扩增DNA片段,构建pstS′-′lacZ融合质粒命名为p6015-pstS翻译融合质粒。
PCR反应体系(50 μL):10×KOD Plus Neo buffer 5 μL,dNTPs (2.5 mmol/L) 5 μL,Mg2+ (25 mmol/L) 3 μl,KOD Plus Neo DNA聚合酶1 μL,引物 (10 μmol/L)各1.5 μL,DNA模板0.5 μL,ddH2O 32.5 μL。PCR反应条件:94 ℃ 5 min;98 ℃ 10 s,55-65 ℃ 30 s,68 ℃ 0.5-3 min,共30个循环;68 ℃ 10 min。
1.3 phoB和phoR基因及上下游片段的克隆、连接到pK18 mobsacB质粒上及测序DNA片段纯化、质粒抽提、酶切、酶连等均参照试剂(盒)说明书方案进行操作,DNA测序委托深圳华大基因科技有限公司。
1.4 phoB和phoR基因敲除采用同源重组无痕敲除的方法将phoB和phoR基因同时敲除,具体方法参照文献[7]。
1.5 Plt产量测定Plt测定方法参照文献[8-9]。每隔12 h取样 一次,每个菌株每次实验中设3个平行样,测定Plt产量及细胞生长密度(OD600)。独立重复实验2-3次。
1.6 β-半乳糖苷酶活性的测定β-半乳糖苷酶活性测定按照文献方法进行操作[3, 10],每个样品设3个平行,独立重复2-3次。
2 结果与分析 2.1 phoB和phoR基因的克隆及比对以荧光假单胞菌H78基因组为模板扩增phoB和phoR基因,通过NCBI Blast发现phoB基因共690 bp,与荧光假单胞菌CHA0和荧光假单胞菌Pf-5均有99%的相似性;而与铜绿假单胞菌(Pseudomonas aeruginosa) M18有88%的相似性。phoR基因全长为1 329 bp,与荧光假单胞菌CHA0和荧光假单胞菌Pf-5的phoR基因均有99%的相似性,与铜绿假单胞菌M18中的phoR基因有84%的相似性。
2.2 H78phoBR突变株的构建采用同源重组的方法敲除phoB-phoR基因,命名为H78phoBR。如图 1A所示,以H78基因组为模板,利用phoBR-P1/phoBR-P2和phoBR-P3/phoBR-P4两对引物对分别扩增phoB-phoR基因上、下游片段,其中上游片段大小为454 bp和下游片段大小471 bp,然后通过融合PCR连接上下游片段。采用EcoR I/ Xba I双酶切融合片段,将酶切片段克隆到pK18mobsacB质粒中,得到pK18-phoBR重组质粒。将重组质粒转化到E. coli S17中,将其作为供体菌,H78野生型菌株作为受体菌,在无抗平板上共培养。质粒pK18-phoBR转入H78菌株后,不能在染色体外自主复制,可与H78基因组发生同源重组。用含Amp和Km抗生素的平板进行筛选单交换菌株。然后将在双抗平板上生长的菌涂布在含10%蔗糖的LB平板上,促使其完成双交换,将该平板上生长的单克隆分别影印在含Amp和Km抗生素的平板上,在Amp平板上生长而在Km平板不生长,即发生双交换,PCR筛选突变株,结果如图 1B所示。
|
| 图 1 phoB和phoR基因突变的物理图谱(A)和突变株H78phoBR的PCR鉴定(B) Figure 1 Physical map for the knockout of phoB and phoR (A) and confirmation of the phoB and phoR mutant by PCR (B) 注:WT:H78野生型菌株PCR片段;H78phoBR:突变株PCR片段. Note: WT: PCR fragment of H78; H78phoBR: PCR amplifying fragment of H78phoBR genome. |
|
|
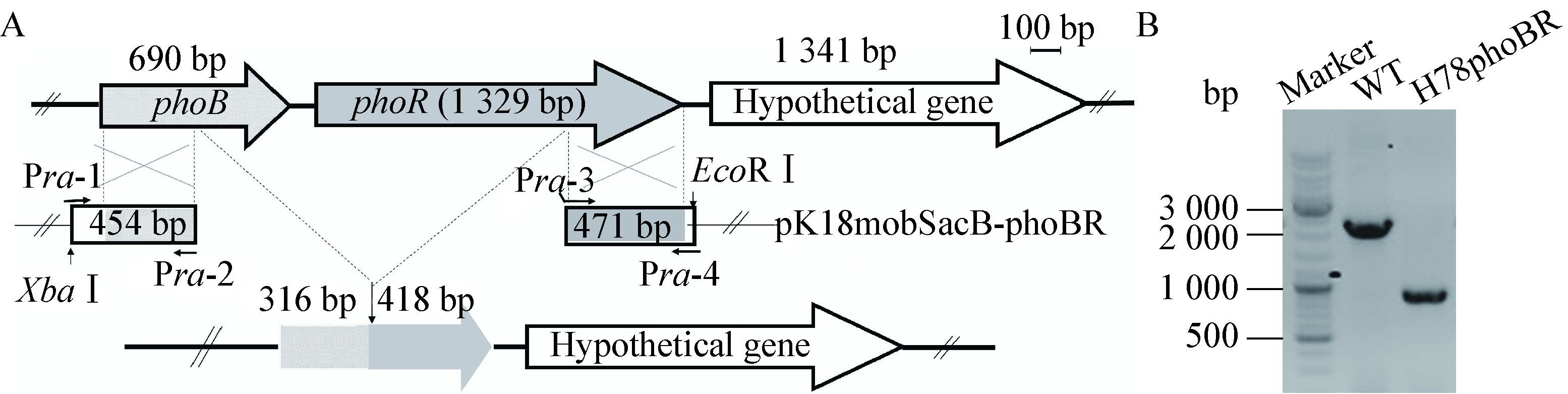
Pst系统是磷特异转运系统,由4个蛋白PstS、PstC、PstA和PstB组成一个ABC转运系统,可以高效捕捉细胞周质中的无机磷低速转运到细胞质中[11]。PstS蛋白是细胞周质蛋白,对无机磷具有高效的亲和力;PstC和PstA是细胞膜通道蛋白,形成Pi的转运通道;PstB是依赖ATP的通透酶,用来提供Pi转运所需要的能量。与pstS、pstC、pstA和pstB相邻的基因还包括phoU,PhoU蛋白能够抑制PhoR/B的活性。Pst转运系统基因结构以及构建pstS′-′lacZ融合质粒p6015-pstS示意图,如图 2所示。
|
| 图 2 Pst转运系统基因物理图谱以及p6015-pstS 翻译融合质粒构建示意图 Figure 2 Physical map of the Pst transport system and sketch map of the constructing translational fusion plasmid p6015-pstS |
|
|
通过测定p6015-pstS质粒在H78以及H78phoBR菌株中的LacZ酶活,研究PhoR/B对pstS基因表达的调控作用,实验结果如图 3所示。从实验结果可以看出pstS′-′lacZ融合质粒在野生型H78菌株中LacZ酶活大约有450 Miller unit,而在H78phoBR突变株中只有约30 Miller unit。由LacZ酶活数据可知,两个菌株中pstS的表达量相差约15倍。表明PhoR/B蛋白对pstS操纵子表达存在正调控作用,因此PhoR/B蛋白可以通过调控Pst系统进而调控无机磷的吸收。

|
| 图 3 PhoR/B对pstS基因表达的影响 Figure 3 Effect of PhoR/B on expression of the pstS |
|
|
PhoR/B正调控pstS基因的表达,因此PhoR/B可以通过调控Pst系统调控无机磷的吸收。分别在磷饥饿和磷丰富的条件下,研究H78和H78phoBR菌株的生长情况。磷利用基本培养基以K2HPO4作为磷源,设计了3个磷元素的浓度:0、0.05和 2.00 mmol/L K2HPO4。H78及H78phoBR在磷利用基本培养基培养时初始接种OD600为0.05,28 ℃、180 r/min培养。实验结果如图 4所示,当培养基中不加K2HPO4时H78和H78phoBR生长受到严重的影响,并且H78phoBR生长的更差,最大OD600为0.1,而H78最大OD600为0.32,其生长相差约为 3倍,说明在极度缺乏磷元素时PhoR/B可以正调控无机磷吸收以维持细胞生长。当培养基中加入0.05 mmol/L K2HPO4时,培养基处于磷饥饿状态,此时H78和H78phoBR生长存在较大的差异,H78phoBR在12 h达到最大OD600约为0.32;而H78在12 h后继续生长,在36 h时OD600达到了0.89,其生长差异也达到了约3倍。当培养基中加入2.00 mmol/L K2HPO4时,培养基中含有丰富磷元素,此时H78和H78phoBR生长基本无差异,在12 h左右生长达到的最大OD600约为2.4。综上所述,PhoR/B可以在磷元素缺乏时正调控磷元素的吸收和利用,以便维持细胞的正常生长。
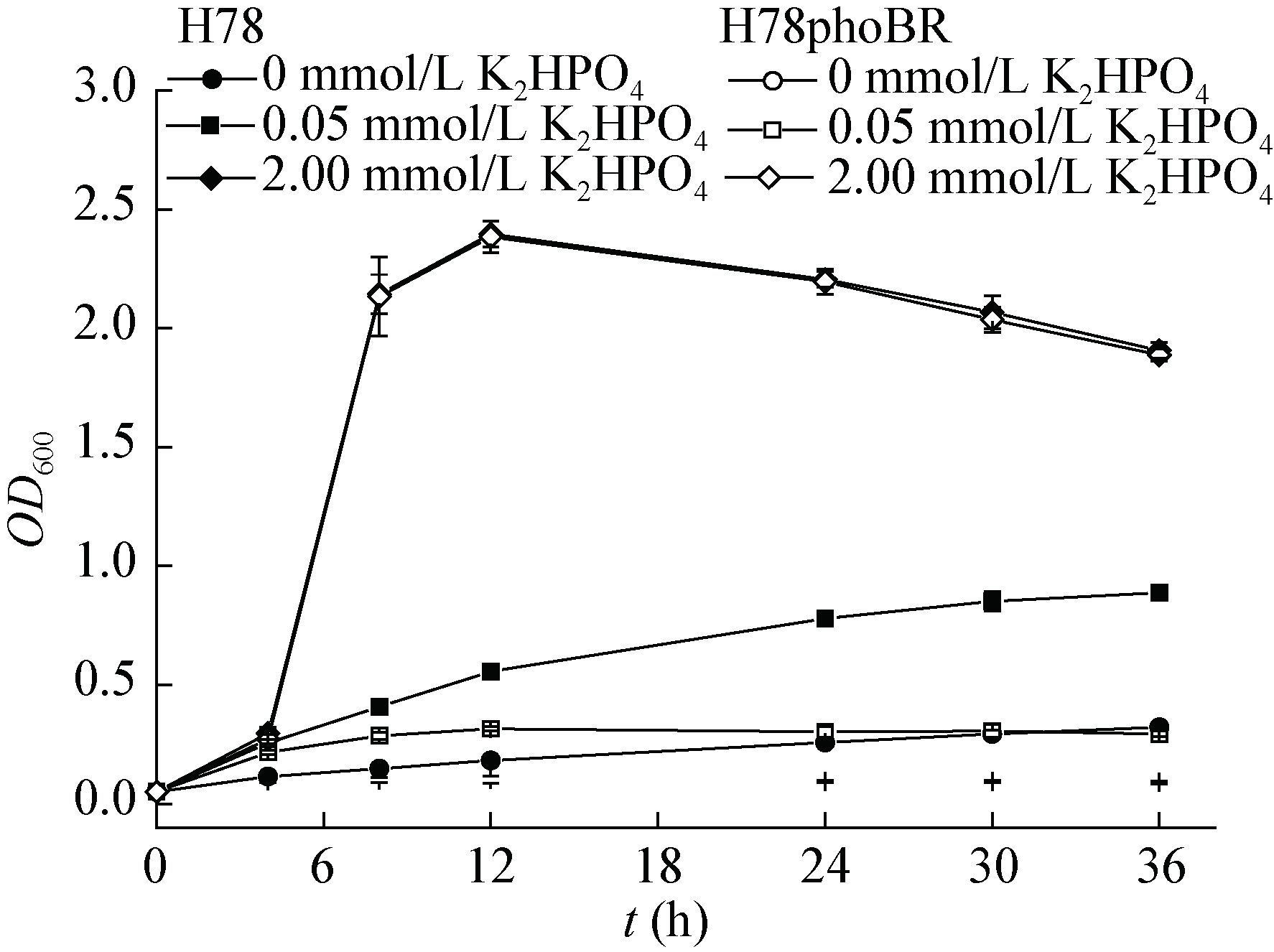
|
| 图 4 H78和H78phoBR菌株在不同磷元素的浓度下生长情况 Figure 4 Growth of H78 and H78phoBR in different concentration of K2HPO4 |
|
|
为了研究双组分调控系统PhoR/PhoB对Plt合成的调控作用,在KMB培养基中测定其生长以及Plt产量。其生长结果如图 5A所示,在整个培养过程中,H78和H78phoBR菌株在KMB培养基中细菌生长差异不大,在其生长后期时,突变株H78phoBR要比野生型H78生长略差。分析可能由于培养后期,培养基中磷元素的含量较低,而突变株H78phoBR中调控磷利用和吸收的调控元件被破坏,影响磷元素的吸收,进而影响细胞生长。

|
| 图 5 假单胞菌H78和H78phoBR菌株细胞生长曲线(A) Plt产量测定(B) Figure 5 Cell growth (A) and Plt production (B) of the wild-type H78 strain and H78phoBR strain in KMB broth |
|
|
PhoR-PhoB对Plt合成的调控结果如图 5B所示,突变株H78phoBR的Plt产量比H78的略低。培养12 h时细胞处于对数生长期,分泌的Plt量较少;当培养到36 h时Plt的产量达到最大值。野生型H78的Plt产量大约为20 mg/L,而突变株H78phoBR的Plt产量大约为12 mg/L,突变株的plt产量比野生型降低了约1倍。结果表明,PhoR/B对Plt合成存在一定程度的正调控作用。
3 讨论PhoB作为一个广泛存在各种细菌中的全局性调控蛋白,参与调控多种生物学功能。研究发现在假单胞菌H78中PhoR/B系统对Pst磷转运系统和Plt的合成都有一定的调控作用。PhoB蛋白磷酸化后构象会发生改变,沿着α4-β5-α5面形成二聚体[12],二聚体的PhoB可以结合在特定的保守DNA序列(pho box),进而可以促进靶基因的转录[13]。通过X-ray 晶体学和点突变技术发现,PhoB可以促使σ70与-35序列的结合[14]。在大肠杆菌中,pho box典型的序列为CTGTCAT-A(AT)A(TA)-CTGT (CA)A(CT) [15-16],同样的在新月柄杆菌(Caulobacter crescentus)也发现类似的序列,即一段富含AT区域两边存在一个6 bp的正向重复序列[1]。同时在假单胞菌H78中发现,pstS基因起始密码子ATG上 游-78 bp到-94 bp (起始密码子ATG为+1)之间存在TTCATC-TAATT-GTCATA类似pho box的序列。预测PhoB可能结合在此位点,促进pstS转录,进而促进无机磷的转运。然而,在pltL和pltR基因的非编码区发现到有类似的序列,分析PhoB对Plt的合成调控作用可能是间接的。综上所述,通过本文研究初步鉴定PhoB对Pst磷转运系统和Plt的调控作用,为遗传改造假单胞菌H78从而提高其生物防治效果奠定了一定的基础。
| [1] | Lubin EA, Henry JT, Fiebig A, et al. Identification of the PhoB regulon and role of PhoU in the phosphate-starvation response of Caulobacter crescentus[J]. Journal of Bacteriology , 2015, 198 (1) : 187–200. |
| [2] | Gristwood T, Fineran PC, Everson L, et al. The PhoBR two-component system regulates antibiotic biosynthesis in Serratia in response to phosphate[J]. BMC Microbiology , 2009, 9 (1) : 112. DOI:10.1186/1471-2180-9-112 |
| [3] | Lu JS, Huang XQ, Li K, et al. LysR family transcriptional regulator PqsR as repressor of pyoluteorin biosynthesis and activator of phenazine-1-carboxylic acid biosynthesis in Pseudomonas sp. M18[J]. Journal of Biotechnology , 2009, 143 (1) : 1–9. DOI:10.1016/j.jbiotec.2009.06.008 |
| [4] | Schäfer A, Tauch A, Jäger W, et al. Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19: selection of defined deletions in the chromosome of Corynebacterium glutamicum[J]. Gene , 1994, 145 (1) : 69–73. DOI:10.1016/0378-1119(94)90324-7 |
| [5] | Gebhard S, Tran SL, Cook GM. The Phn system of Mycobacterium smegmatis: a second high-affinity ABC-transporter for phosphate[J]. Microbiology , 2006, 152 (11) : 3453–3465. DOI:10.1099/mic.0.29201-0 |
| [6] | 萨姆布鲁克 J, 弗里奇 EF, 曼尼阿蒂斯 T. 分子克隆实验指南[M]. 金冬雁, 黎孟枫, 译. 第2版. 北京: 科学出版社, 1992 Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: a Laboratory Manual[M]. Translated by Jin DY and Li MF. 2nd Edition. Beijing: Science Press, 1992(in Chinese). |
| [7] | Du XL, Li YQ, Zhou Q, et al. Regulation of gene expression in Pseudomonas aeruginosa M18 by phenazine-1-carboxylic acid[J]. Applied Microbiology and Biotechnology , 2015, 99 (2) : 813–825. DOI:10.1007/s00253-014-6101-0 |
| [8] | Huang XQ, Zhu DH, Ge YH, et al. Identification and characterization of pltZ, a gene involved in the repression of pyoluteorin biosynthesis in Pseudomonas sp. M18[J]. FEMS Microbiology Letters , 2004, 232 (2) : 197–202. DOI:10.1016/S0378-1097(04)00074-6 |
| [9] | Huang XQ, Yan A, Zhang XH, et al. Identification and characterization of a putative ABC transporter PltHIJKN required for pyoluteorin production in Pseudomonas sp. M18[J]. Gene, 2006, 376(1): 68-78 |
| [10] | Ge YH, Huang XQ, Zhang XH, et al. Analysis of mechanism and relationship of GacA and RsmA, two regulators of antibiotics production in Pseudomonas sp. M18[J]. Acta Microbiologica Sinica , 2006, 46 (4) : 531–536. (in chinese) 葛宜和, 黄显清, 张雪洪, 等. 假单胞菌M18调控因子GacA与RsmA的相关性及对抗生物质合成代谢调控机制的分析[J]. 微生物学报 , 2006, 46 (4) : 531–536. |
| [11] | van Dien SJ, Keasling JD. A dynamic model of the Escherichia coli phosphate-starvation response[J]. Journal of Theoretical Biology , 1998, 190 (1) : 37–49. DOI:10.1006/jtbi.1997.0524 |
| [12] | Mack TR, Gao R, Stock AM. Probing the roles of the two different dimers mediated by the receiver domain of the response regulator PhoB[J]. Journal of Molecular Biology , 2009, 389 (2) : 349–364. DOI:10.1016/j.jmb.2009.04.014 |
| [13] | Blanco AG, Sola M, Gomis-Rüth FX, et al. Tandem DNA recognition by PhoB, a two-component signal transduction transcriptional activator[J]. Structure , 2002, 10 (5) : 701–713. DOI:10.1016/S0969-2126(02)00761-X |
| [14] | Blanco AG, Canals A, Bernués J, et al. The structure of a transcription activation subcomplex reveals how σ70 is recruited to PhoB promoters[J]. The EMBO Journal , 2011, 30 (18) : 3776–3785. DOI:10.1038/emboj.2011.271 |
| [15] | Baek JH, Lee SY. Novel gene members in the Pho regulon of Escherichia coli[J]. FEMS Microbiology Letters , 2006, 264 (1) : 104–109. DOI:10.1111/fml.2006.264.issue-1 |
| [16] | Yang C, Huang TW, Wen SY, et al. Genome-wide PhoB binding and gene expression profiles reveal the hierarchical gene regulatory network of phosphate starvation in Escherichia coli[J]. PLoS One , 2012, 7 (10) : e47314. DOI:10.1371/journal.pone.0047314 |
 2016, Vol. 43
2016, Vol. 43