扩展功能
文章信息
- 保安安, 张娟, 张红梅, 柯文灿, 陈明, 荆佩欣, 郭旭生
- BAO An-An, ZHANG Juan, ZHANG Hong-Mei, KE Wen-Can, CHEN Ming, JING Pei-Xin, GUO Xu-Sheng
- 青藏高原垂穗披碱草青贮饲料中乳酸菌的多样性及低温发酵菌株的筛选
- Screening of low-temperature fermentation lactic acid bacteria from silage of Elymus nutans growing on the Qinghai-Tibetan Plateau
- 微生物学通报, 2016, 43(8): 1785-1794
- Microbiology China, 2016, 43(8): 1785-1794
- DOI: 10.13344/j.microbiol.china.150611
-
文章历史
- 收稿日期: 2015-08-13
- 接受日期: 2015-11-02
- 优先数字出版日期(www.cnki.net): 2015-12-31
2. 兰州大学草地农业科技学院 草地农业生态系统国家重点实验室 甘肃 兰州 730020
2. State Key Laboratory of Grassland and Agro-Ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou, Gansu 730020, China
青藏高原年平均气温较低,在牧草收获季节平均温度为15-20°C,而一般环境中乳酸菌的最适生长温度在37°C左右[1],温度成为限制高原地区牧草青贮的重要因素。如能筛选出在低温条件下生长性能较好的乳酸菌并添加至青贮饲料中,将能改善青藏高原牧草青贮的问题。由于青藏高原特殊的环境条件,传统的商品化乳酸菌添加剂在青藏高原地区的应用受到了一定的限制。越来越多的学者希望能发掘青藏高原本土乳酸菌的特异性,并将其应用于当地的生产生活中。大量研究表明,长期生存于特殊环境中的菌株为了适应严酷的生存条件,适应能力会有所提高。崔国艳等[2]发现,岩石微细缝隙中生存的菌株靠吃“铁、镍、甲烷”等生存,以维持它们的生命活动。Huang等和Chen等也发现,不同来源的乳酸菌益生性和耐酸耐热性均呈现出一定的差异[3-4]。乳酸菌种类也随环境条件而发生改变,如韩吉雨对不同地区青贮饲料中乳酸菌多样性进行研究,发现不同地区乳酸菌种类相似性较低[5]。在我国青藏高原地区,乳酸菌长期生存在相对低温环境中,其多样性和生理生化特性也会受到一定的影响。高静等研究发现,青藏高原藏嵩草上附着的乳酸菌具有更强的碳源利用能力和耐酸性[6];陈芝兰等发现,从西藏地区酸奶中分离出的乳酸菌具有更广泛的温度适应范围[7]。但到目前为止,尚未见关于青藏高原青贮饲料中乳酸菌的多样性及其低温条件下生长特性的研究报道。因此,本试验以青藏高原可供家畜采食的典型优良牧草——垂穗披碱草及其自身附着的乳酸菌为青贮底物,模拟高原地区牧草收获季节的气候条件,并尽量避免青贮过程对乳酸菌种类的影响,从不同温度和发酵阶段的青贮饲料中分离纯化乳酸菌,探明青藏高原垂穗披碱草青贮饲料中乳酸菌的多样性,筛选出适合高原地区牧草青贮的乳酸菌菌株,为高原地区提供有更效的牧草青贮乳酸菌添加剂。
1 材料与方法 1.1 试验材料供青贮的原料为青海省果洛藏族自治州玛沁县大武镇大武滩青海畜牧兽医科学院试验田(100°02′-100°13′E,34°27′-34°31′N,海拔3 800 m)种植的垂穗披碱草,在开花期(2012年7月19日)收割。
MRS培养基:牛肉膏10.00 g,酵母提取物5.00 g,无水乙酸钠5.00 g,蛋白胨10.00 g,磷酸氢二钾2.00 g,葡萄糖20.00 g,吐温-80 1 mL,MgSO4·H2O 0.58 g,柠檬酸铵2.00 g,MnSO4·H2O 0.17 g,溶解于1 L蒸馏水中。
主要试剂和仪器:牛肉膏、蛋白胨,AOBOX公司;细菌总基因组DNA提取试剂盒,天根生化科技有限公司;YJ-875超净工作台,苏州净化设备公司;MLS-3780高压灭菌锅,三洋公司;Microfuge 18型台式离心机,BECKMAN公司;U-2910紫外可见分光光度计,日立公司。
分析得出其干物质、粗蛋白、水溶性碳水化合物、中性洗涤纤维和酸性洗涤纤维的含量分别为31.92%、8.88%、7.9%、66.50%和36.47%。
1.2 试验方法 1.2.1 青贮制作: 将采集的新鲜整株垂穗披碱草切至2-3 cm长,晾晒4 h左右,待其水分含量降至65%左右,按200 g/袋装入30 cm×23 cm聚乙烯青贮袋中,密封后置于放有冰袋的泡沫盒中,第2天早上带回实验室,分别置于5、15和25°C恒温培养箱中进行青贮,将青贮前的原样和青贮2、4、6、8、12、14、30和60 d后的样品分别取样进行乳酸菌的分离纯化。 1.2.2 乳酸菌的分离纯化: 在超净工作台中将青贮样品开封取样,称取10 g放入装有90 mL无菌生理盐水的250 mL三角瓶中,摇床180 r/min室温振荡60 min,用无菌水按照10-1至10-5进行稀释,选取适当的浓度,利用平板划线法在37°C厌氧环境中进行乳酸菌的培养。培养48 h后根据乳酸菌菌落的颜色、大小、光泽和透明程度等,挑取有透明圈的单菌落进行分离,然后进行革兰氏染色、过氧化氢酶检验和油镜镜检[8]。凡是革兰氏染色阳性、过氧化氢酶阴性的菌株疑似其为乳酸菌并以划线的方式在MRS固体培养基上继续分离纯化培养2次,纯化后的菌株在光学显微镜下进行形态学检测,并将纯化得到的单菌株接种到MRS液体培养基37°C厌氧培养12 h后加入10%的二甲基亚砜,在-80°C下保存备用。 1.2.3 乳酸菌的鉴定: (1) DNA的提取。将保存的乳酸菌培养液按10%接种至MRS液体培养基中,37°C厌氧培养至少12 h活化后进行DNA的提取。DNA的提取按照试剂盒使用方法进行。 (2) PCR扩增16S rRNA基因序列。引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-AAGTCGTAACAAGGTAACC-3′)由上海美吉生物技术有限责任公司合成。PCR反应体系:Premix Taq 25μL,引物27F和1492R (10μmol/L)各1μL,补充灭菌蒸馏水至50μL。PCR反应条件:95°C 5 min;95°C 30 s,55°C 30 s,72°C 90 s,循环30次;72°C 5 min。扩增反应完毕后,取5μL扩增产物与等量的6×Loading buffer混合,加样于预先制备溴化乙锭染色的1%的琼脂糖凝胶进行电泳,检测产量。 (3)16S rRNA基因序列测序。将PCR产物送样测序,测序由上海美吉生物技术有限责任公司完成。 16S rRNA基因序列同源性分析及其系统发育树构建。将乳酸菌菌株16S rRNA基因序列用BLAST (http://blast.ncbi.nlm.nih.gov/blast.cgi)在GenBank中搜索,与待测菌株相似性最高的已知分类地位的菌种比对,初步确定待测菌株的属种。然后从GenBank数据库中下载已知乳酸菌菌株的16S rRNA基因序列,用ClustalX进行序列比对后,用MEGA 4.0的UPGMA法构建系统发育树[9],进行1 000次Bootstrap检验。利用16S rRNA基因序列同源性分析的方法进行菌种的鉴定。 1.2.4 耐低温乳酸菌的筛选: (1)培养基筛选。将单个乳酸菌接种至MRS液体培养基中,37°C恒温厌氧培养24 h,稀释一定倍数使乳酸菌数量为108 cfu/ml,分别按所需培养液体积3%的比例将稀释后的乳酸菌接种于MRS液体培养基中,于15°C条件下厌氧培养。用分光光度计分别于培养8、12、24、36、48和60 h后在600 nm处测定其OD值,每种菌挑选在此低温下生长性能最好的一株,于10、15和25°C条件下培养8、12、24、36、48和60 h后分别测定其OD值。 (2)绿汁发酵液筛选。采集孕穗期黑麦草2 kg,将黑麦草与水按照1:2.5的质量比混匀后用榨汁机获取绿汁发酵液,用4层纱布过滤,1 000 r/min离心5 min后灭菌,用于筛选优良乳酸菌。按10%的接种量将乳酸菌接入灭菌的MRS培养基中活化菌种,接种后于37°C厌氧培养24 h后,稀释使乳酸菌数量为108 cfu/ml,按所需培养液体积3%的比例将乳酸菌接种于绿汁发酵液中,置于15°C和25°C条件下培养,培养3 d后测定发酵液pH值。 1.3 数据统计与分析基础数据利用Excel软件处理并制作图表,用SPASS软件进行方差分析与Duncan多重比较。
2 结果与分析 2.1 青藏高原垂穗披碱草青贮饲料中乳酸菌的多样性根据菌落形状、大小、边缘以及隆起程度等,从不同温度和发酵阶段的垂穗披碱草青贮饲料中共分离得到108株菌,所有菌株革兰氏染色阳性,过氧化氢酶呈现阴性反应,油镜镜检发现其中乳杆菌50株、球菌58株。通过16S rRNA基因序列测定,经BLAST比对,所有菌株与基因库中参考菌株相似性均达到了99%以上(表 1),每种菌各选1株作为代表菌株构建系统发生树,与BLAST比对结果也呈现出高度一致性(图 1)。由表 1和图 1可知,108株菌分属于乳杆菌属、片球菌属、乳球菌属、明串珠菌属、魏斯氏菌属和肠球菌属6个属,总共18个种,其中杆菌属有干酪乳杆菌、植物乳杆菌、短乳杆菌、弯曲乳杆菌、卷曲乳杆菌、棒状乳杆菌和清酒乳杆菌7个种,片球菌属有乳酸片球菌和戊糖片球菌2个种,乳球菌属有乳酸乳球菌1个种,明串珠菌属有肠膜明串珠菌、冷明串珠菌、乳明串珠菌和柠檬明串珠菌4个种,魏斯氏菌属有食窦魏斯氏菌和绿色魏斯氏菌2个种,肠球菌属有屎肠球菌和耐久肠球菌2个种。从系统发育树可看出,菌株24与82可鉴定至亚种,其中菌株24与清酒乳杆菌肉亚种(L. sakei. carnosus)处于同一分支,并呈现出99%的相似性,菌株82与乳酸乳球菌乳酸亚种(L. lactis. lactis)在同一分支,相似性达100%。在108株菌中,乳杆菌属和肠膜明串珠菌属为优势属,共占82.4%。50株属于乳杆菌属,占46.3%,其中干酪乳杆菌占21.3%、植物乳杆菌占15.7%、清酒乳杆菌占4.6%;39株属于肠膜明串珠菌属,占36.1%,其中肠膜明串珠菌占17.6%、乳明串珠菌占11.1%;7株属于魏斯氏菌属,占6.5%;6株属于肠球菌属,占5.6%;其余菌种均少于3株。
| 参考菌株 Reference strains |
相似性 Identity(%) |
菌株编号 Number |
菌株数 Strains number |
比例 Percentage(%) |
| 干酪乳杆菌 L. casei |
99 | 17,26,34,36,56,58,64,65,67,71,74,83,84,86,91,95,101,103,111,115,121,124,130 | 23 | 21.30 |
| 植物乳杆菌 L. plantarum |
≥99 | 21,25,32,35,40,48,59,60,69,70,75,88,98,114,117,118,120 | 17 | 15.74 |
| 短乳杆菌 L. brevis |
100 | 85,128 | 2 | 1.85 |
| 弯曲乳杆菌 L. curvatus |
99 | 92 | 1 | 0.93 |
| 卷曲乳杆菌 L. crispatus |
100 | 18 | 1 | 0.93 |
| 棒状乳杆菌 L. coryniformis |
100 | 30 | 1 | 0.93 |
| 清酒乳杆菌 L. sakei |
≥99 | 24,43,50,53,6 | 5 | 4.63 |
| 戊糖片球菌 P. pentosaceus |
100 | 63 | 1 | 0.93 |
| 乳酸片球菌 P. acidilactici |
100 | 11,37 | 2 | 1.85 |
| 乳酸乳球菌 Lactococcus lactis |
≥99 | 20,82,16 | 3 | 2.78 |
| 肠膜明串珠菌 Leuconostoc mesenteroides |
≥99 | 3,8,22,29,44,45,49,54,66,76,78,80,81,93,99,102,106,122,127 | 19 | 17.59 |
| 冷明串珠菌 L. gelidum |
≥99 | 52,73,100 | 3 | 2.78 |
| 乳明串珠菌 Leuconostoc lactis |
≥99 | 27,31,33,39,42,46,51,87,94,105,107,108 | 12 | 11.11 |
| 柠檬明串珠菌 L. citreum |
≥99 | 7,41,72,109,112 | 5 | 4.63 |
| 食窦魏斯氏菌 Weissella cibaria |
100 | 57,62,96,110 | 4 | 3.70 |
| 绿色魏斯氏菌 W. viridescens |
100 | 5,55,61 | 3 | 2.78 |
| 屎肠球菌 Enterococcus faecium |
≥99 | 23,97 | 2 | 1.85 |
| 耐久肠球菌 Enterococcus durans |
≥99 | 19,77,125,129 | 4 | 3.70 |
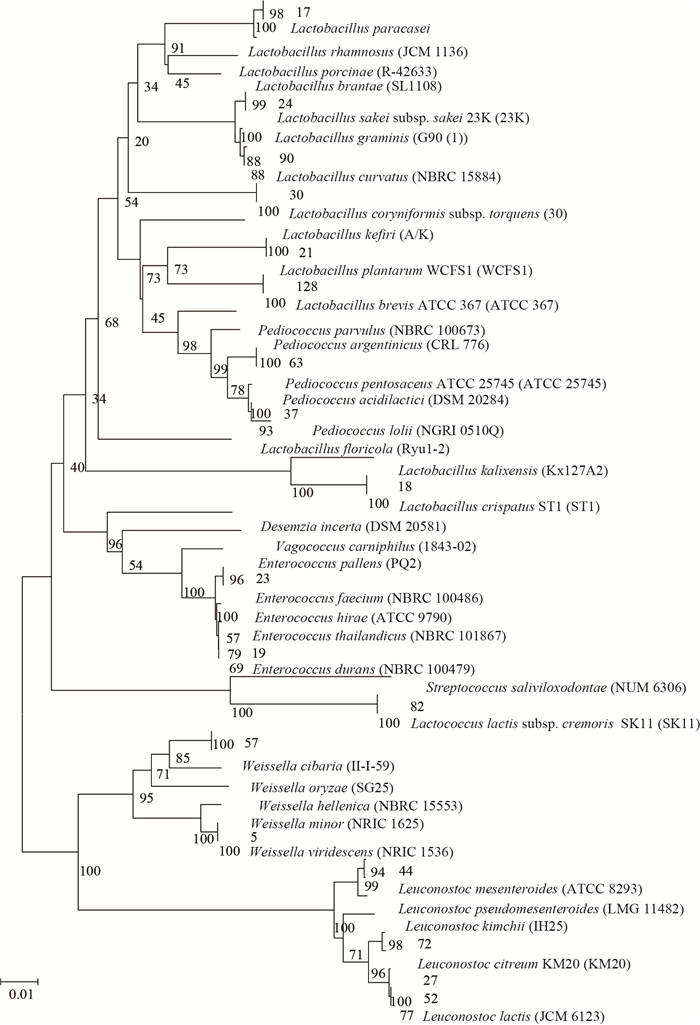
|
| 图 1 部分菌株16S rRNA基因序列系统进化树 Figure 1 Phylogenetic tree of lactic acid bacteria from silage using partial 16S rRNA gene sequences as base 注:系统进化树节点的数字表示Bootstrap值;括号内的数字是在GenBank上的序列登录号;图例为遗传距离. Note: Numbers at nodes present bootstrap percentages. The numbers are accession numbers of sequences in GenBank. Bar "0.001": Sequence divergence. |
|
|
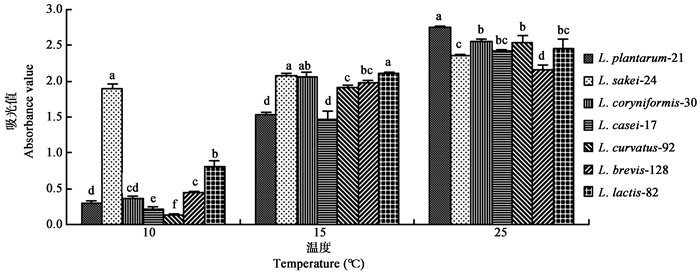
研究发现明串珠菌属和魏斯氏菌属对提升紫花苜蓿青贮品质效果较小[6],对其余62株菌在15°C下培养一定时间后进行吸光值的测定,初筛乳酸菌中发现卷曲乳杆菌和肠球菌属乳酸菌在15°C下生长弱于其他菌株(图 2),不适合低温条件下青贮,予以筛除。从其余不同种中挑选生长性能较好的一株菌,用于下一步的筛选。

|
| 图 2 15°C下不同乳酸菌培养液吸光值 Figure 2 Absorbance value of different lactic acid bacteria at 15°C |
|
|
从图 3、4可以看出,温度对乳酸菌的生长性能产生很大的影响。在25°C时,培养前48 h,所有菌株生长OD值均高于10、15°C;培养前12 h (结果未显示),10°C和15°C下乳酸菌生长差异较小,

|
| 图 3 乳酸菌在不同温度发酵24 h培养液吸光值 Figure 3 Absorbance value of different lactic acid bacteria cultured for 24 h at 10, 15 and 25°C 注:不同小写字母表示同一温度下不同菌株之间差异显著(P < 0.05),下同. Note: Values with different letters show significant differences between different lactic acid bacteria at 0.05 level, the same below. |
|
|
|
| 图 4 乳酸菌在不同温度下发酵48 h培养液吸光值 Figure 4 Absorbance value of different lactic acid bacteria cultured for 48 h at 10, 15 and 25°C |
|
|
培养36 h (结果未显示)后,15°C下OD值较10°C有很明显的升高。不同乳酸菌菌株在同一温度下生长性能各异,在10°C时,L. sakei-24自培养初期开始,一直维持较快生长,12 h后吸光值已达0.18,且OD值显著高于其余菌株(P < 0.05),24 h后OD值增加了近10倍,OD值仍显著高于其余菌株(P < 0.05),后期随着时间的延长,OD值逐渐增加,但增幅较小,60 h (结果未显示)后OD值接近稳定;其余乳酸菌生长均较慢,尤其L. curvatus-92和L. casei-17生长显著慢于其他菌株(P < 0.05),培养前48 h,除L. sakei-24和L. lactis-82外,其余菌株OD值仍保持在0.5以下,所有菌株培养液OD值随着培养时间的延长总体呈现逐渐增加趋势。发酵前12 h,15°C处理的培养液OD值与10°C处理均无明显增加,在前24 h,除L. sakei-24外,其余菌株生长较慢,24-36 h后P. pentosaceus-63培养液OD值从0.08增加至1.66,增加最快,但L. sakei-24培养液OD值仍显著高于其余菌株,36-48 h后L. casei-17和L. plantarum-21培养液OD值显著低于其余菌株(P < 0.05),48 h后所有菌株OD值均接近2.00,在前48 h随着时间的增加,所有菌株OD值增加较快;在25°C时,培养前12 h L. plantarum-21、L. sakei-24和P. pentosaceus-63培养液OD值显著高于其余菌株(P < 0.05),12-24 h,所有菌株OD值仍有增加,并趋于稳定,自培养24 h开始,L. plantarum-21 OD值显著高于其他菌株(P < 0.05),有最大活菌数,36 h开始L. sakei-24和L. brevis-128 OD值显著低于其余菌株(P < 0.05)。
根据上述筛选结果,初步选择L. plantarum-21、L. sakei-24和P. pentosaceus-63作为优良菌种用于进一步的研究。
2.3 绿汁发酵液筛选结果为了使筛选结果能更适应青贮的实际环境,通过将不同乳酸菌分别接种至绿汁发酵液培养3 d后发现(图 5),在15°C时,L. plantarum-21、L. sakei-24使发酵液pH值降低至4.0以下,且显著低于其他菌株(P < 0.05),接种L. brevis-128发酵液pH值最高,P. pentosaceus-63、L. coryniformis-30和L. casei-101差异不显著(P > 0.05)。在25°C下,接种L. lactis-20发酵液pH值显著低于其他处理(P < 0.05),L. sakei-24和P. pentosaceus-63处理下,pH值显著低于除L. lactis-20外的所有处理(P < 0.05),L. coryniformis-30接种发酵液pH值显著高于所有处理(P < 0.05)。
结合培养基筛选结果,选择L. plantarum-21 (植物乳杆菌LP-21)、L. sakei-24 (清酒乳杆菌LS-24)和P. pentosaceus-63 (戊糖片球菌PP-63)作为低温条件生长优势菌株,将进行下一步的青贮添加试验。
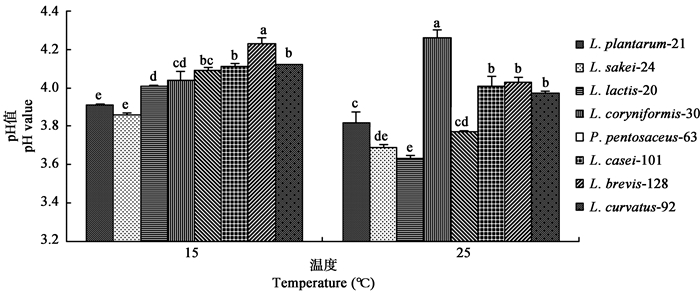
|
| 图 5 15、25°C下绿汁发酵液pH值 Figure 5 5 Green juice fermented liquid pH value at 15 and 25°C |
|
|
青贮是一个复杂的微生物活动体系,其中乳酸菌是种类和数量最多的微生物,对青贮品质的好坏有决定作用[10]。研究表明,青贮发酵中起主要作用的乳酸菌包括乳杆菌、肠球菌、片球菌、乳球菌和明串珠菌等5个属的乳酸菌[5]。Ennahar等从各个时期的青贮饲料中分离得到了161株菌,DNA序列分析发现这些菌株分为肠球菌、明串珠菌属、片球菌属、魏斯氏菌属、乳杆菌属和乳球菌属[11]。张慧杰等从苜蓿青贮饲料中分离得到39株乳酸菌,分属于肠球菌属、片球菌属和乳杆菌属[12]。段宇珩等从青贮饲料中分离得到22株乳酸茵,分属于肠球菌属、片球菌属、明串珠菌属和乳杆菌属[13]。本实验共分离鉴定出6个属、18个种的乳酸菌,基本涵盖了前人在青贮饲料中发现的所有乳酸菌属,但前人在青贮饲料中发现了布氏乳杆菌[14](L. buchneri)和鹑鸡肠球菌[15](Enterococcus gallinarum),而在本实验中并没有检测到其存在,可能是由于某些乳酸菌活力不够,不能在分离培养基中生长或不能生存于温度相对低的气候环境中,因此造成对乳酸菌多样性的低估[16]。
研究发现,垂穗披碱草青贮体系中乳杆菌属为优势属,而片球菌属出现的频率较低,可能与片球菌属乳酸菌在青贮前期发挥作用,随着pH值的降低逐渐被乳杆菌属的乳酸菌替代有关[17],这与Lin和Muck分别在玉米和紫花苜蓿中的研究结果相一致[18-19]。
3.2 优良乳酸菌的低温生长特性在适宜青贮的优良菌株的筛选指标中,产酸性能是一个非常重要的指标。Woolford等提出,青贮原料中pH值一般在5.5以上,青贮初期pH值快速下降有利于抑制腐败菌的繁殖,并为乳酸发酵提供适宜的环境[20]。向青贮原料中添加使初期pH值下降较快的乳酸菌将对青贮意义重大。Tohno等从黑麦草青贮饲料中也曾分离出清酒乳杆菌,但本试验首次发现清酒乳杆菌在低温条件下生长性能优于其他菌株,理论上L. sakei-24在低温条件可用于促进青贮饲料中乳酸发酵[21]。
戊糖片球菌被用于青贮饲料的研究已较多,Cai也从青贮饲料中分离得到戊糖片球菌,发现戊糖片球菌在青贮初期可迅速降低青贮料pH值[22]。本试验也发现,25°C条件下,戊糖片球菌在培养基中初期生长性能较好。因此,在平均温度较低、温差较大的青藏高原地区,戊糖片球菌可用于开启低温条件下的乳酸发酵,为乳杆菌属乳酸菌提供适宜的生存环境。
植物乳杆菌自发现以来,一直被用于青贮添加剂,它有较好的耐酸性,在pH值低于4.0时仍能较好地生长,并且有较大的活菌数,可以改善青贮后期乳酸菌数量逐渐减少的问题[21]。但植物乳杆菌pH值在5.0以上时生长较慢[22],本研究中植物乳杆菌L. plantarum-21显著降低了绿汁发酵液pH值,使发酵液pH低至3.9,与其余菌株相比,在pH为4.0的培养基中也能正常生长,与Huang等的研究相一致[3]。
一般情况下,为提高青贮效果,大多数乳酸菌青贮添加剂都属于复合添加剂,包含植物乳杆菌和片球菌或乳球菌属乳酸菌。结合本试验的研究结果,在高原地区,可将L. plantarum-21和P. pentosaceus-63结合用于牧草青贮,即P. pentosaceus-63可以在低温条件下开启乳酸发酵,迅速降低青贮料pH值,L. plantarum-21还可以维持青贮后期的酸性环境,达到优质青贮的要求。
4 结论(1)本研究发现,低温条件下直接对垂穗披碱草青贮减缓了发酵速度,易增加腐败微生物对营养物质的损耗,筛选并添加低温条件下生长良好的乳酸菌菌株可能对加速pH值下降和提高青贮品质有帮助。
(2)本研究从青藏高原垂穗披碱草青贮饲料中共分离得到108个乳酸菌菌株,分属于6个属,18个种。其中乳杆菌属50株,明串珠菌属39株,魏斯氏菌属7株,肠球菌属6株,片球菌属3株和乳球菌属3株,基本涵盖了前人在常温青贮饲料中发现的所有属,但种数略少。
(3)本研究共筛选出3株在低温条件下生长较好的乳酸菌,分别为清酒乳杆菌LS-53、戊糖片球菌PP-63、植物乳杆菌LP-21。
| [1] | Ma XB, Li DL. The modern trend of temperature change of the Qinghai-Tibet Plateau, and mutation analysis[J]. Journal of Plateau , 2003, 22 (5) : 507–512. (in chinese) 马晓波, 李栋梁. 青藏高原近代气温变化趋势及突变分析[J]. 高原气象 , 2003, 22 (5) : 507–512. |
| [2] | Cui GY, Chen WL, Zhang XY, et al. Isolation and identification of thermotolerant lactic acid bacteria[J]. Journal of Changzhi Medical College , 2009, 23 (2) : 102–104. (in chinese) 崔国艳, 陈五岭, 张雄鹰, 等. 耐高温乳酸菌的分离与鉴定[J]. 长治医学院学报 , 2009, 23 (2) : 102–104. |
| [3] | Huang Y, Wang XJ, Wang JF, et al. Lactobacillus plantarum strains as potential probiotic cultures with cholesterol-lowering activity[J]. Journal of Dairy Science , 2013, 96 (5) : 2746–2753. DOI:10.3168/jds.2012-6123 |
| [4] | Chen MM, Liu QH, Xin GR, et al. Characteristics of lactic acid bacteria isolates and their inoculating effects on the silage fermentation at high temperature[J]. Letters in Applied Microbiology , 2013, 56 (1) : 71–78. DOI:10.1111/lam.2012.56.issue-1 |
| [5] | Han JY. Diversity in lactic acid bacteria silage fermentation system[D]. Hohhot: Doctoral Dissertation of Inner Mongolia Agricultural University, 2009 (in Chinese) 韩吉雨.青贮发酵体系中乳酸菌多样性的研究[D].呼和浩特:内蒙古农业大学博士学位论文, 2009 |
| [6] | Gao J, Guo XS, Wang GC. Physiological and biochemical characteristics of lactic acid bacteria isolated from Kobresia littledalei in Tibet[J]. Pratacultural Science , 2013, 30 (8) : 1266–1271. (in chinese) 高静, 郭旭生, 王国成. 西藏地区藏北嵩草附着乳酸菌的理化特性[J]. 草业科学 , 2013, 30 (8) : 1266–1271. |
| [7] | Chen ZL, Yang JX, Li MH, et al. Biodiversity and quantitative analysis of lactic acid bacteria in traditionally fermented milk products from seven pasturing areas of Tibet[J]. Food Science , 2013, 34 (17) : 140–145. (in chinese) 陈芝兰, 杨吉霞, 李梦寒, 等. 西藏地区传统发酵乳中乳酸菌多样性及微生物数量分析[J]. 食品科学 , 2013, 34 (17) : 140–145. |
| [8] | Zhao B, He SJ. Microbiology Experiment[M]. Beijing: Science Press, 2002 . (in chinese) 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002 . |
| [9] | Kumar S, Tamura K, Jakobsen IB, et al. MEGA2: Molecular evolutionary genetics analysis software[J]. Bioinformatics , 2001, 17 (12) : 1244–1245. DOI:10.1093/bioinformatics/17.12.1244 |
| [10] | Si BW, Wang ZL, Sun QZ, et al. Isolation and identification of high-quality lactic acid bacteria in Hedysarum fruticosum Pall. silage[J]. Acta Agrestia Sinica , 2012, 20 (1) : 166–170. (in chinese) 司丙文, 王宗礼, 孙启忠, 等. 山竹岩黄芪青贮中优质乳酸茵的分离和鉴定[J]. 草地学报 , 2012, 20 (1) : 166–170. |
| [11] | Ennahar S, Cai YM, Fujita Y. Phylogenetic diversity of lactic acid bacteria associated with paddy rice silage as determined by 16S ribosomal DNA analysis[J]. Applied and Environmental Microbiology , 2003, 69 (1) : 444–451. DOI:10.1128/AEM.69.1.444-451.2003 |
| [12] | Zhang HJ, Yu Z, Cai YM, et al. Study of characteristics of lactic acid bacteria from alfalfa silage[J]. China Dairy Cattle , 2011, 8 : 14–17. (in chinese) 张慧杰, 玉柱, 蔡义民, 等. 苜蓿青贮中乳酸菌特性研究[J]. 中国奶牛 , 2011, 8 : 14–17. |
| [13] | Duan YH, Tan ZF, Wang YP, et al. The characteristics of microorganisms and lactic acid bacteria in silage[J]. Journal of Henan Agricultural Sciences , 2008 (6) : 111–113, 124. (in chinese) 段宇珩, 谈重芳, 王雁萍, 等. 青贮饲料中微生物及乳酸菌特性初步研究[J]. 河南农业科学 , 2008 (6) : 111–113, 124. |
| [14] | Schmidt RJ, Emara MG, Kung L. The use of a quantitative real-time polymerase chain reaction assay for identification and enumeration of Lactobacillus buchneri in silage[J]. Journal of Applied Microbiology , 2008, 105 (3) : 920–929. DOI:10.1111/jam.2008.105.issue-3 |
| [15] | Tohno M, Kobayshi H, Nomaru M, et al. Genotypic and phenotypic characterization of lactic acid bacteria isolated from Italian ryegrass silage[J]. Animal Science Journal , 2012, 83 (2) : 111–120. DOI:10.1111/asj.2012.83.issue-2 |
| [16] | Rantsiou K, Urso R, Iacumin L, et al. Culture-dependent and-independent methods to investigate the microbial ecology of Italian fermented sausages[J]. Applied and Environmental Microbiology , 2005, 71 (4) : 1977–1986. DOI:10.1128/AEM.71.4.1977-1986.2005 |
| [17] | Tohno M, Kobayshi H, Nomaru M, et al. Identification and characterization of lactic acid bacteria isolated from mixed pasture of timothy and orchardgrass, and its badly preserved silage[J]. Animal Science Journal , 2012, 83 (4) : 318–330. DOI:10.1111/asj.2012.83.issue-4 |
| [18] | Lin CJ. Epithytic microflora on alfalfa and corn; Lactic acid bacteria succession during the pre-ensiling and ensiling periods; and the effect of additives on microbial succession and silage fermentation[D]. Kansas State, American: Doctoral Dissertation of Kansas State University, 1992 |
| [19] | Muck RE. Initial bacterial numbers on lucerne prior to ensiling[J]. Grass and Forage Science , 1989, 44 (1) : 19–25. DOI:10.1111/gfs.1989.44.issue-1 |
| [20] | Woolford MK, Sawzyc MK. An investigaton into the effect of cultures of lactic acid bacteria on fermentation in silage[J]. Grass and Forage Science , 1984, 39 (2) : 139–148. DOI:10.1111/gfs.1984.39.issue-2 |
| [21] | Tohno M, Kobayshi H, Nomaru M, et al. Genotypic and phenotypic characterization of lactic acid bacteria isolated from Italian ryegrass silage[J]. Animal Science Journal , 2012, 83 (2) : 111–120. DOI:10.1111/asj.2012.83.issue-2 |
| [22] | Cai YM. Identification and nharacterization of Enterococcus species isolated from forage crops and their influence on silage fermentation[J]. Journal of Dairy Science , 1999, 82 (11) : 2466–2471. DOI:10.3168/jds.S0022-0302(99)75498-6 |
 2016, Vol. 43
2016, Vol. 43




