扩展功能
文章信息
- 景春娥, 李萍, 杜欣军, 伍小密, 王硕
- JING Chun-E, LI Ping, DU Xin-Jun, WU Xiao-Mi, WANG Shuo
- 黄芩苷对阪崎克罗诺杆菌生物膜的抑制作用
- Inhibition of Cronobacter sakazakii biofilms by baicalin
- 微生物学通报, 2016, 43(8): 1774-1784
- Microbiology China, 2016, 43(8): 1774-1784
- DOI: 10.13344/j.microbiol.china.150644
-
文章历史
- 收稿日期: 2015-08-28
- 接受日期: 2015-12-15
- 优先数字出版日期(www.cnki.net): 2016-01-06
阪崎克罗诺杆菌(Cronobacter sakazakii)属于肠杆菌科克罗诺杆菌属,是一种无芽孢、有周生鞭毛、能运动、兼性厌氧的革兰氏阴性杆菌[1]。阪崎克罗诺杆菌不是动物和人类肠道内正常菌群,而是一种食源性条件致病菌,它可以引起人类不同年龄组,尤其是新生儿和免疫功能不全的婴幼儿的疾病,包括坏死性小肠结肠炎、菌血症和脑膜炎等[2]。阪崎克罗诺杆菌具有生存温度范围广、抗渗透压能力强以及高效的生物膜形成能力[3],这些特征是其在食品加工行业传播并且成为潜在污染源的重要原因。由于杀菌剂在食品加工环节和家庭环境中被过度使用,导致了耐药菌株的耐药性不断增加,以致于这些耐药菌株对临床使用的重要抗生素出现了交叉抗药性[4]。多重耐药已成为治疗感染性疾病的世界性难题,因此为了解决细菌的抗药性与食品添加物安全性的问题,研究和开发抗菌中药是当务之急。黄芩苷是从黄芩根中提取分离出来的一种黄酮类化合物[5],具有抑菌[6-7]的药理作用。此外,有研究发现,黄芩苷可以抑制铜绿假单胞菌生物膜的形成[8]。目前,使用黄芩苷抑制阪崎克罗诺杆菌及其生物膜的研究很少。本研究通过微孔板法体外建立阪崎克罗诺杆菌生物膜模型,观察黄芩苷对阪崎克罗诺杆菌生物膜的作用,并且使用实时定量荧光PCR检测了与阪崎克罗诺杆菌生物膜形成有关基因的表达量变化,从而推测黄芩苷抑菌机制,为中药预防和控制阪崎克罗诺杆菌及其生物膜相关感染提供科学依据。
1 材料与方法 1.1 菌种、试剂与仪器 1.1.1 材料: C. sakazakii ATCCBAA-894购自美国菌种保藏中心,是已经测序菌株;C. sakazakii IQCC10423购自工业微生物菌种保藏中心,是本实验室从不同阪崎克罗诺杆菌中筛选到的生物膜形成能力较强的菌株。 1.1.2 试剂与仪器: LB培养基(Luria-Bertani)[3]购自北京陆桥技术有限公司;PBS培养基(g/L):NaCl8.00,KCl 0.20,Na2HPO4 1.44,KH2PO4 0.24,pH 7.4;黄芩苷(Baicalin),购自中国食品药品检定研究院,110715-201318;二甲基亚砜、XTT、乳酸钠(L-Lactic acidsodium salt)、甲萘醌(Menadione)、多利培南(Doripenem)购自Sigma公司。酶标仪购自Thermo公司;紫外分光光度仪、Mgstercycler ep realplex实时荧光定量PCR仪,Eppendorf公司;96孔微量培养板购自Corning公司。药物母液配制:黄芩苷用二甲基亚砜溶解为6.4 g/L的药物母液,多利培南用0.85%生理盐水溶解为6.4 g/L的药物母液,−20°C保存备用。 1.2 实验方法 1.2.1 细菌悬液的制备: 为保证每次接种菌的生物活性尽量保持一致,平板划线挑取单菌落接种到盛有5 mL液体LB培养基的试管中,37°C、150 r/min恒温振荡培养12 h得到种子液;4°C、3 000×g离心5 min,弃上清,收集菌体沉淀;然后用无菌的PBS缓冲液重悬菌体,4°C、3 000×g离心5 min,重复3次,收集菌体沉淀,用新鲜的液体LB培养基重悬菌液;按照比例,菌液:甘油(4:1,体积比)加入到1.5 mL Eppendorf管中混匀,用封口膜封口,−20°C保存备用。由于菌传代越多,细菌生物膜的生长情况越不好,每次实验均采用第二代菌株[9]。培养均采用以下条件:接种100μL休止细菌悬液于10 mL液体LB培养基中,于37°C、150 r/min恒温振荡培养过夜;按1%的接种量转接后同样条件培养2 h,菌液在600 nm处测OD值,并将其调至0.1,取1.0 mL菌液3 000xg离心5 min,弃上清,加入1 mL液体LB培养基用于后续实验。 1.2.2 阪崎克罗诺杆菌生物膜形成能力测定方法: 参考文献[10],在96孔细胞培养板上测定阪崎克罗诺杆菌菌膜形成能力,具体方法步骤如下:在96孔细胞培养板中分别加入40μL菌液和160μL的LB培养基,在恒温培养箱中37°C培养24 h,以未接种菌体的LB培养基为对照;用酶标仪在600 nm读数,测菌体吸光度;用PBS洗3次,剧烈摇动去除未粘附细菌,在室温下干燥固定生物膜15 min;加入200μL 0.1%的结晶紫染料进行染色30 min;用无菌水冲洗至对照孔为无色;用200μL 95%乙醇溶解生物膜中的染料,室温静置10 min;将溶解的液体转入新的96孔细胞培养板用酶标仪在波长595 nm处测定吸光值。 1.2.3 药敏试验菌悬液的配制: 根据药敏反应液终浓度,菌液稀释调整为1×105−5×105 CFU/mL,直接加入药敏板。 1.2.4 药敏反应板的制备: 参考文献[11],采用倍比稀释法,取无菌96孔细胞培养板,于每排1号孔加LB液体培养基100μL作空白对照;3−11号孔各加新鲜配制的菌液100μL;2号孔加一定浓度的菌液和受试化合物溶液混合液200μL;12号孔阴性对照孔不含药物,只加菌液100μL作阳性生长对照。2−11号孔进行倍比稀释,使各孔的最终药物浓度分别为2 048、1 024、512、256、128、64、32、16、8、4 mg/L为一组或64、32、16、8、4、2、1、0.5、0.25、0.125mg/L为一组,各孔中二甲基亚砜含量均低于1%,各药敏板于37°C恒温培养。 1.2.5 阪崎克罗诺杆菌最低抑菌浓度(minimum inhibitory concentration,MIC)的判定: 将配制好的药敏反应板于37°C恒温箱中培养24 h,用酶标分析仪于600 nm处测OD值。与阴性对照孔相比(不含药液只有菌生长),以OD值下降80%以上的最低浓度孔中的药物浓度为MIC80 (细菌生长80%被抑制时的药物浓度)。当药物的MIC80值超过测定浓度范围时,按以下方法进行统计,MIC80值为最低浓度或在最低浓度以下时,不作区别,均计为“≤0.125 mg/L”。上述实验均平行操作3次,当MIC80值能准确重复或只差一个浓度时才被接受,并以较高浓度作为MIC80值;当MIC80值相差两个浓度以上时,则需重新实验,直到符合要求为止[12]。 1.2.6 XTT法(XTT-reduction assay): 根据文献[11-13]将XTT以饱和溶液的形式0.5 g/L保存在乳酸盐林格液中,用0.22μm的滤膜过滤除菌、分装,−70°C保存;甲萘醌以100 mmol/L溶解于二甲基亚砜中,−20°C保存。在每次使用之前,从冰柜中取出分装的XTT与甲萘醌,常温溶解。XTT-甲萘醌混合溶液中XTT终浓度为0.5 g/L,甲萘醌终浓度为1 mmol/L。将100μL配制好的XTT-甲萘醌溶液加入用PBS洗过的生物膜生长孔和对照孔中。将培养板37°C避光培养90 min。用酶标仪波长490 nm处测定吸光度值。 1.2.7 不同浓度黄芩苷对阪崎克罗诺杆菌生物膜的抑制作用: 将调整好浓度的菌悬液,接种至96孔细胞培养板,37°C培养1 h,弃去上清,用PBS清洗2次,洗去未粘附的菌体,这一阶段为预粘附阶段;然后加入用新鲜培养基配制的不同浓度的黄芩苷0、256、512、1 024和2 048 mg/L,另设空白对照孔(只加培养基)与阴性对照孔(未加药的生物膜生长对照)以及阳性对照孔(多利培南),37°C培养,24 h形成生物膜,取出培养板,PBS洗去未粘附细菌,加入XTT-甲萘醌溶液,将培养板37°C避光培养90 min。用酶标仪波长490 nm处测定吸光度值。 1.2.8 加入黄芩苷不同时间对阪崎克罗诺杆菌生物膜形成的影响: (1)预粘附阶段不加黄芩苷:将调整好浓度的菌悬液,接种至96孔细胞培养板,37°C培养1 h,弃上清,用PBS清洗2次,洗去未粘附的菌体,这一阶段为预粘附阶段;然后加入新鲜液体LB培养基,37°C培养0、1、3、5、7、12、24 h,弃上清,在生物膜形成的不同阶段,加入新鲜液体LB培养基稀释的浓度为2 048 mg/L的黄芩苷,另设空白对照孔(只加培养基)与阴性对照孔(未加药的生物膜生长对照),24 h后XTT法测定对生物膜的抑制率。(2)预粘附阶段加入黄芩苷:浓度为2 048 mg/L的黄芩苷和调整好浓度的菌悬液同时接种至96孔细胞培养板,37°C培养1 h,弃上清,用PBS清洗2次,洗去未粘附的菌体,这一阶段为预粘附阶段;加入新鲜液体LB培养基,37°C培养0、1、3、5、7、12、24 h,弃上清,在生物膜形成的不同阶段,加入新鲜液体LB培养基稀释的浓度为2 048 mg/L的黄芩苷,设空白对照孔(只加培养基)与阴性对照孔(未加药的生物膜生长对照),24 h后XTT法测定对生物膜的抑制率。 1.2.9 细菌RNA提取与反转录cDNA: 菌体收集:黄芩苷(2 048 mg/L)与菌液混合液200μL接种至96孔板,37°C培养1 h,弃上清,PBS清洗2次,洗去未粘附的菌体;加入新鲜LB培养基37°C培养24 h,弃上清,加入2 048 mg/L的黄芩苷,其中阳性对照不加药液,37°C培养24 h后收集菌体,用于总RNA的提取。RNA提取与反转录cDNA:利用EZNA™ Bacterial RNA Kit (Omega Bio-Tek,Norcross,GA,USA)按照操作步骤提取总RNA,−80°C保藏。紫外分光光度仪检测RNA的纯度和浓度,OD260/OD280值应大于1.8。根据反转录试剂盒PrimeScript™ RT Reagent Kit (TaKaRa Bio-Inc,Otsu,Shiga Japan),按10μL体系配制反转录混和反应液,反应液配制在冰上操作。逆转录的cDNA保存于−20°C。 1.2.10 荧光实时定量PCR (qRT-PCR): 选择与鞭毛组成相关的基因motA、motB、flhD、flhC及fliM[14-16],与生物膜形成相关的基因luxS[17]、sdiA[18]、glpQ[19]、nlpD、deoB及gsiB[10]。参照已经测序的阪崎克罗诺杆菌BAA-894基因序列,通过Primer 5.0软件设计实时定量引物(表 1)。方法用于比较不同样本之间基因的表达量变化[20]。16S rRNA基因作为内参基因[1]。利用SYBR® Premix ExTaq II (TaKaRa Bio Inc.,Otsu,Japan)方法进行荧光实时定量PCR,按20μL体系在冰上操作配制反应液:SYBR® Premix ExTaq II (Tli RNaseH Plus) 10μL,PCR forward/reverse primer (10μmol/L) 0.8μL;50 mg/L cDNA模板2.0μL;dH2O (无RNase) 6.4μL。应用Mastercycler ep realplex实时荧光定量PCR仪操作,反应程序如下:95°C 30 s;95°C 5 s,60°C 30 s,40个循环;添加熔解曲线:95°C 15 s,60°C 15 s后,经过20 min逐渐升至95°C并且维持15 s。不含cDNA模板的体系作为阴性对照。做3次独立的实验,每个样品做3个平行。| Primer | Sequence (5′→3′) | Size (bp) |
| motA-F | GGATGATGTCGTGCTGATTT | 172 |
| motA-R | GATGGCTTTCCCGTTGTT | |
| motB-F | CGCCGCATAAGTTTGCTGGTA | 141 |
| motB-R | TTGGGACGGTGTTGGGTTTG | |
| flhD-F | TCAGGATAAAGCGTCTGCGA | 97 |
| flhD-R | AGCCAGTTTCACCATTTGCG | |
| flhC-F | CGCCAAAAGGTATGTTGCCC | 165 |
| flhC-R | GGCATTGCTCCAGGTACAGA | |
| fliM-F | GCCGCTTCCCGACTAAA | 145 |
| fliM-R | TCTGAACGCACATACTCCAC | |
| luxS-F | TTGCGTGCCGAACAAAGAAG | 104 |
| luxS-R | TCTCTACACCGTTGCCGTTC | |
| sdiA-F | GCTCCTGAAAACCGAAACGC | 139 |
| sdiA-R | TTCCGCCTGGTAATGCTCAA | |
| glpQ-F | CTGGCGATTGGCGTAATGTC | 146 |
| glpQ-R | TCCTGCTCAAGGTAATCCGC | |
| nlpD-F | GCAGCAAAGGACAGGCAATC | 133 |
| nlpD-R | TCGTTATGGGCGTAGGCACT | |
| gsiB-F | AAAGAGATTGTCGTGGCCGT | 171 |
| gsiB-R | GTCATCCGACACGCTGTAGT | |
| deoB-F | ACTGGGGCTATTTCACCGAC | 106 |
| deoB-R | GAGGAGTGGCAGTTACCGAG | |
| ampC-F | GCAGCAAGACGGCAAAC | 137 |
| ampC-R | CATCGGGCACAAAGAGC | |
| ESA_00047-F a | ACCCGCAGAAGAAGCAC | 148 |
| ESA_00047-R | GCAGTTCCCAGGTTGAG | |
| 注:a内参:16S rRNA基因. Note: aInternal control: 16S rRNA gene. | ||
采用SPSS 16.0软件处理,对相关数据进行统计分析。
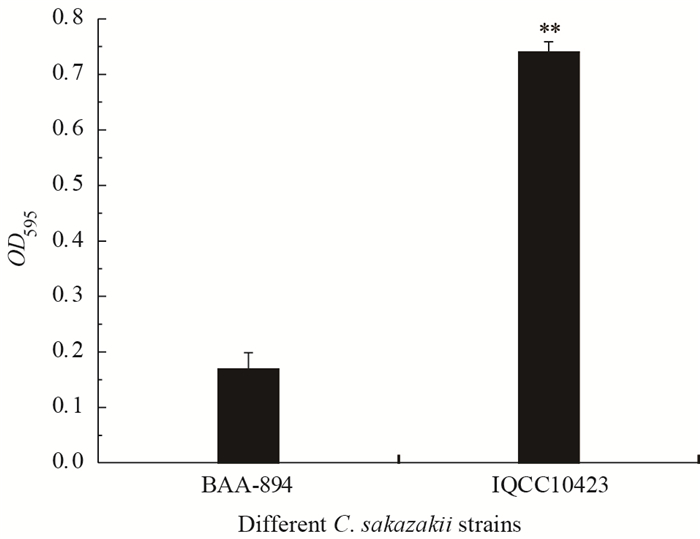
2 结果与分析 2.1 阪崎克罗诺杆菌生物膜形成能力比较阪崎克罗诺杆菌BAA-894和IQCC10423的生物膜形成能力具有极显著差异(P < 0.01),OD595值分别为0.169和0.740 (图 1)。
|
| 图 1 阪崎克罗诺杆菌生物膜形成能力比较 Figure 1 Comparison of biofilm formation levels by different C. sakazakii strains |
|
|
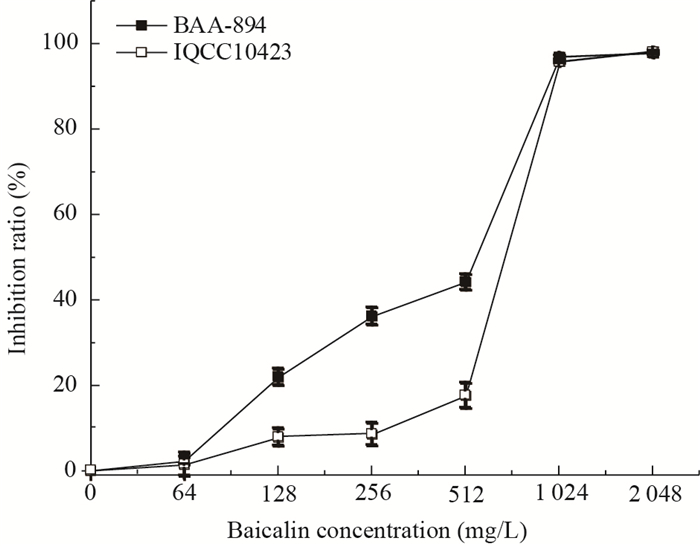
黄芩苷对阪崎克罗诺杆菌BAA-894和IQCC10423的MIC80值为1 024 mg/L (图 2),多利培南对阪崎克罗诺杆菌MIC80值 < 0.125 mg/L。
|
| 图 2 不同浓度黄芩苷对阪崎克罗诺杆菌的抑制 Figure 2 Inhibitory effect of baicalin at different concentrations against C. sakazakii cells |
|
|
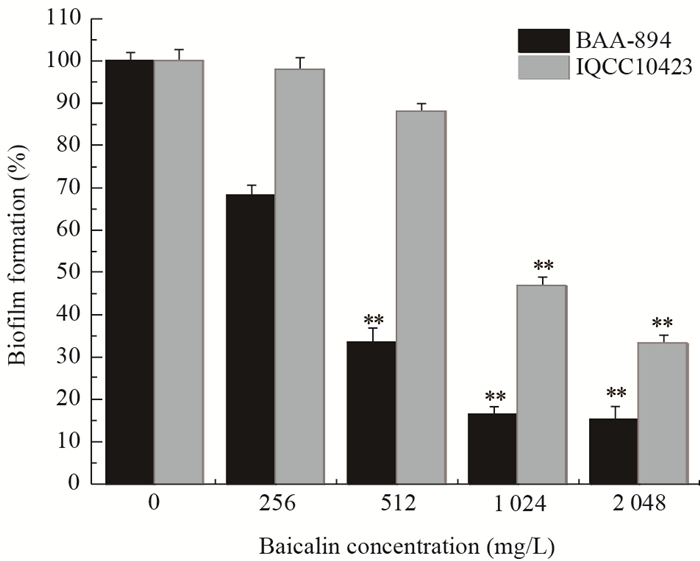
采用不同浓度的黄芩苷处理阪崎克罗诺杆菌BAA-894和IQCC10423,培养24 h后XTT法测定对生物膜的抑制率。结果表明,与对照组相比较,1 024 mg/L和2 048 mg/L的黄芩苷对阪崎克罗诺杆菌BAA-894生物膜的抑制率分别为83.7% (P < 0.01)和85.0% (P < 0.01),同时对阪崎克罗诺杆菌IQCC10423的抑制率分别为53.2% (P < 0.01)和66.9% (P < 0.01) (图 3)。
|
| 图 3 不同浓度黄芩苷对阪崎克罗诺杆菌生物膜的影响 Figure 3 Effects of different concentrations of baicalin on C. sakazakii biofilm formation |
|
|
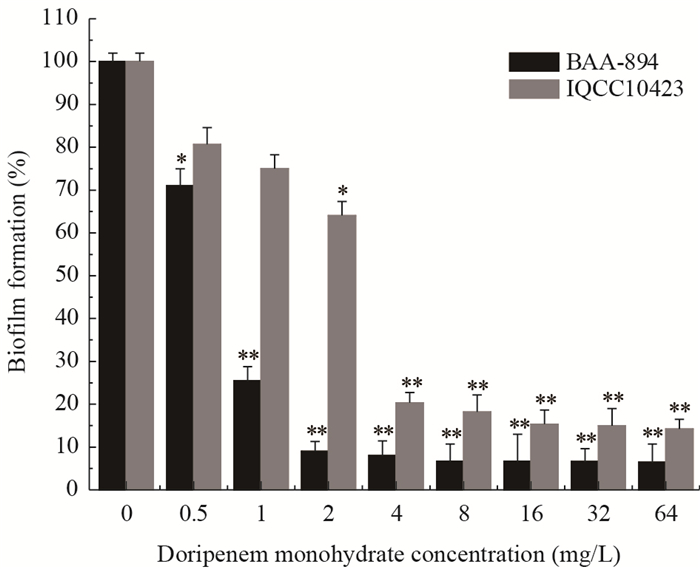
采用不同浓度的多利培南处理阪崎克罗诺杆菌BAA-894和IQCC10423,培养24 h后XTT法测定对生物膜的抑制率,结果表明,与对照组相比较,64 mg/L的多利培南对阪崎克罗诺杆菌BAA-894和IQCC10423生物膜的抑制率分别为93.6% (P < 0.01)和85.8% (P < 0.01) (图 4)。
|
| 图 4 不同浓度多利培南对阪崎克罗诺杆菌生物膜的影响 Figure 4 Effects of different concentrations of doripenem on C. sakazakii biofilm formation Note: **: P < 0.01; *: P < 0.05. |
|
|
阪崎克罗诺杆菌BAA-894和IQCC10423分别在预粘附1 h阶段不加黄芩苷(预粘附未加药组)或加入2 048 mg/L黄芩苷(预粘附加药组)后,在生物膜形成的不同阶段(0、1、3、5、7、12、24 h)加入2 048 mg/L黄芩苷,24 h后XTT法测定对生物膜的抑制率。结果表明,对菌株BAA-894预粘附未加药组与预粘附加药组相比较,在生物膜形成的0、5、24 h阶段对菌株BAA-894的抑制率分别为91.7%和92.2%、70.6%和79.6% (P < 0.05)、30.0%和40.1% (P < 0.05) (图 5);对菌株IQCC10423预粘附未加药组与预粘附加药组相比较,在生物膜形成的0、5、24 h阶段对菌株IQCC10423的抑制率分别为86.4%和93.3% (P < 0.05)、69.0%和85.4% (P < 0.05)、25.2%和35.8% (P < 0.05) (图 5)。与预粘附未加药组相比较,预粘附阶段加入黄芩苷能够降低菌株的粘附能力,从而增强了对生物膜的抑制作用。

|
| 图 5 黄芩苷加入的不同时间对阪崎克罗诺杆菌生物膜形成的影响 Figure 5 Effects of different addition times of baicalin on C.sakazakii biofilm formation 注:A:1 h预粘附阶段不加黄芩苷;B:1 h预粘附阶段加黄芩苷;*:P < lt; 0.05. Note: A: No baicalinwas present during the initial 1 h adhesion period; B: Baicalin was present during the initial 1 h adhesion period; *: P < 0.05. |
|
|
采用荧光实时定量PCR法测定了阪崎克罗诺杆菌与生物膜相关基因的mRNA表达水平(图 6)。与对照组相比较,被2 048 mg/L黄芩苷处理过的阪崎克罗诺杆菌BAA-894和IQCC10423生物膜中,一些与生物膜相关的基因表达量下调,分别为鞭毛合成基因motA、motB、flhC、flhD、fliM;与生物膜形成有关的基因glpQ、nlpD、gsiB、deoB;生物膜群体感应因子转录调节子luxS与sdiA;基因ampC与细菌抗生素抗性有关。
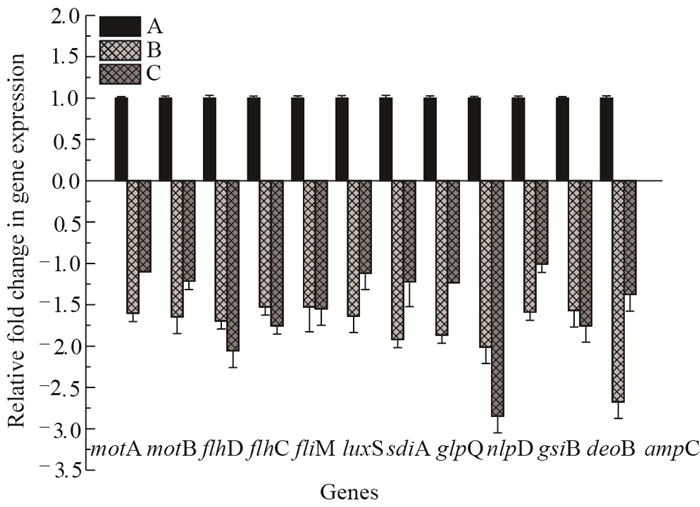
|
| 图 6 黄芩苷对阪崎克罗诺杆菌的生物膜相关基因表达量的影响 Figure 6 Effects of baicalin on expression of biofilm-associated genes in C.sakazakii Note: A: 0 mg/L baicalin; B: 2 048 mg/L baicalin (BAA-894); C: 2 048 mg/L baicalin (IQCC10423). |
|
|
黄芩苷是中药黄芩根部的有效活性成分,临床上该药物具有抗炎免疫、抑菌、解痉及利尿等药理作用,对于多种疾病具有很好的疗效,但其对阪崎克罗诺杆菌生物膜的作用此前未见报道。
生物膜内部细菌具有广泛的异质性,并且对各种外界的环境刺激敏感性均很低,尤其对抗菌剂的敏感性很低[21-22]。由于多利培南对肠杆菌科细菌具有较好的杀灭作用[23],因此本实验采用多利培南作为对照,证实实验方法正确有效,多利培南对阪崎克罗诺杆菌MIC80值 < 0.125 mg/L。Kaniga等[23]发现多利培南对肠杆菌科的环丙沙星抗性菌株和超广谱β-内酰胺酶产生菌株的MIC90s值分别为0.50 mg/L和0.25 mg/L。因此,多利培南对肠杆菌科抗药性细菌引起的感染疾病的治疗是有临床应用价值的。本研究中黄芩苷对阪崎克罗诺杆菌BAA-894和IQCC10423的MIC80值为1 024 mg/L。杨明等[6]的研究发现从黄芩中提取的黄芩苷对大肠杆菌和金黄色葡萄球菌的体外MIC值分别为500 mg/L和200 mg/L。付爽等[24]的研究发现黄芩苷对粪肠球菌的MIC值为2 000 mg/L,浓度为8 000 mg/L时,对粪肠球菌生物膜有显著的抑制作用。Wang等[25]的研究发现黄芩苷对游离白色念珠菌的MIC值为500 mg/L,对生物膜内部菌体的50%抑菌浓度为2 000 mg/L。
在阪崎克罗诺杆菌生物膜抑制实验中使用的XTT法,在不破坏生物膜结构的条件下能检测出生物膜中菌细胞的活性[26-28]。由于阪崎克罗诺杆菌IQCC10423比BAA-894的生物膜形成能力强,从而增强了对菌的保护作用。黄芩苷浓度为1 024 mg/L时,对阪崎克罗诺杆菌BAA-894和IQCC10423生物膜的抑制率分别为83.7%和53.2%。多利培南浓度为64 mg/L时,对阪崎克罗诺杆菌BAA-894和IQCC10423生物膜的抑制率分别为93.6%和85.8%。在两株菌中生物膜形成的不同时间阶段,加入2 048 mg/L黄芩苷,对阪崎克罗诺杆菌生物膜的抑制率不同。5 h前为粘附期,加入黄芩苷可明显抑制生物膜的形成,在24 h时,黄芩苷对成熟生物膜的抑制率明显下降。两株菌的预粘附阶段与2 048 mg/L黄芩苷共孵育可增强对生物膜的抑制作用。由于菌体的粘附能力可能决定着生物膜持续形成和发展的命运,细菌的不可逆粘附发生在细菌表面附属结构的锚定和细胞外多聚物质的产生[29],不可逆粘附在4−20°C时通常发生在20 min到4 h内[30-31],此阶段的菌体不容易被清除。汪长中等[32]的研究发现,100、50、10 mg/L黄芩苷均能有效抑制白念珠菌芽管形成及对口腔上皮细胞的粘附。杜仲业等[33]的研究发现,当黄芩苷浓度≥256 mg/L时,能清除金黄色葡萄球菌成熟的生物膜,并且能够通过降低金黄色葡萄球菌的粘附性以抑制新生物膜的形成。Zeng等[34]的研究发现200μmol/L黄芩苷能够抑制铜绿假单胞菌生物膜形成。陈艳等[35]的研究发现浓度为256 mg/L的黄芩苷联合万古霉素可协同破坏建模3 d的金黄色葡萄球菌生物膜。黄莹莹等[36]的研究发现黄芩苷对金黄色葡萄球菌17546的MIC值为2 048 mg/L,用256 mg/L的黄芩苷与左氧氟沙星联合应用,可显著增强左氧氟沙星对金黄色葡萄球菌生物膜的清除作用。
在研究黄芩苷对阪崎克罗诺杆菌生物膜相关基因表达量影响的实验过程中,在1 h预粘附阶段加入了2 048 mg/L黄芩苷,可能会影响到在生物膜形成的起始阶段以及生物膜发展阶段行使粘附功能的基因的表达量。经过黄芩苷处理后,与鞭毛合成以及运动有关的基因表达量都出现了下调。细菌的运动性在细菌致病过程中发挥着重要的作用[37]。基因flhC与flhD是鞭毛基因的转录调控因子,能根据环境因素的变化控制鞭毛相关基因的表达[14]。基因motA、motB、fliM与鞭毛运动有关,有助于细菌生物膜的形成。Barken等[15]发现鞭毛在铜绿假单胞菌生物膜形成的起始阶段起很重要的作用。Wood等[16]的研究发现,在大肠杆菌中,与野生株相比较,基因motA缺陷菌株的生物膜形成能力下降,并且无法形成成熟的生物膜结构。阪崎克罗诺杆菌也具有鞭毛并且能够运动。Hartmann等[38]的研究发现阪崎克罗诺杆菌鞭毛与生物膜的形成有关,并且有助于其粘附到上皮细胞Caco-2。
此外,与对照组相比较,被2 048 mg/L黄芩苷处理过的阪崎克罗诺杆菌BAA-894和IQCC10423生物膜中,一些与生物膜相关的基因表达量下调,例如,与生物膜形成有关的基因glpQ、nlpD、gsiB、deoB以及生物膜群体感应因子转录调节子luxS与sdiA。基因glpQ在阪崎克罗诺杆菌BAA-894中可能参与宿主的粘附与侵袭以及生物膜的形成[19]。通过对阪崎克罗诺杆菌IQCC10423进行EZ-TN5转座子基因突变研究发现,基因nlpD、gsiB、deoB与阪崎克罗诺杆菌生物膜的形成有关[10]。细菌在完成粘附后,细菌群体感应系统在生物膜形成的过程中发挥着重要作用,群体感应系统残缺的细菌不能形成完整的生物膜系统,易对抗菌剂敏感[39-40]。Lehner等[3]的研究发现在阪崎克罗诺杆菌中具有生物膜形成能力的菌株能够通过表达群体感应信号分子N-酰基高丝氨酸内酯(N-acylated homoserine lactones,AHLs)调控生物膜的形成。阪崎克罗诺杆菌中基因sdiA编码群体感应转录激活因子,通与细胞信号分子结合调控群体感应因子的表达[18]。基因luxS与群体感应因子AI-2的合成有关,并且影响生物膜成熟结构的形成[17]。Brackman等[41-42]的研究发现黄芩苷对酰基高丝氨酸内酯群体感应系统缺陷株没有显著抑制作用(P > 0.05),而对野生株中相应的群体感应系统相关基因的表达量极显著下调(P < 0.01),黄芩苷可能作为群体感应抑制剂(Quorum sensing inhibitors)提高妥布霉素对铜绿假单胞菌生物膜的抑制作用。因此,我们推测黄芩苷可能通过下调阪崎克罗诺杆菌起始粘附相关基因和生物膜群体感应系统相关基因的表达,从而降低阪崎克罗诺杆菌的粘附能力以及对外界环境压力的耐受性,在一定程度上抑制生物膜的形成。虽然生物膜群体感应系统在生物膜形成与发展及在生物膜耐药性方面的确切作用机制并不完全清楚,但是,对生物膜群体感应信号分子抑制剂的使用是一种有潜力的生物膜防治方法[43-44],尚需进行深入研究。
与对照组相比较,被2 048 mg/L黄芩苷处理过的阪崎克罗诺杆菌BAA-894和IQCC10423生物膜中,基因ampC表达量下调,基因ampC编码的β-内酰胺酶与碳青霉烯类抗生素抗性有关[45]。Müller等[46]通过全基因组测序分析发现,阪崎克罗诺杆菌和丙二酸盐阳性克罗诺杆菌中具有编码β-内酰胺酶的基因,从而对氨苄青霉素和头孢菌素表现出了耐药性。与其浮游态细菌相比较,生物膜细菌的耐药性较强,多重耐药性是生物膜群落协同作用的表现[47]。消除R-质粒成为逆转耐药的一个研究方向。陈群等[48]在研究中发现黄芩提取物对大肠杆菌耐药R-质粒具有消除作用。刘克等[49]的研究发现黄芩苷对携带R-质粒的铜绿假单胞菌株PA16中R-质粒的体内外消除率分别为12.0%和5.1%。汪东海等[50]的研究发现黄芩苷能够消除鲍曼不动杆菌低水平耐药菌株携带的质粒,恢复菌株对庆大霉素和环丙沙星的敏感性。梁军等[51]分析了耐药性与质粒之间的关系,探讨耐药质粒在细菌间的传递方式,结果表明耐药菌株的质粒可编码β-内酰胺酶,且耐药质粒可通过接合转移方式传递至感受态大肠杆菌。张晓玲等[52]研究发现8 mg/L黄芩苷与氨曲南联用后对多重耐药鲍曼不动杆菌的抗菌活性有协同作用,氨曲南为β-内酰胺类抗菌药物,黄芩苷可能通过抑制β-内酰胺酶、质粒消除逆转多重耐药鲍曼不动杆菌对氨曲南的耐药性。菅凌燕等[53]研究发现黄芩苷可增强左氧氟沙星对体外黏液型铜绿假单胞菌生物膜内藻酸盐的降解作用,降低细菌的耐药性。Huang等[54]研究发现黄芩苷能够降低一些多重耐药性幽门螺杆菌菌株对羟氨苄青霉素和四环素的MIC值,可能与黄芩苷处理后敏感性菌株中多重耐药基因hefA的表达量下调有关。Liu等[55]研究发现用16 mg/L的黄芩苷协同苄基青霉素处理耐甲氧西林金黄色葡萄球菌与盘尼西林抗性金黄色葡萄球菌后,苄基青霉素对两类菌株的MICs值分别从125 mg/L和250 mg/L降低至4 mg/L和16 mg/L。鉴于黄芩苷的低毒性,黄芩苷可以作为潜在的控制β-内酰胺类抗性细菌感染的临床药物[56]。本研究中黄芩苷能够降低基因ampC的表达,因此我们推测黄芩苷可能降低阪崎克罗诺杆菌对常规抗生素的耐药性,与抗生素联合使用可能会具有协同增效作用,能发挥更强大的抗菌效果,中药对细菌耐药具有逆转作用并且可减轻细菌选择压力,但是这方面还需要进一步的研究。
4 结论通过上述实验发现,黄芩苷对阪崎克罗诺杆菌BAA-894和IQCC10423的MIC80值为1 024 mg/L,该浓度的黄芩苷对阪崎克罗诺杆菌BAA-894和IQCC10423菌株生物膜的抑制率分别为83.7%和53.2%。浓度为2 048 mg/L的黄芩苷,能部分清除阪崎克罗诺杆菌的生物膜,并且能够通过降低阪崎克罗诺杆菌的粘附性以抑制新生物膜的形成。黄芩苷的抑菌机制之一可能是通过下调阪崎克罗诺杆菌生物膜相关基因的表达量以抑制其生物膜的形成能力。因此,黄芩苷有可能被作为抗菌剂以控制阪崎克罗诺杆菌生物膜。
| [1] | Yan QQ, Condell O, Power K, et al. Cronobacter species (formerly known as Enterobacter sakazakii) in powdered infant formula: a review of our current understanding of the biology of this bacterium[J]. Journal of Applied Microbiology , 2012, 113 (1) : 1–15. DOI:10.1111/jam.2012.113.issue-1 |
| [2] | Hol O, Forsythe S. Cronobacter spp. as emerging causes of healthcare-associated infection[J]. Journal of Hospital Infection , 2014, 86 (3) : 169–177. DOI:10.1016/j.jhin.2013.09.011 |
| [3] | Lehner A, Riedel K, Eberl L, et al. Biofilm formation, extracellular polysaccharide production, and cell-to-cell signaling in various Enterobacter sakazakii strains: aspects promoting environmental persistence[J]. Journal of Food Protection , 2005, 68 (11) : 2287–2294. |
| [4] | Condell O, Iversen C, Cooney S, et al. Efficacy of biocides used in the modern food industry to control Salmonella enterica, and links between biocide tolerance and resistance to clinically relevant antimicrobial compounds[J]. Applied and Environmental Microbiology , 2012, 78 (9) : 3087–3097. DOI:10.1128/AEM.07534-11 |
| [5] | Chen G, Zhang HW, Ye JN. Determination of baicalein, baicalin and quercetin in Scutellariae Radix and its preparations by capillary electrophoresis with electrochemical detection[J]. Talanta , 2000, 53 (2) : 471–479. DOI:10.1016/S0039-9140(00)00514-2 |
| [6] | Yang M, Tao L, Wang W, et al. Optimization of the extracting process for baicalin by orthogonal test and study on its antibacterial activity in vitro[J]. Journal of Traditional Chinese Veterinary Medicine , 2011, 30 (3) : 43–45. (in chinese) 杨明, 陶蕾, 王文, 等. 黄芩中黄芩苷的正交提取工艺及体外抑菌活性研究[J]. 中兽医医药杂志 , 2011, 30 (3) : 43–45. |
| [7] | Yang SL, Fu YY, Wu XZ, et al. Baicalin prevents Candida albicans infections via increasing its apoptosis rate[J]. Biochemical and Biophysical Research Communications , 2014, 451 (1) : 36–41. DOI:10.1016/j.bbrc.2014.07.040 |
| [8] | Wang GN, Wu J. In vitro effect of baicalin on Pseudomonas aeruginosa biofilms[J]. Journal of Pathogen Biology , 2010, 5 (8) : 638–639. (in chinese) 王贵年, 吴娟. 黄芩苷对铜绿假单胞菌生物膜的影响[J]. 中国病原生物学杂志 , 2010, 5 (8) : 638–639. |
| [9] | Wang K. Bacterial biofilm formation and the influence of Shuanghuanglian injection to the model of bacterial biofilms[D]. Changchun: Master's Thesis of Changchun University of Chinese Medicine, 2009(in Chinese) 王坤.细菌生物膜的形成和研究注射用双黄连对细菌生物膜的影响[D].长春:长春中医药大学硕士学位论文, 2009 |
| [10] | Du XJ, Wang F, Lu XN, et al. Biochemical and genetic characteristics of Cronobacter sakazakii biofilm formation[J]. Research in Microbiology , 2012, 163 (6/7) : 448–456. |
| [11] | Cao YY, Dai BD, Wang Y, et al. In vitro activity of baicalein against Candida albicans biofilms[J]. International Journal of Antimicrobial Agents , 2008, 32 (1) : 73–77. DOI:10.1016/j.ijantimicag.2008.01.026 |
| [12] | Huang S. Mechanism study of baicalein against Candida albicans[D]. Shanghai: Doctoral Dissertation of the Second Military Medical University, 2009(in Chinese) |
| [13] | Ramage G, Walle KV, Wickes BL, et al. Standardized method for in vitro antifungal susceptibility testing of Candida albicans biofilms[J]. Antimicrobial Agents and Chemotherapy , 2001, 45 (9) : 2475–2479. DOI:10.1128/AAC.45.9.2475-2479.2001 |
| [14] | Chilcott GS, Hughes KT. Coupling of flagellar gene expression to flagellar assembly in Salmonella enterica Serovar Typhimurium and Escherichia coli[J]. Microbiology and Molecular Biology Reviews , 2000, 64 (4) : 694–708. DOI:10.1128/MMBR.64.4.694-708.2000 |
| [15] | Barken KB, Pamp SJ, Yang L, et al. Roles of type IV pili, flagellum‐mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms[J]. Environmental Microbiology , 2008, 10 (9) : 2331–2343. DOI:10.1111/emi.2008.10.issue-9 |
| [16] | Wood TK, Barrios GAF, Herzberg M, et al. Motility influences biofilm architecture in Escherichia coli[J]. Applied Microbiology and Biotechnology , 2006, 72 (2) : 361–367. DOI:10.1007/s00253-005-0263-8 |
| [17] | Sela S, Frank S, Belausov E, et al. A mutation in the luxS gene influences Listeria monocytogenes biofilm formation[J]. Applied and Environmental Microbiology , 2006, 72 (8) : 5653–5658. DOI:10.1128/AEM.00048-06 |
| [18] | Shin H, Lee JH, Choi Y, et al. Complete genome sequence of the opportunistic food-borne pathogen Cronobacter sakazakii ES15[J]. Journal of Bacteriology , 2012, 194 (16) : 4438–4439. DOI:10.1128/JB.00841-12 |
| [19] | Wang J, Du XJ, Lu XN, et al. Immunoproteomic identification of immunogenic proteins in Cronobacter sakazakii strain BAA-894[J]. Applied Microbiology and Biotechnology , 2013, 97 (5) : 2077–2091. DOI:10.1007/s00253-013-4720-5 |
| [20] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method[J]. Methods , 2001, 25 (4) : 402–408. DOI:10.1006/meth.2001.1262 |
| [21] | Nuri R, Shprung T, Shai Y. Defensive remodeling: How bacterial surface properties and biofilm formation promote resistance to antimicrobial peptides[J]. Biochimica et Biophysica Acta-Biomembranes , 2015, 1848 (11) : 3089–3100. DOI:10.1016/j.bbamem.2015.05.022 |
| [22] | Van Acker H, Van Dijck P, Coenye T. Molecular mechanisms of antimicrobial tolerance and resistance in bacterial and fungal biofilms[J]. Trends in Microbiology , 2014, 22 (6) : 326–333. DOI:10.1016/j.tim.2014.02.001 |
| [23] | Kaniga K, Flamm R, Tong SY, et al. Worldwide experience with the use of doripenem against extended-spectrum-β-lactamase-producing and ciprofloxacin-resistant Enterobacteriaceae: analysis of six phase 3 clinical studies[J]. Antimicrobial Agents and Chemotherapy , 2010, 54 (5) : 2119–2124. DOI:10.1128/AAC.01450-09 |
| [24] | Fu S, Xu Y, Ning SB, et al. Inhibitory effect of baicalin on the biofilm of Enterococcus faecalis in vitro[J]. Chinese Journal of Microecology , 2014, 26 (1) : 34–36. (in chinese) 付爽, 许颖, 宁尚波, 等. 黄芩苷体外抑制粪肠球菌生物膜能力的研究[J]. 中国微生态学杂志 , 2014, 26 (1) : 34–36. |
| [25] | Wang TM, Shi GX, Shao J, et al. In vitro antifungal activity of baicalin against Candida albicans biofilms via apoptotic induction[J]. Microbial Pathogenesis , 2015, 87 : 21–29. DOI:10.1016/j.micpath.2015.07.006 |
| [26] | Cerca N, Martins S, Cerca F, et al. Comparative assessment of antibiotic susceptibility of coagulase-negative Staphylococci in biofilm versus planktonic culture as assessed by bacterial enumeration or rapid XTT colorimetry[J]. Journal of Antimicrobial Chemotherapy , 2005, 56 (2) : 331–336. DOI:10.1093/jac/dki217 |
| [27] | Claessens J, Roriz M, Merckx R, et al. Inefficacy of vancomycin and teicoplanin in eradicating and killing Staphylococcus epidermidis biofilms in vitro[J]. International Journal of Antimicrobial Agents , 2015, 45 (4) : 368–375. DOI:10.1016/j.ijantimicag.2014.11.011 |
| [28] | Bazargani MM, Rohloff J. Antibiofilm activity of essential oils and plant extracts against Staphylococcus aureus and Escherichia coli biofilms[J]. Food Control , 2016, 61 : 156–164. DOI:10.1016/j.foodcont.2015.09.036 |
| [29] | Sutherland IW. Microbial exopolysaccharides-their role in microbial adhesion in aqueous systems[J]. CRC Critical Reviews in Microbiology , 1982, 10 (2) : 173–201. DOI:10.3109/10408418209113562 |
| [30] | Lundén JM, Miettinen MK, Autio TJ, et al. Persistent Listeria monocytogenes strains show enhanced adherence to food contact surface after short contact times[J]. Journal of Food Protection , 2000, 63 (9) : 1204–1207. |
| [31] | Mafu AA, Roy D, Goulet J, et al. Attachment of Listeria monocytogenes to stainless steel, glass, polypropylene, and rubber surfaces after short contact times[J]. Journal of Food Protection , 1990, 53 (9) : 742–746. |
| [32] | Wang CZ, Feng X, Zhang XL, et al. Inhibitory effect of baicalin on germ tube formation and adhesion of Candida albicans[J]. China Journal of Chinese Materia Medica , 2010, 35 (23) : 3216–3218. (in chinese) 汪长中, 冯鑫, 张晓露, 等. 黄芩苷对白念珠菌芽管形成及黏附性的影响[J]. 中国中药杂志 , 2010, 35 (23) : 3216–3218. |
| [33] | Du ZY, Chen YQ, Kong JL, et al. Inhibitory effect of baicalin on formation of Staphylococcus aureus biofilm in vitro[J]. Chinese Journal of Nosocomiology , 2012, 22 (8) : 1541–1543. (in chinese) 杜仲业, 陈一强, 孔晋亮, 等. 黄芩苷对金黄色葡萄球菌生物膜抑制作用的体外研究[J]. 中华医院感染学杂志 , 2012, 22 (8) : 1541–1543. |
| [34] | Zeng Z, Qian L, Cao L, et al. Virtual screening for novel quorum sensing inhibitors to eradicate biofilm formation of Pseudomonas aeruginosa[J]. Applied microbiology and Biotechnology , 2008, 79 (1) : 119–126. DOI:10.1007/s00253-008-1406-5 |
| [35] | Chen Y, Chen YQ, Kong JL, et al. In vitroeffect of baicalin combined with vancomycin on Staphylococcus aureus biofilm[J]. Chinese Journal of Nosocomiology , 2014, 24 (2) : 264–264. (in chinese) 陈艳, 陈一强, 孔晋亮, 等. 黄芩苷联合万古霉素对金黄色葡萄球菌生物膜的体外影响[J]. 中华医院感染学杂志 , 2014, 24 (2) : 264–264. |
| [36] | Huang YY, Chen YQ, Kong JL, et al. In vitro effect of baicalin combined levofloxacin on Staphylococcus aureus early biofilm[J]. China Journal of Modern Medicine , 2013, 23 (13) : 42–45. (in chinese) 黄莹莹, 陈一强, 孔晋亮, 等. 黄芩苷及联合左氧氟沙星对金黄色葡萄球菌早期生物膜的体外影响[J]. 中国现代医学杂志 , 2013, 23 (13) : 42–45. |
| [37] | Josenhans C, Suerbaum S. The role of motility as a virulence factor in bacteria[J]. International Journal of Medical Microbiology , 2002, 291 (8) : 605–614. DOI:10.1078/1438-4221-00173 |
| [38] | Hartmann I, Carranza P, Lehner A, et al. Genes involved in Cronobacter sakazakii biofilm formation[J]. Applied and Environmental Microbiology , 2010, 76 (7) : 2251–2261. DOI:10.1128/AEM.00930-09 |
| [39] | Davies DG, Parsek MR, Pearson JP, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm[J]. Science , 1998, 280 (5361) : 295–298. DOI:10.1126/science.280.5361.295 |
| [40] | De Kievit TR, Iglewski BH. Bacterial quorum sensing in pathogenic relationships[J]. Infection and Immunity , 2000, 68 (9) : 4839–4849. DOI:10.1128/IAI.68.9.4839-4849.2000 |
| [41] | Brackman G, Cos P, Maes L, et al. Quorum sensing inhibitors increase the susceptibility of bacterial biofilms to antibiotics in vitro and in vivo[J]. Antimicrobial Agents and Chemotherapy , 2011, 55 (6) : 2655–2661. DOI:10.1128/AAC.00045-11 |
| [42] | Brackman G, Coenye T. Comment on: Synergistic antibacterial efficacy of early combination treatment with tobramycin and quorum-sensing inhibitors against Pseudomonas aeruginosa in an intraperitoneal foreign-body infection mouse model[J]. Journal of Antimicrobial Chemotherapy , 2013, 68 (9) : 2176–2177. DOI:10.1093/jac/dkt151 |
| [43] | Brackman G, Coenye T. Quorum sensing inhibitors as anti-biofilm agents[J]. Current Pharmaceutical Design , 2015, 21 (1) : 5–11. |
| [44] | Kalia VC. Quorum sensing inhibitors: an overview[J]. Biotechnology Advances , 2013, 31 (2) : 224–245. DOI:10.1016/j.biotechadv.2012.10.004 |
| [45] | Quale J, Bratu S, Gupta J, et al. Interplay of efflux system, ampC, and oprD expression in carbapenem resistance of Pseudomonas aeruginosa clinical isolates[J]. Antimicrobial Agents and Chemotherapy , 2006, 50 (5) : 1633–1641. DOI:10.1128/AAC.50.5.1633-1641.2006 |
| [46] | Müller A, H chler H, Stephan R, et al. Presence of AmpC beta-lactamases, CSA-1, CSA-2, CMA-1, and CMA-2 conferring an unusual resistance phenotype in Cronobacter sakazakii and Cronobacter malonaticus[J]. Microbial Drug Resistance , 2014, 20 (4) : 275–280. DOI:10.1089/mdr.2013.0188 |
| [47] | Bordi C, de Bentzmann S. Hacking into bacterial biofilms: a new therapeutic challenge[J]. Annals of Intensive Care , 2011, 1 (1) : 19. DOI:10.1186/2110-5820-1-19 |
| [48] | Chen Q, Wang SC. Experimental study of eliminating action of baicalin and Rhizoma Coptidis on R plasmid of E. coli[J]. Journal of Guangdong Medical College , 1998, 16 (1/2) : 1–3. (in chinese) 陈群, 王胜春. 黄芩和黄连对大肠杆菌R质粒消除作用的实验研究[J]. 广东医学院学报 , 1998, 16 (1/2) : 1–3. |
| [49] | Liu K, Guan J, Li JH, et al. Eliminator effect of Astragalus membranaceus extract on R plasmids of P. aeruginosa PA16 strain in vitro and vivo[J]. Journal of Microbiology[J]. Journal of Microbiology , 2003, 23 (2) : 49–50. (in chinese) 刘克, 关键, 李菁华, 等. 黄芩甙对铜绿假单胞菌R质粒的消除作用[J]. 微生物学杂志 , 2003, 23 (2) : 49–50. |
| [50] | Wang DH, Chen M, Jiang ZQ, et al. Experimental study of Baicalin curing antibiotic-resistant plasmid in Acinetobacter Baumanii[J]. Chinese Journal of Modern Applied Pharmacy , 2012, 29 (5) : 400–404. (in chinese) 汪东海, 陈敏, 姜志强, 等. 黄芩苷消除鲍曼不动杆菌耐药质粒的实验研究[J]. 中国现代应用药学 , 2012, 29 (5) : 400–404. |
| [51] | Liang J, Kuang XH, Yuan L, et al. Detection of theβ-Lactamase of S. flexneri from chicken and its relation with the resistant plasmids[J]. Journal of Henan Agricultural University , 2006, 40 (5) : 510–515. (in chinese) 梁军, 匡秀华, 苑丽, 等. 鸡志贺氏菌β-内酰胺酶的测定及其与耐药质粒的关系[J]. 河南农业大学学报 , 2006, 40 (5) : 510–515. |
| [52] | Zhang XL, Yu CX. Antibacterial effect of berberine hydrochloride and baicalin combined with antibiotics against multidrug resistant Acinetobacter baumannii[J]. Central South Pharmacy , 2014, 12 (5) : 411–414. (in chinese) 张晓玲, 于翠香. 盐酸小檗碱、黄芩苷与抗菌药物联用对多重耐药鲍曼不动杆菌作用研究[J]. 中南药学 , 2014, 12 (5) : 411–414. |
| [53] | Jian LY, He XJ, Yu Y. In vitro activity and related mechanisms of action of baicalin in combination with levofloxacin on Pseudomonas aeruginose biofilms[J]. Chinese Journal of Hospital Pharmacy , 2012, 32 (14) : 1097–1100. (in chinese) 菅凌燕, 何晓静, 于莹. 黄芩苷联合左氧氟沙星对铜绿假单胞菌生物膜的影响及相关机制[J]. 中国医院药学杂志 , 2012, 32 (14) : 1097–1100. |
| [54] | Huang YQ, Huang GR, Wu MH, et al. Inhibitory effects of emodin, baicalin, schizandrin and berberine on hefA gene: treatment of Helicobacter pylori-induced multidrug resistance[J]. World Journal of Gastroenterology , 2015, 21 (14) : 4225–4231. DOI:10.3748/wjg.v21.i14.4225 |
| [55] | Liu IX, Durham DG, Richards RM. Baicalin synergy withβlactam antibiotics against methicillin‐resistant Staphylococcus aureus and otherβlactam resistant strains of S. aureus[J]. Journal of Pharmacy and Pharmacology , 2000, 52 (3) : 361–366. DOI:10.1111/(ISSN)2042-7158 |
| [56] | Tiwari V, Roy R, Tiwari M. Antimicrobial active herbal compounds against Acinetobacter baumannii and other pathogens[J]. Frontiers in Microbiology , 2015, 6 : 618. |
 2016, Vol. 43
2016, Vol. 43




