扩展功能
文章信息
- 徐友强, 姜增妍, 姚粟, 马玉岳, 裴疆森, 程池
- XU You-Qiang, JIANG Zeng-Yan, YAO Su, MA Yu-Yue, PEI Jiang-Sen, CHENG Chi
- 一株产L-天冬氨酸酶大肠埃希氏菌的噬菌体分离和生物学特性
- Isolation and characterization of a phage against an Escherichia coli strain producing L-aspartase
- 微生物学通报, 2016, 43(7): 1491-1498
- Microbiology China, 2016, 43(7): 1491-1498
- 10.13344/j.microbiol.china.150579
-
文章历史
- 收稿日期: 2015-07-31
- 接受日期: 2015-11-13
- 优先数字出版日期(www.cnki.net): 2015-12-04
2. 山东省富马酸生物转化工程技术研究中心 山东 烟台 265709
2. Engineering Technology Research Center of Fumaric Acid Biotransformation in Shandong Province,Yantai,Shandong 265709,China
L-天冬氨酸是一种重要的食品、医药和化工原料,市场需求巨大[1]。微生物转化法利用高L-天冬氨酸酶活力的菌种,转化富马酸和氨水生产L-天冬氨酸,具有反应条件温和、转化率高、副产物少的特点,是目前常用的工业化生产方法[2]。
微生物工业生产中的噬菌体污染时常发生[3, 4],在L-天冬氨酸的生产中也不例外[5]。微生物被噬菌体污染,会导致发酵周期延长、产物难以形成,甚至造成倒罐和停产[3]。利用大肠埃希氏菌生产L-天冬氨酸包括两步:菌体培养和以富马酸和氨水为底物全细胞催化生产L-天冬氨酸[6]。其中,大肠埃希氏菌培养过程易受到噬菌体污染[5],影响菌体生长和L-天冬氨酸酶活力,严重干扰正常生产。研究噬菌体的生物学特性是认识噬菌体的基本前提,也对控制噬菌体污染具有参考价值[7]。
1 材料与方法 1.1 材料 1.1.1 菌种和噬菌体:对噬菌体敏感的L-天冬氨酸生产菌种大肠埃希氏菌(Escherichia coli) CICC 11021S,保藏于中国工业微生物菌种保藏管理中心(CICC),宿主谱分析涉及的大肠埃希氏菌、志贺氏菌、沙门氏菌均来源于CICC。噬菌体CICC 80003分离自某工厂污染噬菌体的发酵液。
1.1.2 培养基:双层平板培养基[8];LB培养基[9];发酵培养基(g/L),富马酸10.0,玉米浆干粉10.0,硫酸镁0.2,磷酸二氢钾1.0,氯化钠1.5,氨水调节pH 6.5−7.5,1×105 Pa灭菌20 min。
1.1.3 主要试剂:DNA Marker和Proteinase K,天根生化科技(北京)有限公司;核酸内切酶,美国Thermo Scientific公司;化学试剂为分析纯或色谱纯。
1.1.4 主要仪器:Eppendorf低温离心机,德国Eppendorf公司;JEM-1400透射电子显微镜,日本电子株式会社;ZF-4型紫外透射反射分析仪,上海康禾光电仪器有限公司;Tanon EPS 300数显稳压稳流电泳仪,上海天能科技有限公司。
1.2 噬菌体的分离与纯化参考江艳华等[8]的方法,采用双层平板法进行噬菌体分离纯化,挑取形态大小一致的噬菌斑,重复分离纯化4次,得到纯化的噬菌体,编号CICC 80003。
1.3 噬菌体形态观察噬菌体制片采用0.25%的醋酸双氧铀负染,待染色的样品晾干后用JEM-1400透射电镜观察噬菌体形态。
1.4 噬菌体基因组提取及酶切参考于子超[10]的方法,提取CICC 80003基因组,BamH I、EcoR I、Hind Ⅲ、Kpn I、Mlu I、Not I、Pst I、Sac I、Sma I、Spe I、Xho I分别单酶切处理,琼脂糖凝胶电泳检测。
1.5 噬菌体最佳感染复数参考Lu等[11]的方法,将噬菌体与宿主菌以1、0.1、0.01、0.001、0.000 1 (PFU/CFU)的比例混合,37 °C、200 r/min温育1 h,然后梯度稀释,双层平板法测定噬菌体效价。效价最高的噬菌体与宿主比例认定为噬菌体最佳感染复数[11]。
1.6 噬菌体一步生长曲线参考Leuschner等[12]和Pajunen等[13]的方法。以噬菌体感染时间为横坐标,效价的对数值为纵坐标,绘制一步生长曲线,计算潜伏期、裂解期和裂解量。
1.7 噬菌体pH稳定性噬菌体纯培养液接于不同pH (2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0)的LB培养基[9]中,25 °C恒温水浴1 h,双层平板法测定效价[14]。
1.8 噬菌体温度稳定性噬菌体纯培养液分别置于不同温度(50、60、70、80和90 °C)水浴15、30、45和60 min后,取出立即置于冰浴中冷却,双层平板法测定效价[14]。
1.9 噬菌体宿主谱选取17株大肠埃希氏菌、3株志贺氏菌和3株沙门氏菌,活化后涂布LB平板,滴加噬菌体悬液,37 °C培养12 h。对产生噬菌斑的菌株通过双层平板法进一步验证噬菌体是否对宿主菌具有感染性[11]。
1.10 噬菌体对菌体生长和酶活力影响配制发酵培养基,500 mL三角瓶装液量50 mL。1%接种量接种E. coli CICC 11021S,平行6瓶,其中3瓶加入终浓度约1×107 PFU/mL的噬菌体。37 °C、200 r/min培养,每2 h取样测定细胞密度和L-天冬氨酸酶活力。
L-天冬氨酸酶活力定义:每分钟催化产生1 μmol的L-天冬氨酸所需要的酶量定义为1个酶活力单位。
L-天冬氨酸酶活力测定方法:取发酵液2 mL,加入以氨水调节pH 8.0的富马酸(1.5 mol/L)溶液25 mL,45 °C、200 r/min培养,每2 h取样,PITC柱前衍生法测定L-天冬氨酸的浓度。
样品衍生:样品400 μL,依次加入0.5 g/L正亮氨酸溶液20 μL、0.1 mol/L PITC-乙腈溶液200 μL、1 mol/L三乙胺-乙腈溶液200 μL,涡旋振荡后室温放置60 min,加入800 μL正己烷,涡旋振荡1 min,静置10 min。用注射器吸取下层溶液,0.22 μm滤膜过滤后HPLC检测。
检测条件:色谱柱为ZORBAX SB-C18 (5 μm,4.6 mm×150 mm),紫外检测器设定波长为254 nm,柱温38 °C,流速设定为0.6 mL/min,进样量为10 μL,流动相A为0.1 mol/L pH 6.5的乙酸铵-乙腈(97:3,体积比)溶液,流动相B为乙腈溶液。洗脱:0−8 min流动相B的比例为18%,8−16 min流动相B的比例由18%梯度升高到80%。
2 结果与分析 2.1 噬菌体形态观察以E. coli CICC 11021S为宿主菌,双层平板培养12 h,CICC 80003噬菌斑直径4.5 mm−6.5 mm,清晰透明,边缘有明显晕环(图 1A)。噬菌体形态如图 1B所示,头部规则,直径50 nm−60 nm,尾部直径120 nm−130 nm。根据国际病毒分类委员会第8次报告提出的噬菌体分类与命名标准,CICC 80003符合长尾噬菌体科(Siphoviridae)的基本特征[15]。

|
| 图 1 噬菌体CICC 80003噬菌斑(A)和微观形态(B) Fig.1 The plaques (A) and morphology (B) of phage CICC 80003 |
BamH I酶切产生2条条带,Mlu I酶切产生5条条带,噬菌体基因组上不存在其余核酸内切酶酶切位点(图 2)。由于核酸内切酶BamH I和Mlu I均为dsDNA酶,表明CICC 80003的基因组为dsDNA。

|
| 图 2 噬菌体CICC 80003基因组核酸内切酶酶切电泳分析 Fig.2 Electrophoresis analysis of phage CICC 80003 genome DNA by endonuclease treatment 注:1:基因组DNA;2:BamH Ⅰ酶切处理;3:Kpn Ⅰ酶切处理;4:Mlu Ⅰ酶切处理;5:Not Ⅰ酶切处理;6:Pst Ⅰ酶切处理;7:Sma Ⅰ酶切处理;8:Spe Ⅰ酶切处理;9:EcoR Ⅰ酶切处理;10:Hind Ⅲ酶切处理;11:Xho Ⅰ酶切处理;12:Sac Ⅰ酶切处理;M1和M2:DNA marker. Note: 1: Genome DNA; 2: BamH Ⅰ treatment; 3: Kpn Ⅰ treatment; 4: Mlu Ⅰ treatment; 5: Not Ⅰ treatment; 6: Pst Ⅰ treatment; 7: Sma Ⅰ treatment; 8: Spe Ⅰ treatment; 9: EcoR Ⅰ treatment; 10: Hind Ⅲ treatment; 11: Xho Ⅰ treatment; 12: Sac Ⅰ treatment; M1 and M2: DNA marker. |
2.3.1 最佳感染复数: 图 3表明CICC 80003的最佳感染复数为0.1。

|
| 图 3 噬菌体CICC 80003最佳感染复数 Fig.3 The optimal multiplicity of infection of phage CICC 80003 |
2.3.2 一步生长曲线: 图 4表明CICC 80003的潜伏期约5 min,裂解期约25 min,裂解量73−100个,平均裂解量约86个。

|
| 图 4 噬菌体CICC 80003一步生长曲线 Fig.4 The one step growth curve of phage CICC 80003 |
2.3.3 pH稳定性: CICC 80003的pH适应范围较广,最适pH值8.0,4.0−11.0均可以稳定存活,效价损失不显着(图 5)。

|
| 图 5 噬菌体CICC 80003 pH稳定性 Fig.5 The pH stability of phage CICC 80003 |
2.3.4 温度稳定性: 图 6表明CICC 80003具有一定的温度稳定性。50 °C处理1 h,基本不失活,70 °C处理1 h,存活率47.5%。

|
| 图 6 噬菌体CICC 80003温度稳定性 Fig.6 The temperature stability of phage CICC 80003 |
2.3.5 宿主谱: CICC 80003可以感染17株大肠埃希氏菌中的8株,包括K12和BL21(DE3)(表 1)。
| 菌株名称 Name of strain | 菌株编号 Number of strain | 菌株来源 Source of strain | 裂解性 Lytic ability |
| Escherichia coli | 11021S | CICC | + |
| Escherichia coli | 11022S | CICC | + |
| Escherichia coli | 10300 | CICC | + |
| Escherichia coli | 10354 | CICC | + |
| Escherichia coli | 10899 | CICC | + |
| Escherichia coli | 20905 | CICC | + |
| Escherichia coli BL21(DE3) | 23796 | CICC | + |
| Escherichia coli K12 | 23872 | CICC | + |
| Escherichia coli | 10305 | CICC | - |
| Escherichia coli ETEC O78:K80 | 10413 | CICC | - |
| Escherichia coli EIEC | 10661 | CICC | - |
| Escherichia coli | 20058 | CICC | - |
| Escherichia coli | 20091 | CICC | - |
| Escherichia coli | 20234 | CICC | - |
| Escherichia coli | 10780G | CICC | - |
| Escherichia coli | 10784G | CICC | - |
| Escherichia coli | 10785G | CICC | - |
| Shigella sonnei | 21535 | CICC | - |
| Shigella dysenteriae | 10983 | CICC | - |
| Shigella bogdii | 21680 | CICC | - |
| Salmonella enterica subsp. enterica serovartyphi | 10871 | CICC | + |
| Salmonella typhimurium | 22956 | CICC | - |
| Salmonella typhimurium | 10420 | CICC | - |
此外,选取与大肠埃希氏菌近缘的志贺氏菌3株和沙门氏菌3株,进行噬菌体感染。表 1表明,CICC 80003可以感染沙门氏菌CICC 10871,但是不能感染所选取的志贺氏菌。
2.4 噬菌体对宿主生长和酶活力影响如图 7所示,正常情况下,E. coli CICC 11021S生长12 h,菌体密度为8.33,L-天冬氨酸酶活力39.8 U/mL。但发生CICC 80003污染时,E. coli CICC 11021S无法正常生长,酶活力几乎检测不到。
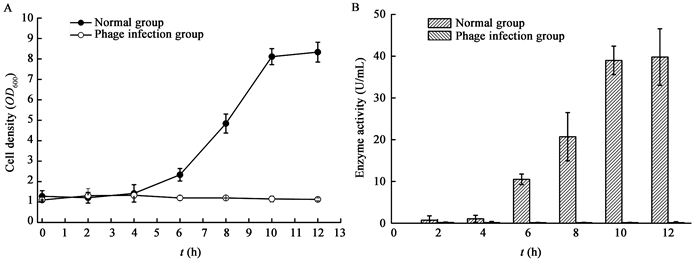
|
| 图7 噬菌体CICC 80003对宿主生长(A)和酶活力(B)影响 Fig.7 The effect of CICC 80003 to cell growth (A) and enzyme activity (B) of the host strain |
微生物生产氨基酸的噬菌体污染已有报道,如L-谷氨酸和L-苯丙氨酸[16, 17]。课题组前期从噬菌体污染样品中分离一株噬菌体CICC 80001[5]。对该样品分离的另一株噬菌体CICC 80003进行研究,发现两株噬菌体既有相似之处,均为有尾噬菌体,基因组均为dsDNA;又有差异之处,CICC 80001属于短尾噬菌体科,噬菌斑无晕环,裂解量约198个;而CICC 80003属于长尾噬菌体科,噬菌斑有明显晕环,裂解量约86个。
噬菌体感染宿主菌的潜伏期、裂解期以及裂解量与噬菌体、宿主菌、培养基和培养条件均有关系[7]。工业生产中噬菌体的潜伏期、裂解期和裂解量与实验室研究中的差异较大,这既与感染复数相关,又与培养基、培养条件和宿主细胞自身所处的生长阶段密切相关。
噬菌体CICC 80003具有较宽的pH适应范围,pH 4.0−11.0均可以稳定存在;CICC 80003对温度具有一定的耐受性,但是随着温度升高,噬菌体显著失活。这表明对CICC 80003污染防治时,采取改变培养基pH来抑制噬菌体是行不通的,可以通过高温杀菌,有效灭杀发酵系统中可能存在的噬菌体。但是,由于噬菌体的专性寄生性,凡是有细菌的地方就可能存在对应的噬菌体,且噬菌体个体微小,一般过滤装置难以完全除去,所以仅采用高温杀菌,并不能够从根本上解决噬菌体污染问题[17, 18]。工业生产中一般通过综合措施防治噬菌体污染,如生产环境质量控制、化学防治以及菌种轮换[4]。噬菌体宿主谱具有一定范围,如CICC 80003仅能感染部分大肠埃希氏菌和沙门氏菌菌株(表 1)。选育噬菌体抗性菌种,并在生产过程中定期轮换,是控制噬菌体污染的有效措施之一,并已经在乳品生产中得到应用[4, 19]。
研究发现,大肠埃希氏菌存在多种噬菌体抗性机制,包括噬菌体吸附阻滞[20]、DNA注入阻滞[21]、限制修饰系统[22]、流产感染系统[23]、毒素-抗毒素系统[24]。基于噬菌体抗性机制构建工程菌,是选育抗噬菌体菌种的有效方法,如异源表达限制修饰系统cglI,构建的L-谷氨酸生产工程菌,表现出较好的噬菌体抗性和工业应用潜力[16]。下一步应对CICC 80003进行基因组测序和注释,分析噬菌体的宿主裂解机制,同时结合现有的噬菌体抗性机制研究,以CICC 11021S为宿主,构建噬菌体抗性工程菌种,并检验在实际应用中的效果。
| [1] | Hu YJ,Liu Y,Cheng C. Production,application and market prospect of L-aspartic acid[J]. Food and Fermentation Industries,2013,39(6): 120-124 (in Chinese)胡育骄,刘勇,程池. l-天冬氨酸生产、应用与市场前景[J]. 食品与发酵工业,2013,39(6): 120-124 |
| [2] | Sheng XY,Fu YQ,Li S,et al. Study on a new strategy for the cultivation of l-ASP-producing bacteria utilizing the wasted fumaric acid fermentation broth[J]. Food Science and Technology,2010,35(1): 23-26 (in Chinese)盛晓燕,付永前,李霜,等. 利用富马酸发酵废液培养l-天冬氨酸转化菌策略的研究[J]. 食品科技,2010,35(1): 23-26 |
| [3] | Huffer S,Roche CM,Blanch HW,et al. Escherichia coli for biofuel production: bridging the gap from promise to practice[J]. Trends in Biotechnology,2012,30(10): 538-545 |
| [4] | Sun WJ,Mo QY,Liu CF,et al. Bacteriophage in fermentation industry: sources,detection and control actions[J]. Food Science and Technology,2013,38(8): 323-327 (in Chinese)孙文敬,莫秋云,刘长峰,等. 发酵工业噬菌体污染的来源、检测与防治[J]. 食品科技,2013,38(8): 323-327 |
| [5] | Liu Y,Ma YY,Xu YQ,et al. Isolation and physiological characteristics study of a bacteriophage against an Escherichia coli with l-aspartase production[J]. Journal of Microbiology,2015,35(5): 43-46 (in Chinese)刘勇,马玉岳,徐友强,等. 一株产l-天冬氨酸酶大肠杆菌噬菌体分离和生理特性初步研究[J]. 微生物学杂志,2015,35(5): 43-46 |
| [6] | Ma YY,Jiang GZ,Jiang ZY,et al. An Escherichia coli strain producing high yield of L-aspartase and its application: China,201110382584[P]. 2012-07-11 (in Chinese)马玉岳,姜国政,姜增妍,等. 高产l-天冬氨酸酶的大肠杆菌及其应用: 中国,201110382584[P]. 2012-07-11 |
| [7] | Nan N,Cao F,Shen JT,et al. Characterization of a bacteriophage of Klebsiella pneumoniae producing 1,3-propanediol[J]. Acta Microbiologica Sinica,2013,53(9): 943-949 (in Chinese)南南,曹放,沈俊涛,等. 一株产1,3-丙二醇的克雷伯氏菌的噬菌体生物学特性[J]. 微生物学报,2013,53(9): 943-949 |
| [8] | Jiang YH,Li FL,Wang LZ,et al. Isolation,identification and biological properties of a lytic phage against Salmonella[J]. Microbiology China,2015,42(3): 534-542 (in Chinese)江艳华,李风铃,王联珠,等. 一株沙门氏菌裂解性噬菌体的分离鉴定及生物学特性[J]. 微生物学通报,2015,42(3): 534-542 |
| [9] | Bertani G. Lysogeny at mid-twentieth century: P1,P2,and other experimental systems[J]. Journal of Bacteriology,2004,186(3): 595-600 |
| [10] | Yu ZC. Study of the adaptation mechanism of marine Pseudomonas to sea ice environment and construction of their genetic manipulation system[D]. Ji’nan: Doctoral Dissertation of Shandong University,2014 (in Chinese)于子超. 海洋假交替单胞菌适应海冰环境的机制及其遗传操作体系的建立[D]. 济南: 山东大学博士学位论文,2014 |
| [11] | Lu Z,Breidt F Jr,Fleming HP,et al. Isolation and characterization of a Lactobacillus plantarum bacteriophage,ØJL-1,from a cucumber fermentation[J]. International Journal of Food Microbiology,2003,84(2): 225-235 |
| [12] | Leuschner RGK,Arendt EK,Hammes WP. Characterization of a virulent Lactobacillus sake phage PWH2[J]. Applied Microbiology and Biotechnology,1993,39(4/5): 617-621 |
| [13] | Pajunen M,Kiljunen S,Skurnik M. Bacteriophage φYeO3-12,specific for Yersinia enterocolitica serotype O:3,is related to coliphages T3 and T7[J]. Journal of Bacteriology,2000,182(18): 5114-5120 |
| [14] | Sun WJ,Liu CF,Yu L,et al. A novel bacteriophage KSL-1 of 2-Keto-gluconic acid producer Pseudomonas fluorescens K1005: isolation,characterization and its remedial action[J]. BMC Microbiology,2012,12: 127 |
| [15] | Feng SZ,Liu J,Sun Y. An introduction to the bacterial viruses in 8th report of ICTV[J]. Chinese Journal of Veterinary Science,2007,27(4): 604-608 (in Chinese)冯书章,刘军,孙洋. 细菌的病毒——噬菌体最新分类与命名[J]. 中国兽医学报,2007,27(4): 604-608 |
| [16] | Hu YF,Li TM,Yang ZY,et al. Phage resistance of Corynebacterium crenatum conferred by the restriction and modification system cglI[J]. Chinese Journal of Biotechnology,2008,24(5): 760-765 (in Chinese)胡永飞,李铁民,杨智勇,等. 限制修饰系统cglI赋予钝齿棒杆菌抗噬菌体功能活性[J]. 生物工程学报,2008,24(5): 760-765 |
| [17] | Zhou HY,Liu L,Du GC,et al. Screening of bacteriophage-resistant strain for l-phenylalanine production[J]. Food and Fermentation Industries,2013,39(7): 88-93 (in Chinese)周海岩,刘龙,堵国成,等. l-苯丙氨酸抗噬菌体生产菌的选育和应用[J]. 食品与发酵工业,2013,39(7): 88-93 |
| [18] | Breitbart M,Rohwer F. Here a virus,there a virus,everywhere the same virus?[J]. Trends in Microbiology,2005,13(6): 278-284 |
| [19] | Guglielmotti DM,Binetti AG,Reinheimer JA,et al. Streptococcus thermophilus phage monitoring in a cheese factory: phage characteristics and starter sensitivity[J]. International Dairy Journal,2009,19(8): 476-480 |
| [20] | Stummeyer K,Schwarzer D,Claus H,et al. Evolution of bacteriophages infecting encapsulated bacteria: lessons from Escherichia coli K1-specific phages[J]. Molecular Microbiology,2006,60(5): 1123-1135 |
| [21] | Lu MJ,Stierhof YD,Henning U. Location and unusual membrane topology of the immunity protein of the Escherichia coli phage T4[J]. Journal of Virology,1993,67(8): 4905-4913 |
| [22] | Anton BP,Raleigh EA. Transposon-mediated linker insertion scanning mutagenesis of the Escherichia coli McrA endonuclease[J]. Journal of Bacteriology,2004,186(17): 5699-5707 |
| [23] | Meineke B,Shuman S. Determinants of the cytotoxicity of PrrC anticodon nuclease and its amelioration by tRNA repair[J]. RNA,2012,18(1): 145-154 |
| [24] | Hazan R,Engelberg-Kulka H. Escherichia coli mazEF-mediated cell death as a defense mechanism that inhibits the spread of phage P1[J]. Molecular Genetics and Genomics,2004,272(2): 227-234 |
 2016, Vol. 43
2016, Vol. 43




