扩展功能
文章信息
- 赵芳, 李艳琴, 李彬春
- ZHAO Fang, LI Yan-Qin, LI Bin-Chun
- 模拟人体胃肠道环境筛选益生乳杆菌
- Screening of probiotic Lactobacillus in simulated gastrointestinal environment
- 微生物学通报, 2016, 43(6): 1396-1403
- Microbiology China, 2016, 43(6): 1396-1403
- DOI: 10.13344/j.microbiol.china.150898
-
文章历史
- 收稿日期: 2015-11-10
- 优先数字出版日期(www.cnki.net): 2016-02-03
益生菌是指对宿主健康有一定促进作用的微生物[1]。理想的益生菌定义基于以下标准:耐胃酸和胆盐,在肠道中有较强繁殖能力,与宿主消化道具有强大的黏附能力,对宿主细胞无致病性和毒副作用,能减少病原微生物等[2]。目前市场上常见的益生菌主要有:鼠李糖乳杆菌、罗伊氏乳杆菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、植物乳杆菌、嗜热链球菌、双歧杆菌等。2015年,Xu等[3]和Liu等[4]分别对新疆和西藏的38个自然发酵乳样品进行高通量测序研究,均得出了乳杆菌属为绝对优势菌群的结论。
乳杆菌作为一种优良益生菌,可有效改善宿主的肠道环境、抑制有害菌的生长[5, 6]、提高免疫力[7]、调节肠道黏膜屏障功能[8]、降低胆固醇含量[9],为宿主健康生长提供保证。随着乳杆菌益生作用的深入研究,越来越多的乳杆菌被广泛应用于生物技术、食品制作和医疗领域。
益生菌在宿主中的存活和定殖能力是其发挥益生作用的前提,来源于人体胃肠道的菌更容易在人体肠道定殖。传统的天然发酵食品因长期食用而更具有安全性。基于以上原因,本研究拟从成人粪便和传统发酵食品奶豆腐中分离、筛选既耐受人工胃肠液、耐胆盐,又具有抑菌活性和降胆固醇能力的菌株,这对于开发新的益生菌产品促进人类健康具有重要的现实意义和广阔的应用前景。
1 材料与方法 1.1 材料1.1.1 材料:成人粪便采自山西大学学生(样本10名,男女各5名,年龄在20−25岁之间),用无菌竹棒挑取自然排出的粪便,置于无菌采集管中,2 h内分离其中菌株。奶豆腐购自内蒙古赤峰市牧民(自制),24 h内分离其中菌株。
1.1.2 对照菌株:鼠李糖乳杆菌GG ATCC53103 (LGG),购于Culturelle LGG并从中分离纯化。
1.1.3 试剂:磷酸二氢钾、磷酸氢二钠、氯化钠、氯化钾、无水乙醇、氢氧化钠、盐酸、胆固醇、巯基乙酸钠、胆盐、邻苯二甲醛、浓硫酸、冰醋酸、正己烷、氢氧化钾、胃蛋白酶、胰蛋白酶等均为分析纯。
1.1.4 培养基:MRS培养基[10]:用于乳酸菌的培养和计数。乳杆菌分离培养基:MRS培养基中加10 g/L CaCO3。胆盐培养基[11]:MRS培养基中加入2 g/L巯基乙酸钠和不同浓度的胆盐,用于菌株耐胆盐能力的测定。胆固醇培养基:按参考文献[12]所述,胆盐浓度改为1 g/L,用于菌株降胆固醇活力的测定。
1.1.5 人工胃液制备[11]:NaCl 0.20%、胃蛋白酶0.30%,HCl调pH至2.5,过滤除菌备用。
1.1.6 人工肠液制备[11]:胰腺液:胰蛋白酶0.10%,调pH至8.0,过滤除菌备用。胆液:胆盐1.80%,调pH至8.0,过滤除菌备用。将胰腺液和胆液以2:1混合即为人工肠液。
1.2 耐受人工胃液乳杆菌的分离、纯化及筛选1.2.1 乳杆菌的分离和纯化:将收集的样品经梯度稀释,用倾倒平板法,乳杆菌分离培养基37 °C厌氧培养48 h,挑取周围有溶钙圈的单菌落,用平板划线法纯化3次用于后续实验或冷冻保藏。
1.2.2 耐酸性菌株筛选[11]:将纯化的菌株接种于pH 3.0的MRS培养基中,37 °C厌氧静置培养72 h,以∆A600(菌株在72 h和0 h时600 nm处吸光度之差)为指标,筛选耐酸菌株。
1.2.3 耐人工胃液菌株的筛选[11]:取1.0 mL菌悬液(浓度约为1×109 cfu/mL)与9.0 mL pH 2.5的人工胃液混合后,37 °C厌氧静置培养,分别在开始(0 h)和3 h取样,倾注培养法测定活菌数并计算其存活率。
N1:人工胃液处理3 h后的活菌数;N0:0 h的活菌数。
1.3 菌种鉴定细菌通用引物扩增16s rRNA基因片段[13]并测序,将结果与GenBank中数据比对。
1.4 菌种的驯化对筛选得到的乳杆菌和对照菌株进行驯化。将菌种在pH 2.5的人工胃液中处理2 h后,在MRS固体培养基划线培养,选取生长状态好的菌落转接至液体MRS培养基37 °C静置厌氧培养24 h,重复前面的操作3−5次。平板计数,计算存活率。
1.5 乳杆菌益生特性的研究1.5.1 乳杆菌对人工胃肠液耐受性测定:将1 mL菌悬液与9 mL人工胃液混匀置37 °C厌氧静置培养。在0、2 h分别取样,测定其活菌数。然后吸取1 mL处理2 h的含菌人工胃液与9 mL pH 8.0人工肠液混合,置37 °C继续厌氧静置培养,分别在6、10、14、26 h取样测定活菌数,计算存活率。
1.5.2 乳杆菌胆盐耐受性的测定:将活化的乳杆菌以1%接种于胆盐培养基(胆盐浓度0%−0.25%)中,37 °C厌氧静置培养,每隔1 h取样,于波长620 nm处测定OD值,直到OD值增加0.3个单位以上或时间达到24 h为止。计算菌株生长迟滞期。
迟滞期(LT)=胆盐培养基中菌株的吸光值增长0.3个单位所需时间−无胆盐培养基中菌株的吸光值增长0.3个单位所需时间。
1.5.3 乳杆菌抑菌活性测定:以4种常见的人体肠道有害菌或条件致病菌(大肠杆菌、沙门氏菌、粪肠球菌、金黄色葡萄球菌)为靶标,采用牛津杯法测定样品的抑菌活性[14]。
1.5.4 乳杆菌降胆固醇特性测定:选择邻苯二甲醛法[14]。菌株按1%接种于5 ml胆固醇培养基中,37 °C静置厌氧培养24 h。测定波长550 nm处OD值,然后4 000 r/min离心10 min,上清用于测定胆固醇含量。未接菌的胆固醇培养基作为对照。
B:未接种的培养基中胆固醇浓度,mg/l;S:发酵上清中胆固醇浓度,mg/l;OD:发酵24 h后A600值。
1.6 数据分析数据采用SPSS 17.0软件进行方差分析,采用Origin软件做图。所有试验均重复3次。
2 结果与分析 2.1 耐受人工胃液乳杆菌的分离、纯化及筛选2.1.1 乳杆菌的分离、纯化:挑选乳杆菌分离培养基上周围有溶钙圈的菌落,经分离纯化,共筛出源于人体肠道的细菌25株,源于奶豆腐的细菌16株。经过连续传代,留取溶钙圈稳定并生长速度较快的15株菌用于后面的实验。
2.1.2 耐酸性菌株筛选:乳杆菌食入人体后能否抵抗胃液较强的酸性环境是益生菌在肠道存活并定殖的先决条件。实验选用pH 3.0的MRS培养基进行耐酸性菌株的筛选,结果见表 1。
| 来源 Source | 菌株 Strains | ∆A600 |
| 来自成人粪便 From adult feces | AF-1 | 0.046±0.024a |
| AF-4 | 0.047±0.024a | |
| AF-5 | 1.100±0.120e | |
| AF-6 | 0.059±0.062a | |
| AF-7 | 0.370±0.007d | |
| AF-8 | 0.226±0.068bcd | |
| AF-10 | 0.193±0.049abc | |
| AF-14 | 0.150±0.075ab | |
| AF-15 | 0.057±0.071a | |
| 来自奶豆腐 From milk tofu | MT-1 | 0.953±0.052e |
| MT-2 | 0.307±0.031abc | |
| MT-3 | 1.083±0.157e | |
| MT-4 | 1.064±0.201e | |
| MT-5 | 0.333±0.103cd | |
| MT-6 | 0.313±0.04bcd | |
| 注:a、b、c、d、e不同字母表示差异性显著(p<.0.05). Note: a,b,c,d,e: the same column followed by different superscript letters differ significantly (P<.0.05). | ||
由表 1可知,各菌株间对低pH的耐受性差异较大,源自奶豆腐菌株的∆A600普遍大于源自人体肠道的菌株。本实验选取∆A600>0.3的8株菌进行下一步实验。
2.1.3 耐人工胃液菌株的筛选:人体胃液主要成分包括胃酸和胃蛋白酶,这些分泌物质具有抗菌性。作为益生菌,必须具备耐受胃液的能力。由表 2可知,各菌株在酸性培养基中的生长情况与在人工胃液中的耐受能力并不一致,MT-6与AF-7在pH 3.0培养基中的生长情况相当,但在人工胃液中的存活率却相差10倍。
| 菌株 Strains | 活菌数 The number of live bacteria (CFU/mL) | 存活率 Survival rate (%) | |
| N0(0 h) | N1(3 h) | ||
| AF-5 | (5.20±0.40)×108 | (3.47±0.18)×107 | 6.68±0.17d |
| AF-7 | (1.70±0.08)×109 | (1.79±0.03)×107 | 1.05±0.03b |
| MT-1 | (7.37±0.03)×108 | (2.50±0.46)×106 | 0.34±0.05ab |
| MT-2 | (1.59±0.09)×109 | (6.86±0.11)×106 | 0.43±0.02ab |
| MT-3 | (1.31±0.05)×109 | (2.53±0.01)×107 | 1.93±0.04c |
| MT-4 | (6.77±0.93)×108 | (6.10±1.90)×105 | 0.09±0.02a |
| MT-5 | (1.77±0.33)×108 | (3.42±0.20)×106 | 1.97±0.26c |
| MT-6 | (6.47±1.37)×108 | (6.75±0.64)×107 | 10.62±1.36e |
| 注:a、b、c、d、e不同字母表示差异性显著(p<.0.05). Note: a,b,c,d,e: the same column followed by different superscript letters differ significantly (P<.0.05). | |||
综合菌株在pH 3.0 MRS上的生长情况和对pH 2.5人工胃液的耐受情况,选取MT-3、MT-5、MT-6、AF-5、AF-7菌株进行鉴定,结果见表 3。MT-3、MT-5为植物乳杆菌,MT-6为表皮葡萄球菌,AF-5为蒙氏肠球菌,AF-7为唾液乳杆菌。选择3株乳杆菌进行后续试验,分别命名为LpMT-3、LpMT-5和LsAF-7。
| 菌株 Strains | 同源性菌株 Closest relative | 相似性 Similarity (%) | 登录号 Accession No. |
| MT-3 | Lactobacillus plantarumstrain FJ005 | 100 | KT371517 |
| MT-5 | Lactobacillus plantarumWCFS1 strain | 100 | KT371518 |
| MT-6 | Staphylococcus epidermidisstrain MB2M14 | 100 | KT371519 |
| AF-5 | Enterococcus mundtiiQU 25 | 99 | KT371515 |
| AF-7 | Lactobacillus salivariusstr. Ren | 100 | KT371516 |
为了提高菌株对胃液的耐受性,对菌株进行驯化,结果见图 1。经过3−5次pH 2.5人工胃液的驯化,3株菌的存活率增加了0.3−3.0倍。
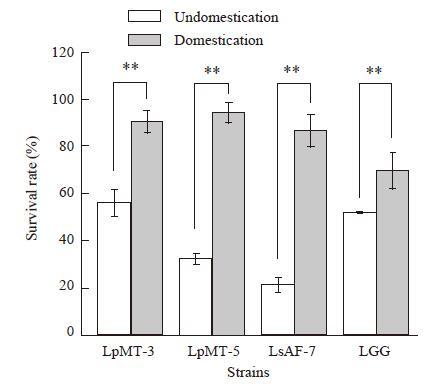
|
| 图 1 驯化前后菌株的存活率 Figure 1 Survival rate of strains before and after domestication 注:存活率:pH 2.5人工胃液处理2 h的乳杆菌的生存能力;**:同未驯化的菌株相比具极显著性(p<.0.01). Note: Survival rate: Effects of gastric juice on the viability of Lactobacillus strains after 2 h represented as survival rate; **: compared with undomesticated strains (p<.0.01). |
|
|
2.4.1 乳杆菌对人工胃肠液的耐受力测定:外来细菌除经过胃消化外还必须经过小肠的消化转运才能到达它们的目的地定殖并发挥作用,因此,研究对分离的3株乳杆菌耐受胃肠液的能力进行了测定,并以LGG为对照,结果见图 2。由图 2可知,分离菌株在人工胃液中的耐受力均强于对照菌。转入肠液后,LGG前4 h菌量不但没有减少,反而还有增加,之后,存活率缓慢降低,直至26 h的49.54%;LpMT-5前4 h菌量急剧减少,之后,存活率基本稳定在45%左右,仅次于LGG。LsAF-7和LpMT-3的耐胃肠液能力均较差,26 h的存活率分别为12.28%和1.50%。
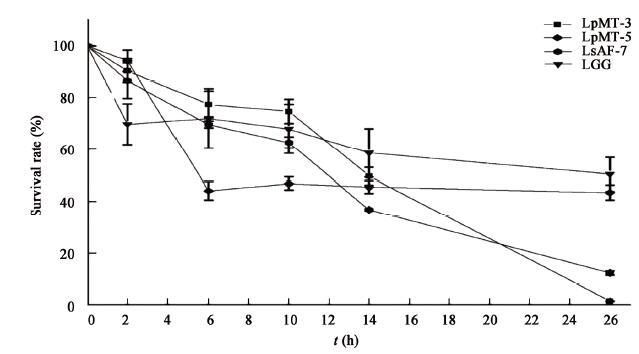
|
| 图 2 菌株经人工胃肠液处理后的存活率 Figure 2 Survival rate of Lactobacillus in artificial gastrointestinal juice 注:0−2 h:菌株对人工胃液的耐受;2−26 h:菌株对人工肠液的耐受. Note: 0−2 h: Tolerance to simulated gastric juice; 2−26 h: Tolerance to simulated intestinal juice. |
|
|
2.4.2 乳杆菌耐胆盐能力测定:对胆盐的耐受能力不仅决定着乳杆菌进入肠道后的活性状态,而且对于其发挥降胆固醇功能具有重要意义。小肠中胆汁浓度在0.03%−0.30%范围内波动,本实验据张旻对乳酸菌胆盐耐受性的测定,选择胆盐梯度进行研究[15],结果见表 4。菌株耐胆盐能力以其生长的迟滞期LT表示,LT越大表示菌株的胆盐耐受性越差。由表 4可知,胆盐浓度为0.10%时,4株菌均能生长,耐胆盐能力为LsAF-7>LpMT-3>LpMT-5>LGG。胆盐浓度为0.15%时,LpMT-5和LGG被完全抑制;胆盐浓度为0.25%时,其余2株菌也不能生长。
| 菌株 Strains | 胆盐浓度 Concentrations of bile salts (%) | |||||
| 0.00 | 0.05 | 0.10 | 0.15 | 0.20 | 0.25 | |
| LpMT-3 | 0.00 | 3.22±0.05 | 4.33±0.14 | 6.36±0.13 | 8.42±0.63 | − |
| LpMT-5 | 0.00 | 2.83±0.17 | 8.89±0.10 | − | − | − |
| LsAF-7 | 0.00 | 1.47±0.05 | 2.14±0.05 | 3.06±0.42 | 6.75±0.08 | − |
| LGG | 0.00 | 1.81±0.10 | 10.58±0.29 | − | − | − |
| 注:−:代表菌株被完全抑制. Note: −: Representative strain was completely inhibited. | ||||||
2.4.3 乳杆菌的抑菌活性测定:抑菌活性被认为是益生菌竞争性地杀死或抑制肠道中有害微生物的一个重要的指标。由表 5可知,LpMT-3和LsAF-7的抑菌活性略强于其它菌株,4株菌对粪肠球菌的抑制作用最明显,其次是金黄色葡萄球菌,对大肠杆菌、沙门氏菌的抑制作用较差。
| 菌株 Strains | 大肠杆菌Escherichia coli | 沙门氏菌Salmonella | 粪肠球菌Enterococcus faecalis | 金黄色葡萄球菌Staphylococcus aureus |
| LpMT-3 | 9.67±0.58 | 15.17±0.42 | 17.5±0.5 | 15.83±1.04 |
| + | ++ | +++ | +++ | |
| LpMT-5 | 9.17±0.29 | 13.13±0.81 | 18.5±0.5 | 16.17±0.76 |
| − | ++ | ++++ | +++ | |
| LsAF-7 | 12.67±0.58 | 11.83±0.29 | 19.67±0.29 | 15.9±0.66 |
| ++ | + | ++++ | +++ | |
| LGG | 11.00±1.00 | 12.17±0.29 | 20.5±0.5 | 14.17±0.29 |
| + | + | ++++ | ++ | |
| 注:数值为抑菌圈直径(mm);++++:直径19−24 mm;+++:16−18 mm;++:13−15 mm;+:10−12 mm;−:没有抑菌圈. Note: Value is the diameter of the antibacterial zone (mm); ++++: diameter between the 19−24 mm; +++: diameter between the 16−18 mm; ++: diameter between the 13−15 mm; +: diameter between the 10−12 mm; −: no effect. | ||||
2.4.4 乳杆菌的降胆固醇作用:以吸光度A550为横坐标,胆固醇浓度(mg/L)为纵坐标绘制标准曲线。计算回归方程为y=647.04 x;R2=0.996 2。将各菌株测定结果带入回归方程,计算胆固醇浓度、胆固醇清除率和清除效力。表 6结果表明:4株菌对胆固醇的清除效力依次为LGG>LpMT-3> LpMT-5>LsAF-7;清除率依次为LsAF-7>LpMT-3> LGG>LpMT-5。LsAF-7单个细胞清除胆固醇能力差,但其耐胆盐能力强,生长快,所以清除率高;LGG单个细胞清除胆固醇能力大,但其生长受胆盐抑制明显,所以清除率较低。这一结果与前面的耐胆盐能力测定结果一致。因此,菌株自身的代谢特性与生长情况共同影响其降胆固醇能力的大小。
| 菌株 Strains | 清除效力 Cholesterol reducing ability [mg/(L·OD)] | 清除率 Cholesterol reducing rate (%) |
| LpMT-3 | 35.17±8.25 | 28.77±6.75 |
| LpMT-5 | 19.49±6.32 | 8.00±2.60 |
| LsAF-7 | 18.63±3.71 | 29.22±5.83 |
| LGG | 55.09±5.48 | 22.15±2.20 |
益生菌被摄入人体后,在人体肠道中存活和定殖能力的强弱直接决定着其是否能发挥益生作用,因此耐胃酸、肠液等特性是优良乳杆菌作为益生菌的一个重要指标[16]。已有研究表明[17],胃液pH值因饮食结构不同而波动很大,通常pH值为3.0 左右,空腹或食用酸性食物时pH值低至1.5,食用碱性食物pH值可高达4.0−5.0,食物通过时间为1−2 h。本研究发现,分离菌株在pH 2.0人工胃液中处理2 h几乎都无法存活。该结果与以往研究结果类似[18],这也提示我们益生菌应避免空腹食用。通过模拟胃肠道条件对乳杆菌进行体外筛选,只能预测菌株在无食物保护条件下的体内存活状况。当菌株混于食品中时,情况则可能会发生些许改变。但体外的生存测试仍然有可能反应细菌在胃肠道条件下可能存在的问题,揭示细菌数量的变化趋势。
对菌株的益生特性进行评估时,通常会选择著名的商业益生菌作为对照,本实验选用的鼠李糖乳杆菌GG ATCC53103是从健康人体内分离而得,每天被超过500万的人摄入[19]。Goldin等[20]研究LGG对胃液的耐受性,发现在pH 3.0的胃液中加入3.24×108的LGG,2 h的活菌数为2.04×108,存活率达到62.96%,而当pH为1.0时,活菌数迅速下降,0.5 h活菌数为0。本实验中对照菌株LGG在pH 2.5的胃液中孵育2 h,存活率达到69.78%,在pH 1.0的条件下不能存活,与前者研究结果类似。而本文筛选的3株乳杆菌在pH 2.5的胃液中孵育2 h,存活率达到86.65%以上,均高于LGG。
小肠是人体内胆固醇合成和吸收的重要场所,也是益生菌发挥其降胆固醇作用的主要部位,所以益生菌必须具有胆盐耐受性。小肠中胆汁浓度在0.03%−0.30%范围内波动。本实验通过比较吸光值增加0.3个单位的迟滞期来判断菌株胆盐耐受性。结果表明,胆盐浓度为0.10%时,4株菌均能生长,胆盐浓度为0.25%时,所有的菌株均完全被抑制。杨焱炯[10]从健康人肠道分离的乳杆菌和双歧杆菌在胆盐浓度为0.1%时菌株被完全抑制。包艳[11]从自然发酵乳制品和酸粥分离到的植物乳杆菌,在胆盐浓度大于0.3%时,菌株几乎都没有受到抑制。与他们相比,本实验菌株的胆盐耐受性居中。Argyri等[1]认为一些食物成分的保护功效能提高菌株对胆盐的耐受性,因此推断,益生菌在体内的存活状况可能会提高。另外,在体外对益生菌耐胆盐特性的研究通过存活和生长两种方式研究。本文对人工肠液的耐受实验中,人工肠液添加了0.60%的胆盐,相当于是对存活实验的补充。结果表明,人工肠液处理26 h,LpMT-5存活率为45%,仅次于LGG。益生菌应具有调节人体肠道菌群平衡的功能,因此需要判断其对肠道常见致病菌的抑菌活性。本研究所获菌株对4种指示菌均有抑制作用,且对革兰氏阳性菌的抑制作用较大,这与赵佳锐[14]的研究结果类似。
目前,文献中多以清除效力和清除率共同衡量菌株体外降胆固醇能力。清除效力是将清除效果归一化,表示单位细菌生长能够清除的胆固醇量,所以从单个细胞的角度讲以清除效力作为依据具有可比性[21]。而对于宿主来说,总的清除胆固醇量是衡量菌株降胆固醇能力强弱的依据,清除率是胆固醇清除量与总胆固醇量的比值,包含了个体自身的代谢特性和群体的生长情况,从这个方面来看以清除率作为依据更具有说服力。
本实验从健康人肠道和奶豆腐中分离筛选出耐酸、耐胃液较好的乳杆菌,对其进行鉴定,之后经人工胃肠液耐受性、胆盐耐受性、抑菌活性、及胆固醇降解能力等益生特性的研究,获得3株具有益生特性的乳杆菌,可以作为研制保健型酸奶的候选菌株。LpMT-5在模拟人体胃肠液中存活率最高,这是其益生活性的前提;LpMT-3和LsAF-7耐胆盐、抑菌及降胆固醇的能力强。我们可通过进一步的动物体内实验,更准确的评价3株菌的特性。
| [1] | Argyri AA, Zoumpopoulou G, Karatzas KG, et al. Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J]. Food Microbiology, 2013, 33 (2): 282–291. |
| [2] | Brown M. Modes of action of probiotics: recent developments[J]. Journal of Animal and Veterinary Advances, 2011, 10 (14): 1895–1900. |
| [3] | Xu HY, Liu WJ, Sudu Q, et al. Assessment of the bacterial and fungal diversity in home-made yoghurts of Xinjiang, China by pyrosequencing[J]. Journal of the Science of Food and Agriculture, 2015, 95 (10): 2007–2015. |
| [4] | Liu WJ, Xi XX, Sudu Q, et al. High-throughput sequencing reveals microbial community diversity of Tibetan naturally fermented yak milk[J]. Annals of Microbiology, 2015, 65 (3): 1741–1751. |
| [5] | Su BX, Ai J, Zhu DQ, et al. Inhibition of Streptococcus pyogenes by Lactobacilli metabolites[J]. Microbiology China, 2015, 42 (1): 117–124. (in chinese) 苏本宪, 艾静, 朱德全, 等. 乳杆菌代谢产物对化脓性链球菌的抑制作用[J]. 微生物学通报, 2015, 42 (1):117–124. |
| [6] | Wang H, Gong HS, Meng XC. Partial characteristics of the bacteriocin produced by Lactobacillus brevis[J]. Microbiology China, 2011, 38 (7): 1036–1042. (in chinese) 王辉, 贡汉生, 孟祥晨. 一株短乳杆菌所产细菌素的部分特性[J]. 微生物学通报, 2011, 38 (7):1036–1042. |
| [7] | 石英军. 德氏乳酸杆菌对哺乳仔猪肠道免疫的影响研究[D]. 长沙: 湖南农业大学硕士学位论文, 2012 |
| [8] | 曹力. 乳酸杆菌对肉鸡肠道黏膜屏障功能的调节及机理[D]. 杨凌: 西北农林科技大学博士学位论文, 2012 |
| [9] | Bierg AT, Ktistensen M, Ritz C, et al. Four weeks supplementation with Lactobacillus paracasei subsp. paracasei L. casei W8? shows modest effect on triacylglycerol in young healthy adults[J]. Beneficial Microbes, 2015, 6 (1): 29–39. |
| [10] | 杨焱炯. 具有降血压功能的益生菌的筛选[D]. 上海: 上海交通大学硕士学位论文, 2006 |
| [11] | 包艳. 益生菌Lactobacillus plantarum P8发酵特性和降血脂功效的研究[D]. 呼和浩特: 内蒙古农业大学博士学位论文, 2011 |
| [12] | 李婷婷. 降胆固醇益生乳酸菌的筛选及其在大鼠体内的应用研究[D]. 哈尔滨: 东北农业大学硕士学位论文, 2013 |
| [13] | 郭佩莉. 土壤中解磷微生物的筛选及诱变育种[D]. 太原: 山西大学硕士学位论文, 2009 |
| [14] | 赵佳锐. 人体肠道益生菌的分离鉴定, 抑菌和降脂功能研究[D]. 上海: 上海交通大学硕士学位论文, 2005 |
| [15] | 张旻. 降胆固醇功能乳杆菌的筛选及降解机理研究[D]. 上海: 上海交通大学硕士学位论文, 2006 |
| [16] | Del Piano M, Morelli L, Strozzi GP, et al. Probiotics: from research to consumer[J]. Digestive and Liver Disease, 2007, 38 (S2): S248–S255. |
| [17] | Guo XH, Kim JM, Nam HM, et al. Screening lactic acid bacteria from swine origins for multistrain probiotics based on in vitro functional properties[J]. Anaerobe, 2010, 16 (4): 321–326. |
| [18] | Dunne C, O’Mahony L, Murphy L, et al. In vitro selection criteria for probiotic bacteria of human origin: correlation in vivo findings[J]. The American Journal of Clinical Nutrition, 2001, 73 (2S): 386S–392S. |
| [19] | Hibberd PL, Kleimola L, Fiorino AM, et al. No evidence of harms of probiotic Lactobacillus rhamnosus GG ATCC 53103 in healthy elderly?a phase I open label study to assess safety, tolerability and cytokine responses[J]. PLoS One, 2014, 9 (12): . |
| [20] | Goldin BR, Gorbach SL, Saxelin M, et al. Survival of Lactobacillus species (strain GG) in human gastrointestinal tract[J]. Digestive Diseases and Sciences, 1992, 37 (1): 121–128. |
| [21] | 王晓君. 降胆固醇乳酸菌体外筛选条件优化的研究[D]. 青岛: 青岛农业大学硕士学位论文, 2010 |
 2016, Vol. 43
2016, Vol. 43




